再发骨质疏松性椎体骨折的危险因素分析:一项回顾性多中心研究
潘明铭,姜为民,王喜安,唐锦程,徐 涛,顾强荣,罗勇骏
(1.苏州市独墅湖医院骨科,江苏 苏州 215125;2.苏州大学附属第一医院骨科,江苏 苏州 215006;3.江苏省人民医院骨科,江苏 南京 210029;4.南京市第一医院骨科,江苏 南京 210012)
骨质疏松症是世界性的一大健康问题,它影响着50 岁以上的33%的女性和20%的男性的骨骼健康[1]。骨密度(BMD)不断下降最终会导致患者因轻微外伤甚至自发性出现低能量的脆性骨折。骨质疏松性骨折导致患者死亡率和致残率增加,严重影响患者的生活质量。其中,骨质疏松性椎体压缩性骨折(OVCF)是骨质疏松极为常见的一大并发症。
双能X线骨密度仪(DXA)测量的BMD常用于量化骨质疏松症的严重程度。许多其他临床生物学指标,如25-羟基维生素D[25(OH)D]、β-胶原降解产物(β-CTX)和Ⅰ型胶原氨基端延长肽(PINP)也与骨质疏松症的进展有关[2-3]。因此,临床医生常通过这些指标来评估骨质疏松症的病情进展。骨质疏松症的治疗主要基于抗骨质疏松药物和合成代谢药物,如双膦酸盐[唑来膦酸(ZA)最常用],间歇性低剂量甲状旁腺激素(PTH)[4-8],补充钙和维生素D,同时适量的运动也是抗骨质疏松的辅助疗法[9-10]。其他治疗方法,如雌激素疗法(ET)和激素替代疗法(HRT)等也可显著减少绝经后妇女的骨量丢失[11-12]。双膦酸盐是焦膦酸盐的合成类似物,可使破骨细胞失活并抑制骨吸收[5]。
我们随访调查了行经皮椎体后凸成形术(PKP)的一些老年患者,按是否再发OVCF进行分组,研究了OVCF复发的几个潜在危险因素,从而构建疾病预测模型,更好地理解和揭示其规律,为预防OVCF的复发提供相对客观的依据。
1 资料与方法
1.1 一般资料 本研究纳入了432 例确诊为OVCF的老年(60 岁以上)患者。有严重系统性基础疾病或无随访信息的患者已排除在外。这些患者于2019年1月1日—2021年7月1日在苏州市独墅湖医院、苏州大学附属第一医院、江苏省人民医院和南京市第一医院住院接受治疗,随访时间中位数为20.6 个月。所有患者在接受PKP术后,均静脉注射5 mg唑来膦酸钠。我们统计了所有患者的性别、年龄、体重指数(BMI)、吸烟饮酒习惯、T评分、25(OH)D、PINP和β-CTX血清浓度。此外,我们还研究了初发的多椎体骨折和至少连续2 年的唑来膦酸钠治疗是否会影响这些患者再发骨质疏松骨折的风险。所有方案均遵循苏州大学和南京医科大学伦理委员会的指导原则,获得了所有患者的同意和知情签名。
1.2 统计分析 偏态变量以中位数和四分位数范围表示,而正态分布的连续方差则以平均值±标准差表示。比较采用非配对t检验和Mann-WhitneyU检验。分类变量以百分比表示,并采用χ2检验、对数秩检验进行比较。使用逻辑模型评估终点事件的单变量和多变量的意义,协变量对终点事件发生的意义用森林图来显示。
根据多变量逻辑回归分析结果,使用R的‘rms’包4.0.2版(http://www.r-project.org/)计算提名图。提名图的基础是将多变量逻辑回归中的每个回归系数转换为0到100的比例。具有最高β系数(绝对值)的变量的影响被赋予100 分。独立变量的积分相加,得到一个总积分,然后将其转换为预测概率。提名图的预测性能由协方差指数(C-index)来衡量,并用1 000 个随机内部抽取样本进行校准,以减少过拟合偏差。
2 结果
本次研究共纳入432 例患者:其中399 例(92.0%)为女性,33 例(8.0%)为男性。所有患者年龄中位数为68.0 岁(64, 73),体重和身高中位数分别为58.5 kg和160.0 cm,BMI中位数为23.02(20.67, 24.73)kg/m2。410 例(94.9%)没有吸烟习惯,401 例(92.8%)不喝酒。T评分中位数为-2.50(-3.00, -1.80),25(OH)D为43.13(34.64, 48.09)ng/mL。我们还收集了β-CTX和PINP的值,中位数分别为305.88(230.08, 370.14)pg/mL和48.03(38.49, 58.54)ng/mL。有27 例(6.0%)患者初次骨折为多发性椎体骨折,235 例(54.0%)仅接受了一次ZA治疗。这些病人中,有59 例再次出现OVCF。我们将患者分为再骨折组和未再骨折组。使用非配对t检验和Mann-WhitneyU检验进行比较。再骨折组的患者T评分较低(分别为-2.40和-3.10,P<0.001),而β-CTX评分较高(表1)。
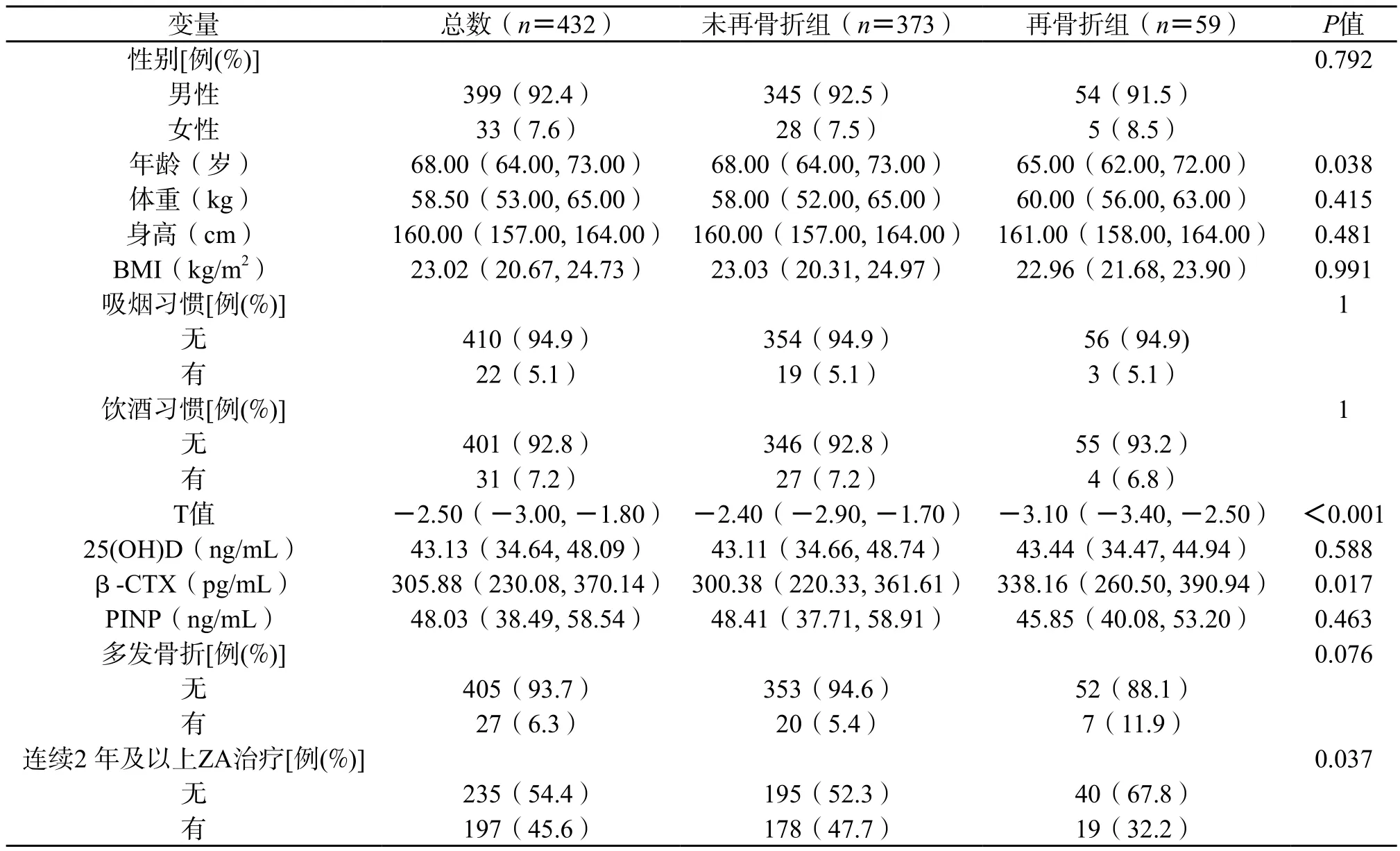
表1 患者一般信息
单变量分析显示,T评分偏低(OR=0.25,95%CI0.13~0.46,P<0.001)和未连续进行ZA治疗(OR=0.52,95%CI0.29~0.92,P=0.028)都是再次骨折的显著预测因子。经年龄和性别调整后,T评分也是再次骨折的一个因素(OR=0.25,95%CI0.13~0.47,P<0.001)(表2)。将上述所有变量(P<0.1)进行多元逻辑回归分析,结果表明,较低的T评分是再发OVCF的独立危险因素(OR=0.10,95%CI0.04~0.20,P<0.001)(表3)。

表2 再发OVCF危险因素的单因素生存分析

表3 多因素分析获得的再发OVCF危险因素
如图1所示,我们生成了逻辑模型的列线图来量化导致二次骨折的每个协变量。采用列线图评估不同变异情况下再发椎体骨折的风险。使用列线图时,找到每个变量在相应轴上的位置,在点轴上画一条线表示点数,将所有变量中的点相加,并在总点轴上画一条线,以确定列线图下一行的概率。使用引导验证方法对生成的模型进行了内部验证。列线图在评估再发骨折风险方面表现出了极好的准确性,未经调整的C指数为0.870,自举校正的C指数为0.851。此外还有一个适合风险评估的校准曲线(图2)。
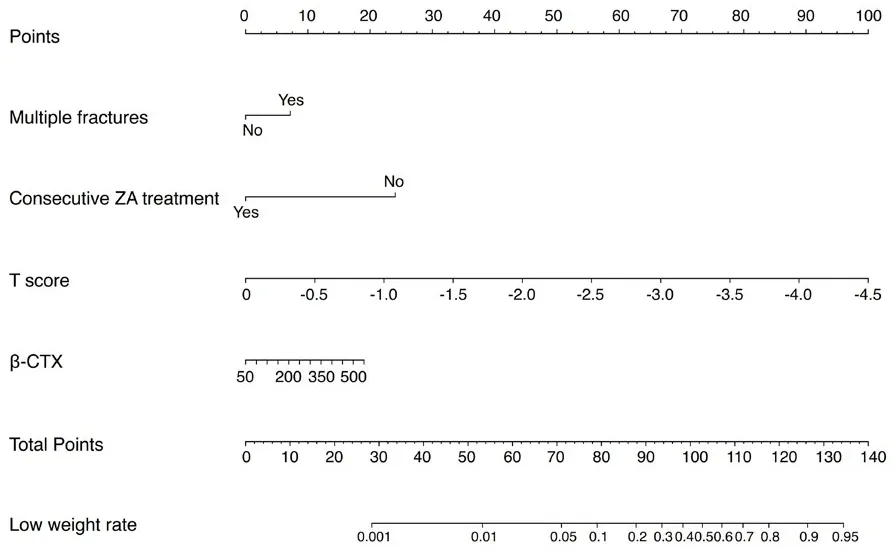
图1 椎体再发骨折的风险评估及其预测性能
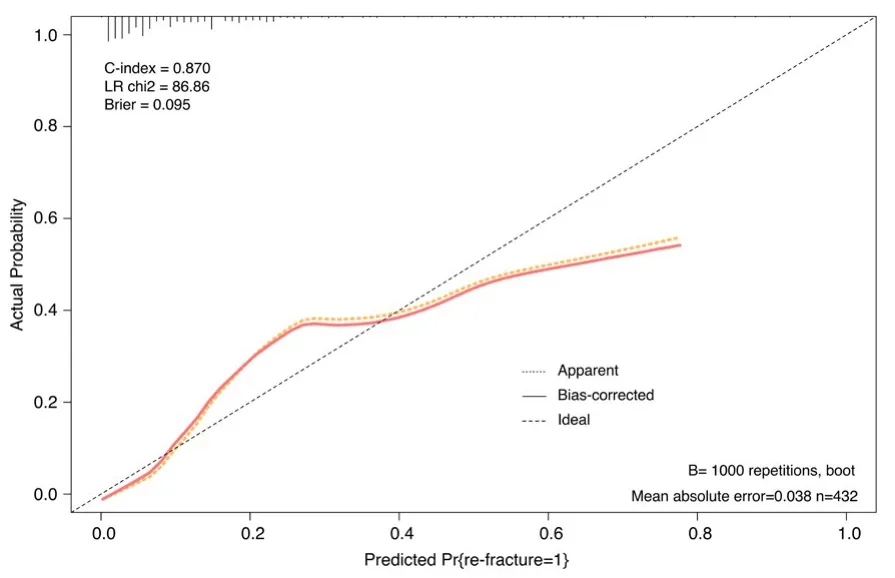
图2 列线图在评估患者椎体再发骨折风险方面的有效性
3 讨论
骨质疏松症严重影响全球老年人口的骨骼健康,曾被认为是衰老不可避免的并发症之一,但如今学者们普遍认为骨质疏松症可防可治。在50 岁以上人群中,超过半数的女性和20%的男性,可能会在余生中发生骨质疏松性骨折[13]。只有1/3的髋部骨折的老年女性,最终可以恢复生活自理。研究显示:白人男性骨质疏松性骨折的风险为20%,然而,一旦发生髋部骨折,男性患者的一年死亡率却是女性患者的两倍;黑人患骨质疏松症的风险低于白人,但一旦被诊断为骨质疏松症,其发生骨折的风险与白人无明显差异[14]。随着社会人口的老龄化,未来骨质疏松性骨折的患者数量会增加1~2倍。在发展中国家,尤其在亚洲,骨质疏松性骨折的发病率正在逐年增加[15-16]。在所有骨质疏松性骨折中,脊柱也是最常见的骨折部位之一,其发病率和致残率都很高[17]。患者常有间歇性或持续性腰痛,并可能合并有神经系统症状。因此,如何科学合理地进行OVCF的风险评估,理应得到我们的高度重视。
既往的一些研究已经列出了OVCF的几个危险因素,如高BMI、低BMD、钙摄入不足和体力活动过少[18-19]。值得注意的是,这些因素在不同国家和人口之间具有不可忽视的差异性。例如,美国黑人骨折的风险低于白种人,而同样是黑人,美国黑人髋部骨折的发生率比非洲黑人高得多[20]。上述发现均表明:人种、遗传和环境因素的差异显著影响骨质疏松性骨折的风险。
本研究评估了中国江苏地区老年人群再发OVCF的几个潜在危险因素。共有432 例老年患者被纳入研究,其中59 例(13.7%)发生了二次骨折。这一结果比我们想象的要高得多,但实际发病率可能比我们观察到的更高。OVCF具有隐匿性的特点,一些患者并没有明确的外伤史,因此并非所有患者都在再次发生OVCF后前往医院接受诊治,而把背痛误认为是第一次外伤或PKP术后的残留症状。
根据WHO的标准,骨质疏松症的严重程度可以根据BMD(T评分)进行评估。当患者T值<-2.5,并伴有脆性骨折史,就可诊断为严重的骨质疏松症。不同地区的不同人种,均可通过T评分进行骨折风险的评估[21]。在我们的研究中,大多数二次骨折患者在初次住院时就已被确诊为严重的骨质疏松症(T值<-2.5),再骨折组的平均T评分显著低于未再骨折组(表1),表明T评分低的患者不仅易发生OVCF,还容易复发。此次研究,女性患者占比高达92.4%,而两组之间没有性别差异。少数患者有吸烟或饮酒的习惯,这两种习惯与骨折复发无显著相关性。两组之间年龄、身高、体重、BMI差异无统计学意义(P>0.05)(表1)。我们此次研究的样本量较小、血清学指标的不稳定性可能导致上述结果与其他研究不完全一致。
除BMD外,骨转换标记物(BTM)具有高度的敏感性和特异性,能反映骨转换的状态,是骨质疏松性骨折最常用的风险评估工具[22-23]。PINP和β-CTX分别作为骨形成和骨吸收的标志物,被国际骨质疏松协会(IOF)指定为骨代谢的参考标记物[3,24]。关于PINP、β-CTX与再发OVCF的相关性的观点不少。一些学者认为PINP与骨质疏松性骨折无关,而另一些则认为呈正相关,且比β-CTX更能准确地预测骨折的发生[25]。Eastell等[26]研究发现,用PINP预测绝经后个体的骨折风险并不准确。Nguyen等[27]总结,尽管在骨质疏松症患者血液中同时检测到了高水平的PINP和β-CTX,但只有β-CTX与BMD显著相关。同样的,Yang等[28]发现,首次脆性骨折发生1 年后,血清β-CTX浓度会影响骨丢失速度,监测β-CTX水平有助于预测骨折的复发。关于PINP、β-CTX在BMD和骨折风险预测方面的争议仍然存在,需要进一步研究和讨论。此次研究我们发现,血液中高水平的β-CTX与椎体二次骨折的风险呈正相关。相比之下,两组之间的PINP水平差异无统计学意义。其他标志物的研究结果也一样不尽相同,Sakuma等[29]发现25(OH)D不足是髋部骨折的危险因素。一项印度研究[30]也检测到髋部骨折患者的血清25(OH)D水平较低(<20 ng/dL)。然而,我们的研究结果显示,血清25(OH)D水平的变化对OVCF复发并无显著影响。这样的差异,可能是由于骨折位置和环境的异质性导致。
表1所示,共有27 例患者(6.3%)在初次骨折时即为多椎体的骨折,而他们中有7 例遭遇了二次骨折,占所有二次骨折受试者的11.9%,表明多个椎体骨折是OVCF复发的危险因素。这一结果表明,多发性椎体骨折的患者需要在未来重点预防骨折复发。
我们建议所有患者至少接受连续3 年的ZA治疗。但在初次手术出院后,只有一半左右的患者对这一治疗措施有充分的认识。一些患者直到OVCF复发,才意识到手术治疗远远不是该疾病治疗的终点。根据Zhang等[31]的报道,PKP治疗后6 个月和12个月,空白对照组的椎体二次骨折的发生率显著高于ZA治疗组。Wu等[32]总结:患者在PVP/PKP术后每年使用ZA一次,可显著改善BMD,缓解疼痛,降低OVCF的复发率。在我们的研究中,所有患者在术后都静滴了ZA。未连续每年使用ZA治疗的患者对二次椎体骨折的易感性更高,证实了持续ZA治疗比单次使用更能有效防止再发骨折。
基于上述风险因素,我们构建了一个再发OVCF的预测模型,用以更好地预测患者骨折复发的概率,帮助临床医生预测这种疾病,并进行精准干预。我们的研究仍然有一些局限性。首先,本研究属回顾性研究,且只主要包括了中国江苏地区人口。其次,样本量不够大,导致结果偏倚。这项研究包括的骨代谢标志物种类有限,碱性膦酸酶(ALP)、骨钙素N末端(N-MID)和许多其他标志物并未纳入研究。另外,本研究只针对PKP术后的脊柱再发骨折开展了研究和讨论,并未将手术操作纳入研究的范围,且没有针对如髋部骨折和桡骨远端骨折等其他骨质疏松性骨折进行探究。未来需要更多更详细设计的前瞻性试验来进一步验证我们的结论。
此次研究结果表明,BMD低是一个被广泛认可的再发OVCF的独立危险因素。β-CTX水平较高的患者也容易出现OVCF复发。此外,我们发现初次即为多椎体骨折的患者,再发OVCF的风险也更高。相比仅使用1 年ZA治疗骨质疏松症,连续2 年或以上的治疗是二次骨折的一个保护因素。

