黄瓜嫁接苗与接种哈茨木霉菌黄瓜直根苗对根腐病防效及根系生理响应
靳亚忠,熊亚男,齐 娟,刘蕾庆,任金立,李春霞 ,卢美燕,陈 慧,陈泳池
(1.黑龙江八一农垦大学园艺园林学院,黑龙江 大庆 163319; 2.青岛金妈妈农业科技有限公司,山东 青岛 266000)
黄瓜(CucumissativusL.)是重要的葫芦科蔬菜作物,为人类饮食提供了营养元素和食用纤维,在世界范围内广泛种植,尤其是设施生产中占有重要地位[1],但设施黄瓜连作栽培造成黄瓜根腐病发生较为严重[2]。目前,世界范围内黄瓜栽培主要依赖于嫁接栽培提高黄瓜对非生物胁迫、土传病害及线虫的抗性,以达到优质高产的目的[3-4]。黄瓜根腐病是由茄镰刀菌瓜类专化型(Fusariumsolanif.sp.cucurbitaeSnyder et Hansen)[5]、腐霉菌(Pythiumultimum)[6]、瓜类疫霉菌(Phytophthoramelonis)[7]、辣椒疫霉菌(Phytophthoracapsici)[8]引起的一种根部病害。嫁接栽培可以提高瓜菜抗生物和非生物胁迫性能以及肥水利用,减少农药投入量,是黄瓜栽培中一种绿色、安全生产的重要方法。在番茄[9]、辣椒[10-11]、西瓜[12]、甜瓜[13]等研究中,利用嫁接栽培明显地控制了根腐病的发生,得到了种植者广泛认可。但是,近年来,我国的山东、辽宁、内蒙古等地设施栽培黄瓜根腐病发生严重,发生率高达20%~30%[14-15],可能与选择使用的南瓜砧木以及砧木与接穗组合搭配对根腐病的抗性有关[12]。虽然嫁接栽培能促进黄瓜生长和提高黄瓜抗土传病害能力,但是黄瓜的可溶性糖和香味品质明显降低[16],暗示了嫁接黄瓜品质的维持与抗病性的提高主要依赖于适宜砧木和接穗组合选择[17-18]。此外,在生产中,蔬菜嫁接栽培的应用还存在嫁接苗的生产成本、种苗管理以及运输成本等较高的现象[19]。前人研究表明,作物根腐病的防治主要采用化学药剂进行土壤消毒[5,20-21]和田间灌根处理的方法[22-26],但是化学农药在杀死病原菌的同时也杀灭了土壤中的有益菌,不利于可持续生产。因此,在蔬菜生产中,采用微生态理论指导生产是一种绿色、优质生产的方向,同时也能降低蔬菜育苗及生产的成本[27],且利用有益微生物或拮抗微生物抑制土传病害病原物的生长,以控制土传病害的发生,已经在黄瓜和甜菜[1,6,8]、蚕豆[28]、木薯[29]、油豆角[30]、蓝莓[31]、木香[32]、烟草[33]、大蒜[34]以及大豆[35]等作物栽培中得到验证。在黄瓜根腐病防治的研究中,假单胞菌(Pseudomonas)和芽孢杆菌(Bacillus)菌株[6,8]、哈茨木霉菌(Trichodermaharzianum)和淡紫拟青霉(Paecilomyceslilacinus)菌株[36]以及拮抗镰孢菌(Fusarium)菌株[37]能有效抑制根腐病病原菌生长及根腐病的发生,且防效与化学药剂的防效相当[36]。此外,在田间试验中,木霉菌与芽孢杆菌混合菌剂[1]、木霉菌及芽孢杆菌生物有机肥[15]及绿色木霉菌与草炭复配基质[2]的使用能明显地降低黄瓜根腐病的发病率。
嫁接栽培与木霉菌的使用都能提高瓜菜作物的抗病性以及发挥促生的作用,但是二者作用的效果及生理调节机理是否相同还不明确。研究表明,木霉菌接种植物后会诱导植物体内抗病相关酶的活性增加及抗逆基因表达,激发自身的抗性反应,从而减轻病害的发生[1]。此外,木霉菌产生的效应因子,如丝氨酸蛋白酶、几丁质酶等会激活植物信号传导途径,诱导植物系统抗性和植物免疫系统,参与病害防治[38-39];木霉菌菌株与植物相互作用过程中产生的代谢物,既可以对植物病原菌发挥直接抑制作用,也可以通过触发植物防御系统或增强营养生长来增加抗性[40]。在嫁接辣椒的研究中,接种根腐病病原菌的条件下,嫁接辣椒植株与砧木根系中可溶性糖、苯丙氨酸裂解酶(PAL)活性、酚类物质及木质素含量显著高于对照,暗示了嫁接提高辣椒抗根腐病能力与苯丙烷类物质代谢有关[41];在甜瓜[13]、西瓜[12]和黄瓜[14-15]的研究中也发现嫁接能提高抗根腐病能力,但嫁接对其植株根系生理调节的研究报道较少,且是否与木霉菌调控直根苗抗根腐病的效果及生理调节相类似,鲜有报道。因此,本研究采用哈茨木霉菌DQ002与根腐病原菌孢子悬浮液对黄瓜幼苗进行根部接种,通过对比木霉菌与根腐病病原菌接种直根苗与病原菌单独接种嫁接苗对根腐病的防效及根系生理变化,探讨木霉菌防治黄瓜根腐病效果以及调控根腐病的生理机理是否与嫁接苗抗根腐病的效果及调节生理相类似,所得结果将为研究木霉菌与植物的互作机制和推动木霉菌的开发应用提供科学基础,也将为设施黄瓜进行节本增效生产提供理论依据。
1 材料与方法
1.1 材 料
采用插接法繁殖的嫁接黄瓜苗以及黄瓜直根苗(强雌性密刺黄瓜6501),其中嫁接苗的接穗品种为强雌性密刺黄瓜6501,砧木品种为砧大力1989,均由青岛金妈妈农业科技有限公司提供。
哈茨木霉菌DQ002,由黑龙江八一农垦大学园艺园林学院靳亚忠副教授提供,在PDA培养基上28℃培养5~7 d后,用无菌水洗涤孢子,配制成1×108CFU·mL-1孢子悬浮液,备用。
黄瓜根腐病原菌(Fusariumsolanif. sp.cucurbitaeSnyder et Hansen),由青岛金妈妈农业科技有限公司提供,在PDA培养基上28℃培养5~7 d,用无菌水洗涤孢子,配制成1×108CFU·mL-1,备用。
1.2 试验设计
试验在青岛金妈妈农业科技有限公司温室基地进行。采用穴盘育苗,基质为草炭∶蛭石∶珍珠岩=3∶1∶1的混合基质,播种前采用1%的次氯酸钠对砧木种子和黄瓜接穗种子进行消毒,清洗干净后播种、嫁接。当黄瓜直根苗与嫁接苗长至3叶1心时,采用根部接种的方式,把哈茨木霉DQ002与根腐病原菌孢子悬浮液接种于黄瓜苗的根部土壤中,每棵幼苗接种5 ml相应的孢子悬浮液,木霉菌孢子悬浮液浓度为1×108CFU·mL-1,病原菌孢子悬浮液浓度为1×108CFU·mL-1,接种后进行薄膜覆盖。
试验设置6个处理,分别为CK1,直根苗清水处理; CK2,嫁接苗清水处理; T1,直根苗接种病原菌处理; T2,嫁接苗接种病原菌处理; T3,直根苗先接种病原菌,2 d后接种木霉菌; T4,直根苗先接种木霉菌,2 d后接种病原菌。在接种后的0、2、4、6、8 d进行根部样品采集,每个处理采集100株黄瓜苗。将幼苗植株洗净后,分离根部样品,之后用锡纸包好,做标记,于液氮中快速冷冻,并放置于-80℃超低温冰箱保存,用于生理指标的测定。
在接种根腐病2周后,每个处理采集100株黄瓜苗记录病情级别,计算发病率和病情指数。病害分级标准参照贲海燕等[5]的分级方法,发病率和病情指数计算按照公式:
发病率=(染病株数/调查总数)×100%
病情指数(DI)=∑(病级株数×病级代表值)/(调查总株数×最高病级代表值)×100
1.3 测定项目与方法

1.4 数据统计与分析
采用Excel(2010)和SPSS.26.0软件对数据进行处理和统计分析,采用Duncan新复极差法进行显著性分析,Origin 9.0软件进行绘图。
2 结果与分析
2.1 黄瓜幼苗根腐病的发生率及病情指数
由表1可以看到,直根苗清水处理(CK1)、嫁接苗清水处理(CK2)、直根苗接种病原菌(T1)、嫁接苗接种病原菌(T2)、直根苗先接种病原菌后接种哈茨木霉菌(T3)以及直根苗先接种木霉菌后接种病原菌(T4)发病率分别为35.82%、23.05%、57.39%、42.90%、22.39%、17.87%,病情指数分别为37.10%、25.67%、46.97%、40.47%、23.03%、14.33%,且T3和T4处理的黄瓜直根苗根腐病的发病率则明显低于CK1、T1和T2处理(P<0.05),而T3与T4处理间也存在明显差异,T4处理黄瓜直根苗根腐病的发病率与病情指数均明显低于T3处理(P<0.05)。
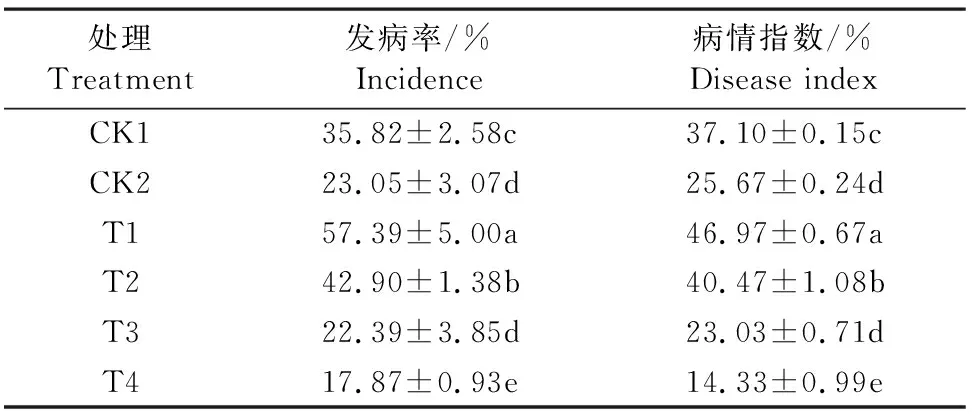
表1 黄瓜根腐病调查Table 1 Investigation of cucumber root rot
2.2 黄瓜幼苗根系过氧化物酶(POD)活性
由图1可以得知,不同处理下黄瓜幼苗根系中POD活性存在差异。在接种培养期间,单独接种根腐病病原菌(T1)、先接种病原菌后接种哈茨木霉菌(T3)以及先接种哈茨木霉菌后接种病原菌(T4)处理的黄瓜直根苗根系中POD活性显著高于CK1(P<0.05),且T3和T4处理的黄瓜直根苗根系中POD活性也明显高于T1处理;而在接种培养4 d后,T3处理黄瓜直根苗根系POD活性显著高于T4处理(P<0.05)(图1A)。在未接种根腐病原菌的条件下,随着培养时间的推移黄瓜嫁接苗(CK2)植株根系中的POD活性显著高于黄瓜直根苗(CK1)(P<0.05),但变化规律相似;而在接种根腐病原菌条件下,黄瓜嫁接苗(T2)根系中的POD活性始终明显高于未接种处理的CK1、CK2以及T1处理(P<0.05)(图1B)。此外,由图1C可以看出,在接种根腐病病原菌条件下,黄瓜嫁接苗(T2)根系中POD活性高于T3和T4处理黄瓜直根苗根系中的POD活性(P<0.05)(接种培养的第4天除外)。

图1 不同处理下黄瓜幼苗根系过氧化物酶(POD)活性Fig.1 POD activity of cucumber seedlings roots under different treatments
2.3 黄瓜幼苗根系多酚氧化酶(PPO)活性
由图2A看出,黄瓜直根苗在接种根腐病病原菌后,T1(单独接种病原菌)处理根系PPO活性在接种培养4 d后明显高于CK1(对照)处理,但与T3(先接种病原菌后接种哈茨木霉菌)和T4(先接种哈茨木霉菌后接种病原菌)处理相比较,T1处理PPO活性则显著低于T3和T4处理,而T3和T4处理间无明显差异(P<0.05)。由图2B可以看出,在接种根腐病病原菌条件下,黄瓜嫁接苗(T2处理)根系中PPO活性显著高于CK1(清水处理黄瓜直根苗)和CK2(清水处理黄瓜嫁接苗),且在接种后培养的0~6 d期间,T1处理植株根系PPO活性也明显低于T2(黄瓜嫁接苗)处理(P<0.05)。此外,在接种根腐病病原菌后培养期间,黄瓜嫁接苗(T2)根系PPO活性与T1处理的黄瓜直根苗根系PPO活性仅在培养前期差异明显(P<0.05),而T3和T4处理的直根苗根系PPO活性则显著高于T2(嫁接苗)处理(P<0.05)(图2C)。
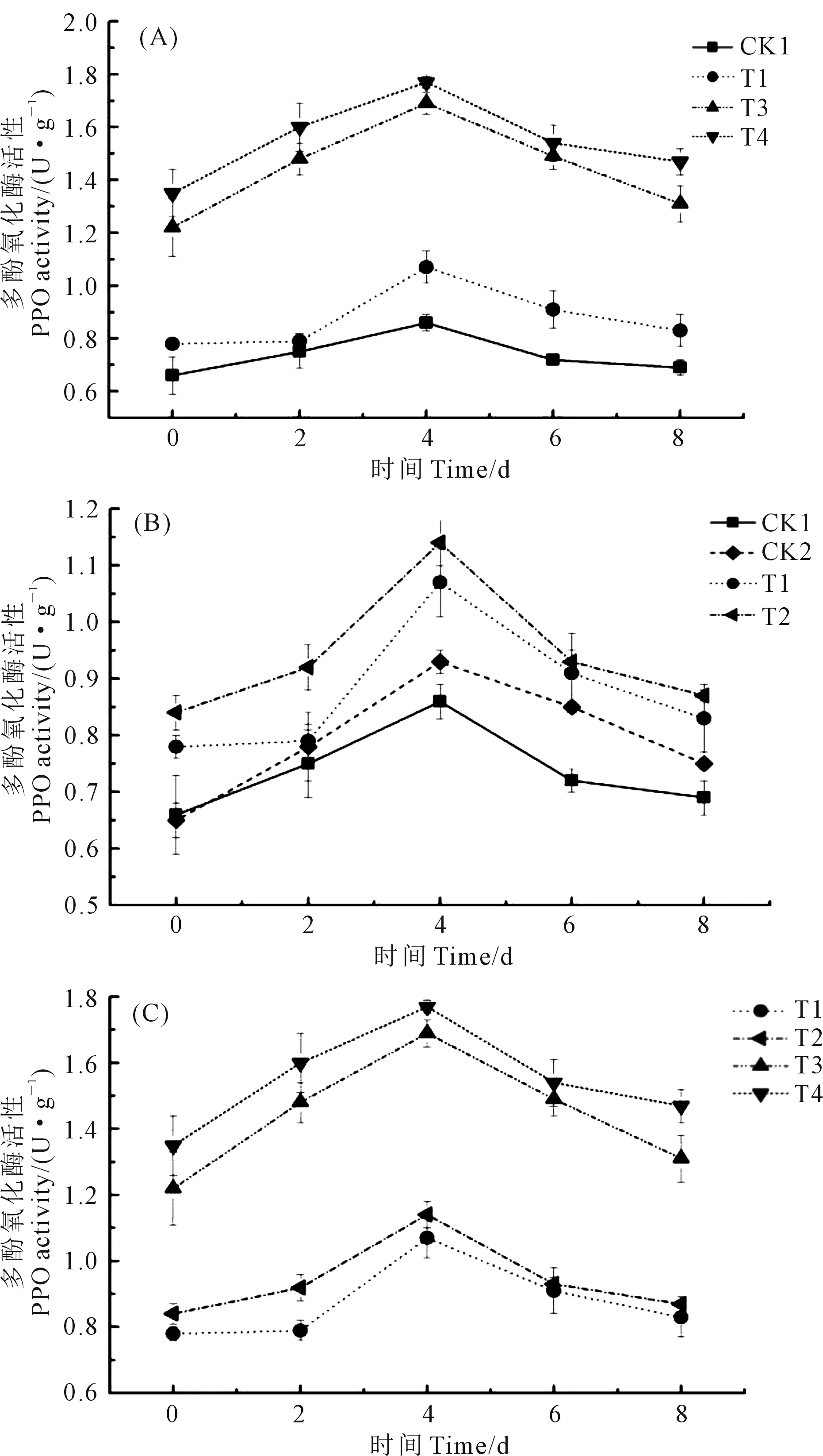
图2 不同处理下黄瓜幼苗根系多酚氧化酶活性Fig.2 PPO activity of cucumber seedlings roots under different treatments
2.4 黄瓜幼苗根系超氧化物歧化酶(SOD)活性
由图3A看出,黄瓜直根苗单独接种根腐病病原菌的处理(T1)根系中SOD活性明显大于CK1(清水处理黄瓜直根苗),显著低于T3(先接种病原菌后接种哈茨木霉菌)和T4(先接种哈茨木霉菌后接种病原菌)处理直根苗根系SOD活性,而T3和T4处理之间相比,黄瓜直根苗根系中SOD活性仅仅在接种后的0 d和6 d期间存在差异,但都明显高于CK1处理(P<0.05)。在接种根腐病病原菌后培养2~8 d期间,T2(嫁接苗接种根腐病病原菌)处理的嫁接苗根系中SOD活性明显高于CK1和CK2(清水处理黄瓜嫁接苗)处理植株根系中SOD活性,而在接种培养的第2~8天期间,T2处理黄瓜嫁接苗根系SOD活性则明显大于T1处理(P<0.05);且发现接种后的第0~6天期间,T1处理黄瓜直根苗根系SOD活性显著高于CK2处理嫁接苗根系SOD活性(P<0.05)(图3B)。此外,在接种病原菌条件下,T3处理的黄瓜直根苗根系SOD活性始终显著高于T2处理(P<0.05),而T4处理的黄瓜直根苗根系中的SOD活性则在接种培养前期高于T2处理(P<0.05)(图3C)。

图3 不同处理下黄瓜幼苗根系超氧化物歧化酶活性Fig.3 SOD activity of cucumber seedlings roots under different treatments
2.5 黄瓜幼苗根系活性氧


图4 不同处理下黄瓜幼苗根系过氧化氢(H2O2)含量Fig.4 H2O2 content of cucumber seedlings roots under different treatments

图5 不同处理下黄瓜幼苗根系超氧阴离子产生速率Fig.5 produce rate of cucumber seedlings roots under different treatments
2.6 黄瓜幼苗根系β-1, 3-葡聚糖酶和几丁质酶活性
由图6、7可以得知,接种后随着时间的推移,不同处理的黄瓜幼苗植株根部β-1, 3-葡聚糖酶、几丁质酶活性变化不同。在接种处理后培养期间,单独接种根腐病病原菌(T1)、先接种病原菌后接种哈茨木霉菌(T3)以及先接种木霉菌后接种病原菌(T4)处理下的黄瓜直根苗植株根系中β-1, 3-葡聚糖酶、几丁质酶活性显著高于CK1(P<0.05),而T3和T4处理黄瓜直根苗根系β-1, 3-葡聚糖酶(图6A)、几丁质酶(图7A)活性明显大于T1处理(单独接种病原菌)(P<0.05)。未接种病原菌条件下,CK1(清水处理黄瓜直根苗)和CK2(清水处理黄瓜嫁接苗)根系中β-1, 3-葡聚糖酶、几丁质酶活性之间无明显差异(P<0.05);而单独接种病原菌后,在培养的0~2 d期间,T1处理黄瓜直根苗根系中的β-1, 3-葡聚糖酶活性明显低于T2处理嫁接苗根系中β-1, 3-葡聚糖酶活性(图6B),而几丁质酶活性则在培养期间显著低于T2处理嫁接苗(P<0.05)(图7B)。此外,还发现接种根腐病的黄瓜嫁接苗(T2)根部中β-1, 3-葡聚糖酶、几丁质酶活性明显高于CK1和CK2处理的β-1, 3-葡聚糖酶和几丁质酶活性(P<0.05)。另外,在接种根腐病病原菌条件下,T3和T4处理直根苗根系β-1, 3-葡聚糖酶、几丁质酶活性则在培养期间始终显著高于T2处理的黄瓜嫁接苗根系中β-1, 3-葡聚糖酶(第0天除外)、几丁质酶活性(P<0.05)。

图6 不同处理下黄瓜幼苗根系β-1,3-葡聚糖酶活性Fig.6 β-1,3-glucanase activity of cucumber seedlings roots under different treatments

图7 不同处理下黄瓜幼苗根系几丁质酶活性Fig.7 Chitinase activity of cucumber seedlings roots under different treatments
2.7 黄瓜幼苗根系苯丙氨酸解氨酶活性
由图8可以看出,不同处理黄瓜苗根系中苯丙氨酸解氨酶(PAL)活性之间存在差异。在接种病原菌条件下,根腐病病原菌促进了黄瓜直根苗(T1)(图8A)和黄瓜嫁接苗(图8B)根系中PAL活性的升高,在培养的第4天呈现峰值,且明显高于CK1和CK2(P<0.05)。在培养期间,T3(先接种病原菌后接种木霉菌)和T4(先接种木霉菌后接种病原菌)处理的黄瓜直根苗根系中PAL活性显著高于T1(单独接种病原菌的黄瓜直根苗)处理,尤其是在培养的第4天(P<0.05)(图8A)。此外,在未接种病原菌的条件下,CK1(清水处理)处理的黄瓜直根苗根系PAL活性明显低于CK2处理(清水处理)的黄瓜嫁接苗;同时也发现,接种病原菌后,随着培养时间的推移,T1处理黄瓜直根苗根系中的PAL活性显著低于T2处理嫁接苗(培养的第4天除外)(P<0.05)(图8B),但是T3和T4处理中黄瓜直根苗根系中PAL酶活性显著高于T2处理嫁接苗,尤其是在培养的第4天,差异显著(P<0.05)(图8C)。

图8 不同处理下黄瓜幼苗根系苯丙氨酸解氨酸酶活性Fig.8 PAL activity of cucumber seedlings roots under different treatments
2.8 黄瓜幼苗根系类黄酮含量
由图9可以看出,黄瓜直根苗和嫁接苗根系中类黄酮含量随着培养时间的推移呈现先升高后降低趋势,且在培养的第6天呈现峰值。接种根腐病病原菌促进了黄瓜直根苗(T1)和嫁接苗(T2)根系中类黄酮含量的增加(图9B),显著高于CK1(清水处理黄瓜直根苗)和CK2(清水处理黄瓜嫁接苗)(P<0.05);在先接种病原菌后接种木霉菌(T3)和先接种木霉菌后接种病原菌(T4)处理的黄瓜直根苗根系中类黄酮含量明显高于CK1处理,且在培养期间,T3处理黄瓜直根苗根系中类黄酮含量显著大于T1处理,而T4处理黄瓜直根苗根系类黄酮含量则在培养的第4天后显著高于T1处理(图9A)(P<0.05)。

图9 不同处理下黄瓜幼苗根系类黄酮含量Fig.9 Flavonoid content of cucumber seedlings roots under different treatments
另外,在接种病原菌的条件下,整个培养期间,T1、T3和T4处理黄瓜直根苗根系中的类黄酮含量始终显著高于T2(单独接种病原菌的嫁接苗)处理(P<0.05)(图9C)。
3 讨 论
根腐病是黄瓜栽培中最严重的土传病害之一,设施栽培中根腐病发病尤为严重。目前为止,对于作物根腐病的防治,生产中多采用化学药剂进行土壤消毒和根部滴灌的方式[3,22-26]。此外,瓜菜嫁接栽培能明显降低根腐病的发病率,是一种有效的防病、促生的栽培方式[13,45-47];但是由于设施连续种植,在黄瓜嫁接栽培中也出现严重根腐病发生的现象[14-15]。在本研究中,黄瓜嫁接采用的砧木为南瓜砧木(砧大力1989),嫁接黄瓜能促进黄瓜植株生长和产量增加(数据未发表),且未接种根腐病原菌的黄瓜直根苗和嫁接苗根腐病发生率分别为35.82%和23.05%,而接种根腐病原菌条件下黄瓜直根苗和嫁接苗根腐病的发病率分别为57.39%和42.90%(表1),说明试验中采用的南瓜砧木虽有一定抗病能力,但也容易感染根腐病病原菌,暗示了该南瓜砧木虽然能促进黄瓜生长,但对于黄瓜根腐病的抵抗能力具有局限性。作物根腐病防治研究中,发现利用木霉菌、芽孢杆菌、假单胞菌进行种子浸种[6]、包衣[8]、灌根[36-37]或者配制生物有机肥[15,48]以及微生物复配菌剂[1,28]等都能明显控制根腐病的发生,效果与化学药剂对根腐病的防效相当[37],且荞麦作物还田通过调节土壤中有益菌群数量的增加也明显降低了黄瓜根腐病的发生[49]。本研究发现,接种根腐病病原菌后,采用哈茨木霉菌DQ002处理的黄瓜直根苗(T3和T4处理),其抗根腐病的能力增强,且发病率分别为22.39%和17.87%,显著低于CK1和T1处理,说明哈茨木霉菌DQ002的使用降低了根腐病的发生程度,且效果优于嫁接黄瓜抗根腐病的能力;先用木霉菌处理黄瓜直根苗(T4)对根腐病的防治效果优于发病后木霉菌的使用(T3)效果,且哈茨木霉菌DQ002 对黄瓜直根苗根腐病发生的控制效果与前人在黄瓜[1,15,36]、蓝莓[31]、木薯[29]上研究结果一致。

木霉菌发挥其生物防治活性的途径之一是提高植物次生代谢物的合成。次生代谢物在木霉菌与植物互作中作为激活子或抗逆诱导子发挥作用,且抗逆诱导作用发挥主要是由于抗逆代谢物数量的增加[56],这些物质包括来自于苯丙氨酸代谢途径[41]。TrichodermaharzianumJF419706接种黄瓜幼苗刺激植株体内脯氨酸和这总酚含量的升高,提高了黄瓜抗根腐病(Fusariumoxysporiumf. sp.cucumerinumHQ905450转化型根腐病原菌)能力[1]。本研究结果表明,接种哈茨木霉菌DQ002促进了根腐病病原菌胁迫下黄瓜直根苗根系中PAL酶活性和类黄酮总量的增加,可能通过激活苯丙氨酸代谢途径中抗菌次生代谢物质-类黄酮的合成与积累,增强了细胞壁的抗菌侵染能力,进而缓解了病原菌对根系细胞的攻击与危害。辣椒接种根腐病病原菌后,嫁接辣椒根系中PAL 活性、可溶性糖、酚类物质和木质素含量显著增加,且嫁接辣椒根腐病发病率和病情指数显著低于直根苗[41]。本研究中,嫁接苗能明显降低黄瓜植株的根腐病发病率与病情指数,可能还与嫁接黄瓜苗根系中PAL活性、类黄酮的合成有关,但是T2处理嫁接苗根系类黄酮含量显著低于T1处理以及木霉菌处理的黄瓜直根苗(T3和T4),因此推测木霉菌和病原菌接种黄瓜直根苗可能存在双重真菌的刺激作用,促进类黄酮积累,但木霉菌的促进作用是否占重要地位,还不清楚,需进一步进行探索。这些结果也暗示了接种病原菌条件下,嫁接黄瓜苗苯丙氨酸代谢途径生成的次生代谢物参与抗根腐病,但是其代谢物质发挥抗菌作用不以类黄酮为主要的抗病原菌物质,可能还存在苯丙氨酸代谢途径中合成的其他次生代谢物质——酚类物质、木质素等[41],可能也是二者调节黄瓜根腐病发生率存在差异的原因之一,但需要从代谢组和分子生物学方面进行进一步验证。
当植物受到病原菌侵染时,也会诱导植物体内抗病相关的几丁质酶和葡聚糖酶类活性升高,增加防御能力[56]。木霉菌几丁质酶基因(Chit42)在烟草、土豆以及大麦中的表达提高了其对土传病害的抗性[57],而哈茨木霉菌T-203接种黄瓜根系促进了根系POD和几丁质酶活性升高,根系积累了大量的胼胝质和纤维素,诱导了植株系统抗性增强[56]。这些研究说明木霉菌接种植物根系后,能通过诱导抗病相关的几丁质酶和葡聚糖酶活性增强抗病能力。本研究中黄瓜直根苗在接种根腐病病原菌的条件下,接种木霉菌的处理(T3和T4)黄瓜直根苗根系几丁质酶、β-1,3-葡聚糖酶活性显著升高,且明显高于嫁接苗(T2)处理,这可能也是哈茨木霉菌DQ002降低黄瓜直根苗根腐病发生率能力高于嫁接苗的原因之一。高苇等[58]研究报道,在添加菌糠木霉菌发酵物后,土壤中几丁质酶和β-1, 3-葡聚糖酶的活性显著升高,对病原真菌细胞壁具有较强的分解作用;在接种辣椒疫霉菌前,嫁接苗接穗的β-1,3-葡聚糖酶活性得到提高,且砧木抗病性越强,接穗中的抗病性相关酶活性越高[59]。前人的研究暗示了木霉菌的使用和嫁接栽培都能有效防治土传病害,但本研究发现木霉菌接种处理对黄瓜直根苗的生理代谢及抗病相关酶活性的促进作用强于黄瓜嫁接对黄瓜苗的调节作用,因此木霉菌处理的黄瓜直根苗发病率则低于嫁接苗的发病率,而二者对抗病相关酶的调节产生差异的分子生物学机理还不清楚。木霉菌接种植物根系刺激植物产生的H2O2、NO、乙烯等信号物质参与了信号传导及植物抗毒素物质、类黄酮、萜类、酚类物质及其他杀菌物质的合成[60],且黄瓜与拟南芥中MAPK信号级联系统参与了木霉菌激活植物抗毒素合成[56],提高了抗逆能力。此外,哈茨木霉菌接种拟南芥促进了WRKY18、WRKY40、WRKY60和WRKY33的表达,启动了JA介导的防御系统[61],而在甜瓜中,哈茨木霉菌提高SA和JA水平,改变了甜瓜对尖孢镰刀菌的响应[62];在烟草中,绿色木霉菌激活乙烯的释放和植株抗逆系统[56]。而关于蔬菜嫁接栽培提高植株抗病害性能中,是否也存在与木霉菌调节植株抗病性能相同的分子调控网络,鲜有报道;且在黄瓜抗根腐病方面,二者之间是否存在分子调控网络的差异而导致病害发生率差异,还需进一步探讨。
4 结 论


