氢吗啡酮对急性肺损伤大鼠水通道蛋白1、5表达的影响
李心怡 王庆元 张 静 王 锦 王成夭
1武汉大学中南医院麻醉科 湖北 武汉 430071;2团风县人民医院麻醉科 湖北 黄冈 438800
急性肺损伤/急性呼吸窘迫综合征(acute lung injury/acute respiratory distress syndrome,ALI/ARDS)是由严重感染、创伤、休克等各种非心源性因素导致的弥漫性肺部损伤病变。脂多糖(lipopolysaecharide,LPS)导致的内毒素血症是造成ALI/ARDS 最常见的原因[1]。ALI 病理学特征是:大量炎性细胞浸润、破坏肺泡上皮完整性、毛细血管的通透性增加。液体在通过毛细血管内皮时发生转运障碍而进入肺泡和间质,形成渗出性肺水肿[2]。水通道蛋白(aquaporins,AQPs)是介导肺组织内水分快速跨膜转运的蛋白。当发生急性肺损伤后,AQPs 表达下降,肺内液体转运功能受损,肺水肿加重[3]。阿片类药物是临床常用的麻醉药物,研究表明,阿片类药物减轻ALI 中的炎症反应[4]。氢吗啡酮(hydromorphone,HYD)是一种μ 受体激动剂,其镇痛效果比吗啡高5 倍。氢吗啡酮除具有较强镇痛效应外,对心肌缺血再灌注损伤还具有较好的器官保护作用[5],其能否减轻急性肺损伤目前尚未见报道。本研究拟评价氢吗啡酮预先给药对LPS 导致的急性肺损伤肺组织AQP-1 和AQP-5 表达的影响,来探讨氢吗啡酮减轻肺损伤的机制。
1 资料与方法
1.1 药品、试剂与仪器盐酸氢吗啡酮注射液(批号:H20120100,湖北宜昌人福药业有限公司);LPS(Sigma 公司,美国);IL-1β、TNF-α 试剂盒(Sigma 公司,美国),ABL80FLEX 血气分析仪(Radiometer 公司,丹麦),高速低温离心机(Heraeus 公司,德国),Leica-DM6000CCD 摄像系统(Leica 公司,德国)。
1.2 动物分组SD 大鼠36 只(成年雄性),体质量300~350 g,为武汉大学医学部动物中心提供,随机分为3 组(n=12):假手术组(Sham 组)、ALI 组(ALI组)和氢吗啡酮预先给药组(HYD 组)。
大鼠LPS 性ALI 模型制备:采用经股静脉注射LPS 8 mg/kg 制备大鼠ALI 模型。大鼠麻醉之后,采取仰卧位固定,分离右侧股动脉及股静脉,股静脉朝向心脏方向穿刺并置管用于给药。HYD 组经股静脉注射2 mg/kg 氢吗啡酮,Sham 组与ALI 组分别注射等容积生理盐水。于10 min 后ALI 组和HYD 组 经 股 静 脉 注 射LPS 8 mg/kg,Sham 组 注 射等容积生理盐水。
1.3 观察指标模型制备后6 h 时,静脉采血留取血样,然后行支气管肺泡灌洗,并收集支气管肺泡灌洗液(BALF),取肺组织冻存于-70 ℃冰箱。
1.3.1肺组织W/D 比 取左肺组织,4 ℃生理盐水冲洗,用滤纸吸干表面水分,先称湿重(W),随后置于干燥箱80 ℃烘干,于24 h 后称干重(D),最后计算肺组织W/D 比值。
1.3.2肺通透性指数(LPI) 将血样置于EP 管中,在4 ℃下离心15 min(12 000×g),取上清保存于-70 ℃冰箱。将BALF 在4 ℃温度离心15 min(12 000×g),取上清保存于-70 ℃冰箱。考马斯亮蓝法检测血浆和BALF 总蛋白浓度,并计算LPI(LPI=BALF 中总蛋白浓度/血浆总蛋白浓度)。
1.3.3肺组织病理学评分 取右肺上叶组织,石蜡包埋后,制备切片,HE 染色,光镜下观察肺组织病理学改变。肺组织病理学损伤评分标准:肺泡出血;充血;肺泡腔及血管壁中性粒细胞浸润聚集;肺泡壁增厚以及透明膜形成。4 项指标分别按照病变轻重评0~4 分(无病变或非常轻微为0 分,轻度病变为1 分,中度病变为2 分,重度病变为3 分,极重度病变为4 分)。肺损伤评分为计算4 项指标的总分[6]。
1.3.4免疫组化检测AQP-l、AQP-5 蛋白表达用链霉亲和素-过氧化物酶复合物(SABC)法进行染色。5 μm 切片脱蜡,采用3%过氧化氢灭活内源性的过氧化物酶,5~10 min 后热修复抗原,用血清封 闭20 min,再 滴 加AQPs 一 抗(Abcam 公 司,英国)。4 ℃过夜后,加入二抗(山羊抗兔IgG),37 ℃孵育20 min,随后滴加SABC(免疫组化试剂盒,武汉博士德生物工程公司),37 ℃孵育20 min。在二氨基联苯胺(DAB)下显色,光镜下观察肺组织棕褐色染色为阳性表达。Image J 软件分析测定AQP-1 及AQP-5 相对蛋白表达。
1.3.5肺组织TNF-α、IL-1β 含量的测定 取右肺中叶组织,精确称重,匀浆,在10 000×g转速下超速离心10 min 后,取上清,ELISA 法测定肺组织IL-1β、TNF-α 含 量,按 照IL-1β、TNF-α 试 剂 盒(R&D,美国公司)说明书进行操作。
1.3.6RT-PCR 检 测AQP-1、AQP-5 mRNA 的 表达 取100 mg 右肺下叶组织,用TRIzol 法提取总RNA,逆转录得cDNA。引物由Invitrogen Biotechnology Co,LTD 公 司 合 成。 AQP-1 正 义 引 物5'-TGTGCGTTCTGGCTAC-3';反 义 引 物 :5'-CTATTTGGGCTTCATCTC-3'。AQP-5 正 义引物:5'-CAAGGCGGTGTTCGCAGAGTTCC-3';反 义 引 物:5'-CCTCTCGATGATCTTCCCAGTCC-3'。PCR 完成后,结果以目的条带与β-actin 的IOD 比值表示AQP-1 mRNA、AQP-5 mRNA 表达的相对强度。
1.3.7免疫印迹法检测AQP-1、AQP-5 蛋白表达 取50 mg 右肺下叶组织约,匀浆、裂解后,提取组织蛋白,取蛋白质样品30 g,加同等体积的缓冲液(2×SDS-PAGE 样 品),沸 水 煮5 min 后,进 行SDS-PAGE 蛋白电泳。随后转移至PVDF 膜,ECL下发光、显影,成像系统扫描蛋白条带,进行半定量分析影带。以目的条带与β-actin(内参)光密度值的比值计算肺组织AQP-1、AQP-5 蛋白的相对表达量。
1.4 统计学分析SPSS 20.0 统计学软件进行统计分析,以均数±标准差(±s)表示计量资料,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 肺组织病理学改变光镜下观察Sham 组肺泡间隔均匀,肺泡内未见炎性细胞浸润。ALI 组肺组织大量炎性细胞浸润,肺泡间隔明显增宽,肺泡水肿明显,部分肺泡有透明膜形成。HYD 组肺泡间隔呈轻度增宽,肺泡内少量出血伴有少量炎性细胞浸润,见图1。Sham 组病理学损伤评分低于ALI 组与HYD 组(P<0.05),HYD 组病理学损伤评分低于ALI 组(P<0.05),见表1。
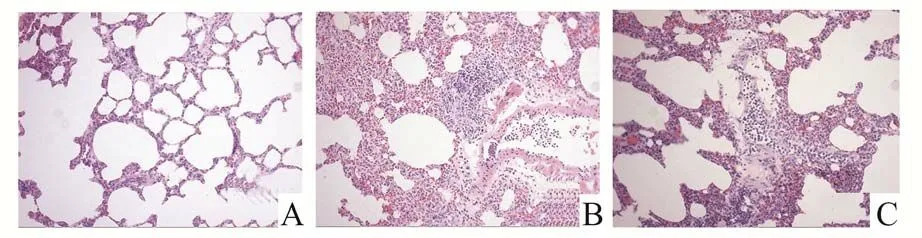
图1 三组大鼠肺组织病理学结果(×200)
表1 三组大鼠W/D 比值、LPI、病理学评分、TNF-α 和IL-1β 含量的比较(n=12, ±s)
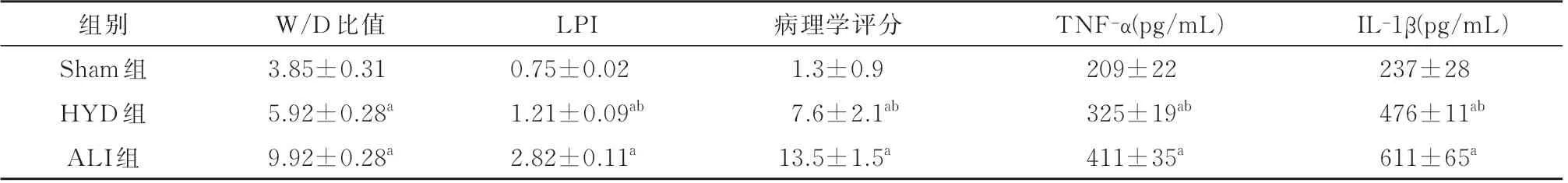
表1 三组大鼠W/D 比值、LPI、病理学评分、TNF-α 和IL-1β 含量的比较(n=12, ±s)
与Sham 组比较,aP<0.05;与ALI 组比较,bP<0.05
IL-1β(pg/mL)237±28 476±11ab 611±65a组别Sham 组HYD 组ALI 组W/D 比值3.85±0.31 5.92±0.28a 9.92±0.28a LPI 0.75±0.02 1.21±0.09ab 2.82±0.11a病理学评分1.3±0.9 7.6±2.1ab 13.5±1.5a TNF-α(pg/mL)209±22 325±19ab 411±35a
2.2 免疫组化检测肺组织AQP-1 和AQP-5 表达光镜下三组肺组织中肺泡周围和支气管周围的毛细血管内皮及肺泡上皮均有AQP-1 和AQP-5阳性染色(呈棕黄色)。与Sham 组比较,ALI 组、HYD 组AQP-1、AQP-5 表达明显降低;与ALI 组比较,HYD 组 AQP-1、AQP-5 表 达 明 显 升 高(P<0.05),见图2、3。
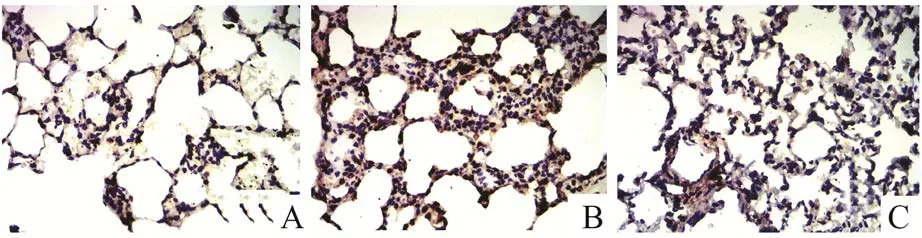
图2 三组大鼠肺组织AQP-1 免疫组化染色结果(×200)
2.3 肺组织通透性及炎性因子的改变与Sham组 比 较,ALI 组、HYD 组 的W/D 比 值、LPI 及TNF-α 和IL-1β 含量明显升高(P<0.05);而与ALI组 比 较,HYD 组 的W/D 比 值、LPI 及TNF-α 和IL-1β 含量明显降低(P<0.05),见表1。
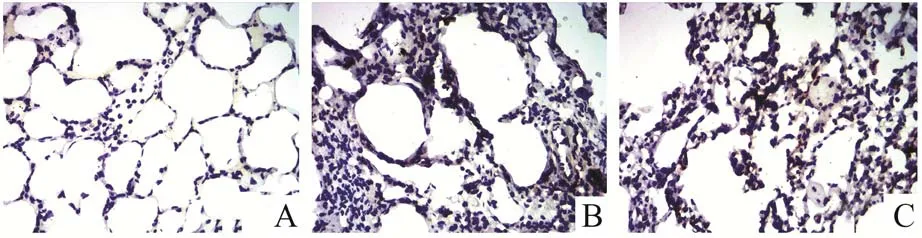
图3 三组大鼠肺组织AQP-5 免疫组化染色结果(×200)
2.4 免疫印迹及RT-PCR 检测肺组织AQP-1 和AQP-5 的mRNA 及蛋白表达与Sham 组比较,ALI 组、HYD 组肺组织AQP-1、AQP-5 mRNA 以及蛋白表达下调(P<0.05);与ALI 组比较,HYD 组肺组织AQP-1、AQP-5 mRNA 以及蛋白表达上调(P<0.05),见图4、表2。
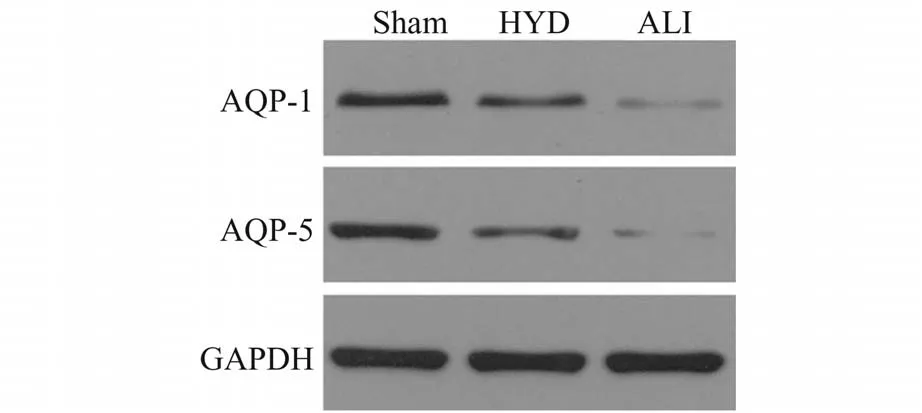
图4 Western Blot 检测三组大鼠肺组织中AQP-l、AQP-5 蛋白表达含量
表2 三组大鼠AQP-1、AQP-5 mRNA 和蛋白表达的比较(n=12,±s)
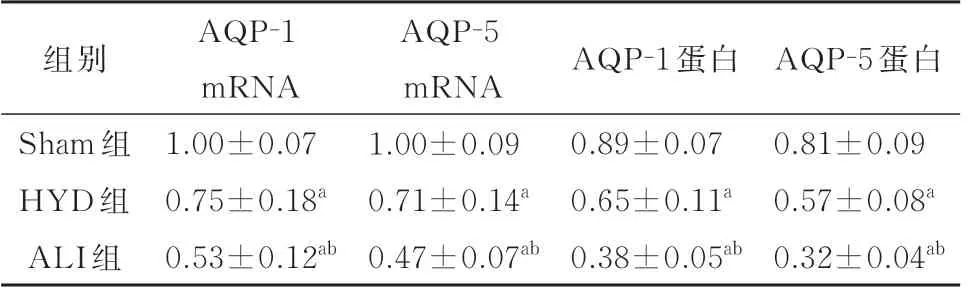
表2 三组大鼠AQP-1、AQP-5 mRNA 和蛋白表达的比较(n=12,±s)
与Sham 组比较,aP<0.05;与ALI 组比较,bP<0.05
组别AQP-1 蛋白AQP-5 蛋白Sham 组HYD 组ALI 组AQP-1 mRNA 1.00±0.07 0.75±0.18a 0.53±0.12ab AQP-5 mRNA 1.00±0.09 0.71±0.14a 0.47±0.07ab 0.81±0.09 0.57±0.08a 0.32±0.04ab 0.89±0.07 0.65±0.11a 0.38±0.05ab
3 讨论
本研究采用经静脉注射LPS 的经典方法建立大鼠ALI 模型。实验结果表明,与Sham 组相比,ALI 组及HYD 组肺组织病理学评分、肺通透性指数及W/D 比值均升高,提示模型制备成功。
ALI 早期的病理生理改变就是肺泡上皮/微血管 内 皮(pulmonary microvascular endothelial cells,PMEC)屏障破坏,对蛋白、液体通透性的增加,可导致肺泡内外的液体转运失衡。肺通透性指数可反映肺组织对蛋白的通透性[3]。LPS 性ALI,4~8 h肺水肿达到高峰期,出现肺泡性肺水肿。PMEC 的液体转运功能在肺水肿发生中发挥重要作用,其对液体转运的完成有赖于水通道蛋白(AQPs)的主动转运[7]。
AQPs 是对水具有特异转运功能的细胞膜通道蛋白,其在细胞膜中以四聚体形式存在,且每一单体均可形成一个功能性水通道,具有减轻肺水肿形成的作用。AQPs 在哺乳动物体内被确认有13 种,分布于肺组织中的有6 种(AQP-1,-3,-4,-5,-8,-9)。其中,AQP-1、AQP-5 与肺部炎症密切相关,其参与肺泡炎性水肿的形成[8]。AQP-1 主要分布于肺泡Ⅱ型上皮细胞、肺泡毛细血管内皮,QP-1 作用主要是清除支气管及脉管周围的内水分。AQP-5 位于肺泡Ⅰ型细胞膜,其作用主要是清除肺泡腔内水分。文献报道,AQP-1 KO 小鼠的肺泡-毛细血管对水的渗透性较野生型降低10 倍,AQP-1、-5 基因均敲除的小鼠通透性降低25~30 倍[9]。谢艳萍等[10]采用同位素示踪法,观察原代培养的PMEC,发现TNF-α、IL-1β 对AQP-1、AQP-5 可产生损伤作 用:包括减弱AQP-1、AQP-5 的水转运功能,并导致其蛋白表达显著下降。LPS 诱发的ALI 中,炎性因子释放,启动和扩大“级联瀑布样”炎症反应,损伤PMEC,AQP-1、AQP-5 在肺组织的表达显著减少,其水转运功能受损,肺泡-毛细血管之间对水的跨膜转运速率减慢,导致水分在肺泡腔及肺间质的积聚,因为加重肺水肿[10]。
研究表明阿片类药物用于围术期,除镇痛作用外,亦可减轻心、肺、肝、肠等重要脏器的缺血再灌注损伤[4,11-13],其机制可能与抗炎、抗氧化、抗细胞凋亡有关。μ 阿片类受体和κ 阿片类受体激活后,能刺激内皮细胞的一氧化氮合酶,诱导一氧化氮的产生,进而干扰炎症因子信号通路来抑制炎症因子的表达[14]。另有研究表明,阿片类受体激活可稳定线粒体膜电位,下调细胞内细胞色素C 和Bax 蛋白表达,通过抑制caspase-3 激活来阻止细胞凋亡的发生,从而抑制炎症反应[15,16]。氢吗啡酮是吗啡的半合成衍生物,强效作用于中枢μ 受体,目前广泛用于麻醉镇痛[17]。氢吗啡酮究竟通过何种机制来抑制急性肺损伤中的炎症反应,还有待进一步研究。本实验结果表明,与ALI 组比较,HYD 组中肺组织病理学损伤程度、肺通透性指数、肺W/D 比值均降低,提示氢吗啡酮可减轻ALI 的肺水肿程度。而与ALI 组 比 较,HYD 组 中 炎 性 因 子 降 低,AQP-1 和AQP-5 的表达上调,并且AQP-1 和AQP-5 与肺损伤指标之间的变化存在明显负相关,推测氢吗啡酮可抑制炎症反应,上调AQP-1 和AQP-5 的表达。
综上所述,氢吗啡酮预先给药减轻急性肺损伤的机制可能与抑制炎症反应以及上调AQP-1 和AQP-5 的表达有关。

