A型塞内卡病毒VP1蛋白的原核表达及纯化
杜文琪,夏立叶,李桂梅,2,3,单 虎,2,3
(1.青岛农业大学动物医学院,青岛 266109;2.山东省新兽药创制协同创新中心,青岛 266109;3.山东省兽药诊断试剂工程技术研究中心,青岛 266109)
猪塞内卡病毒病是由A型塞内卡病毒(Seneca virus A,SVA)引起的猪发生水疱性相关疾病的传染性疾病[1]。SVA可感染不同品种和年龄的猪,仔猪感染后死亡率高,成年猪感染后症状不明显,育肥猪感染后出现生产停滞,饲料转化率降低。SVA最早于2002年在美国首次分离到,早期研究显示该病毒对人和动物无致病性[2-3]。2008和2012年分别于加拿大和美国在感染了水疱病的猪中发现了SVA。2014和2015年,研究发现SVA感染与母猪水疱病(SVD)的暴发及巴西和美国的新生猪死亡率有关[2]。随后美国、澳大利亚、意大利、巴西、哥伦比亚、泰国等均有相关报道[4]。2015年,中国广东地区养猪场出现了猪塞内卡病毒病,随后湖南、河南、福建、黑龙江等地均有相关报道[5]。SVA是小核糖核酸病毒科(Picornaviridae)塞内卡病毒属(Senecavirus)中唯一一种病毒,基因组长约为7.3 kb,包括1个大的开放阅读框(ORF)、5′-端非翻译区(5′-UTR)和多腺苷酸化的3′-端非翻译区(3′-UTR)[6]。SVA的衣壳蛋白主要由VP1、VP2、VP3和VP4 4种结构蛋白构成,其中VP1和VP2蛋白决定塞内卡病毒的细胞嗜性,VP1和VP3蛋白决定塞内卡病毒的抗原性,此外VP2和VP4蛋白参与塞内卡病毒的核酸包装。VP1最具抗原性,可刺激机体产生中和抗体[7],常被用作SVA诊断试剂的研制。
SVA临床症状与猪水疱病、口蹄疫(FMD)等水疱性疾病难以区分,且尚无商品化疫苗,给SVA的防控工作带来巨大挑战。目前,在血清学方面可用于SVA筛查的抗体检测方法主要包括酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)、间接免疫荧光抗体试验(indirect immunofluorescenct antibody test,IFA)和病毒中和试验(virus neutralization test,VN),但耗时久、需样本量大、花费成本高,且在单个反应中同时检测多种分析物的能力受到限制[8]。液相芯片也称为微球体悬浮芯片,是1995年美国 Luminex公司基于xMAP(flexible multi analyte profiling)技术研发的新型生物芯片技术平台,其检测更加开放灵活,能同时检测多个样品的多个目标,可确保数小时内获得更灵敏的检测结果,且仅需极少量的样品,具有常规方法无法比拟的优势[9]。本研究旨在原核表达可溶性SVA的VP1蛋白,将其纯化后与荧光微球进行偶联,初步建立SVA抗体单重液相芯片检测方法,以期为后续完成其评估性试验以及实现SVA与其他相似疾病的鉴别诊断奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 大肠杆菌DH5α和BL21(DE3)感受态细胞(TaKaRa公司);原核表达载体pCold TF质粒由青岛农业大学预防兽医学重点实验室保存。
1.1.2 主要试剂 SanPrep 柱式质粒DNA 小量抽提试剂盒(生工生物工程(上海)股份有限公司);IPTG(上海蓝季科技发展有限公司);His标签蛋白纯化试剂盒(北京康为世纪生物科技有限公司);Bradford蛋白浓度测定试剂盒、增强型HRP-DAB底物显色试剂盒(天根生化科技(北京)有限公司);抗His单克隆抗体、预染蛋白质分子质量标准及SDS-PAGE上样缓冲液(北京索来宝科技有限公司);辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(北京中杉金桥生物技术有限公司);磁珠检测平底板、96 孔板避光封板膜、Bio-Plex 偶联试剂盒、Bio-Plex 羧基磁珠(MC10044)、EDC和S-NHS、Bio-Plex 检测反应试剂盒(伯乐生命医学产品(上海)有限公司);生物素化的抗His单克隆抗体(6×His Tag Monoclonal Antibody,Biotin)(Invitrogen公司);SVA 阳性血清及阴性血清均为青岛农业大学预防兽医学重点实验室保存。
1.2 方法
1.2.1 重组质粒的构建及鉴定 根据GenBank收录的塞内卡病毒VP1基因序列(登录号:KY747514.1),在不影响VP1蛋白氨基酸序列的前提下,对该序列进行分析和密码子优化,同时构建pColdⅠ-VP1重组载体,由中美泰和生物技术有限公司合成和测序。用NedⅠ和PstⅠ对pColdⅠ-VP1原核表达质粒进行双酶切,37 ℃水浴酶切4 h,利用1.0%琼脂糖凝胶电泳进行分离后回收目的基因VP1。利用连接酶将目的基因VP1连接于表达载体pCold TF中,将连接产物转化大肠杆菌DH5α感受态细胞,涂布于含氨苄青霉素的LB平板过夜培养,挑取单菌落接种于含氨苄青霉素的LB液体培养基,37 ℃、220 r/min振荡培养12 h,提取质粒。构建pCold TF-VP1原核表达质粒,将采用双酶切方法鉴定为阳性的重组质粒送至生工生物工程(上海)股份有限公司测序。
1.2.2 VP1重组蛋白诱导表达 将阳性重组质粒转化大肠杆菌BL21(DE3)感受态细胞,加入LB液体培养基,37 ℃、220 r/min振荡培养1 h。离心弃部分上清液,取100 μL混匀的细菌溶液涂布于含氨苄青霉素的LB平板37 ℃过夜培养。挑取单菌落于含氨苄青霉素的LB液体培养基中,37 ℃、220 r/min振荡培养过夜,菌液于-80 ℃保存。按1∶100比例将空载体菌液和重组蛋白菌液接种于含氨苄青霉素的LB液体培养基中,37 ℃、220 r/min 振荡培养至D600 nm值为0.6~0.8,每管加入终浓度为1 mmol/L的IPTG,16 ℃、220 r/min诱导表达9 h。同时设立对照。诱导结束后4 ℃、12 000 r/min离心15 min,分别收集菌体,加入适量PBS重悬菌体,分别取10 μL与4×SDS-PAGE上样缓冲液混合均匀,煮沸10 min,进行SDS-PAGE。
1.2.3 VP1重组蛋白诱导表达条件优化 将空载体菌液和VP1重组菌37 ℃、220 r/min 振荡培养至D600 nm值为0.6~0.8。VP1重组菌分别加入终浓度为0.4、0.6、0.8、1.0、1.2和1.5 mmol/L的IPTG,空载体菌液加入终浓度为1 mmol/L的IPTG,同时设立对照,诱导12 h后,收集菌液,处理样品并进行SDS-PAGE,分析最佳IPTG诱导浓度[10-12]。
将空载体菌液和重组蛋白菌液37 ℃、220 r/min振荡培养至D600 nm值为0.6~0.8。每管加入终浓度为1.2 mmol/L的IPTG进行诱导,同时设立对照。重组蛋白菌液分别于诱导后3、6、9、12、22和24 h取等量的菌液,处理样品并进行SDS-PAGE,分析最佳的诱导时间[9-10]。
1.2.4 VP1重组蛋白可溶性分析 使用优化的诱导条件培养重组菌体,分别收集菌体加入适量PBS重悬后冰浴超声破碎。超声结束后,4 ℃、12 000 r/min离心15 min,分别收集上清液和菌体沉淀进行SDS-PAGE[11-12]。
1.2.5 VP1重组蛋白纯化及SDS-PAGE鉴定 在优化的诱导条件下大量扩增重组菌液,如1.2.4所述制备菌液上清。用Bradford 法测定蛋白浓度[11]。参照His标签蛋白纯化试剂盒说明书纯化VP1重组蛋白,收集洗脱峰并进行SDS-PAGE鉴定分析。
1.2.6 VP1重组蛋白Western blotting分析 将纯化的VP1重组蛋白转移至PVDF膜上5%脱脂奶粉4 ℃封闭过夜。以抗His单克隆抗体作为一抗室温孵育2 h,以山羊抗小鼠IgG作为二抗室温室温孵育2 h。用HRP-DAB显色试剂盒进行显色,用凝胶扫描成像系统进行检测[11-12]。
1.2.7 微球活化和蛋白偶联 参照Bio-Plex胺偶联试剂盒说明书进行两步酰胺反应。取100 μL微球(1.25×106珠)转移到偶联反应管中,注意避光。旋涡混匀后瞬时离心,于磁力架上沉降1 min并弃掉上清,加入100 μL清洗缓冲液清洗微球,于磁力架上沉降1 min并弃掉上清,将微球重新悬浮在80 μL微球活化缓冲液中,加入10 μL 50 mg/mL EDC,随后立即加入10 μL 50 mg/mL S-NHS 漩涡混匀。用铝箔覆盖偶联反应管,在室温下振荡孵育20 min。用PBS清洗并重悬微球。加入适量SVA VP1蛋白,用PBS定容至500 μL,漩涡混匀后,于4 ℃避光过夜偶联。将偶联的微球离心并用PBS清洗,加入250 μL的微球封闭缓冲液,在室温下避光振荡孵育30 min。PBS清洗微球后,悬浮在150 μL的微球储存缓冲液中。
1.2.8 偶联效率的验证 取2个偶联反应管并做好标记,1个作为阴性对照,1个作为测试管。每管分别加入10 000 个偶联的微球。测试管加入50 μL稀释的生物素抗体,对照管中加入50 μL分析缓冲液。室温避光反应30 min。并于磁力架上沉降1 min,缓慢除去上清液。将50 μL稀释的藻红蛋白(P-phycoerythrin,PE)标记的链霉亲和素(streptavidin-PE,SA-PE)加入测试管中,在对照管中加入50 μL分析缓冲液,室温避光孵育10 min。磁力架上沉降1 min,缓慢除去上清液。将微球重悬于125 μL微球贮存缓冲液中,并转移到96孔板中,上机检测。
结果判定标准:阴性对照(背景)的中值荧光强度(median fluorescence intensity,MFI)<100,偶联微球的荧光值>2 000 MFI可认为偶联成功。
1.2.9 最佳结合蛋白浓度的确定 将不同含量(6、9、12和15 μg/1.25×106珠)的SVA-VP1蛋白与1.25×106珠微球偶联,确定最佳结合的蛋白浓度。
1.2.10 SVA抗体单重液相芯片检测方法的建立 偶联好的微球稀释至5 000个/孔,96孔平板中每孔加入50 μL稀释好的微球,于磁力架静置1 min,使微球完全沉淀后甩去上清。微球清洗缓冲液清洗微球2次,样本孔对应加入50 μL SVA阴、阳性血清,对照孔中加入50 μL分析缓冲液。避光贴封板,室温震荡孵育1 h。结束后,清洗微球,每孔加入50 μL稀释好的生物素化的抗His单克隆抗体,避光贴封板,室温振荡孵育45 min,完成后清洗微球,每孔加入50 μL稀释好的SA-PE,避光贴封板,室温振荡孵育10 min,完成后清洗微球,每孔加入125 μL储存缓冲液充分重悬微球,上机检测。
1.3 统计分析
数据用GraphPad Prism 6.0软件分析,采用ANOVA分析。P<0.01表示差异极显著。
2 结 果
2.1 重组质粒的构建及鉴定
重组质粒pCold TF-VP1经NedⅠ、PstⅠ双酶切鉴定,载体片段大小为5 769 bp,目的片段大小为822 bp(图1),与预期大小一致,测序结果与目的基因序列一致,结果证明重组质粒构建成功。

M,DL10000 DNA Marker;1~5,重组质粒 pCold TF-VP1
2.2 VP1重组蛋白的诱导表达
重组蛋白经IPTG诱导后,对诱导前、后菌液及空载体诱导前、后菌液进行SDS-PAGE分析,结果显示,在约82 ku处有一条目的条带(含标签蛋白52 ku)(图2),与预期大小相符,表明VP1重组蛋白初步表达成功。
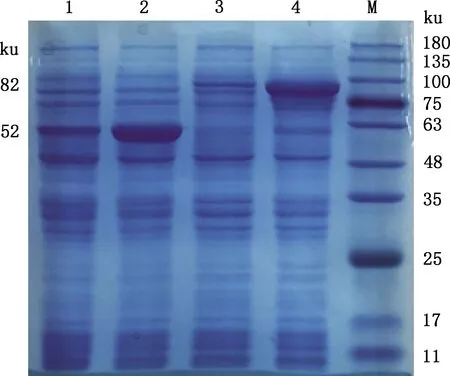
1,未诱导的空载体;2,诱导的空载体;3,未诱导的重组蛋白;4,诱导的重组蛋白;M,蛋白质分子质量标准
2.3 VP1重组蛋白诱导条件优化
由图3可知,当IPTG终浓度为1.2 mmol/L时,蛋白表达量最高。由图4可知,诱导3 h后的蛋白表达量最高。说明16 ℃、220 r/min、1.2 mmol/L IPTG诱导3 h时表达结果最佳。
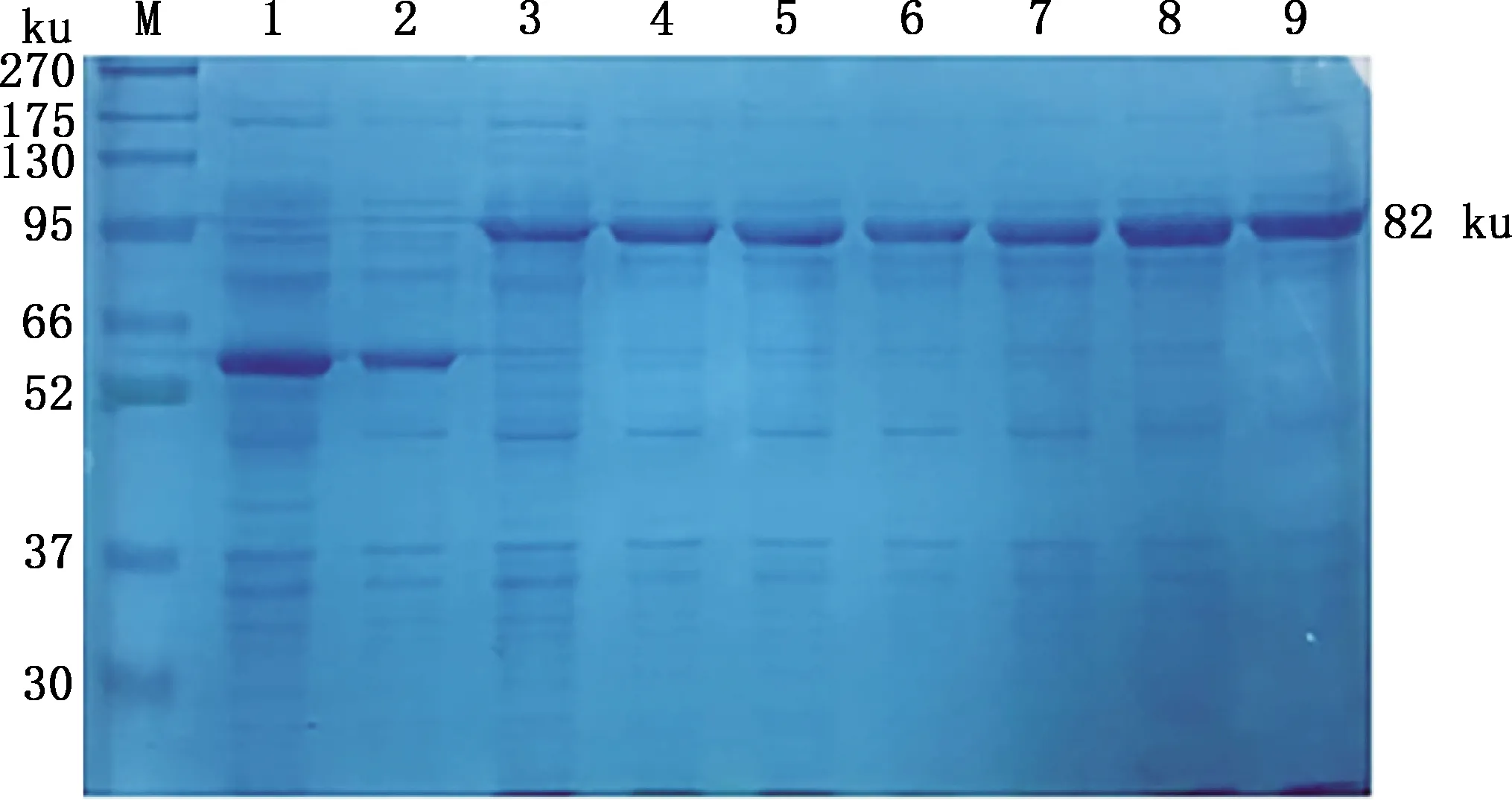
M,蛋白质分子质量标准;1,诱导的空载体;2,未诱导的空载体;3,未诱导的重组蛋白;4~9,IPTG浓度分别为0.4、0.6、0.8、1.0、1.2和1.5 mmol/L
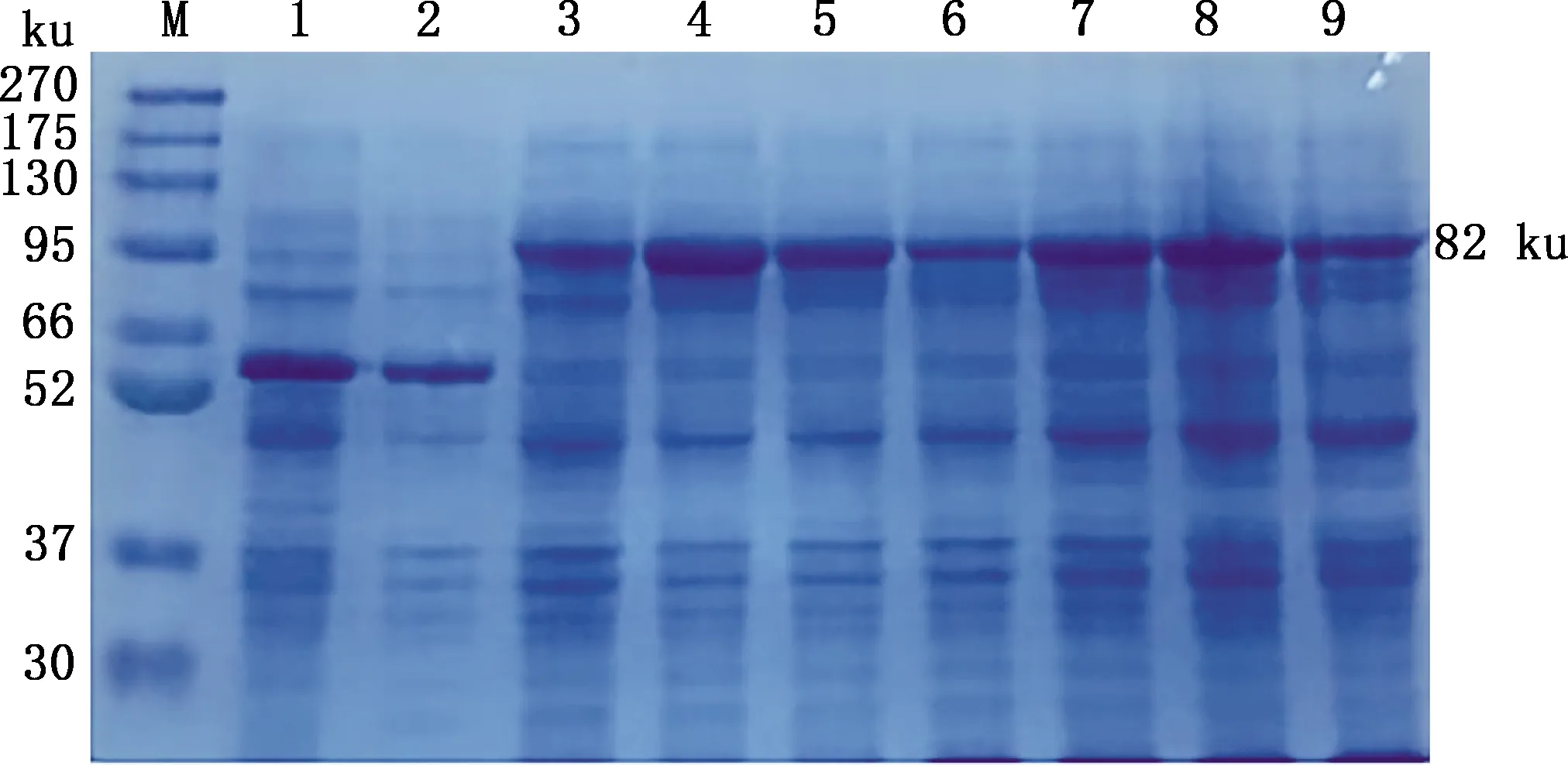
M,蛋白质分子质量标准;1,诱导的空载体;2,未诱导的空载体;3,未诱导的重组蛋白;4~9,诱导时间分别为3、6、9、12、22和24 h
2.4 VP1重组蛋白可溶性鉴定
VP1重组蛋白可溶性分析结果显示,在约82 ku处有目的条带,上清和沉淀中均有表达,且上清中表达量较高(图5),说明该蛋白具有可溶性。
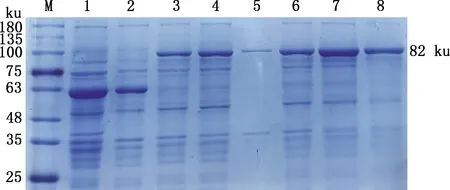
M,蛋白质分子质量标准;1,诱导的空载体;2,未诱导的空载体;3,未诱导的重组蛋白全菌液;4,未诱导的重组蛋白上清;5,未诱导的重组蛋白沉淀;6,诱导的重组蛋白全菌液;7,诱导的重组蛋白上清;8,诱导的重组蛋白沉淀
2.5 VP1重组蛋白的纯化
根据最佳诱导条件诱导VP1重组蛋白大量表达并用蛋白纯化试剂盒进行纯化,分别收集洗脱峰进行SDS-PAGE分析,结果显示在约82 ku处有目的条带(图6),表明成功纯化VP1重组蛋白。
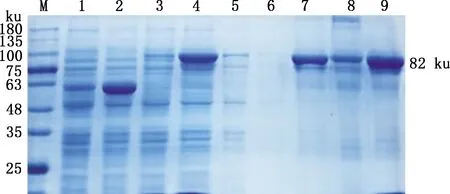
M,蛋白质分子质量标准;1,未诱导的空载体;2,诱导的空载体;3,未诱导的重组蛋白;4,诱导的重组蛋白上清;5,流穿液;6,洗涤液;7~9,分别为洗脱液1、2和3
2.6 VP1重组蛋白Western blotting分析
Western blotting检测结果显示,纯化后重组VP1蛋白能被His单克隆抗体识别,在约82 ku处有目的条带(图7),与SDS-PAGE中重组VP1蛋白大小一致。
2.7 偶联效率验证
偶联效率验证结果显示,阴性对照(背景)的平均MFI为17(<100);测试孔的平均MFI为2 339.5(>2 000),证明SVA VP1蛋白与微球偶联成功。
2.8 最佳结合蛋白浓度的确定
将不同含量(6、9、12和15 μg/1.25×106珠)的SVA-VP1蛋白与1.25×106珠微球偶联,结果显示当蛋白浓度<12 μg/1.25×106珠时,样品中的MFI随着VP1蛋白浓度增加而逐渐升高,当蛋白浓度为12 μg/1.25×106珠时,平均MFI达到2 689.0,进一步升高蛋白浓度并不能增加MFI。不同蛋白浓度下,背景对照的平均MFI均<100,由此确定出最佳结合的蛋白浓度为12 μg/1.25×106珠微球(表1)。
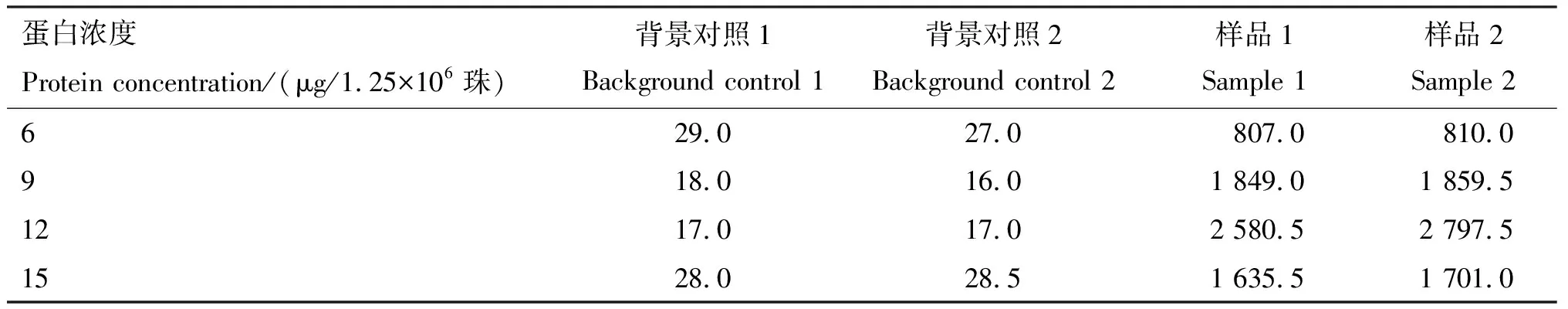
表1 不同浓度蛋白MFI
2.9 SVA抗体单重液相芯片检测方法的建立
由图8可知,背景对照MFI的平均值为23.5,SVA阳性血清MFI的平均值为10 172,极显著高于阴性血清MFI的平均值162.5(P<0.01),说明VP1蛋白偶联的荧光微球可用于SVA抗体的检测。

①BC,背景对照;NC,阴性血清;SVA-4×,4倍稀释阳性血清。②与BC相比,**,差异极显著(P<0.01)
3 讨 论
猪塞内卡病毒病被认为是一种新兴的家畜传染病,近年来持续引发关注[13]。作为猪水疱病的新病原体,SVA在不同地区、国家迅速进化和传播,但早期的塞内卡病毒分离株对猪没有明显致病性,而近年来从巴西、美国、中国、加拿大、哥伦比亚和泰国等国家的相关病例报道可发现其致病性显著增强[14-19],表明塞内卡病毒正朝着更强毒力的表型进化,应引发高度关注。为了更好地防控和检测塞内卡病毒病,开展塞内卡病毒病检测技术的相关研究十分必要[20]。
对于SVA的防控有赖于对其准确快速的检测,血清学方法因操作简单、成本较低,常用于流行病学研究或监测。然而传统的ELISA、IFA和VN检测方法耗时久、所需样本量大、且在单个反应中很难同时将SVA感染与其他类似疾病区分开来,因此亟需建立一种灵敏、快速且高通量的抗体检测技术。新型液相芯片技术的主要优势在于在简单检测的基础上增加了另一个维度,致力于多重分析技术。近年来,研究者致力于液相芯片检测技术在动物疫病检测方面的研究和应用,肖丽等[21]建立同步检测伪狂犬病病毒(PRV)和猪繁殖与呼吸综合征病毒(PRRSV)抗体的双重液相芯片检测方法,与ELISA法相比PRV和PRRSV抗体的最高血清检出稀释倍数分别提高66和32倍。本研究在检测抗原的选择上,SVA VP1蛋白具有高度保守性,且最具抗原性,可刺激机体产生中和抗体[22-23],可作为首选。在表达系统的选择上,大肠杆菌作为最常用的原核表达系统,广泛用于同源和异源蛋白质的表达。重组蛋白在大肠杆菌中包含可溶性和包涵体两种表达形式。由于包涵体难溶且不具天然生物活性,在纯化过程中操作繁琐且成本较高。因此本研究采用冷休克表达载体pCold TF对于VP1蛋白进行表达,以期增加蛋白产量、纯度及可溶性。
本研究利用原核表达载体对SVA VP1蛋白进行了表达,并探索研究了诱导表达过程中诱导时间、IPTG浓度几个重要诱导条件,利用优化后的最佳诱导表达条件,可在短时间内对VP1蛋白大量表达,提高了VP1重组蛋白的表达效率。本试验借助重组载体多克隆位点携带的His标签对重组VP1蛋白成功进行了纯化。为了提高VP1蛋白的纯化效率,在蛋白纯化试验中将Bingding Buffer的咪唑浓度由10 mmol/L降至5 mmol/L,洗脱液中的咪唑浓度为500 mmol/L,获得了纯化效率较高的VP1重组蛋白。纯化后SVA VP1蛋白与微球偶联成功,本研究探讨了VP1蛋白与荧光微球偶联的最佳蛋白浓度,应用偶联成功的荧光微球,通过液相芯片检测技术可对塞内卡病毒阳性血清进行检测,初步建立了SVA抗体液相芯片检测技术。本试验结果为实现区分塞内卡病毒病与其他类似症状的疾病及血清学检测方法的建立奠定了基础。
4 结 论
本研究利用pCold TF原核表达载体对SVA VP1蛋白进行了高效可溶性表达与纯化,纯化后的VP1重组蛋白与荧光微球偶联后,结合液相芯片技术可用于猪血清中塞内卡病毒抗体的检测。

