犬ANP32蛋白多态性及其对A型流感病毒RNA聚合酶活性的影响
张 媛,于萌萌,孙留克,郭 兴,那 雷,刘荻萩,姜 骞,张海丽,2,王晓钧
(1.中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,哈尔滨 150069;2.吉林大学动物医学学院,人兽共患病研究教育部重点实验室,长春 130062)
A型流感病毒(Influenza A virus,IAV)是一种单股、分节段负链RNA病毒,亚型多且在全球范围内广泛传播[1]。野生水禽被公认为是A型流感病毒最大的天然储存库[2]。在特定条件下,A型流感病毒可突破种间屏障感染其他宿主,如感染人、家禽、猪、犬、马等宿主[3-5]。近年来,养殖场经常出现马/犬或犬/禽混合饲养,因此,当有禽流感或马流感暴发时,病毒经不断变异和重组,有可能跨种传播到犬[6-7],引起犬呼吸系统传染性疾病,威胁动物的生命健康,造成严重的社会经济损失,甚至有潜在大流行风险。
RNA聚合酶的适应性是影响A型流感病毒跨物种传播的重要因素之一[8-10]。2016年,Long等[11]首次揭示了禽流感病毒RNA聚合酶在不同宿主细胞中的适应性与鸡酸性核磷蛋白32A(chicken acidic(leucine-rich)nuclear phosphoprotein 32 ku,chANP32A)种属特异性相关。随后有研究报道禽源ANP32A基因存在多态性,且不同的ANP32A剪接变体对禽流感病毒RNA聚合酶的适应性和病毒进化的驱动力不同[12-13]。中国农业科学院哈尔滨兽医研究所马传染病与慢病毒病创新团队前期已从众多宿主因子中筛选并证明宿主因子ANP32A和ANP32B是A型流感病毒RNA聚合酶活性的决定性宿主蛋白,且存在种属特异性[14-15]。犬肾传代细胞系MDCK对不同物种来源的多种亚型的流感病毒株均易感,常用来进行流感病毒的分离及疫苗的研发生产[16]。但目前关于犬ANP32(caANP32)蛋白对不同物种A型流感病毒RNA聚合酶活性的影响报道较少。
本研究克隆并表达了caANP32家族成员caANP32A、caANP32B及caANP32E,初步分析了caANP32A、caANP32B及caANP32E蛋白组织分布及在MDCK细胞中的多态性。利用流感病毒RNA聚合酶双荧光报告系统探索caANP32家族蛋白对不同物种来源的A型流感病毒RNA聚合酶活性的影响,以期为开发应用于疫苗生产、病毒分离等高效犬肾细胞系MDCK提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 犬心脏、肝脏、脾脏、肺脏、肾脏、气管、盲肠、大脑组织样品均由中国农业科学院哈尔滨兽医研究所自然疫源性人兽共患病研究创新团队保存。
1.1.2 质粒及毒株 鸡ANP32A/B(chANP32A/B)、人ANP32A/B(huANP32A/B)、猪ANP32A/B(swANP32A/B)、马ANP32A_X2/32B(eqANP32A_X2/32B)、犬ANP32A/B/E(caANP32A/B/E)的表达质粒及人胚肾细胞(HEK293T,CRL-3216)、人胚肾细胞ANP32A/B双基因敲除细胞系(DKO,CRL-3216)、犬肾细胞系MDCK(CCL-34)均由中国农业科学院哈尔滨兽医研究所马传染病与慢病毒病创新团队保存。
犬流感毒株A/canine/Guangdong/1/2011(H3N2GD11)聚合酶为广东省兽医临床重大疾病综合防控重点实验室馈赠;禽流感病毒A/chicken/Zhejiang/1/2012(H9N2ZJ12)聚合酶由中国农业科学院上海兽医研究所动物流感与禽新发病毒病团队馈赠;马流感毒株A/equine/Jilin/1/1989(H3N8JL89)聚合酶由中国农业科学院哈尔滨兽医研究所保存。上述流感病毒RNA聚合酶报告系统真核表达质粒均构建于pCAGGS-Flag表达载体上。含有人Pol Ⅰ启动子的萤火虫荧光素酶基因报告质粒pEZ-vLuc、含有海肾荧光素酶基因的内参质粒pRL-TK均由中国农业科学院哈尔滨兽医研究所马传染病与慢病毒病研究创新团队制备并保存。
1.1.3 主要试剂及仪器 Trizol、反转录酶试剂盒和KOD PCR酶试剂盒(TOYOBO公司);质粒小量提取试剂盒、PCR产物纯化试剂盒和胶回收试剂盒(南京诺唯赞生物科技有限公司);胎牛血清(FBS)、DMEM培养基、胰蛋白酶、Opti-MEM减血清培养基和蛋白质分子质量标准(Thermo Fisher公司);鼠源抗Flag标签单克隆抗体和鼠源抗β-actin单克隆抗体(Sigma-Aldrich 公司);硝酸纤维素膜(NC膜)(Millipore公司);In-Fusion连接酶试剂盒(Clontech公司);Simply P总RNA提取试剂盒、实时荧光定量PCR TB Green Premix ExTaq(Tli RNaseH Plus)(TaKaRa公司);双荧光素酶试剂盒(Promega公司);细胞消化胰酶(Gibco公司);聚乙烯亚胺P转染试剂、细胞裂解液(150 mmol/L Tris-HCl、5 mmol/L EDTA、50 mmol/L NaCl、1% Triton X-100)以及5×蛋白上样buffer(0.25 mol/L Tris-base、50%甘油、10% SDS、0.5%溴酚蓝、0.1 MDTT)均由中国农业科学院哈尔滨兽医研究所马传染病与慢病毒病创新团队配制及保存。
1.2 方法
1.2.1 组织、细胞RNA提取及反转录 组织RNA提取:将犬心脏、肝脏、脾脏、肺脏、肾脏、气管、盲肠及脑组织分别取约0.1 g剪成小块,按照Trizol法RNA提取试剂盒说明书提取组织基因组RNA,以随机引物按照反转录试剂盒说明书反转录获得cDNA。MDCK细胞RNA提取:按照Simple P总RNA提取试剂盒说明书提取1×106个MDCK细胞总RNA,取1 μg RNA按照反转录试剂盒说明书反转录获得cDNA。
1.2.2 引物设计及合成 基于GenBank数据库登录的caANP32家族基因序列caANP32A(NM_001003013)、caANP32B_X1(XM_022425638)、caANP32B_X2(XM_014117879)、caANP32B_X3(XM_005626854)、caANP32E_X1(XM_022404962)和caANP32E_X2(XM_003639621),针对caANP32基因开放阅读框分别设计实时荧光定量PCR(表1)和基因克隆所需的特异性引物(表2)。引物均由吉林库美有限公司合成。
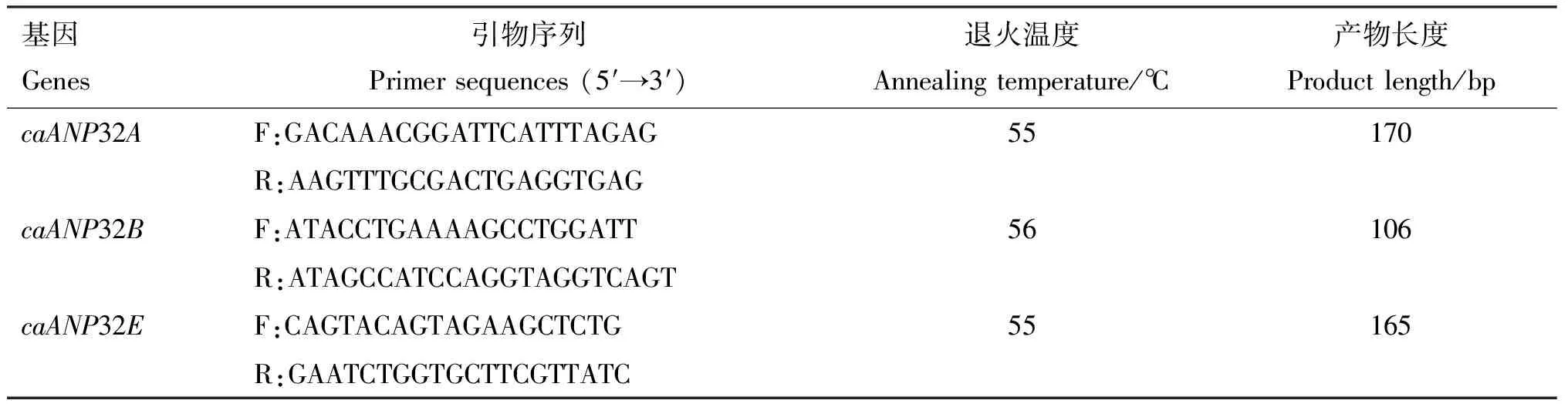
表1 caANP32基因实时荧光定量PCR引物信息
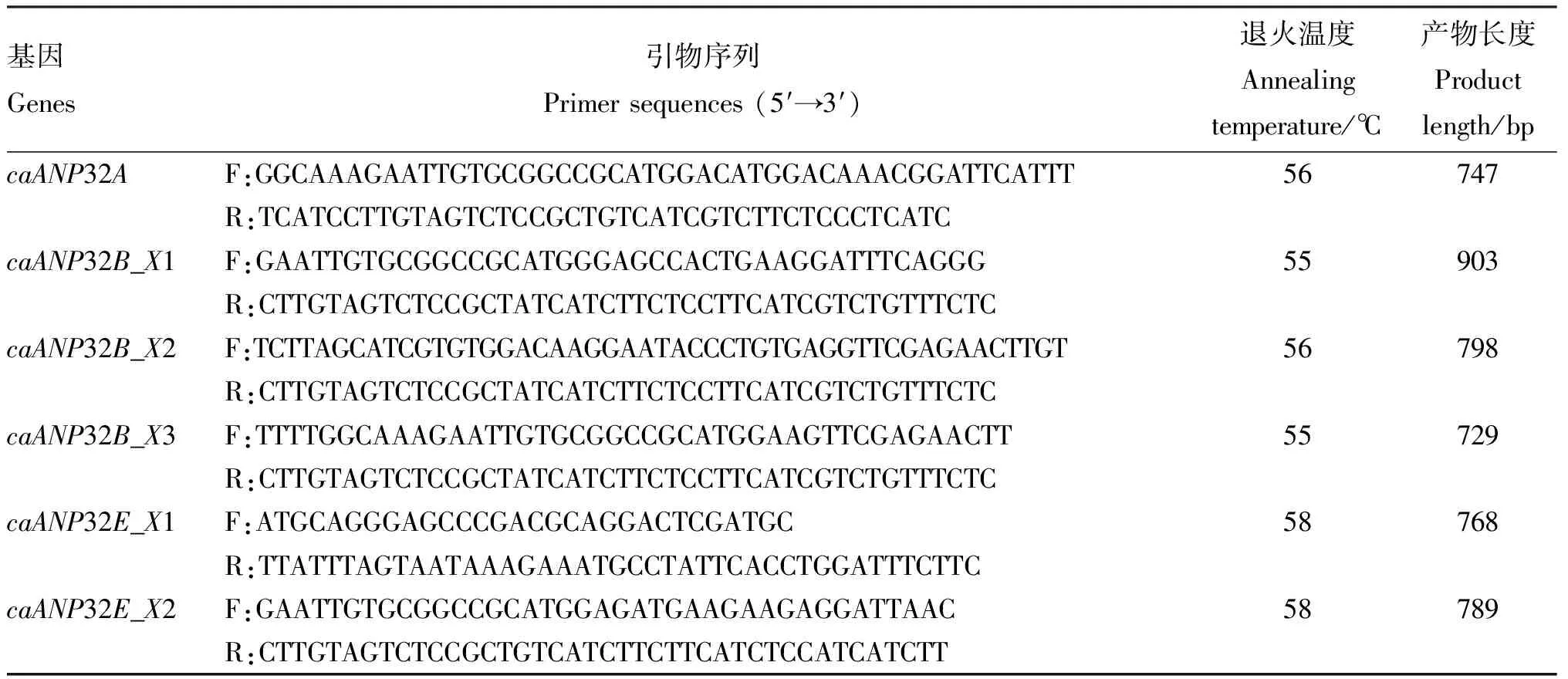
表2 caANP32基因克隆引物信息
1.2.3caANP32A、caANP32B和caANP32E基因组织分布 以1.2.1获得的组织cDNA为模板,采用表1基因特异性引物进行实时荧光定量PCR。反应体系20 μL:TB Green Premix ExTaq(Tli RNaseH Plus)10 μL,上、下游引物(10 pmol/L)各0.8 μL,cDNA模板2.0 μL,ddH2O 6.4 μL。反应程序:95 ℃ 10 min;95 ℃ 30 s,60 ℃ 1 min,72 ℃ 1 min,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 s。
1.2.4caANP32A、caANP32B和caANP32E基因克隆和真核表达质粒的构建 以1.2.1获得的心脏组织cDNA和MDCK细胞cDNA分别作为模板,用表2特异性引物进行PCR反应,扩增caANP32全长目的基因。PCR反应体系50 μL:2×PCR Buffer 25 μL,dNTPs 10 μL,上、下游引物(10 pmol/L)各1 μL,模板200 ng,KOD FX 酶 1 μL,ddH2O补至50 μL。PCR反应程序:95 ℃预变性2 min;98 ℃变性30 s,退火(退火温度见表2)30 s,68 ℃延伸90 s,共35个循环;68 ℃延伸10 min。PCR产物进行1.0%琼脂糖凝胶电泳检测,将目的条带纯化后,通过In-fusion试剂盒连接于真核表达载体pCAGGS-Flag,经测序正确后进行质粒提取以获得相应的重组质粒。
1.2.5 细胞转染 将HEK293T细胞铺于6孔细胞培养板,待细胞汇合度达80%时,将上述获得的caANP32蛋白表达质粒利用转染试剂PEI转染于细胞中,并分别设置pCAGGS-Flag空载体和pCAGGS-huANP32A-Flag质粒为阴性对照和阳性对照。8 h后更换细胞培养液,48 h后裂解细胞,12 000×g离心10 min后,取上清样品加5×SDS上样缓冲液处理后进行SDS-PAGE,按照快速湿转仪将蛋白转移到NC膜上,以鼠源抗Flag单克隆抗体(1∶10 000)和兔源抗β-actin单克隆抗体(1∶5 000)为一抗,DyLight80TM标记的山羊抗鼠IgG(1∶10 000)和山羊抗兔IgG(1∶5 000)为二抗,经Western blotting检测蛋白表达。
1.2.6 氨基酸序列比对 利用DNAMAN和Geneious软件进行氨基酸序列比对。
1.2.7 caANP32家族蛋白对不同物种A型流感病毒RNA聚合酶活性的影响 将ANP32A/B敲除细胞系(DKO)铺于24孔板中,恒温培养约16 h待细胞汇合度达80%左右,分别将不同种属的ANP32蛋白表达质粒pCAGGS-chANP32A-Flag、pCAGGS-chANP32B-Flag、pCAGGS-huANP32A-Flag、pCAGGS-huANP32B-Flag、pCAGGS-swANP32A-Flag、pCAGGS-swANP32B-Flag、pCAGGS-eqANP32A-Flag、pCAGGS-eqANP32B-Flag、pCAGGS-caANP32A-Flag、pCAGGS-caANP32B-Flag、pCAGGS-caANP32E-Flag与不同亚型流感病毒RNA聚合酶亚基和NP基因真核表达质粒(分别为来源于犬流感病毒H3N2GD11、马流感病毒H3N8JL89和禽流感病毒H9N2ZJ12的pCAGGS-NP/PA/PB1/PB2、pEZ-vLuc和pRL-TK)共转染DKO细胞。转染体系如下:每孔分别加入NP(80 ng)、PA(20 ng)、PB1(40 ng)、PB2(40 ng)、vLuc(40 ng)和pRL-TK(1 ng),当研究不同物种ANP32蛋白对聚合酶活性的影响时,在上述体系中加入ANP32真核表达质粒(20 ng)或pCAGGS-Flag空载体(20 ng),转染24 h后弃掉细胞培养液,参照双荧光素酶报告基因检测试剂盒说明书裂解细胞和取样,利用Centro XS LB 960 Luminometer仪器检测Firefly和Renilla的荧光值,萤火虫荧光素酶活性与海肾荧光素酶活性的比值即为病毒RNA聚合酶的活性。
1.2.8 统计分析 试验数据使用GraphPad Prism 7.0软件进行分析,使用方差分析并配合Tukey检验共同进行组间比较,结果以平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 caANP32A、caANP32B和caANP32E基因mRNA的表达及其组织分布
利用实时荧光定量PCR方法对不同组织中caANP32家族基因mRNA表达水平进行定量检测,结果显示,在犬不同组织中均可检测到caANP32A、caANP32B和caANP32E基因mRNA的表达,且在各组织中caANP32家族基因mRNA表达均不同,caANP32B基因mRNA表达丰度均显著或极显著高于caANP32A和caANP32E基因(P<0.05;P<0.01)。caANP32A基因mRNA表达最低。在气管、肺脏、盲肠和大脑中caANP32B基因丰度极显著高于caANP32A和caANP32E基因(P<0.01),在肾脏和脾脏中caANP32B基因丰度显著高于caANP32A和caANP32E基因(P<0.05);在犬心脏中caANP32E基因组织丰度极显著高于caANP32A基因(P<0.01),在盲肠和大脑中caANP32E基因组织丰度显著高于caANP32A基因(P<0.05);在肝脏、肾脏、肺脏、肾脏和气管中caANP32E与caANP32A基因丰度无显著性差异(P>0.05)(图1)。
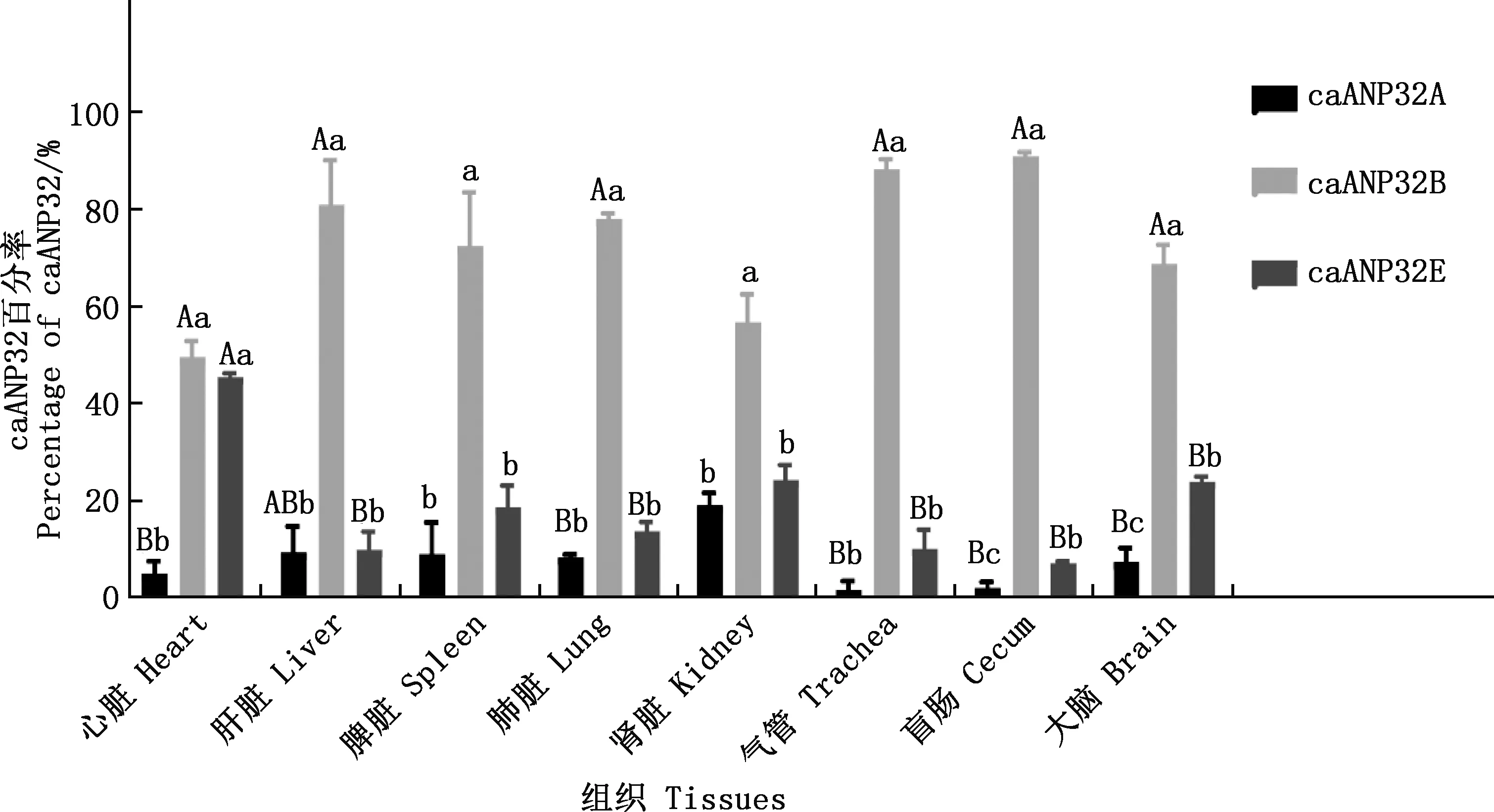
肩标不同小写字母表示差异显著(P<0.05);肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母表示差异不显著(P>0.05)
2.2 caANP32A、caANP32B和caANP32E基因克隆和鉴定
2.2.1caANP32A、caANP32B和caANP32E基因克隆 经PCR反应扩增,获得大小分别为747、903、798、729、768和789 bp的目的条带(图2、3),与caANP32A、caANP32B_X1、caANP32B_X2、caANP32B_X3、caANP32E_X1及caANP32E_X2基因大小一一对应。目的条带经纯化后连接于pCAGGS-Flag真核表达载体,进一步经测序鉴定正确,分别命名为pCAGGS-caANP32A-Flag、pCAGGS-caANP32B_X1-Flag、pCA-GGS-caANP32B_X2-Flag、pCAGGS-caANP32B_X3-Flag、pCAGGS-caANP32E_X1-Flag和 pCAGGS-caANP 32E_X2-Flag。以上结果表明caANP32家族基因在MDCK细胞和犬组织中均确切存在,且caANP32A有1种转录形式,caANP32B有3种转录形式(剪接变异体),caANP32E有2种转录形式。
M,DL2000 DNA Marker;1~6,分别为caANP32A、caANP32B_X1、caANP32B_X2、caANP32B_X3、caANP32E_X1和caANP32E_X2基因。图3同
图3 犬心脏组织caANP32家族基因的克隆
2.2.2 caANP32A、caANP32B和caANP32E蛋白的表达 经转染和Western blotting检测结果显示,空载体未见阳性反应条带,同pCAGGS-huANP32A-Flag相比,在30和40 ku之间出现与预期相符的特异性条带,证明pCAGGS-caANP32A-Flag、pCAGGS-caANP32B_X1-Flag、pCAGGS-caANP32B_X2-Flag、pCAGGS-caANP32B_X3-Flag、pCAGGS-caANP32E_X1-Flag、pCAGGS-caANP32E_X2-Flag和pCAGGS-huANP32A-Flag蛋白在HEK293T细胞中成功获得表达,caANP32B_X1和caANP32E_X1因分子质量较大而导致其特异性条带稍高于其他蛋白(图4)。
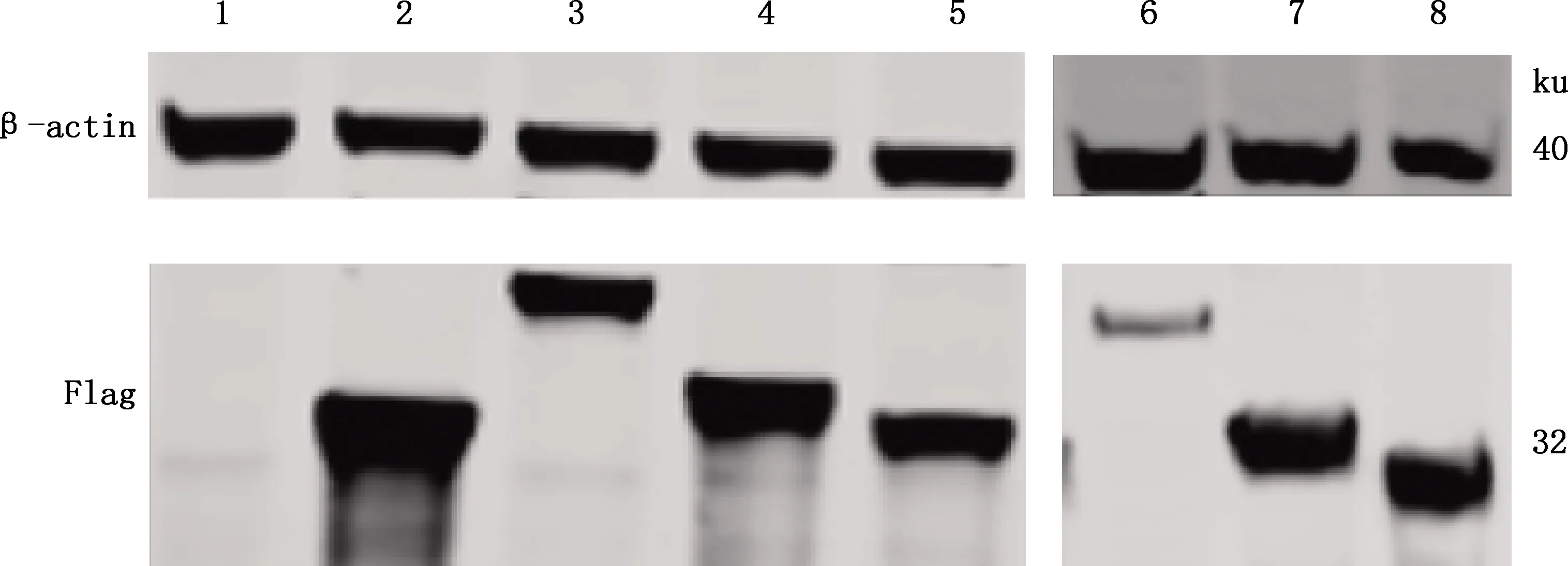
1,空载体;2~8,分别为caANP32A、caANP32B_X1、caANP32B_X2、caANP32B_X3、caANP32E_X1、caANP32E_X2和huANP32A蛋白
2.2.3 caANP32A、caANP32B和caANP32E氨基酸序列比对 基于基因克隆结果发现,caANP32基因存在序列多态性。对caANP32家族蛋白氨基酸序列进行分析发现,caANP32家族基因在其亮氨酸重复区域(leucinerich repeat domain,LRR)较为保守,在低复杂酸性区域C-端区域(low-complexity acidic region,LCAR)具有较大差异。caANP32家族全长蛋白序列为:caANP32A含有249个氨基酸,caANP32B_X1氨基酸序列最长,含有301个氨基酸;caANP32B_X2次之,含有266个氨基酸;caANP32B_X3含有243个氨基酸,caANP32E_X1含有256个氨基酸,caANP32E_X2含有263个氨基酸。caANP32B的3个剪接变异体主要在N-Cap区域存在差异;而caANP32E的2个剪接变异体在N-Cap和C-Cap区域均存在较大差异,caANP32E_X1 N-端序列较长,C-端序列较短,caANP32E_X2则与之相反,即C-端氨基酸数多于N-端(图5)。
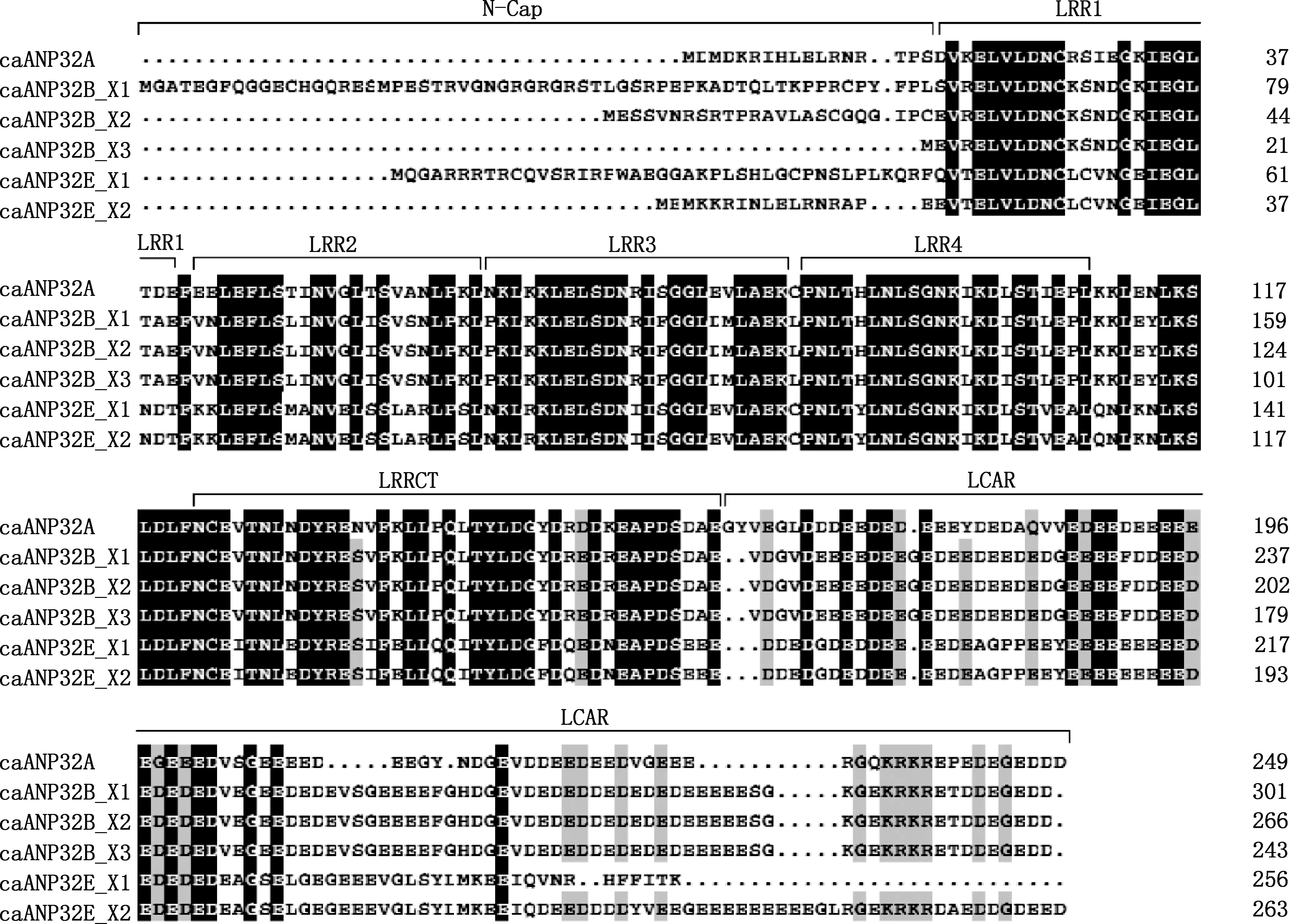
图5 caANP32家族氨基酸序列比对
2.3 caANP32A 对不同物种A型流感病毒RNA聚合酶活性的影响
以不同种属ANP32A表达质粒与病毒RNA聚合酶共转染DKO细胞,结果显示,过表达caANP32A或人、猪、马的ANP32A均可支持犬流感病毒H3N2GD11和马流感病毒H3N8JL89RNA聚合酶活性(图6A、6B),即caANP32A或人、猪、马ANP32A组犬流感病毒H3N2GD11和马流感病毒H3N8JL89RNA聚合酶活性均极显著高于空载体组(P<0.01);而caANP32A对禽源流感病毒H9N2ZJ12RNA聚合酶活性影响与空载体、huANP32A和eqANP32A_X2无显著性差异(P>0.05)(图6C)。chANP32A均极显著支持3种亚型流感病毒RNA聚合酶活性(P<0.01)。
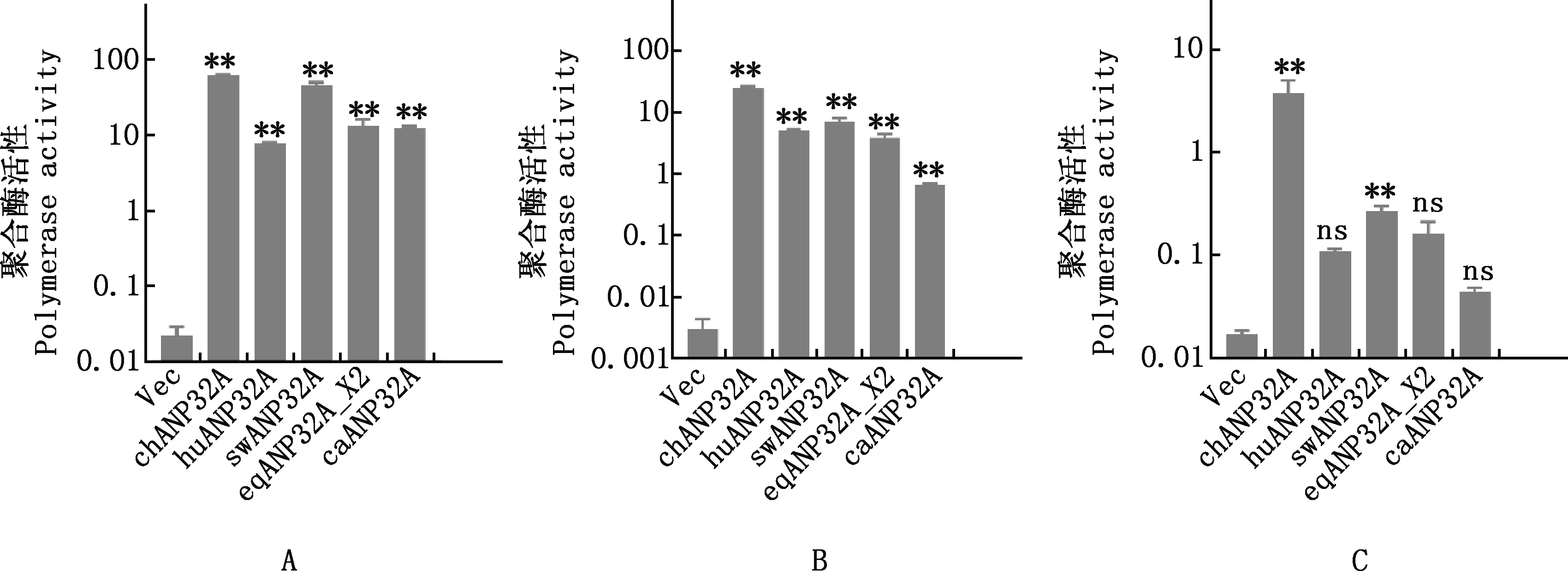
①A,犬流感病毒H3N2GD11;B,马流感病毒H3N8JL89;C,禽流感病毒H9N2ZJ12。②与空载体对照组(Vec)相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);ns,差异不显著(P>0.05)。下同
2.4 caANP32B 对不同物种A型流感病毒RNA聚合酶活性的影响
以不同种属ANP32B表达质粒与病毒RNA聚合酶共转染DKO细胞,结果显示,caANP32B显著支持犬流感病毒H3N2GD11RNA聚合酶活性(P<0.05);caANP32B显著或极显著支持马流感病毒H3N8JL89RNA聚合酶活性(P<0.05;P<0.01);过表达caANP32B或人、猪、马的ANP32B均可支持犬流感病毒H3N2GD11和马流感病毒H3N8JL89RNA聚合酶活性(图7A、7B),而对禽流感病毒H9N2ZJ12RNA聚合酶活性有较低的支持作用(图7C)。chANP32B均不支持3种亚型流感病毒RNA聚合酶活性。同时,caANP32B 3个剪接变体对于犬流感病毒H3N2GD11或马流感病毒H3N8JL89RNA聚合酶活性呈现不同的支持作用,其中caANP32B_X2活性支持最高(图7A、7B)。此外,通过对不同物种来源的ANP32B蛋白进行序列比对分析发现,caANP32B 3种剪接变异体与其他ANP32B蛋白的氨基酸相似性较高,caANP32B 3种剪接变异体主要在N-Cap区域存在序列长短和氨基酸差异(图7D)。

A,犬流感病毒H3N2GD11;B,马流感病毒H3N8JL89;C,禽流感病毒H9N2ZJ12;D,不同物种ANP32B的序列比对
2.5 caANP32E对不同物种A型流感病毒RNA聚合酶活性的影响
以同一种属caANP32A、caANP32B_X2和caANP32E表达质粒与病毒RNA聚合酶共转染DKO细胞,结果显示,过表达caANP32E_X1和caANP32E_X2对犬流感病毒H3N2GD11、马流感病毒H3N8JL89和禽流感病毒H9N2ZJ12RNA聚合酶活性影响与空载体相比均无显著差异(P>0.05),即caANP32E蛋白不支持A型流感病毒RNA聚合酶活性(图8A~8C)。
A,犬流感病毒H3N2GD11;B,马流感病毒H3N8JL89;C,禽流感病毒H9N2ZJ12
3 讨 论
哺乳动物细胞对禽流感病毒RNA聚合酶活性具有物种限制性,是禽流感病毒跨种传播的重要屏障之一。已有研究表明多种宿主因子可通过与 RNA 聚合酶互作调控病毒的复制及宿主适应性范围,其中ANP32家族蛋白在A型流感病毒复制及跨物种传播中起着决定性作用[17-18]。MDCK细胞作为一种哺乳动物细胞,常用作禽、人、马、犬等不同物种流感病毒分离及疫苗培养的细胞系[19],然而MDCK细胞中caANP32蛋白对不同物种流感病毒RNA聚合酶活性的支持作用如何鲜有报道。本研究对犬组织和MDCK细胞中ANP32家族蛋白的多态性进行分析,明确了caANP32蛋白的表达形式,并评估了caANP32家族成员对不同物种A型流感病毒RNA聚合酶活性的影响。
犬可感染多种亚型流感病毒[20],但仅H3N8和H3N2亚型流感病毒可在犬群中流行[21],推测可能与不同亚型流感病毒RNA聚合酶在犬宿主细胞上的适应能力相关,而ANP32家族蛋白决定了流感病毒RNA聚合酶活性[14-15]。基于NCBI提供的预测序列信息可推测caANP32家族基因存在潜在变体,因此本研究首先对caANP32家族蛋白基因进行组织分布及序列分析。组织分布结果提示,不同组织中caANP32B丰度均极显著高于其他2个家族成员caANP32A和caANP3E;而caANP32A和caANP32E在不同组织中的基因丰度略有不同。这可能是由于ANP32家族蛋白参与细胞发育及生命周期的多个过程[22-24],因某些组织的生长特性导致ANP32家族基因丰度分布有所不同。犬心脏组织及MDCK细胞中ANP32家族基因克隆结果证实,caANP32家族基因存在转录本多态性:caANP32A存在1个转录本,caANP32B存在3种剪接变体,而caANP32E存在2种剪接变体。
研究发现,chANP32A基因在其LRR与LCAR区域之间具有独特的33个氨基酸序列插入,从而能特异性支持禽流感病毒RNA聚合酶活性[11],且chANP32A基因在其特有的33个氨基酸关键结构域处存在3个序列长短差异的剪接变体,而这一差异显著影响了不同变体对流感病毒RNA聚合酶的支持活性[12,25]。本研究发现,caANP32B及caANP32E均存在不同剪接变异体,但其序列差异主要体现在N-Cap区域,并没有类似禽ANP32A的33个氨基酸插入,这种N-Cap区域差异导致其对犬流感病毒H3N2GD11和马流感病毒H3N8JL89RNA聚合酶活性的支持能力不同,其中caANP32B_X2支持能力显著高于caANP32B_X1和caANP32B_X3,但不改变其对禽流感病毒RNA聚合酶的支持活性。序列分析提示,caANP32B_X2的N-端序列与其他物种ANP32B序列相似性更高,而caANP32B_X1 N-端氨基酸残基偏长,caANP32B_X3的N-端氨基酸残基偏短,推测可能是由于caANP32B剪切变异体N-Cap区域序列长短和所编码氨基酸差异,导致其对流感病毒RNA聚合酶活性的支持能力不同。ANP32蛋白与流感病毒RNA聚合酶结合能力直接影响了其对RNA聚合酶的支持活性[15],而caANP32B不同剪接变体的N-Cap区域序列长短差异是否影响了其与流感病毒RNA聚合酶的结合能力,仍需进一步试验验证。caANP32E不支持A型流感病毒RNA聚合酶的活性,也符合马传染病和慢病毒病创新团队实验室前期的研究结果[26]。此外,过表达caANP32A/caANP32B对禽流感病毒H9N2ZJ12RNA聚合酶活性支持能力均较低,表明犬和其他哺乳动物ANP32A/ANP32AB蛋白在支持哺乳动物流感病毒RNA聚合酶和禽流感病毒RNA聚合酶活性方面存在差异,表现出较强的种间限制作用。在针对不同亚型流感病毒RNA聚合酶活性分析时,阴性对照数值出现变化是由于不同亚型流感病毒RNA聚合酶的本底值不同造成的,本试验前期对多个物种的流感RNA聚合酶分析时发现均存在这一现象,此现象不会影响单个亚型RNA聚合酶活性[14-15,26]。
禽ANP32A的3个剪接变体具有物种特异性,且禽ANP32A不同变体的丰度对禽流感病毒的进化和RNA聚合酶的适应性具有不同的驱动力[12]。ANP32蛋白的N129/130D氨基酸位点已被确认为是其支持不同物种流感病毒RNA聚合酶复制的关键活性位点[14],而有研究发现部分人群中自然携带ANP32B D130A的突变体,该突变体可能通过竞争性与流感病毒RNA聚合酶结合从而降低携带人群对流感病毒的易感性[27]。本研究发现,caANP32B存在3种剪接变异体,且这3种剪接变异体对A型流感病毒RNA聚合酶活性的支持能力不尽相同,这是否可能是驱动犬流感病毒不断进化的内在原因仍需进一步探索。
4 结 论
caANP32A和caANP32B能较好地支持哺乳动物A型流感病毒RNA聚合酶活性,对H9N2亚型禽流感病毒支持活性较低,而caANP32E不支持A型流感病毒RNA聚合酶活性。

