响应面法优化双层包埋格氏乳杆菌微胶囊制备工艺
李乔,都凤华,沙丙含
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
格氏乳杆菌(Lactobacillus gasseri)又称加氏乳杆菌,是一种革兰氏阳性菌[1],具有多种功能性的益生菌,是存在于人体内的天然菌丛[2]。格氏乳杆菌适宜生长环境温度为30℃~37℃。最适生长pH值为6~7,在pH值为2时依旧可以存活,存活率在2%左右[3]。格氏乳杆菌具有可维持人体肠道内稳态等多种益生功能[4],如可通过调节肠道内厚壁菌门和拟杆菌门的比例防止体重的过度增加[5-7]。格氏乳杆菌的代谢产物可抑制肠道对胆汁酸的重吸收以及增强人体对酸性类固醇排泄能力,从而具有降低胆固醇的作用[8-10];菌体代谢产物可以通过与脂多糖的结合,阻止脂多糖对细胞受体的作用,干扰细胞外激酶调节信号、撕裂蛋白激酶信号通路达到消炎、抗菌的效果[11-13]。格氏乳杆菌的发酵产物对自由基具有较强的清除能力,是一种良好的天然抗氧化剂[14-16]。格氏乳杆菌可产生抗菌肽,经试验研究,这些细菌素对引起食品腐败的细菌具有广谱抗菌活性,因此格氏乳杆菌可代替抗生素、作为生物防腐剂[17]。
微胶囊化可改善芯材的形态、味道和色泽等物理性质;控制被包埋物质的溶解释放的时间和速度[18]。微胶囊技术被广泛的应用于食品行业,如用于改善食品添加剂(调味剂、食用色素、膨松剂)的颜色气味;提高营养强化剂与生物活性物质(维生素、多肽)的稳定性。国内外相关研究人员通过改变包埋材料、微胶囊化方法等,不断优化乳杆菌包埋的制备工艺,保护乳杆菌不受外界不良环境影响,使其能抵御胃液的腐蚀并在肠道中定殖[19-21],从而增强其对人体的益生作用。本研究采用内源乳化法,以格氏乳杆菌作为芯材,海藻酸钠、壳聚糖为壁材,制备双层包埋格氏乳杆菌微胶囊,为扩大格氏乳杆菌使用范围提供参考。
1 材料与方法
1.1 材料与试剂
格氏乳杆菌:中国工业微生物菌种保藏管理中心;壳聚糖、海藻酸钠、冰乙酸、碳酸钙、乳酸细菌培养基:国药集团化学试剂有限公司,以上试剂均为分析纯。
1.2 仪器与设备
磁力搅拌器(SN-MS-6D1):尚普仪器设备有限公司;摇床(TB-200B):天呈试验仪器制造有限公司;蒸汽灭菌器(LDZX-30KBS):申安医疗器械厂;冷冻机(Sigma 2-16k):博劢仪器有限公司。
1.3 试验方法
1.3.1 双层包埋格氏乳杆菌微胶囊制备工艺流程
将10 mL浓缩菌泥与质量分数3.0%的海藻酸钠溶液按照体积比1∶4菌胶比混合后,加入2%碳酸钙并搅拌均匀。然后按照体积比1∶6的水油比加大豆油(含Span80),搅拌形成乳状液,15 min后加入20 mL含有冰乙酸的大豆油,搅拌30 min后,加入洗涤介质,离心收集后置于10 mL壳聚糖溶液中,置于磁力搅拌器上(400 r/min)搅拌20 min,静置后过滤收集微胶囊[22]。
1.3.2 单因素试验
选择壳聚糖溶液浓度(0.2%、0.4%、0.6%、0.8%、1.0%)、pH 值(4.0、4.5、5.0、5.5、6.0)、成膜时间(5、10、15、20、25 min)3个因素进行单因素试验,分析各因素对双层包埋格氏乳杆菌微胶囊包埋率的影响。
1.3.3 双层包埋格氏乳杆菌微胶囊制备工艺响应面优化试验
对成膜时间、壳聚糖溶液浓度、pH值3个因素进行响应面试验优化设计,因素水平如表1所示。以包埋率作为响应值,确定双层包埋微胶囊的最佳制备工艺组合。

表1 响应面因素水平编码Table 1 Factors and levels of response surface
1.3.4 格氏乳杆菌微胶囊包埋率的测定
称取1.0 g微胶囊,置于10 mL磷酸盐缓冲液中,用高速剪切机进行破碎处理(19 000 r/min,2 min),37℃恒温振荡,使微胶囊溶解并释放菌体,经梯度稀释后,吸取适宜稀释度的菌悬液涂布于固体培养基上,37℃下厌氧培养48 h后进行活菌计数[7]。微胶囊的包埋率计算公式如下。
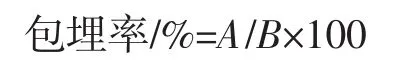
式中:A为解囊液菌落数,cfu/mL;B为制备微胶囊的原菌液菌落数,cfu/mL。
1.3.5 格氏乳杆菌微胶囊在模拟胃肠液中存活试验
取1.0 g制得的微胶囊置于50 mL人工模拟胃液中,于37℃、100 r/min恒温摇床中振荡,分别于0、30、60、90、120 min时离心收集微胶囊,用生理盐水洗涤后,置于适量磷酸盐缓冲液中溶解,进行活菌计数。同时以1.0 g未包埋格氏乳杆菌作为对照组。
称取1.0 g制得的微胶囊置于50 mL人工模拟肠液中,于37℃、100 r/min恒温摇床中振荡,分别对振荡0、30、60、90、120 min 时的微胶囊进行活菌计数。
1.3.6 格氏乳杆菌微胶囊贮藏稳定性试验
将制得的微胶囊放置于-18℃与常温(25℃)条件中,储藏4周。每隔1周对储存的微胶囊取样并进行活菌计数。同时以1 g未包埋格氏乳杆菌作为对照组。
1.4 数据处理与分析
试验重复3次,结果采用测定平均值。利用Design-Expert 10.0.1软件对试验数据进行响应面试验分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 壳聚糖浓度对微胶囊包埋率的影响
壳聚糖浓度对微胶囊的包埋率的影响如图1所示。
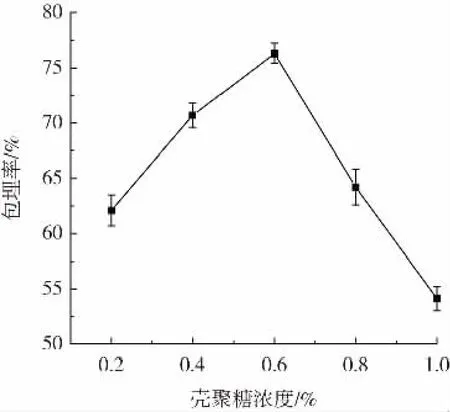
图1 壳聚糖浓度对微胶囊包埋率的影响Fig.1 Effect of chitosan concentration on the encapsulation rate of microcapsules
由图1可知,微胶囊的包埋率随着壳聚糖浓度的增大而升高,当壳聚糖浓度为0.6%时,微胶囊的包埋率最高,然而当壳聚糖浓度继续增加时包埋率呈下降趋势。这可能是由于在一定范围内,壳聚糖浓度越高,壳聚糖与海藻酸钠形成的聚电解质复合膜越致密,减少了格氏乳杆菌菌体的外泄,从而有效地提高了微胶囊的包埋率。当壳聚糖浓度继续增高时,溶液的黏度增加、流动性降低,从而影响了壳聚糖与海藻酸钠的交联反应。因此最佳壳聚糖浓度为0.6%。
2.1.2 壳聚糖溶液pH值对微胶囊包埋率的影响
壳聚糖溶液pH值对微胶囊包埋率的影响如图2所示。
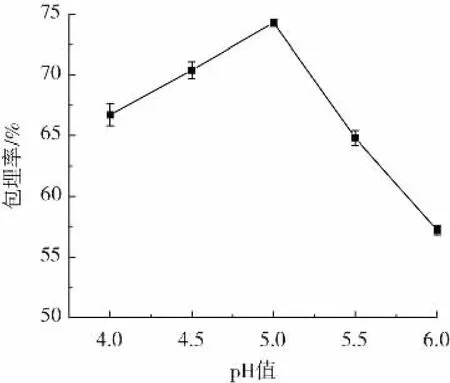
图2 壳聚糖溶液的pH值对微胶囊包埋率的影响Fig.2 Effect of pH of chitosan solution on the encapsulation rate of microcapsules
由图2可知,微胶囊的包埋率随着壳聚糖溶液pH值的增大而升高,当pH值为5.0时,微胶囊的包埋率最高,然而当pH值继续增加时包埋率呈下降趋势。这可能是由于壳聚糖溶液pH值较高时,壳聚糖分子链上的铵根离子以NH2+为主,与-COO-反应的-NH3+数量较少,静电吸引力减弱,形成的膜机械强度较低,从而降低了微胶囊的包埋率。因此壳聚糖溶液最佳pH值为5.0。
2.1.3 成膜时间对微胶囊包埋效果的影响
成膜时间对微胶囊包埋效果的影响如图3所示。
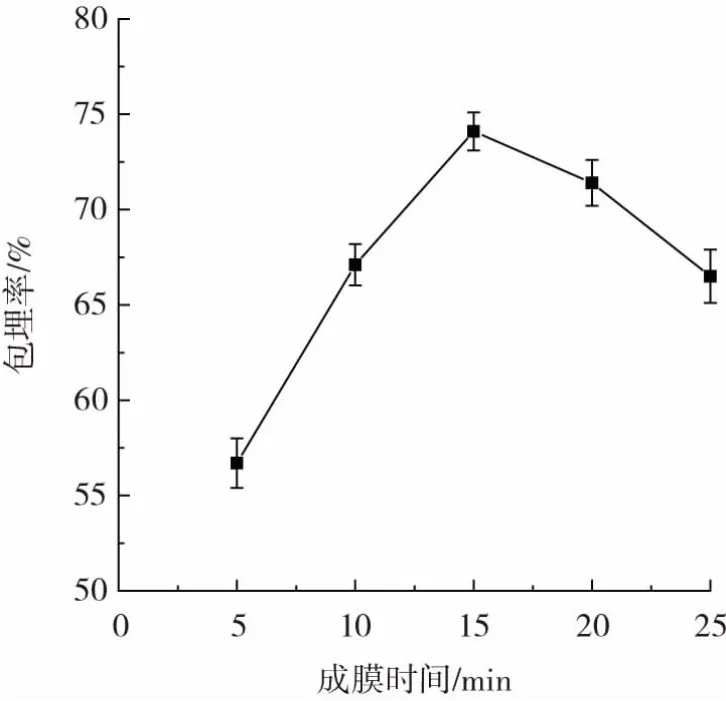
图3 成膜时间对微胶囊包埋率的影响Fig.3 Effect of film formation time on the encapsulation rate of microcapsules
由图3可知,微胶囊的包埋率随着成膜时间的延长而升高,当成膜时间为15 min时,微胶囊的包埋率最高,然而当成膜时间继续延长时包埋率呈下降趋势。这可能是由于成膜时间较长影响了壳聚糖与海藻酸钠间的静电吸引力,导致壳聚糖与海藻酸钠形成的聚电解质复合膜的机械强度降低,从而降低了微胶囊的包埋率。因此最佳成膜时间为15 min。
2.2 双层包埋格氏乳杆菌微胶囊制备工艺响应面试验优化结果
为进一步研究变量之间交互作用的影响关系,使用响应面分析法筛选包埋率最佳制备工艺。基于Box-Benhnken采样原理,对A成膜时间、B壳聚糖浓度、C pH值3个因素进行响应面分析试验,从而确定双层包埋格氏乳杆菌微胶囊制备工艺的最佳组合。响应面试验设计与结果如表2所示,方差分析如表3所示。
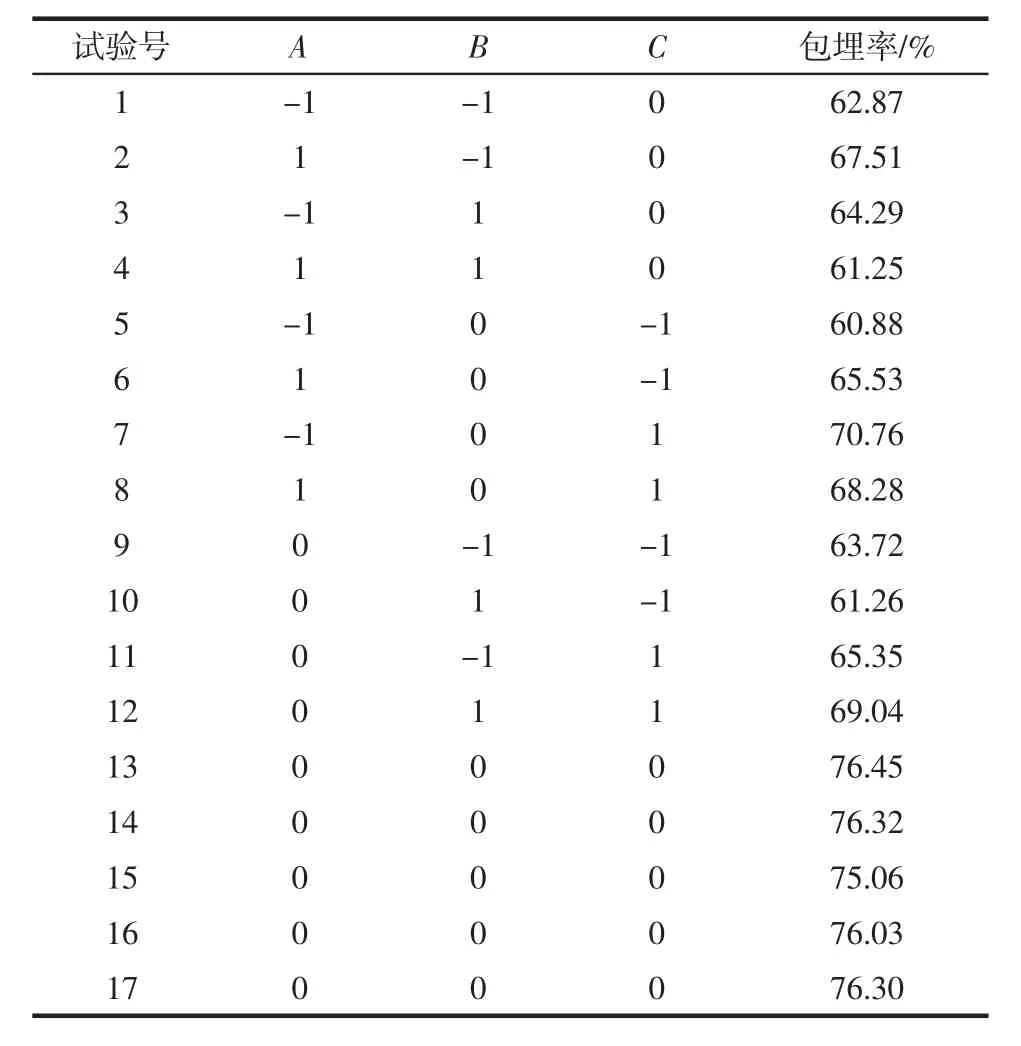
表2 响应面试验设计与结果Table 2 Results of response surface experiments
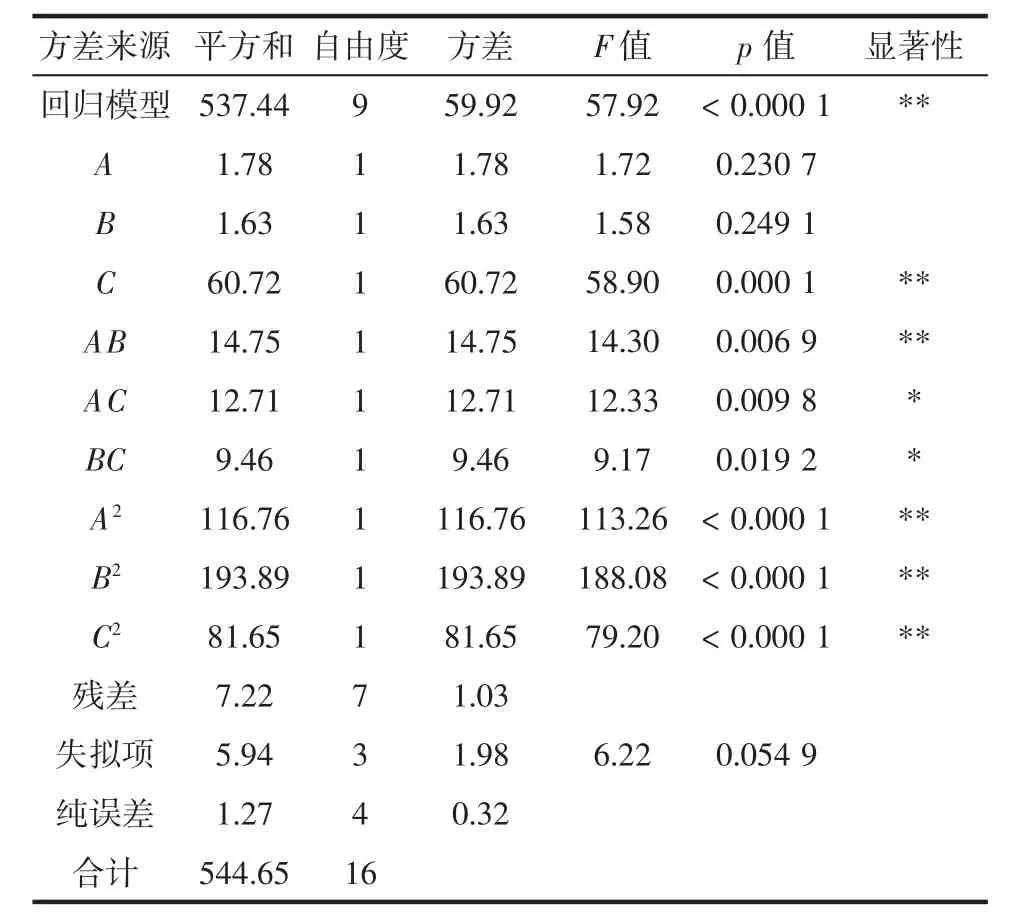
表3 方差分析Table 3 Analysis of variance
利用Design-Expert 10.0.1软件对试验数据进行统计分析,对表2试验数据建立二次回归模型,拟合得到二次多元回归方程:Y=76.03+0.471 3A-0.4512B+2.76C-1.92AB-1.78AC+1.54BC-5.27A2-6.79B2-4.4C2。
F值可用来检验各变量对响应值影响的显著性的高低。F值越大,则响应变量的显著性程度越高。当模型显著性检验p<0.05,说明该模型具有统计学意义。从表3中可以看出,3种工艺条件对包埋率影响大小顺序:C>A>B,即pH值>成膜时间>壳聚糖浓度。模型的决定系数R2为0.986 8,而R2adj=0.969 7,能够解释试验96.97%的响应值变异,且与预测相关系数Pred R2(0.821 8)接近,说明此试验模型与真实数据拟合程度良好,具有实践指导意义,由此可以用该模型来分析和预测包埋率最优工艺。
由响应面试验优化得到格氏乳杆菌微胶囊包埋最佳工艺:成膜时间为15 min、壳聚糖浓度为0.6%、pH值为5.2,进行3次重复试验,得平均包埋率为76.52%,接近模型预测结果,表明此响应面模型分析优化包埋工艺的方法有效可行。
2.3 格氏乳杆菌微胶囊在模拟胃肠液中存活试验
格氏乳杆菌微胶囊在人工模拟胃液中菌体的存活率如图4所示。
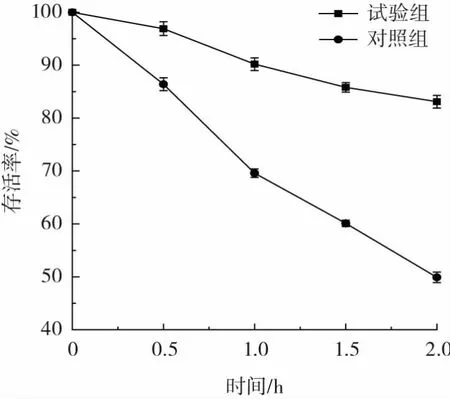
图4 格氏乳杆菌微胶囊在人工模拟胃液中菌体的存活率Fig.4 Survival of microencapsulated Lactobacillus gasseri in simulated gastric fluid
如图4可知,在胃液作用下菌体存活率不断下降。经人工模拟胃液处理2 h后,双层包埋微胶囊的存活率为84.1%,大于未包埋菌体的存活率。结果表明在人工模拟胃液中,经双层包埋的格氏乳杆菌存活率大于未经微胶囊化的格氏乳杆菌。
格氏乳杆菌微胶囊在人工模拟肠液中菌体的存活率如图5所示。
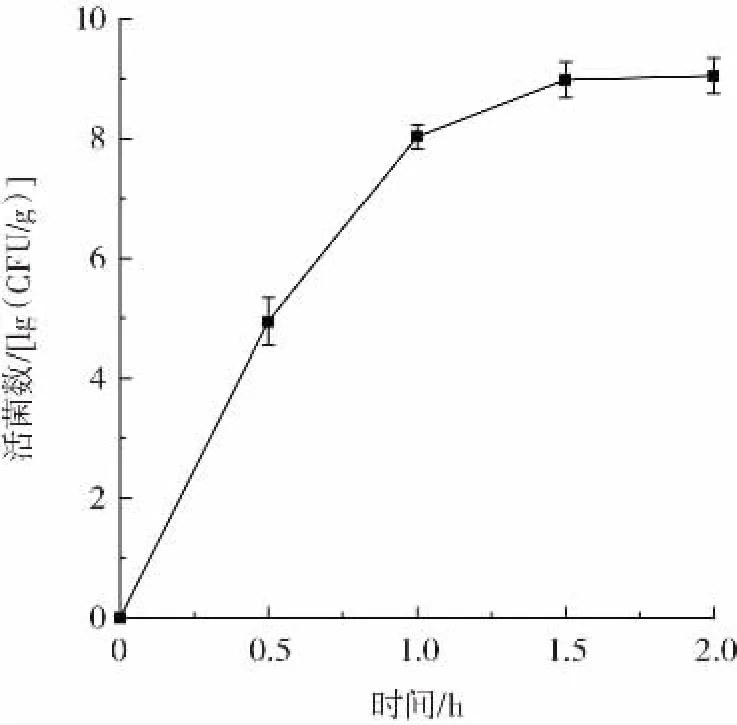
图5 格氏乳杆菌微胶囊在人工模拟肠液中菌体的存活率Fig.5 Survival of microencapsulated Lactobacillus gasseri in simulated intestinal fluid
由图5可知,经人工模拟肠液反应1.5 h后,双层包埋格氏乳杆菌的活菌数不再发生变化。结果表明格氏乳杆菌微胶囊肠溶性较好,有利于格氏乳杆菌在人体肠道中定殖。
2.4 格氏乳杆菌微胶囊贮藏稳定性试验
格氏乳杆菌微胶囊在不同条件环境下的贮藏稳定性如图6、图7所示。
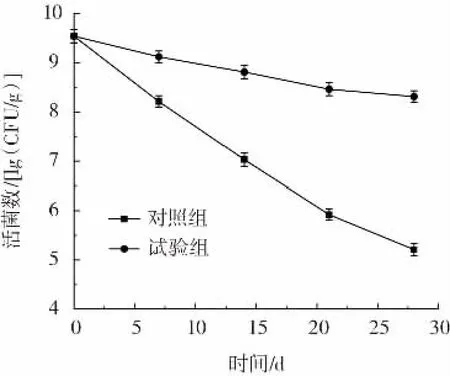
图6 格氏乳杆菌微胶囊在-18℃条件下的贮藏稳定性Fig.6 Storage life of microencapsulated Lactobacillus gasseri at-18℃
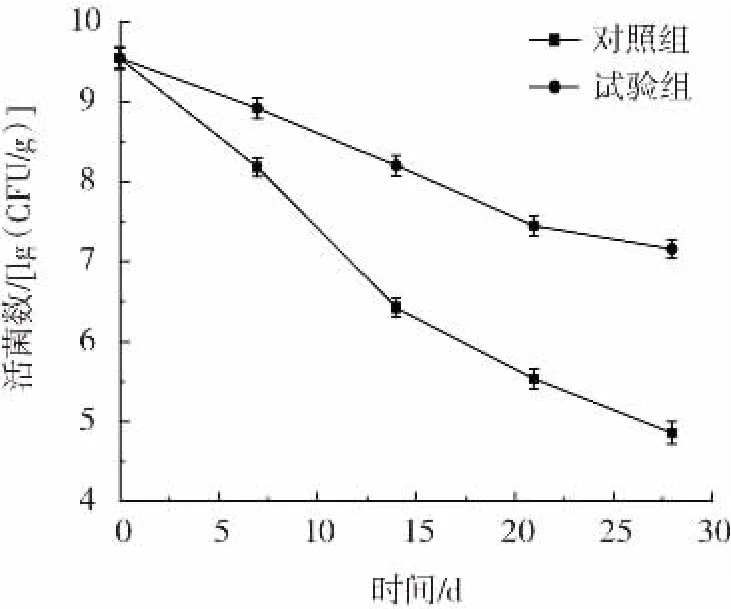
图7 格氏乳杆菌微胶囊在常温条件下的贮藏稳定性Fig.7 Storage life of microencapsulated Lactobacillus gasseri at room temperature
由图6、图7可知,在室温(25℃)和-18℃条件环境下,微胶囊中的活菌数随着时间的延长不断下降,贮藏28 d后试验组样品中的活菌数分别为8.31、7.14 lg(CFU/g)。经双层包埋后微胶囊的活菌数远高于未包埋的活菌数,说明在不同环境下微胶囊化对菌体都具有较强的保护作用。
3 结论
利用响应面试验对双层包埋格氏乳杆菌微胶囊的制备工艺进行优化,最佳制备工艺参数为成膜时间为15 min、壳聚糖浓度为0.6%、pH值为5.2。制得双层包埋格氏乳杆菌微胶囊的包埋率为76.52%。经各试验表明工艺优化后制得的微胶囊耐酸性明显增大,在人工肠液中1.0 h~1.5 h内可完全释放,贮藏稳定性明显提高。本试验说明双层包埋格氏乳杆菌微胶囊具有一定的耐酸性、贮藏性,能够提高格氏乳杆菌在人体内的益生作用,扩大了格氏乳杆菌的使用范围,可为格氏乳杆菌作为营养强化剂、生物防腐剂等应用于生产实践提供更多的基础与技术支撑。

