掺Fe(Ⅱ)羟基磷灰石对水溶液中Pb(Ⅱ)吸附性能研究
李辉,江群,姜思盟,曲建华,姜昭,张颖
(东北农业大学资源与环境学院,哈尔滨 150030)
水体重金属污染是当前迫在眉睫的环境问题,在环境污染修复领域备受关注。重金属不可降解且容易通过食物链在生物体内富集而放大其生物毒性,进而威胁人类和动植物健康。随着我国工农业的快速发展,水体重金属,尤其是水体Pb(Ⅱ)污染形势日益严峻。Pb 被世界卫生组织(World Health Organiza⁃tion,WHO)列为强污染物。含Pb(Ⅱ)的污水排放后可通过地表径流、污水灌溉等方式向农田等环境扩散,影响农作物生长,并最终通过食物链在人体内富集。Pb(Ⅱ)对人体的肾脏、神经系统、生殖系统、肝脏和大脑具有毒性,严重影响人体健康甚至可能导致死亡[1]。重金属不能被分解,但可以转变为其他赋存形态[2]。如何高效去除水体中的Pb(Ⅱ)已成为保障生态环境安全与人体健康亟待解决的问题。目前应用于处理重金属Pb(Ⅱ)污染废水的方法很多,如化学沉淀法、吸附法、电解法、膜过滤法和微生物分离法等,其中,吸附法因工艺简单、经济、高效等特点而得到广泛应用[3]。目前,许多吸附剂,如活性炭、生物炭、铁氧化物、黏土、沸石以及天然或合成聚合物,被广泛用于Pb(Ⅱ)的吸附[4]。其中,羟基磷灰石(HAp)具有特殊的晶体结构,对二价重金属离子的结合力强,环境友好,不易造成二次污染[5-6],且对水中的Pb(Ⅱ)离子可选择性吸附,是一种典型的Pb(Ⅱ)吸附剂。WANG 等[7]使用HAp 吸附Cd(Ⅱ)、Pb(Ⅱ)、Cu(Ⅱ),发现其对Pb(Ⅱ)表现出优异的吸附效果。然而,受限于原始HAp 的机械稳定性、抗腐蚀性和吸附容量,亟需扩大其吸附性能的应用范围,近年来国内外学者通过各种物理化学手段开发了大量改性的HAp 材料[8]。由于其特殊的六方体晶系结构,HAp 具有很强的离子交换能力。钙离子所占据的金属阳离子位置具有良好的反应活性,可以与其他阳离子发生置换,从而生成不同类型的HAp,这种特殊的改性方法已经引起了世界材料研究者们的广泛关注[9]。例如,陈奕瑄[10]以Sr(Ⅱ)为掺杂离子替换部分Ca(Ⅱ)进行羟基磷灰石掺杂改性实验,发现当掺杂比例为20%时,吸附Pb(Ⅱ)的效果提升了54%。而含铁材料广泛存在于土壤与水体中,部分含铁化合物对Pb(Ⅱ)具有良好的吸附性能[11]。因此开发铁作为掺杂离子的羟基磷灰石材料具有重要的研究意义。
本研究以进一步增加吸附位点、提高吸附性能为改性目标,通过水合反应引入Fe(Ⅱ)离子,对传统的羟基磷灰石进行改性,并以原始羟基磷灰石作为对照材料,旨在用硝酸亚铁部分取代传统的钙源制得Fe-HAp,并评估Fe-HAp 对Pb(Ⅱ)的吸附效果,同时探究Fe-HAp对水溶液中Pb(Ⅱ)的多重吸附机制。
1 材料与方法
1.1 试验原料
本研究中使用的所有化学药品均为分析纯。磷酸二氢钾(天津天力化学试剂有限公司);硝酸钙(天津博迪化学有限公司);氨水(25%,天津致远化学试剂有限公司);硝酸亚铁(天津巴斯夫化学有限公司);硝酸铅(上海测试化学试剂有限公司)。
1.2 羟基磷灰石的合成与Fe-HAp的合成
用Ca(NO3)2作为钙源、KH2PO4作为磷源进行水合制备HAp。首先,在搅拌下以恒定速率将50 mL 的0.1 mol·L-1KH2PO4溶液缓慢添加到75 mL 的0.1 mol·L-1Ca(NO3)2溶液中。在该反应过程中,用氨水将溶液的pH 调至10 左右。在60°C 的温度下恒定搅拌3 h,老化48 h 后,将沉淀物与母液分离,并用去离子水洗涤沉淀物,直至溶液的pH 值接近中性,以5 000 r·min-1的速度离心后并在80°C 下完全干燥,过100 目筛获得粉末产物HAp。同样,使用Fe(NO3)2作为铁源,按照(Ca+Fe)与P 摩尔比为1.67∶1(Ca 与Fe 摩尔比为1∶1),重复上述步骤获得Fe-HAp。
1.3 吸附实验
以0.01 mol·L-1的NaNO3溶液作为吸附背景液。
1.3.1 吸附剂用量
分别称取0、10、25、50、80、100 mg 的Fe-HAp 或HAp,依次加入含50 mL 的Pb(Ⅱ)水溶液(250 mg·L-1)的11个150 mL锥形瓶中,将吸附剂均匀分散。在25 ℃、150 r·min-1的摇床中充分反应至平衡,取出混合物离心后,上清液通过0.45 μm的水系滤膜过滤后,测定剩余的Pb(Ⅱ)的浓度。
吸附剂的吸附容量和Pb(Ⅱ)的吸附率采用公式(1)和(2)[12]计算:

式中:Qe是当吸附达到平衡时吸附在HAp 或Fe-HAp上Pb(Ⅱ)的量,mg·g-1;C0是初始Pb(Ⅱ)浓度,mg·L-1;Ce是平衡状态下溶液中Pb(Ⅱ)的浓度,mg·L-1;V为介质的体积,L;m为反应体系中吸附剂的质量,g。吸附前后Pb(Ⅱ)浓度测定采用原子吸收分光光度计法(Thermo ICE3500,美国)。
1.3.2 pH值
将Pb(Ⅱ)溶液(250 mg·L-1)移入锥形瓶中,将Pb(Ⅱ)溶液的pH 值调节至2~6,分别添加两种吸附剂,在恒温摇床中振荡180 min。经离心过滤测定残留的Pb(Ⅱ)浓度,计算出Pb(Ⅱ)的吸附量。
1.3.3 吸附动力学
分别向装有pH=6 的Pb(Ⅱ)溶液(初始浓度为250 mg·L-1)的锥形瓶(150 mL)加入两种吸附剂,分时取样,取样时间设置为2、5、10、15、20、30、60、90、120、150 min 和180 min。样品取出后,立即通过0.45 μm的滤膜测定Pb(Ⅱ)的浓度。
1.3.4 吸附热力学
探究Pb(Ⅱ)的初始浓度对吸附量的影响,初始浓度设置为100、150、200、250、300、400、500 mg·L-1,在不同温度恒温摇床里振荡吸附至达到吸附平衡,取样,过滤,检测Pb(Ⅱ)的浓度,其中温度设置为25、35 ℃和45 ℃。
1.4 HAp与Fe-HAp的表征分析
对HAp 和Fe-Hap 表面性能进行表征。使用傅里叶红外光谱仪(FT-IR,Nicolet IS50,美国)在500~4 000 cm-1范围内记录表面官能团表征结果。通过电子扫描电镜(SEM,Hitachi SU8010,日本)观察HAp 和Fe-HAp 的形貌,通过能谱仪(EDS)对吸附剂表面原料进行分析。采用Zeta 电位仪(Nano-zs90,英国)对样品在不同pH条件下的Zeta电位进行测定。比表面积、孔径等数据由比表面积和孔隙率分析仪(ASAP 3020,美国)获得。吸附剂的物相组成和晶型结构通过X射线衍射图谱(XRD,SmartLab,中国)表征。
1.5 循环与再生研究
通过多次吸附-再生实验评估吸附剂的可重复利用性和再生能力。具体操作:吸附后的Fe-HAp 通过离心收集,并转移到0.1 mol·L-1的EDTA-Na 中以解吸Pb(Ⅱ),用去离子水洗涤3 次,干燥后投入到新的体系中,并循环该过程。
1.6 数据统计分析
所有试验均进行了3 次,所选择的结果是独立试验的平均值,显示误差线。采用Origin进行拟合制图。
2 结果与讨论
2.1 吸附特性分析
2.1.1 环境因素对Pb(Ⅱ)吸附的影响
(1)投加量
图1(嵌入图)显示了吸附剂的投加量对Pb(Ⅱ)吸附的影响。随着投加量的增加,Pb(Ⅱ)的吸附效率迅速提高,吸附量明显不同。这是由于活性位点增加,在投加量为50 mg后,吸附效率保持稳定。Pb(Ⅱ)的吸附量接近平衡,Fe-HAp 对Pb(Ⅱ)的最佳吸附量为223 mg·L-1。因此,选择50 mg为最佳投加量。
(2)反应时间
反应时间对Pb(Ⅱ)吸附量的影响如图1所示,由图1 可以发现吸附包括两个阶段:第一阶段是快速吸附过程,第二阶段是慢速吸附过程[13]。第一阶段持续约90 min,为Pb(Ⅱ)吸附的主要过程。之后吸附达到稳定值,而吸附平衡值在120 min内达到。因此,选定120 min作为最佳反应时间。

图1 反应时间和吸附剂投加量对HAp、Fe-HAp吸附Pb(Ⅱ)的影响Figure 1 The effect of reaction time and adsorbent dosage on Pb(Ⅱ)adsorption by HAp and Fe-HAp
(3)pH和Zeta电位
pH 对Pb(Ⅱ)吸附的影响如图2 所示,两种材料的吸附趋势相似,但对Pb(Ⅱ)的吸附能力表现为Fe-HAp>HAp,且吸附剂对Pb(Ⅱ)的吸附效果受pH影响较大。pH 在2~6 范围内,Pb(Ⅱ)吸附效果随pH 增大而急剧增加,Fe-HAp 对Pb(Ⅱ)的吸附量从24.8 mg·g-1升至226 mg·g-1。当pH>6 时,吸附基本不受pH影响,由于碱性条件Pb(Ⅱ)容易发生沉淀,因此,选定pH 值为6 进行试验。Zeta 电位结果(图2)表明,HAp 和Fe-HAp 的零电位点为3.7 和2.5。当pH 低于零电位点时,吸附剂的表面带正电,由于静电排斥作用而不利于重金属的吸附。当溶液的pH 值高于零电位点时,吸附剂的表面带负电,重金属与带负电的吸附剂表面之间产生明显的静电吸引[14],且随着pH 的增加,吸附剂所带负电量增强,更有助于对Pb(Ⅱ)的吸附。相比于HAp,Fe-HAp 带有更多的负电荷,这可能是Fe-HAp对Pb(Ⅱ)的吸附优于HAp的原因之一。

图2 pH对材料Zeta电位和Pb(Ⅱ)吸附能力的影响Figure 2 The influence of solution pH on materials Zeta potential and Pb(Ⅱ)adsorption quantity
2.1.2 吸附动力学
分别采用拟一级动力学和拟二级动力学模型对Pb(Ⅱ)的吸附过程进行描述,如公式(3)和(4)[15]所示:

式中:Qe和Qt分别是吸附剂对Pb(Ⅱ)的平衡吸附量和吸附时间为t时的吸附量,mg·g-1;K1和K2是拟一级和拟二级动力模型吸附速率常数。
HAp、Fe-HAp 对Pb(Ⅱ)的吸附动力学模型拟合如图3所示,模型对应拟合参数如表1所示。
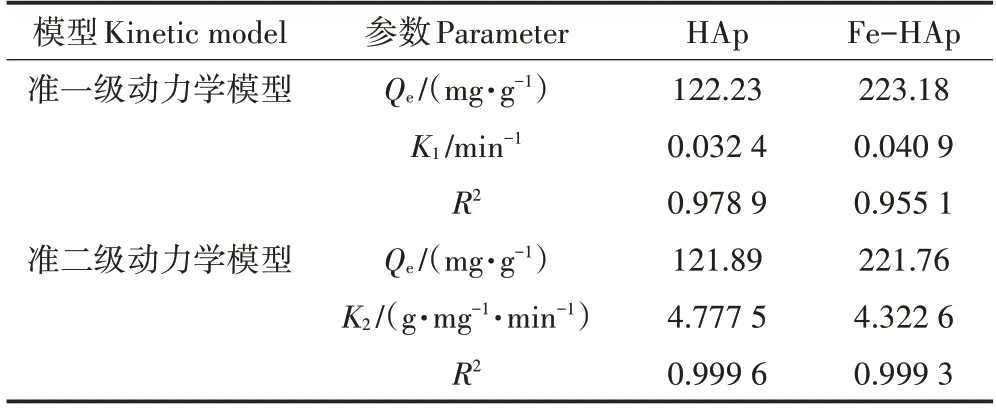
表1 HAp和Fe-HAp对Pb(Ⅱ)的吸附动力学模型参数Table 1 Adsorption kinetic model parameters of Pb(Ⅱ)by HAp and Fe-HAp
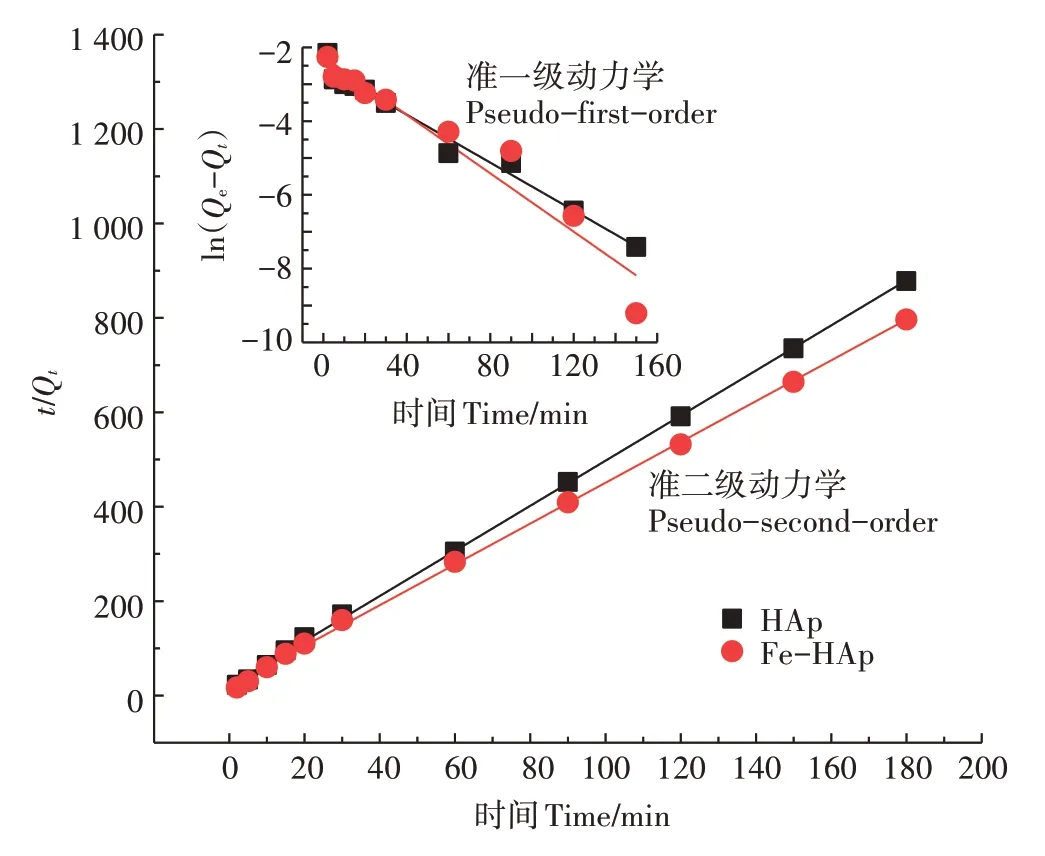
图3 HAp和Fe-HAp对Pb(Ⅱ)的吸附动力学模型拟合Figure 3 Kinetic model fitting of Pb(Ⅱ)adsorption onto HAp and Fe-HAp
根据R2值判断,Pb(Ⅱ)在两种吸附剂上的吸附过程更符合拟二级动力学模型,这表明吸附以化学吸附为主[16-17],且Fe-HAp 的吸附能力优于HAp,说明Fe(Ⅱ)掺杂改性是一种有效的改性方式。
2.1.3 吸附等温线
通过吸附等温线测试研究了吸附剂对Pb(Ⅱ)的最大吸附潜能。根据Langmuir 和Freundlich 模型进行拟合分析,方程如下:

吸附等温曲线如图4所示,拟合参数如表2所示,HAp 吸附等温线更符合Freundlich 模型,说明Pb(Ⅱ)离子的吸附形式不均匀,以异质吸附为主;而Fe-HAp 的等温吸附曲线更符合Langmuir 模型,这表明Pb(Ⅱ)在此材料上吸附为单层吸附,吸附均匀,表面具有相同的吸附活化性能。
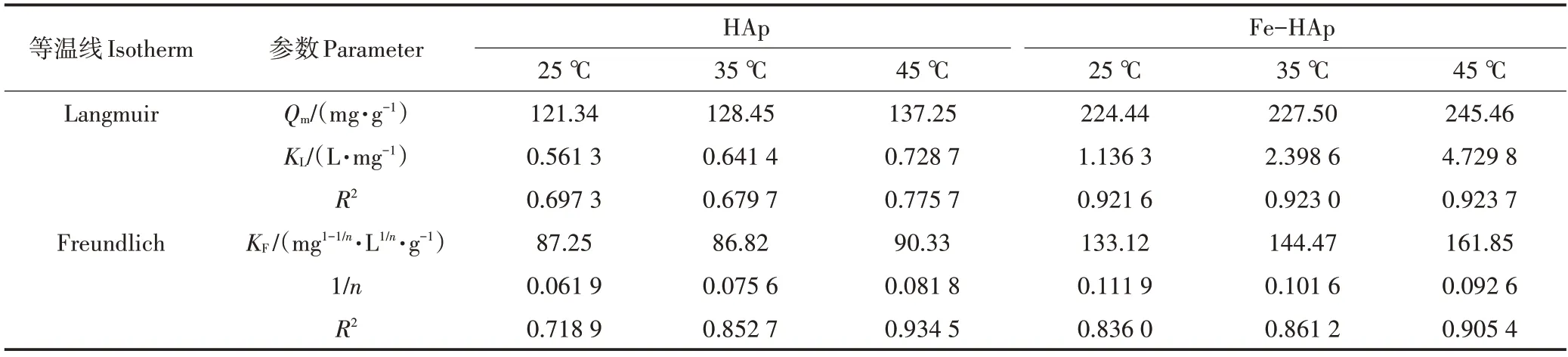
表2 HAp和Fe-HAp对Pb(Ⅱ)的等温吸附模型参数Table 2 Isothermal adsorption model parameters of HAp and Fe-HAp on Pb(Ⅱ)

图4 HAp和Fe-HAp对Pb(Ⅱ)的吸附等温线拟合Figure 4 Adsorption isotherms fitting of Pb(Ⅱ)onto HAp and Fe-HAp
2.1.4 吸附热力学
吸附热力学可以判断吸附过程的自发性。吉布斯自由能(ΔG)、焓变(ΔH)和熵变(ΔS)由公式(7)和(8)[18]计算得出:

式中:Kd为Langmuir 平衡常数;R为气体常数(8.314 0 J·mol-1·K-1);T为Kd下的温度,K。如图5 所示,对ln(Qe/Ce)与1/T进行线性拟合,根据斜率得到Kd值。根据公式(7)求出ΔG,再由方程(8)计算出ΔH和ΔS,计算结果见表3。由于ΔG为负值,所以两种吸附剂吸附Pb(Ⅱ)的过程是自发的,ΔH为正值表示该过程是吸热的[19]。
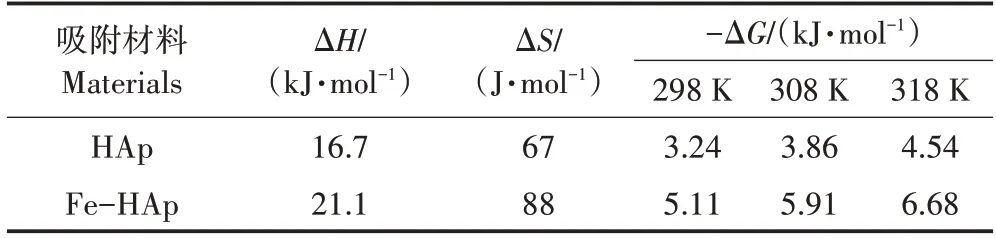
表3 HAp和Fe-HAp对Pb(Ⅱ)的吸附热力学参数Table 3 Adsorption thermodynamic parameters of HAp and Fe-HAp on Pb(Ⅱ)

图5 HAp和Fe-HAp对Pb(Ⅱ)的吸附热力学研究Figure 5 Adsorption thermodynamics of Pb(Ⅱ)onto HAp and Fe-HAp
2.2 HAp和Fe-HAp吸附前后的理化性质变化
HAp 和Fe-HAp 的SEM 和EDS 图像如图6 所 示。在相同的放大倍数下观察,可以看到,HAp 材料呈有层次的颗粒状分布,而Fe-HAp 表面形成了更多大小均一的纳米球状颗粒。吸附后HAp 的表层出现大量棒状结构,可能是吸附过程中产生了重金属络合物;而Fe-HAp 吸附Pb(Ⅱ)后,形貌并未发生显著的变化。图6A~图6D中的EDS图(嵌入图)表明Pb(Ⅱ)成功地吸附在两种材料上。Fe-HAp 吸附Pb(Ⅱ)后的元素分布如图6E~6I 所示,材料中各种元素分布均匀,符合掺杂改性后的结果。同时发现Pb(Ⅱ)均匀吸附在吸附剂表面,这与等温吸附拟合结果一致。

图6 HAp和Fe-HAp吸附Pb(Ⅱ)前后的形貌与元素组成(A~D)以及Fe-HAp吸附Pb(Ⅱ)后的元素分布(E~I)Figure 6 Morphology and EDS element analysis of HAp and Fe-HAp before and after adsorption of Pb(Ⅱ)(A-D);Element mapping of Fe-HAp after adsorption of Pb(Ⅱ)(E-I)
吸附前后吸附剂HAp 和Fe-HAp 的FT-IR 图谱如图7 所示,在1 042 cm-1和1 039 cm-1处分别是与磷酸盐基团有关的不对称拉伸振动峰[20]。Fe-HAp 和HAp 中3 367 cm-1处的峰值显示—OH 基团存在于晶体表面[21]。在512 cm-1和632 cm-1出现的峰可被认为是羟基[22],进一步表明,所获得的材料包含上述两种官能团。
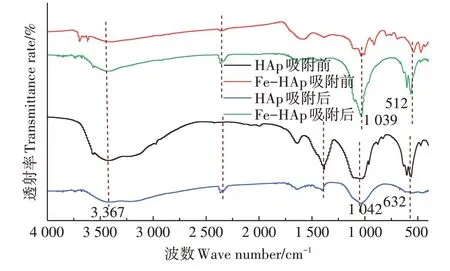
图7 HAp和Fe-HAp吸附Pb(Ⅱ)前后的FT-IR分析Figure 7 FT-IR analysis before and after adsorption Pb(Ⅱ)by HAp and Fe-HAp
相应的XRD 光谱(图8)显示2θ分别对应于(002)、(102)、(211)、(130)、(213)、(222)的羟基磷灰石标准光谱,分别对应25.9°、28.9°、31.8°、39.3°、46.4°、49.5°,表明所获得的样品是羟基磷灰石。图8中的HAp 原始材料中出现的几个明显的衍射峰分别对应于Ca10(PO4)6(OH)2晶面,而Fe-HAp 的特征衍射峰明显减弱甚至消失,这是由Fe(Ⅱ)掺杂引起的。掺杂有两种主要类型:一种是在晶格原子之间插入间隙并扰乱Ca 和O 原子之间的离子键,这种掺杂方法不会产生新的晶体产物;另一种是掺杂离子通过影响晶体的形成和生长来改变晶体的结构,当铁的掺杂量达到一定浓度时,Fe 取代晶格中晶体的某些原始位置,然后形成新产物。从图8 中可以发现,铁能干扰晶体的形成和晶粒的生长,导致晶格畸变,进而Fe-HAp 中出现大量晶格缺陷。这些变化有利于发生各种物理和化学反应,从而提高材料对Pb(Ⅱ)的吸附能力。通过观察两种材料吸附Pb(Ⅱ)后的XRD图谱(图8)可以发现,HAp 吸附后的材料基本保持了原有的衍射峰。Fe-HAp 吸附后的2θ分别对应于25.9°、28.9°、31.8°、39.3°、46.4°、49.5°处的(002)、(102)、(211)、(130)、(213)、(222)晶面类似于HAp[23],恢复了类似HAp晶型,这也证明了吸附后的产物更稳定。因此,可以判断出Fe(Ⅱ)掺杂改性的Fe-HAp 对重金属Pb(Ⅱ)的吸附效率得到了提高[24]。同时,两种材料吸附后在22.1°处均产生明显增益,这是由于材料吸附Pb(Ⅱ)产生Pb3(PO4)2。此外,在22.6°、61.8°处出现的新衍射峰代表Pb10(PO4)6(OH)2的产生[25]。
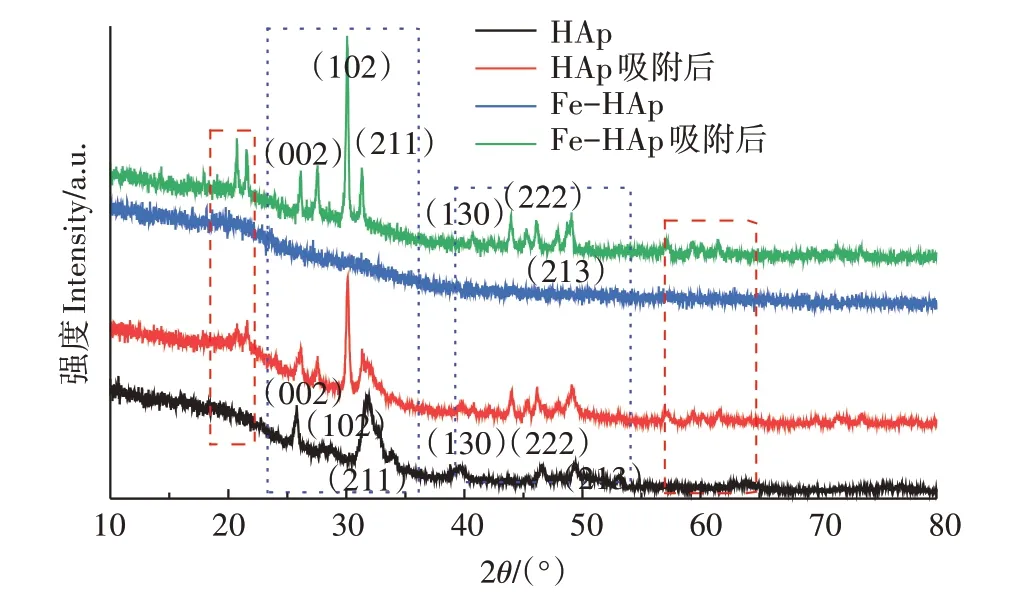
图8 HAp和Fe-HAp吸附Pb(Ⅱ)前后的XRD变化Figure 8 XRD analysis of HAp and Fe-HAp before and after adsorption of Pb(Ⅱ)
如图9 所示,HAp 和Fe-HAp 材料N2吸附等温线属于典型的吸附-解吸Ⅳ型,说明HAp 和Fe-HAp 均属于介孔材料[26]。HAp和Fe-HAp的比表面积分别为94.09 m2·g-1和55.66 m2·g-1,这表明材料的表面积并不是吸附的主导因素。孔径分布结果进一步提供了证据,其中HAp的孔径分布在3.31~52.36 nm 之间,而Fe-HAp具有更加均匀的孔径,孔径为34.44 nm,这与等温吸附结果一致。

图9 HAp和Fe-HAp对N2吸附等温曲线及孔径分布Figure 9 N2 adsorption isotherms and pore size distribution of HAp and Fe-HAp
2.3 吸附机理分析
基于材料表征结果和批量吸附实验结果,分析Fe-HAp高效吸附水溶液中Pb(Ⅱ)的多重吸附机制。
(1)络合沉淀:溶液中Pb(Ⅱ)可以与Fe-HAp 表面磷酸盐和羟基发生化学反应,Fe-HAp 释放出磷酸盐,与Pb(Ⅱ)结合产生沉淀Pb10(PO4)6(OH)2。一些研究表明,在一定的pH值下,Pb(Ⅱ)在HAp上吸附的主要机理是溶解-沉淀[27]。溶解的磷酸盐与Pb(Ⅱ)结合形成Pb-磷灰石[Pb10(PO4)6X2]。络合沉淀的机理可由反应式(9)~(11)表示:

(2)离子交换:阳离子掺杂羟基磷灰石的离子半径越接近Ca2+的半径,相对掺杂率越高[28]。钙离子半径为0.099 nm,铁为0.064 nm,铅为0.119 nm。铁与钙离子半径差值较大,因此严重影响Fe-HAp 结晶,使其更加不稳定,当出现离子半径相近的铅时,更容易发生结合,生成类似HAp 的稳定结构,这也是Fe-HAp 在吸附铅后部分恢复羟基磷灰石晶型的原因。Pb(Ⅱ)可以与HAp 和Fe-HAp 表面Ca(Ⅱ)和Fe(Ⅱ)发生离子交换反应[29],见化学反应式(12)~(14)。吸附后材料的XRD 分析验证了这一机制,HAp 吸附Pb(Ⅱ)后,Ca2.5Pb7.5(PO4)6(OH)2存在于主要产物中;而Fe-HAp吸附后,产物中还发现Fe2.5Pb7.5(PO4)6(OH)2和Pb10(PO4)6(OH)2的衍射峰[10],部分Pb10(PO4)6(OH)2来自于离子交换作用。
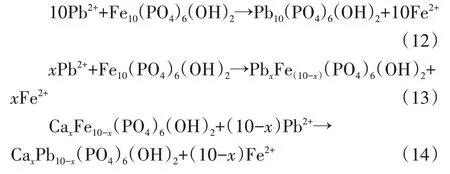
(3)静电引力:HAp 和Fe-HAp 表面带负电荷,且Fe-HAp 表面Zeta 电位的绝对值大于HAp,这可能是Fe-HAp更高效吸附水溶液Pb(Ⅱ)的另一个关键原因。
2.4 循环/再生分析以及重金属阳离子对Pb(Ⅱ)吸附的影响
循环和再生研究能够全面评估吸附剂回收的经济适用性。如图10 所示,在连续4 个吸附/解吸循环之后,Fe-HAp 材料的吸附和解吸效率降低,尽管在每个循环中均降低,但仍可达到77%。通过再生分析可发现,4 个周期后再生率高达85.4%。该现象表明Fe(Ⅱ)掺杂的Fe-HAp 材料具有优异的回收能力,并且可以更经济地处理水溶液中的Pb(Ⅱ)。

图10 Fe-HAp吸附Pb(Ⅱ)的循环与再生分析Figure 10 Cycles and regeneration of Fe-HAp adsorption of Pb(Ⅱ)
其他共存重金属阳离子对Pb(Ⅱ)吸附的影响如图11 所示。结果表明,有共存重金属时,Fe-HAp 对Pb(Ⅱ)的吸附量均有一定程度的降低,但降幅较小,因此可以推断Fe-HAp 对Pb(Ⅱ)吸附的专一性较强,是一种理想的Pb(Ⅱ)吸附剂。

图11 共存重金属对Fe-HAp吸附Pb(Ⅱ)效果的影响Figure 11 The effect of coexisting heavy metals on the adsorption capacity of Fe-HAp on Pb(Ⅱ)
2.5 Fe-HAp与其他吸附剂对比
本研究以Fe(NO3)2为改性剂在水热条件下制备铁掺杂HAp,工艺简单,成本低,不需要严苛的制备条件,仅在典型温度(60 ℃)下反应获得样品。另外,批量吸附实验表明:反应温度为25°C、pH为6时,Fe-HAp 对Pb(Ⅱ)的吸附容量为224.44 mg·g-1,远高于未改性的HAp(121.34 mg·g-1)。与表4中列举的其他典型HAp类吸附剂相比,Fe-HAp吸附能力优异。
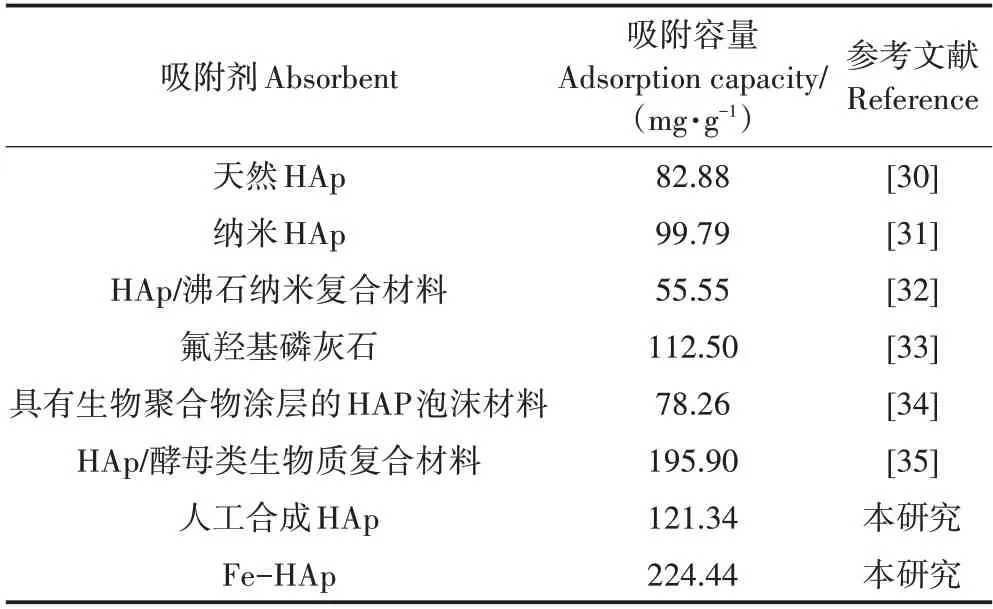
表4 典型HAp类吸附剂对Pb(Ⅱ)吸附效果对比Table 4 Comparison of Pb(Ⅱ)adsorption effects of typical HAp adsorbents
3 结论
本研究通过简单而有效的方法成功制备了掺Fe(Ⅱ)羟基磷灰石,并得到以下结论:
(1)批量吸附试验发现Fe-HAp 对Pb(Ⅱ)的吸附性能随pH(2~6)的增加而明显增加。
(2)Fe-HAp 对Pb(Ⅱ)的吸附过程符合拟二级动力学模型和Langmuir 吸附等温模型,且对Pb(Ⅱ)的吸附是自发的吸热过程。
(3)Fe-HAp 是介孔材料,为孔隙吸附提供大量结合位点。通过综合分析发现,静电引力、离子交换、络合沉淀反应为吸附过程的主要吸附机制。
(4)Fe-HAp 合成过程中形成了无定型晶体,晶格的增强导致其活性位点增多,因而相比于HAp,Fe-HAp对Pb(Ⅱ)的吸附效果更好。
(5)吸附剂再生和可循环试验表明,Fe-HAp 具有良好的可重复利用性,可用于处理重金属污染废水。

