提高乳杆菌属冷冻干燥存活率研究进展
寇佳祥,乔建军,,朱宏吉*,吴昊,张悦
1(天津大学 化工学院,天津,300072)2(天津大学 浙江绍兴研究院,浙江 绍兴,312300)
2014年6月10日,国际益生菌和益生元科学协会在NatureReviewsGastroenterology&Hepatology杂志上发表文章,系统介绍了益生菌的定义和范围[1]。文章肯定了FAO/WHO 在2001年对益生菌的定义,即当食用足够数量时,对所在宿主产生健康益处的活性微生物。对益生菌如何更好地发挥益生作用以及如何更好地被应用于食品、保健品当中,正在成为营养科学、合成生物学、食品科学等学科深度融合及学科交叉发展的热点领域。乳杆菌是目前开发研究较为深入的一类重要的益生菌[2],是人类肠道中重要的生理菌,在食品开发方面有广阔的市场空间,但菌株在产品开发及应用过程中容易受到外界温度、压力、含氧量等不利因素的影响,导致乳杆菌存活率降低,影响乳杆菌的生理活性[3],这是影响乳杆菌在食品方面更深层应用的一大障碍。通过冷冻干燥技术能够获得具有长期保持细胞活力和稳定性的乳杆菌菌粉,并且对细菌损伤较小,但在冻干过程中细胞仍然会受到胞外冰晶的形成和由此导致的渗透压的增加对细胞的损害,因此研究人员针对如何增强乳杆菌的抗冻能力,进而提高乳杆菌的冷冻干燥存活率做了许多研究。如乳杆菌菌粉制备工艺流程(图1)所示,培养基优化、胁迫预处理、添加冻干保护剂、优化预冷冻条件这4方面是影响菌株冻干存活率的关键环节,本文从这4方面总结了提高乳杆菌冻干存活率的最新研究进展。

图1 乳杆菌菌粉制备工艺流程图Fig.1 Process flow chart for preparation of Lactobacillus powder
1 优化培养基组成提高乳杆菌的冻干存活率
1.1 优化培养基增强乳杆菌生理活性
乳杆菌的体外培养离不开培养基,培养基是通过添加各种适合微生物生长所需要的营养物质得到的混合物,包括碳源、氮源、无机盐、金属离子和水等[4]。常规的MRS培养基能够满足绝大多数乳杆菌的正常培养,但在冷冻干燥前需要培养出生理活性更强的乳杆菌,才能更好地抵抗真空冷冻干燥过程对菌株的损伤。通过优化培养基中各成分的比例,可以更好地保护乳杆菌中参与能量代谢的关键酶,如β-半乳糖苷酶、Na+K+-ATP酶和乳酸脱氢酶的活力,从而增强菌株的生理活性[5]。优化培养基比例可使菌株生理活性增强,生长能力就越强,通过高密度培养就会产生越多菌株,李娜等[6]通过响应面实验优化了MRS培养基组成及比例,蔗糖43 g/L、玉米浆干粉60 g/L、Na2HPO4-柠檬酸0.12 mol/L、MgSO4·7H2O 0.20 g/L、MnSO4·H2O 0.10 g/L、吐温80 1 m L/L时,植物乳杆菌ZJ316活菌数比常规培养基提高了3.44倍。CHOI等[7]通过优化MRS培养基比例,提高了植物乳杆菌200665的生长能力,在相同时间内产生的菌种量是常规培养基的1.58倍。此外,研究人员还开发了新型培养基,LIEWSKA等[8]开发了以小麦、玉米、大麦和黑麦粉为原料的培养基,使鼠李糖乳杆菌有更好的生理活性,其最大生长速率比在常规MRS培养基中提高了1倍。乳杆菌能够利用的碳源较多,除葡萄糖外,还有蔗糖、半乳糖、乳糖、果糖、甘露糖、水苏糖、低聚果糖、低聚木糖等。由于乳杆菌基因的特异性及多样性,不同的乳杆菌对培养基中碳源利用的偏好性不同,针对不同的乳杆菌可以添加或替换不同碳源以达到增强菌株活性的目的。如CARVALHO等[9]比较了葡萄糖、果糖、乳糖、甘露糖4种糖分别作为碳源时保加利亚乳杆菌的生理活性和抗冻性能,结果表明以甘露糖为碳源的培养基培养出的菌株生长量最大,同时菌株具有最好的抗冻效果。以蔗糖代替葡萄糖为碳源得到优化培养基用以培养植物乳杆菌LIP-1,冻干存活率也会有很大提升[10]。除了对常规培养基进行碳源的添加或替换,在培养基中添加一些生长因子也能提高乳杆菌的生理活性,使乳杆菌更好地适应冻干过程中的不利环境,这些生长因子包括无机盐、氨基酸、天然产物等。如在MRS培养基中添加了0.5 mmol/L的Ca2+,不但使植物乳杆菌LIP-1的冻干存活率从55.15%提高到76.67%,并且常温储存8周后,比未添加组活菌数提高了13.65倍[10]。在常规培养基中额外添加氨基酸能够提高保加利亚乳杆菌L2的抗冷冻干燥能力,添加了L-半胱氨酸的培养基得到了活性更高的菌株[11]。同样在MRS液体培养基中添加了10%的番茄汁作为嗜酸乳杆菌的生长因子,也增强了菌株活性,提高了菌株的抗冻能力。此外,一些天然分子添加到培养基中也会增强菌株的抗冻能力。CHEN等[12]将NaCl、甜菜碱、谷氨酸钠、山梨醇、甘露醇、甘露糖6种天然分子分别添加到MRS培养基中,研究添加天然分子对德氏乳杆菌生长活性及冻干存活率的影响,发现NaCl、山梨醇对菌株的冻干存活率有显著影响,当二者的浓度分别为0.6%、0.15%时,保加利亚乳杆菌的冻干存活率最高,分别为42.7%和45.4%。以上研究可以看出,针对不同的乳杆菌开发出对应的优化培养基能够得到活性更强的菌株,进而能提高菌株应对冷冻干燥不利条件的能力。
1.2 优化培养基促进乳杆菌生物膜的形成
生物膜可以维持细胞之间的化学物质交换,调节细胞运动和代谢产物的生产,并具有一定的机械稳定性,因此通过培养基优化促进乳杆菌形成更多生物膜有利于增强菌株抵抗不利环境的能力,提高菌株的冷冻干燥存活率。研究表明,若培养基中无碳源,则乳杆菌很难形成生物膜,当培养基中碳源浓度过高,也会抑制生物膜的形成[13]。因此,针对不同乳杆菌选择合适的碳源浓度能促进生物膜的形成。另外一些金属离子对生物膜的形成也有影响,Mn2+、Fe3+、Mg2+和Na+等金属离子能促进生物膜形成,这是由于部分金属离子能直接促进相关基因的表达,有学者将生物膜测定与转录组实验相结合,发现培养基中K+显著促进植物乳杆菌LIP-1中的luxs/ai-2群体感应系统中luxs基因的表达,促进了AI-2信号分子的合成,上调了生物膜形成的关键基因cysE基因的表达,从而促进了生物膜的形成,增强菌株的抗冻性能[14]。若加入D-半乳糖抑制剂则会抑制luxS和cysE基因的表达,减少生物膜的形成,降低冻干性能。而Cu2+、Al3+、Pb+和Zn+等金属离子对生物膜的生长产生抑制作用,不利于菌株抵抗外界环境[15-16],导致乳杆菌存活率降低,因此在培养基中选择性地添加一些金属离子能够促进生物膜的形成,增强菌株的抗冻能力,进而提高冻干存活率。
1.3 优化培养基改变细胞膜不饱和脂肪酸比例
在冷冻干燥过程中,细胞内外形成的冰晶会刺破细胞膜,影响细胞膜的完整性;细胞由于脱水导致流动性降低,代谢功能受到影响,降低了冷冻干燥存活率。脂肪酸是影响细胞膜流动性的关键因素,不饱和脂肪酸的含量决定了细胞膜的黏度和厚度,不饱和脂肪酸所占比例越高,细胞膜的流动性越好,细胞抵抗冷冻能力就越强。因此研究人员通过优化培养基组分等方式提高细胞膜不饱和脂肪酸比例。通过调节pH、添加适宜浓度的油酸、无机盐离子、吐温80等能够提高不饱和脂肪酸的比例。若将MRS培养基初始pH从7.4下调至6.8,则植物乳杆菌LIP-1的冻干存活率由72.43%增加至81.76%[17]。研究发现pH为6.8的培养基能更好地提高细胞膜不饱和脂肪酸的含量、更好地保持代谢关键酶活性、更好地维持细胞膜的完整性,减少菌株的冻干损伤,从而提升菌株的抗冷冻干燥性能。钱志浩等[18]通过气相质谱联用检测发现在培养基中添加2 mL/L的吐温80能显著提高细胞膜不饱和脂肪酸比例,使鼠李糖乳杆菌FJND和短乳杆菌173-1-2的冻干存活率有了显著提升。在培养基中添加适宜浓度的K+能促进基因簇中trkA基因和lysR型转录因子的上调,而lysR的上调促进了acc和fab家族基因上调。acc和fab基因的上调增加了植物乳杆菌LIP-1细胞膜不饱和脂肪酸C18:ln9c、C18:2n6c、C20:3n6和C20:4n6的含量,提高了细胞膜流动性,增强了植物乳杆菌LIP-1抗冻干性[19]。在培养基中添加0.001%的油酸同样能够提高细胞膜不饱和脂肪酸比例,提高植物乳杆菌冷冻干燥后的存活率,并且不同的乳杆菌具有不同的最佳油酸浓度[20]。
总之,通过优化培养基组成能够增强菌株的代谢能力,提高菌株生理活性,促进菌株生物膜的形成增强自我保护能力,提高细胞膜不饱和脂肪酸含量增强细胞膜流动性并保护关键酶活性,进而提高乳杆菌的冷冻干燥存活率。
2 胁迫预处理增强乳杆菌抗冻能力
胁迫预处理是指在冻干前将菌液转移至特定环境中一段时间,使菌株在该环境影响下增强抗冻能力,进而提高菌株的冻干存活率。具体的胁迫预处理方式包括冷胁迫[21]、热胁迫[22]、酸胁迫[23]等。
2.1 冷胁迫预处理增强乳杆菌抗冻能力
冷胁迫预处理是将菌株放置于低于其最适生长温度的环境一定时间,以增强其抗冻能力。冷胁迫对菌株抗冻能力的提升体现在维持细胞膜流动性、刺激冷应激蛋白的表达2个方面。研究表明冷冻环境下细胞膜的流动性会受到影响,冷胁迫能改变乳杆菌细胞膜脂肪酸的组成,提高其抗冻能力。不饱和脂肪酸所占比例越高,细胞膜流动性越好,抗冻能力也相应越强。王晓萌等[24]采用冷胁迫方法对嗜酸乳杆菌 ATCC 4356进行处理,8 ℃冷胁迫处理15 h,冷冻干燥后的存活率提升至96.64%,比未冷胁迫组提高了17.65%。乳杆菌为适应寒冷环境会上调冷应激蛋白的表达。冷应激蛋白(cold shock proteins,CSPs)是在冷刺激条件下产生的一系列抗冻蛋白质,分子质量约为7 ku,能使菌株更好地适应低温环境和增强抗冻能力。李梦洋等[25]利用实时荧光定量PCR技术研究了冷胁迫处理对保加利亚乳杆菌LM1冷应激蛋白表达的影响,冷胁迫条件为20 ℃环境中静置2 h,该处理能使菌株的cspA基因的mRNA拷贝数增加3.34倍左右,由此可以推测CSPs的表达量有所增加。EROGLU等[26]发现微生物菌体内的CSPs在低温条件下,其蛋白质的空间结构稳定,保持了与底物的结合能力,仍具有较高的催化活性,提高了细胞的抗冻干能力,同时CSPs能保护细胞膜上相关酶,防止因酶变性而损害细胞[27]。以上研究均表明在乳杆菌冷冻干燥前进行冷胁迫预处理能够增强其冻干存活率,并且不同的乳杆菌最适预冷冻温度有差异。
2.2 热胁迫预处理增强乳杆菌抗冻能力
热胁迫预处理是指将乳杆菌放置在高于其最适生长温度的环境中一定时间。经过热胁迫与处理的乳杆菌抵抗不利环境能力增强,对冷冻干燥不利条件的抵抗能力也有一定的增强。研究显示,热胁迫处理使细菌细胞在冷冻干燥后能够更快地恢复生长和产酸[28]。另外热胁迫能促进热休克蛋白的表达,这是细胞为适应不利热环境选择性上调表达的一类蛋白(Hsps),包括伴侣蛋白(DnaK和GroEL)和辅因子(GOES)。热休克蛋白能够促进正确的蛋白质折叠,并帮助恢复变性蛋白质和新生多肽的结构-功能,保持菌株的代谢功能更为稳定[29]。ZHEN等[30]以45 ℃条件热休克处理嗜酸乳杆菌 ATCC 4356 30 min,其冻干成活率由39.1%提高到56.3%。除了冻干存活率有所提升,菌株的糖代谢和能量代谢能力也有一定程度的增强。热胁迫处理后,菌株的胞内葡萄糖转化率提高了24.04%,胞外多糖的产量增加,半乳糖的产量从17%增加到26%,Na+-K+-ATPase活性显著升高,这些变化共同提高了细菌细胞在冻干环境中的活力和存活率。嗜酸乳杆菌通过热胁迫处理也能提高冻干存活率,当胁迫处理条件为46 ℃温度下热胁迫处理30 min,冻干存活率为56.77%,比对照组存活率提高了50.66%[31]。以45 ℃热胁迫处理嗜酸乳杆菌ATCC 4356 30 min并结合冻干保护剂,菌株的存活率达到92.8%[32]。总之,热胁迫预处理对菌株的积极作用体现在促进热休克蛋白表达、维持细胞的正常能量代谢,维持细胞在不利环境中的活力,进而增强其抗冻能力,提高冷冻干燥存活率。
2.3 酸胁迫预处理增强乳杆菌抗冻能力
酸胁迫预处理是指将菌株放置于低于其最适生长pH的环境一定时间,以增强其抗冻能力。不同的乳杆菌有不同的最适酸胁迫条件。低pH环境对菌株抗冻能力的增强主要是通过调节其代谢途径使菌株更加适应冷冻条件。酸胁迫对菌株代谢途径影响最大的是糖酵解途径和脂肪酸代谢途径。研究人员通过转录组学和蛋白质组学技术研究发现,一方面酸胁迫促进了糖酵解途径中丙酮酸向乳酸的转化,在酸胁迫下,乳酸脱氢酶基因表达上调,加速了糖酵解,为菌株生长提供了更多的能量,菌株可以利用这些能量来提高对恶劣环境的适应能力[33]。另一方面,酸胁迫促进了ACC家族基因、Fab家族基因和丙酮酸脱氢酶基因表达上调,ACC家族基因和Fab家族基因的表达促进了脂肪酸碳链的延伸,增加了碳链上的不饱和双键,提高了不饱和脂肪酸的相对含量,而丙酮酸脱氢酶基因表达上调能促使丙酮酸转化为乙酰辅酶A,进而影响了细胞膜脂肪酸的代谢和合成[34]。由此可见,经过酸胁迫预处理乳杆菌细胞膜不饱和脂肪酸的比例更高,使菌株细胞膜有更好的流动性,细胞膜完整性更高,因此具有更高的冻干存活率。
目前除了单一条件的胁迫预处理,也有将多种胁迫预处理方式交互使用的研究,并且取得了良好的效果。如杨婕等[35]研究发现酸-冷交互胁迫对发酵乳杆菌ATM的冻干存活率有很大提升,存活率达到87.19%。交互胁迫预处理对于不同的胁迫条件有更为严格的要求,因此需要更加深入的研究。
3 添加冻干保护剂降低乳杆菌冷冻干燥损伤
3.1 冻干保护剂分类
冷冻干燥技术被认为是最为温和的脱水技术,广泛应用于各类益生菌菌粉的制备。但在冻干过程中,由于低温、干燥、高渗等多重不利因素影响,菌体细胞膜易受到环境中及胞内水分子形成的不规则冰晶的破坏,代谢能力下降导致菌株受到不可逆的损伤,因此需要在冷冻干燥之前加入保护剂以保持冻干过程中菌株的稳定性,提高菌株的存活率,维持细胞内部关键酶活性。保护剂的种类很多,按照渗透性可以分为渗透类、半渗透类和不渗透类保护剂。如图2所示,渗透类保护剂指保护剂能够透过细菌的细胞壁和细胞膜,调节胞内胞外渗透压平衡。甘油是经典的渗透类保护剂,能够增强细胞膜的流动性,抑制细胞过度脱水,冰与水结合,抑制冰晶的形成,从而达到保护菌株的效果。半渗透类保护剂指保护剂能透过细胞壁但无法透过细胞膜,一般包括小分子糖如海藻糖[36]、甘露糖[37]、棉籽糖[38]、蔗糖[39]等,小分子糖含有的游离羟基能够与蛋白质极性基团和细胞膜上磷脂结合形成氢键,为细胞提供机械保护。另外这类保护剂能够诱导细菌质壁分离,集中在细胞膜和细胞壁之间阻止冰晶的生长。不渗透类保护剂指保护剂不能进入细胞壁及细胞膜,在细胞的外侧为细菌提供保护,包括乳清蛋白[40]、脱脂乳[41]等大分子。这类保护剂可以吸附在细菌壁外表面形成保护壳[42],为菌株提供一个相对封闭的环境,阻止细胞与冰晶的接触并能减少与氧气的接触,从而减少菌株损伤。

图2 冻干保护剂的分类Fig.2 Classification of lyophilized protective agents
3.2 冻干保护剂对乳杆菌的保护
由于不同类型保护剂的保护机制不同,单一类型的冻干保护剂往往不能达到很好的保护效果,因此研究人员通常将多种类型的保护剂进行复配从而得到复合冻干保护剂,从多个方面对菌株进行保护。复合冻干保护剂的开发一般通过正交试验或响应面法,将不同类型的保护剂进行组合,以菌株的冻干存活率为响应值,通过实验数据预测出最佳复合冻干保护剂配方并加以验证,最终得到保护效果最好的冻干保护剂。表1总结了近年来针对不同的乳杆菌开发的冻干保护剂。由表1可以看出,冻干保护剂的种类较多,添加了复合冻干保护剂的乳杆菌冻干存活率都在80%以上。
4 优化预冷冻条件降低乳杆菌冷冻干燥损伤
4.1 预冷冻温度对乳杆菌冷冻干燥存活率的影响
合适的预冷冻温度是冷冻干燥技术的重要一环,若预冷冻温度不足够低,则样品将无法完全冷冻,真空升华过程中融化并且膨胀发泡,影响最终的菌粉状态。若预冷冻温度过低,不仅会增加能耗浪费资源,而且会加重菌体损伤,降低菌株的冻干存活率,因此预冷冻温度对菌株的冻干存活率有重要影响。如表1所示针对不同的菌株和保护剂,研究人员采用不同的预冷冻温度最大程度降低对菌株的损伤。不同属的乳杆菌有不同的最适预冷冻温度,如鼠李糖乳杆菌Lr-1的最适预冷冻温度为-20 ℃,植物乳杆菌SC1的最适预冷冻温度为-70 ℃。同属的乳杆菌在不同条件时最适预冷冻温度也有所差异。WANG等[52]的研究表明,当使用山梨醇为保护剂时,植物乳杆菌AR113、AR307和WCFS1的最佳预冷冻温度分别为-196、-40和-20 ℃,当使用海藻糖为保护剂时,植物乳杆菌AR113、AR307和WCFS1的最佳预冷冻温度分别为-20、-60和-60 ℃,可见最佳预冷冻温度的选择与保护剂种类和菌株的特异性有关。

表1 不同乳杆菌对应的冻干保护剂Table 1 Lyophilized protective agents corresponding to different Lactobacillus
4.2 降温速率对乳杆菌冷冻干燥率的影响
降温速率是影响菌株在预冷冻过程中保持活性的关键因素。如图3所示,在预冷冻阶段,合理控制降温速率能够减少细胞冷冻损伤[53],A表示降温速率过慢,细胞会由于过度脱水而收缩,细胞内部溶质集中,过度浓缩,可能导致蛋白质失活,进而引起细胞死亡;C表示降温速率过快,胞外环境以及胞内水分子容易形成大量细小的无规则冰晶,容易刺破细胞对菌体造成严重损伤;B表示最佳降温速率,在最佳降温速率条件下不会出现溶质效应和胞内结冰,降温速率与细胞内部水分的渗透率相适应,能最大程度降低细胞损伤。不同乳杆菌的最佳降温速率不同,植物乳杆菌ST-3在降温速率为-1 ℃/min条件下得到最高冻干存活率,干酪乳杆菌LC2 W在-10 ℃/min条件下冻干存活率最高[54]。目前针对乳杆菌冷冻干燥过程中降温速率对存活率的影响研究有限,因此设计合理的降温速率进行梯度降温还有很大的研究空间。
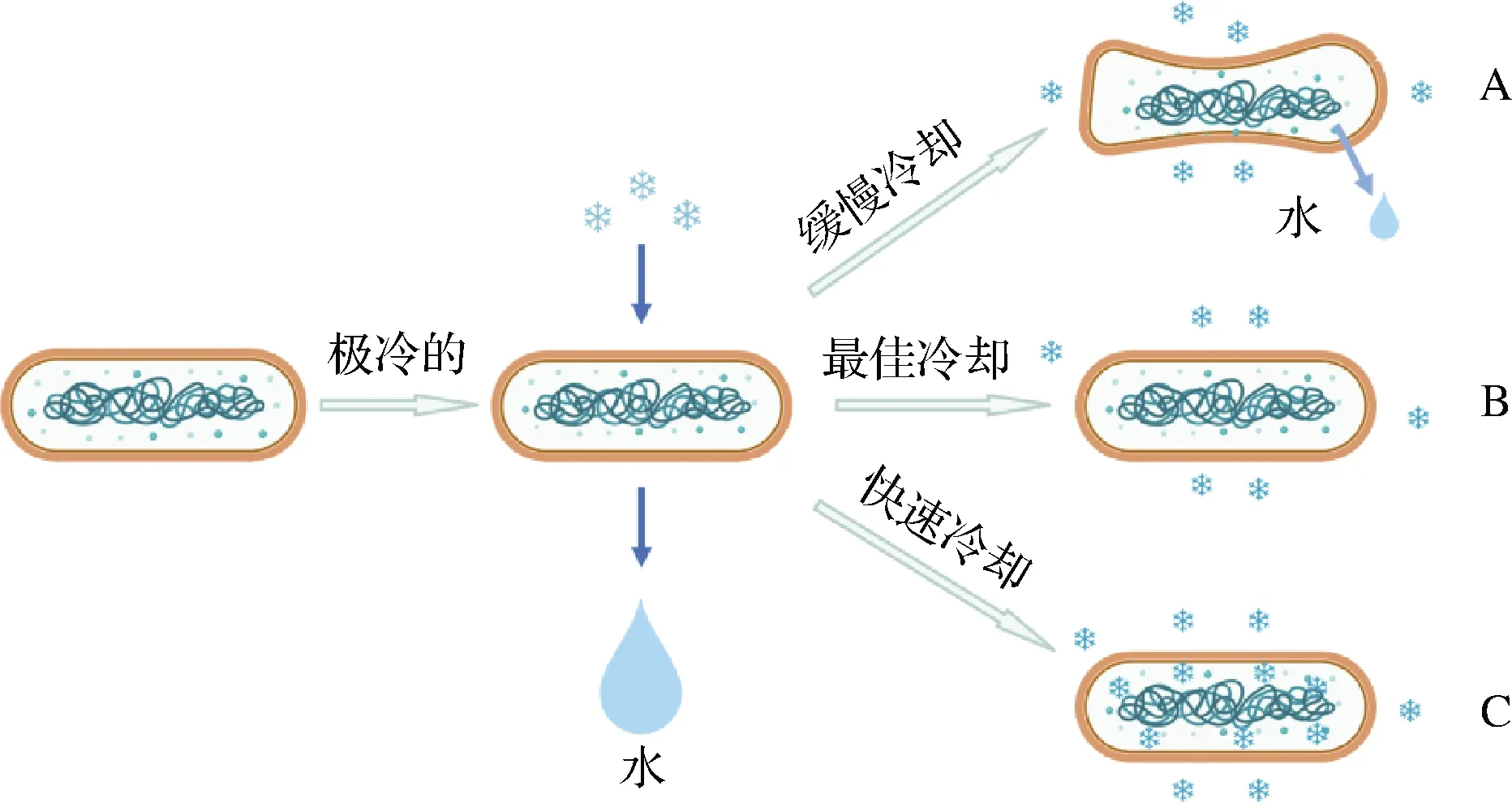
图3 不同降温速率对细菌存活的影响(修改自RAJU等[53])Fig.3 Effects of different cooling rates on bacterial survival
5 展望
近年来,对于如何将乳杆菌更好地应用于产品开发成为食品学领域的热点。生产出具有高活菌数并且能够很好耐受胃液、肠液、胆盐环境等不利条件的乳杆菌菌粉是研究人员的目标。目前针对增强乳杆菌抗冻性能,提高乳杆菌冷冻干燥存活率的研究仍在不断探索当中,针对特定的菌株确定特定的培养及优化、胁迫预处理、冻干保护剂和预冷冻条件的研究较多,但对不同乳杆菌具有普适性保护效果的冻干保护剂及保护条件研究较少。对于既能起到冻干保护作用,又能促进菌株生长发育的新型益生元类冻干保护剂也在不断开发当中,这对提高乳杆菌冷冻干燥存活率及后续乳杆菌在肠道中的生长定植有着重要意义,同时也对人类健康发展有着重要的意义。

