藜麦醇溶蛋白的氨基酸组成、抗氧化性与乳化性研究
刘乐,李艳,连加达,张颖,郑亚军
(山西师范大学 食品科学学院,山西 太原,030092)
醇溶蛋白由于其独特的溶解性能与功能特性受到日益广泛的关注[1]。与一般蛋白质相比,醇溶蛋白具有较好的凝胶性能和乳化性能,在制药、高端化妆品、保健食品行业被广泛应用[2]。抗氧化剂一般指能够清除过剩自由基的物质。当机体失衡时,大量过剩的自由基会引发连锁反应使得细胞的结构受到破坏,各类疾病随之而来[3]。因此,寻找安全、高效、无毒的天然抗氧化剂成为现代医学等学科研究的热点。近年来,研究发现,由于某些天然蛋白质含有特定的氨基酸序列而表现出良好的抗氧化活性,同时它们又具有较高的营养价值,因此,从天然蛋白质中开发抗氧化剂逐渐引起人们的关注。藜麦(ChenopodiumquinoaWilld.)是一种藜科植物,其蛋白质含量高达18%,且氨基酸配比平衡,藜麦蛋白中醇溶蛋白的含量约占12%[4]。藜麦自20世纪90年代引入我国,目前在山西省、河北省和内蒙古自治区的种植面积较大,属于新型经济作物[5]。近年来,学者们对藜麦总蛋白的结构、加工特性与生物活性进行了分析,并从中鉴定出一些降血压肽和降血脂肽[6-7]。但目前国内外对藜麦蛋白尤其是醇溶蛋白(quinoa prolamine,QP)的研究报道极少[4]。由于醇溶蛋白的氨基酸组成和亚基构成与其营养价值与加工特性密切相关,而醇溶蛋白的抗氧化性与乳化性是其能否作为天然抗氧化剂与乳化剂的主要指标,因此本试验研究藜麦醇溶蛋白的提取、分子质量分布、氨基酸组成、抗氧化性与乳化性,以探究其作为天然抗氧化剂与乳化剂的可能性,同时也为藜麦产业的发展提供理论基础。
1 材料与方法
1.1 材料与试剂
藜麦,山西省忻州市藜农食品公司。2-D脱氧核糖、2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基,武汉清季生物科技公司;FeCl3、FeSO4、邻苯三酚等,西安科维化学试剂有限公司;玉米醇溶蛋白、维生素C,上海素培生物公司。
1.2 仪器与设备
UV-1800PC紫外可见分光光度计,浙江上虞光申科仪器公司;PR18CK-2冷冻高速离心机,德国Hettich公司;BA210生物显微镜,上海Motic Otic有限公司;HSA-D数显水浴振荡仪,苏州瑞天仪器厂;DYCZ-24D型电泳槽、DYY-6C型电泳仪,北京六一生物仪器有限公司;Gene TBFW-1型凝胶成像仪,日本GENE公司;HITACHI L-8900型氨基酸自动分析仪,日本日立公司。
1.3 实验方法
1.3.1 藜麦醇溶蛋白的制备工艺
藜麦→清洗→干燥→粉碎→过60目筛→脱脂→干燥→二次粉碎→脱脂藜麦粉→过100目筛→加入0.3 mol/L NaCl[1∶10(g∶mL)]→室温下搅拌提取2 h→过滤→弃滤液、收集滤渣→加入75%乙醇[1∶10(g∶mL)]→搅拌提取2 h→过滤→收集滤液→离心(6 000×g,20 min)→收集上清液→真空冷冻干燥→藜麦醇溶蛋白
其中,加入0.3 mol/L NaCl的目的是将脱脂藜麦中球蛋白与清蛋白提取出来,再从剩余的滤渣中提取醇溶蛋白,以提高醇溶蛋白的纯度;蛋白质的浓度采用考马斯亮蓝法测定[8]。
1.3.2 SDS-PAGE分析
参考SAHNI等[9]方法。将藜麦醇溶蛋白溶解于样品缓冲液中,使其质量浓度为1 mg/mL,在100 ℃下煮沸4 min,上样12 μL,恒压电泳(浓缩胶100 V,分离胶150 V)。电泳结束后,将胶片用考马斯亮蓝R-250染色并过夜,放入脱色液中脱色,直至胶片背景蓝色完全透明,用凝胶成像仪分析。
1.3.3 藜麦醇溶蛋白的氨基酸组成分析
取6 mol/L的盐酸5 mL,缓慢加入装有0.1 g藜麦醇溶蛋白的带塞试管中,搅拌均匀,密封,置于110 ℃下放置24 h。过膜(水相、孔径为0.45 μm)后取滤液,在氨基酸自动分析仪上分析氨基酸组成与含量[10]。
1.3.4 抗氧化性分析
将藜麦醇溶蛋白复溶于75%乙醇中,配制成质量浓度分别为0.1、0.15、0.2、0.25、0.3 mg/mL的溶液,进行抗氧化活性试验。
1.3.4.1 还原力的测定[9]
首先将0.5 mL藜麦醇溶蛋白溶液(0.1~0.3 mg/mL)、1.2 mL磷酸缓冲溶液(pH 6.6,0.2 mol/L)和1.25 mL铁氰化钾(1%,质量分数)混合均匀,50 ℃下反应0.5 h。然后加入1.25 mL三氯乙酸(10 mg/mL),离心(3 000×g,10 min),将1.25 mL上清液,1.25 mL蒸馏水和0.25 mL的FeCl3(1%,质量分数)混合均匀,静置3 min后在700 nm处比色。同时以玉米醇溶蛋白(zein)和维生素C作为参比。
1.3.4.2 Fe2+络合能力的测定
取450 μL藜麦醇溶蛋白溶液(0.1~0.3 mg/mL),加入45 μL FeSO4(2 mmol/L),然后摇匀,再加入90 μL的Ferrozine(5 mmol/L),然后加入1 815 μL的蒸馏水,摇匀后反应30 min,在532 nm处测其吸光度[10]。同时以玉米醇溶蛋白和维生素C作为参比。Fe2+络合率计算如公式(1)所示:

(1)
式中:AS、AB和AC分别是样品组、样品空白组(以蒸馏水代替Ferrozine)和对照组(蒸馏水代替样品)的吸光值。
1.3.4.3 清除·O2-能力
取样品液(0.1~0.3 mg/mL)0.1 mL,加入0.2 mol/L、pH 8.0的磷酸缓冲溶液1.5 mL和3 mmol/L邻苯三酚1.5 mL,混匀后立即在320 nm处比色,每30 s记录1次,共检测5 min[11]。·O2-清除率计算如公式(2)所示:

(2)
式中:AS、AB和AC分别是样品组、样品空白组(以0.2 mol/L pH 8.0磷酸缓冲液代替邻苯三酚)和对照组(以0.2 mol/L、pH 7.4磷酸缓冲液代替样品)的吸光值。同时以玉米醇溶蛋白和维生素C为参比。
1.3.4.4 对·OH的清除作用
在0.1 mL藜麦醇溶蛋白溶液(0.1~0.3 mg/mL)中依次加入0.1 mL FeSO4-EDTA(10 mmol/L)、0.1 mL 2-D脱氧核糖(10 mmol/L)和1.4 mL磷酸缓冲溶液(0.1 mol/L pH 7.4),混匀,以0.1 mL双氧水(20 mmol/L)启动反应[12]。水浴反应(37 ℃)1 h后,将反应液与1 mL三氯乙酸(质量分数28%)和10 mg/mL的硫代巴比妥酸混合,在沸水浴中继续反应20 min,冷却至室温,于532 nm处比色。同时设置样品空白组(以蒸馏水代替2-D脱氧核糖)和对照组(以蒸馏水代替样品)。同时以玉米醇溶蛋白和维生素C为参比。·OH清除能力按公式(3)计算:
(3)
式中:AS、AB和AC分别是样品组、样品空白组和对照组的吸光值。
1.3.4.5 对ABTS阳离子自由基的清除能力
配制7 mmol/L的ABTS(溶于0.1 mol/L pH 7.4磷酸缓冲液)溶液,与3 mmol/L的过硫酸钾按1∶1(体积比)混匀,暗反应12~16 h[10]。然后用0.1 mol/L、pH 7.4磷酸缓冲液稀释原液至溶液在734 nm处的吸光值为(0.7±0.01),并记录稀释倍数。取稀释液2 mL,加入样品溶液(0.1~0.3 mg/mL)0.02 mL,30 ℃下避光反应6 min后,测定其在734 nm处的吸光值。同时以玉米醇溶蛋白和维生素C为参比。按公式(4)计算ABTS阳离子自由基清除率。
(4)
式中:AS、AB和AC分别是样品组、样品空白组(以0.1 mol/L、pH 7.4的磷酸缓冲液代替ABTS溶液)和对照组(以0.1 mol/L、pH 7.4磷酸缓冲液代替样品)的吸光值。
1.3.5 藜麦醇溶蛋白乳化性测定
试验共分为5组,各组称取0.2 g藜麦醇溶蛋白于离心管中,将15 mL蒸馏水与5 mL大豆油混合。分别调节pH为2.0、4.0、6.0、8.0和10.0,然后在均质机中均质2 min(10 000 r/min)。从形成的乳浊液底部迅速吸出50 μL加入比色皿中,用十二烷基硫酸钠(1 g/L)稀释至2.5 mL,立即测定其在500 nm处的吸光值(A0)以及放置30 min的吸光值(At)[13]。乳化指数(emulsify ability index,EAI)和乳化稳定性(emulsion stability,ES)按公式(5)(6)计算:
(5)
式中:V,油相体积,L;c,藜麦醇溶蛋白溶液浓度,mol/L;n,稀释倍数。
(6)
为观察藜麦醇溶蛋白形成乳化液的微观形态,取少量新形成的乳状液转移到载玻片上,立即在BA210型生物显微镜下观察并拍照,放置30 min后再次拍照。放大倍数40倍,观察比例为1 μm。
1.3.6 数据处理
试验至少重复3次,取平均值,方差分析采用SPSS 16.0软件。
2 结果与分析
2.1 藜麦醇溶蛋白的含量与SDS-PAGE分析
采用SDS-PAGE电泳方法对藜麦醇溶蛋白的亚基组成和分子质量进行分析,分析结果见图1,本试验中藜麦醇溶蛋白只得到1个亚基,分子质量为9.74 kDa,这与前人的研究报道一致[4]。与大分子质量的蛋白质相比,小分子质量的蛋白质在溶解性、乳化性和消化吸收方面具有一定优势。同时,小分子质量的醇溶蛋白具有较好的抗氧化性[11]。例如,将小米、玉米醇溶蛋白酶解后生成的小分子水解肽,其抗氧化性要显著高于未水解的小米和玉米醇溶蛋白[15-16]。
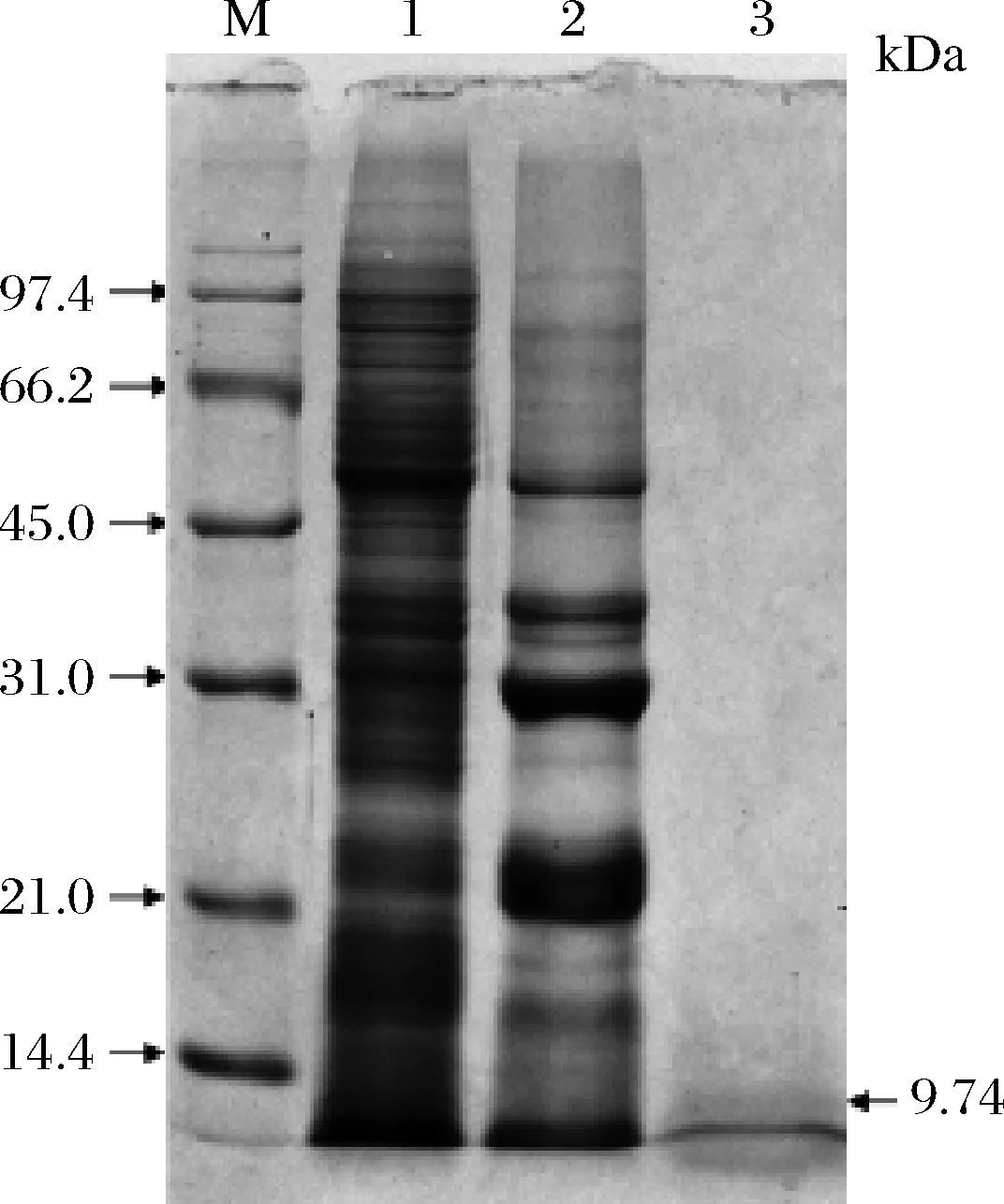
M-标准蛋白;1-清蛋白;2-球蛋白;3-醇溶蛋白图1 藜麦醇溶蛋白的 SDS-PAGE图谱Fig.1 SDS-PAGE profiles of quinoa prolamine
2.2 藜麦醇溶蛋白的氨基酸组成
从表1可知,本试验从藜麦醇溶蛋白中共检测出14种氨基酸,其中必需氨基酸在总氨基酸的比例达到20.36 g/100 g蛋白质;世界卫生组织与联合国粮农组织(FAO/WHO)[14]曾指出优质蛋白质中必需氨基酸在总氨基酸的比例应大于12.7 g/100 g,这表明藜麦醇溶蛋白的营养价值较高。此外,藜麦醇溶蛋白中色氨酸、苯丙氨酸、精氨酸、谷氨酸和组氨酸的含量较高,均高于小米与玉米醇溶蛋白[15-16]。

表1 藜麦醇溶蛋白的氨基酸组成 单位:g/100 g(蛋白质)Table 1 Amino acid composition of quinoa prolamine
研究表明,苯丙氨酸与色氨酸侧链上的酚羟基、精氨酸的胍基和组氨酸的咪唑基,都是性能优良的质子提供体或电子淬灭基团,抗氧化性很高[10,16];而谷氨酸上的羧基可以很好地络合过渡态金属离子(主要是Fe2+和Cu2+),清除氧化反应的催化剂,抑制油脂自氧化的发生[17]。此外,藜麦醇溶蛋白中非极性氨基酸的含量为21.68 g/100 g,其含量决定了氨基酸的疏水性,而表面疏水性又是影响蛋白质乳化性能的重要内在因素[10]。
2.3 藜麦醇溶蛋白的抗氧化性
2.3.1 藜麦醇溶蛋白的还原力
以玉米醇溶蛋白与维生素C为对照,藜麦醇溶蛋白的还原力见图2。相同质量浓度(>0.25 mg/mL)时,藜麦醇溶蛋白的还原力与玉米醇溶蛋白接近,但显著低于维生素C的还原力(P<0.05)。玉米醇溶蛋白是良好的抗氧化剂,具有较高的还原力;而维生素C是功能强大的抗氧化剂,被广泛应用于食品工业中[16, 18]。本试验结果与前人的报道一致。同时也表明,藜麦醇溶蛋白的还原力较强。此外,藜麦醇溶蛋白的质量浓度从0.1 mg/mL逐渐增大到 0.3 mg/mL时,其还原力也越来越大。这可能与其独特的溶解性及氨基酸组成有关。表1结果表明藜麦醇溶蛋白中组氨酸和精氨酸以及芳香族氨基酸的含量较高,这几种氨基酸具有较强的给出质子能力,因此还原力较强。随着浓度的增大,这些氨基酸的浓度也变大,因此藜麦醇溶蛋白表现出较高的还原力。

图2 藜麦醇溶蛋白的还原力Fig.2 Reducing power of quinoa prolamine注:图中不同小写字母表示显著性差异(P < 0.05)(下同)
2.3.2 藜麦醇溶蛋白对Fe2+的络合能力
由图3可知,随着浓度的增加,藜麦醇溶蛋白对Fe2+的络合能力逐渐增大。当藜麦醇溶蛋白质量浓度达到0.25 mg/mL时,对Fe2+的络合趋于饱和,因此络合率随浓度的增大变化并不明显。此外,相同浓度时,藜麦醇溶蛋白对Fe2+的络合能力显著高于玉米醇溶蛋白;但显著低于维生素C对Fe2+的络合能力(P<0.05)。金属离子螯合剂可通过络合金属离子来阻断或抑制油脂的自氧化反应链或食品中酚类物质的酶促褐变[18]。玉米醇溶蛋白因为金属离子络合能力较强、成膜性能好,是目前被广泛应用的可食性保鲜膜[19]。本试验结果表明,藜麦醇溶蛋白的Fe2+络合能力显著高于玉米醇溶蛋白,具有开发为天然金属离子螯合剂的潜力。

图3 藜麦醇溶蛋白对Fe2+的络合能力Fig.3 Ferrous ion chelating capacity of quinoa prolamine
2.3.3 藜麦醇溶蛋白对·O2-的清除能力
从图4可以看出,藜麦醇溶蛋白、玉米醇溶蛋白和维生素C均表现出较好的·O2-清除能力。其中,维生素C对·O2-的清除能力最强,玉米醇溶蛋白次之,这与前人的报道一致[19]。图4结果也证实了藜麦醇溶蛋白的·O2-清除能力较强,且清除能力与浓度在一定范围内呈正相关关系。这表明藜麦醇溶蛋白可以通过提供质子或清除电子而使·O2-淬灭,表现出超氧化物歧化酶活性。在0.2~0.3 mg/mL范围内,藜麦醇溶蛋白对·O2-的清除能力与小米醇溶蛋白的清除能力接近[10]。
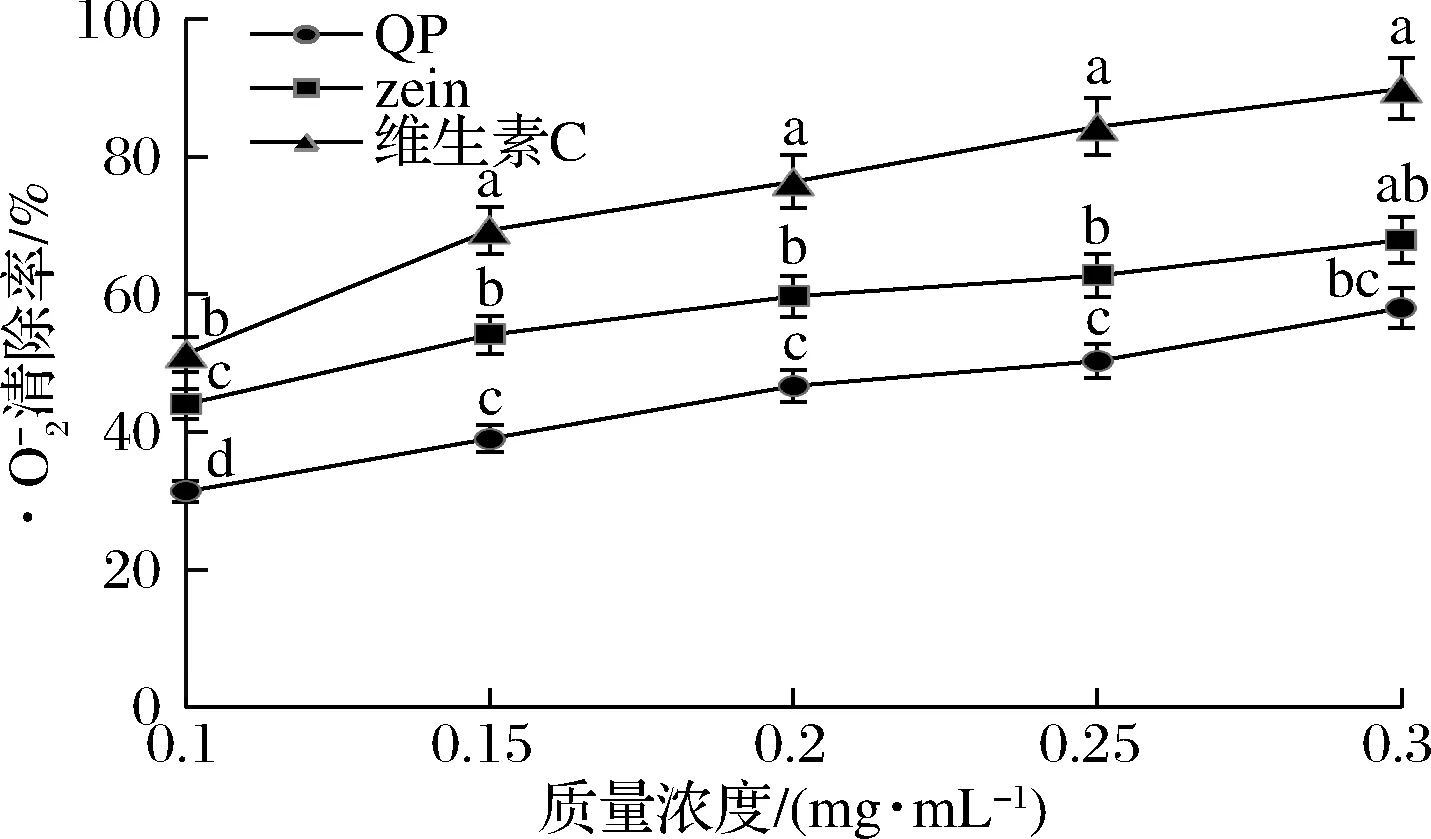
图4 藜麦醇溶蛋白对·O2-的清除能力Fig.4 Superoxide radical scavenging activity of quinoa prolamine
2.3.4 藜麦醇溶蛋白对·OH的清除能力
·OH是一种重要的活性氧,氧化反应中生成的·OH可以攻击核酸、蛋白质等生物大分子,产生更多种类和数量的自由基,加速油脂自氧化链式反应的速度[5]。藜麦醇溶蛋白对·OH的清除能力见图5。可以看出,藜麦醇溶蛋白对·OH的清除率会随浓度增大而呈上升趋势。整体来看,藜麦醇溶蛋白的·OH清除能力显著低于维生素C;但在相同浓度下,藜麦醇溶蛋白对·OH的清除能力显著高于玉米醇溶蛋白,而小米醇溶蛋白在0.3 mg/mL时,对·OH的清除能力为37.89%,这表明藜麦醇溶蛋白的·OH清除能力较强[14]。
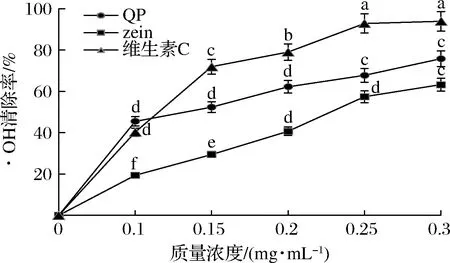
图5 藜麦醇溶蛋白对·OH的清除能力Fig.5 Hydroxyl radical scavenging activity of quinoa prolamine
2.3.5 藜麦醇蛋白对ABTS阳离子自由基的清除能力
在抗氧化体系中,ABTS阳离子自由基清除能力被认为是物质总抗氧化能力的评价指标[12]。藜麦醇溶蛋白、玉米醇溶蛋白与维生素C对ABTS阳离子自由基的清除能力见图6。

图6 藜麦醇溶蛋白对ABTS阳离子自由基的清除能力Fig.6 ABTS cation free radical scavenging activity of quinoa prolamine
从图6可以看出,藜麦醇溶蛋白对ABTS阳离子自由基的清除能力显著高于玉米醇溶蛋白,但低于维生素C(P<0.05),这表明藜麦醇溶蛋白对ABTS阳离子自由基的清除能力较高,且清除能力随浓度的增大而显著升高。在质量浓度为0.3 mg/mL时,藜麦醇溶蛋白对ABTS阳离子自由基的清除率达到98.21%。综合分析图2~图5,藜麦醇溶蛋白既有较强的提供质子能力(还原力),又具有快速淬灭自由基的能力(清除·OH和·O2-),还能够通过络合金属离子(氧化反应的催化剂)而阻断氧化反应,因此表现出很强的总抗氧化能力。
2.4 不同pH下藜麦醇溶蛋白的乳化性质
图7和图8分别显示了藜麦醇溶蛋白在不同pH下的乳化性和乳化稳定性。在pH 4.0时,藜麦醇溶蛋白的乳化能力最差。这主要是因为藜麦醇溶蛋白的等电点在pH 4.0附近,由于其溶解度最低而使得吸附在油-水界面的蛋白质少,所形成的乳状液界面也相对较小[19]。当远离等电点时,随着pH的不断增加,溶解度也不断增加,更多的蛋白质可以参与乳化液的形成,也有利于蛋白质分子的移动,因此提高了藜麦醇溶蛋白的乳化性[20],使其在pH 10.0时表现出最高的乳化性(943.32 m2/g)和乳化稳定性(54.68%)。相同pH下,藜麦醇溶蛋白的乳化性高于紫苏球蛋白与玉米醇溶蛋白[20, 22],而其乳化稳定性高于豌豆蛋白[21],这表明藜麦醇溶蛋白的乳化性能较好。

图7 pH对藜麦醇溶蛋白乳化性的影响Fig.7 Effect of pH on emulsifying activity of quinoa prolamine
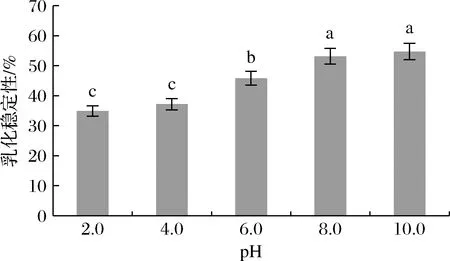
图8 pH对藜麦醇溶蛋白乳化稳定性的影响Fig.8 Effect of pH on emulsion stability of quinoa prolamine
藜麦醇溶蛋白形成乳化液的微观结构见图9。在pH 10.0时,较多的藜麦醇溶蛋白参与形成乳化液分布在水中,为典型的O/W型乳化液。乳滴数量较多且分布相对均匀,与图7中所示藜麦醇溶蛋白较高的乳化活性一致。该乳浊液在放置30 min后,乳滴的数量减少,但乳滴的分布相对均匀,没有发生明显的油水分离的现象,这表明藜麦醇溶蛋白具有较好的乳化稳定性。因此,图9中的结果直观地验证了藜麦醇溶蛋白有较高的乳化性和乳化稳定性。此结果意味着藜麦醇溶蛋白可以作为天然乳化剂应用于食品工业中[22]。

a-乳化液形成0 min时;b-乳化液形成30 min时图9 pH 10.0时藜麦醇溶蛋白形成乳液的微观结构Fig.9 Micro structures of quinoa prolamine emulsion formation at pH 10.0
3 结论与讨论
实验结果表明,藜麦醇溶蛋白中富含谷氨酸、精氨酸、天冬氨酸、色氨酸和苯丙氨酸;其必需氨基酸总和为20.36 g/100 g,营养价值较高。SDS-PAGE分析表明,藜麦醇溶蛋白为小分子质量蛋白。抗氧化活性分析表明,藜麦醇溶蛋白具有较高的ABTS阳离子自由基清除能力、·OH清除力、较强的Fe2+络合能力和还原力,均优于玉米醇溶蛋白。同时,藜麦醇溶蛋白也具有较好的·O2-清除能力,表现出一定的超氧化物歧化酶活性。与玉米醇溶蛋白和豌豆蛋白相比,藜麦醇溶蛋白具有较高的乳化性(943.32 m2/g)和乳化稳定性(54.68%)。由于藜麦的产量较大,藜麦醇溶蛋白的制备工艺相对比较简单,且安全性高,因此藜麦醇溶蛋白具有开发为天然营养强化剂、乳化剂和抗氧化剂的潜力。然而,藜麦醇溶蛋白的结构和体内抗氧化效果还需进一步的研究。

