降解草酸盐益生菌的筛选及其体内功效评价
纪媛媛,马欣莹,步雨珊,刘奥,刘同杰,公丕民,张兰威,易华西
(中国海洋大学 食品科学与工程学院,山东 青岛,266000)
肾结石是晶体物质在肾脏异常聚集所引发的疾病[1],在人群中发病率较高,可达到12%[2],为泌尿系统的第三大疾病[3]。目前最常用的肾结石治疗方法为手术疗法,具有见效快、周期短的优点,但极易复发,副作用严重,5~10年内,患者复发率可达50%,20年内的复发率甚至可达75%[2]。此外,药物治疗也是比较常用的方法,但治疗周期长、见效较慢。因此,需要寻找一种更为有效的预防和控制肾结石的疗法。
90%的结石晶体含有钙,其中以草酸钙结石最为常见[4],因此高草酸尿症也就成为引发肾结石的第一危险因子[5]。这些进入尿液的草酸绝大部分来自外源摄入,小部分来自肝脏内源合成[6]。人体自身无法消化分解草酸盐,所以外源摄入的草酸在肠道内被吸收,随血液循环进入尿液。过量的草酸在尿液蓄积,就会引发高草酸尿症,并伴有草酸钙晶体形成[7]。如果能够通过某种手段控制肾脏及尿液中草酸的浓度,减少草酸在肾脏中的蓄积,便可以起到预防肾结石形成的作用。
前期研究发现,某些分离自发酵乳制品、粪便中的乳酸菌具有一定的降解草酸盐活性[8-10];进一步动物实验表明,乳杆菌、双歧杆菌菌株灌胃后鼠尿草酸含量显著降低[11-13]。任志华[14]研究发现1株乳酸乳球菌可以降低犬尿钙和尿草酸的分泌,说明具有降解草酸活性的乳酸菌在动物医学领域具有广泛的应用前景。与手术和药物治疗相比,利用乳酸菌等微生态制剂降解草酸盐来预防肾结石具有独特的优势,目前国内外对该方面的研究报道不多。本研究旨在筛选具有高效降解草酸活性的菌株,进一步评估其在小鼠体内的作用功效,探究其基于降解草酸预防肾结石的潜力,为利用益生菌预防或缓解肾结石提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
36株乳酸菌:分离自人体肠道及乳制品,保存于中国海洋大学食品科学与工程学院功能性乳制品与益生菌工程研究室。对照菌株加氏乳杆菌ATCC 33323,中国普通微生物菌种保藏中心。
1.1.2 实验动物及饲料
6周龄SPF级雄性C57BL/6小鼠,山东济南朋悦实验动物繁育有限公司;动物饲料,北京维通利华实验动物技术有限公司。
1.1.3 主要试剂
MRS肉汤培养基、MRS琼脂培养基、NaCl、草酸、草酸钠,青岛海博生物技术有限公司;TiCl3,国药集团化学试剂有限公司;PBS缓冲液、草酸试剂盒,北京索莱宝试剂有限公司;肌酸酐(serum creatinine,SCr)试剂盒、尿素氮(blood urea nitrogen,BUN)试剂盒、柠檬酸ELISA试剂盒、镁离子试剂盒,上海泛音生物科技有限公司;超氧化物歧化酶(superoxide dismutas,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、钙离子试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
SW-CJ-1D洁净工作台,苏州净化设备有限公司;TG20KR-D高速冷冻离心机,长沙东旺实验仪器有限公司;LDZX-75KBS全自动灭菌锅,上海申安医疗器械厂;SpectraMax190多功能酶标仪,上海美谷分子仪器有限公司;高温低速组织研磨仪,武汉赛维尔生物科技有限公司。
1.3 实验方法
1.3.1 降解草酸盐益生菌的筛选
乳酸菌按照2%(体积分数,下同)的接种量接种至MRS液体培养基中,37 ℃传代活化2~3次,活化好的菌液按5%的接种量接种至含有5 mmol/ L草酸钠的MRS培养液(MRS-Ox培养液)中,37 ℃培养5 d,以不接菌的MRS-Ox培养液作为对照组。采用草酸-TiCl3反应法测定培养基中的草酸浓度[15]:取10 mL培养5 d后的MRS-Ox培养液,8 000 r/min离心10 min,取上清液5 mL,再加入1 mL 0.5 mol/L CaCl2溶液静置沉淀,12 000 r/min离心10 min,弃去上清液,烘干离心管中的水分。加入5 mL 0.2 mol/L HCl溶液振荡混匀,溶解沉淀。再加入新配制的0.25 mL 5%(质量分数)TiCl3溶液,振荡混匀,测定405 nm波长下的吸光度。根据草酸标准曲线计算草酸浓度,根据公式(1)计算草酸降解率:

(1)
式中:c空白和c接菌分别为空白组和接菌组培养后草酸浓度。
目的菌株培养期间草酸浓度变化的测定:筛选到的菌株传代活化3次,接入含有5 mmol/ L草酸钠的MRS培养基,每隔6 h测定培养基中剩余草酸浓度,测定方法同上述草酸-TiCl3反应法[14],根据测定结果做出草酸浓度随时间变化规律曲线。
1.3.2 小鼠预灌胃造模实验及28 d急性毒性实验
小鼠预灌胃实验:28只小鼠分成4组,每组7只,其中,对照组、模型组每天灌胃10 mL/kg PBS缓冲液,低剂量组每天灌胃10 mL/kg低浓度(5×107CFU/mL)菌液;高剂量组每天灌胃10 mL/kg 高浓度(5×109CFU/mL)菌液,预灌胃周期为14 d。
小鼠造模实验:预灌胃结束后,对照组每天灌胃两次10 mL/kg PBS缓冲液;模型组每天灌胃上午9时灌胃10 mL/kg PBS缓冲液,下午3时灌胃10 mL/kg 3%(质量分数,下同)草酸钠溶液;低剂量组每天上午9时灌胃3%草酸钠溶液,下午3时灌胃10 mL/kg 低浓度(5×107CFU/mL)菌液;高剂量组每天上午9时灌胃3%草酸钠溶液,下午3时灌胃10 mL/kg 高浓度(5×109CFU/mL)菌液,周期为28 d。
28 d急性毒性实验:14只小鼠分为2组,对照组每天灌胃10 mL/kg PBS缓冲液,灌菌组每天灌胃10 mL/kg,5×107CFU/mL菌液,每天记录小鼠体重,处死后称取小鼠肾脏、肝脏质量,计算脏器指数。
1.3.3 小鼠尿草酸含量的测定
收集各组小鼠的尿液,按照试剂盒说明书的方法检测尿液草酸浓度。
1.3.4 小鼠尿液Mg2+、Ca2+、柠檬酸浓度的测定
收集各组小鼠的尿液,按照试剂盒说明书的方法检测尿Mg2+、Ca2+、柠檬酸浓度。
1.3.5 小鼠肾脏SOD活性、CAT活性及MDA水平的测定
小鼠处死后取肾脏,按1∶9(g∶mL)的比例加入生理盐水,冰水浴条件下,制成10%的组织匀浆,2 500 r/min离心10 min,取上清液,按照试剂盒说明测定SOD、CAT活性、MDA水平。
1.3.6 小鼠血液肌酸酐、尿素氮浓度的测定
小鼠眼球取血,4 ℃条件下,4 000 r/min离心10 min,取上清液,按照试剂盒说明书测定肌酸酐、尿素氮的浓度。
1.3.7 小鼠肾脏组织病理学检查
小鼠处死后取肾脏,置于10%多聚甲醛固定液中固定组织48 h以上,进行苏木精-伊红(hematoxylin-eosin staining,HE)染色法和Von Kossa染色,观察小鼠肾脏中晶体聚集情况、肾脏病理学变化。
1.3.8 统计学分析
采用SPSS 26.0进行显著性差异分析(P<0.05),不同字母表示具有显著性差异,采用Origin软件作图。
2 结果与分析
2.1 降解草酸盐益生菌的筛选
以草酸降解率为指标,评估了36株乳酸菌降解草酸的能力,结果如表1所示。不同菌株降解草酸的能力存在明显差异,乳杆菌1F-6的草酸降解率为83.6%,显著高于对照菌株加氏乳杆菌(43.9%),菌株Q7、MN11、YZX21、FN3的降解率均在10%~15%,其余31株菌的草酸降解率均在10%以下。鉴定结果表明,乳杆菌1F-6为Lactobacillusvaginals。

表1 乳酸菌在培养基中的草酸降解率Table 1 Oxalate degrading ability of LAB strains in culture medium
进一步探究了乳杆菌1F-6的草酸降解率随时间的变化规律,结果如图1所示。自2.5 d起,培养基内的草酸浓度开始急剧下降,到第5.5天,草酸基本被完全降解,这与KULLIN等[16]报道的Lactobacillusreuteri100-23C从培养初始就降解草酸的变化规律不同,表明不同菌株降解草酸的机制存在差异。乳杆菌1F-6降解草酸可能是其维持生命活动的补救代谢途径。当培养基中葡萄糖等碳源消耗完毕,乳杆菌1F-6开始利用草酸作为碳源,从而达到降解草酸的目的。以乳杆菌1F-6为候选菌株,开展下一步动物实验研究。

图1 1F-6培养过程中草酸浓度的变化Fig.1 Change of oxalic acid concentration during 1F-6 culture
2.2 L.vaginals 1F-6的急性毒性评价
利用小鼠动物模型对乳杆菌1F-6的毒性进行了评价。结果表明,灌胃期间小鼠活动情况、毛色、精神状态正常,饮水量和摄食量无异常。体重是判定小鼠是否健康的重要指标[17],体重变化如图2-a所示。灌胃期间对照组和实验组小鼠体重均正常增长,无显著性差异;小鼠肝脏、肾脏等器官也无异常,肝脏、肾脏指数对照与实验组没有显著性差异(图2-b)。上述结果表明L.vaginals1F-6对小鼠无急性毒性作用。

a-体重;b-脏器指数图2 灌胃L.vaginals 1F-6对小鼠体重及脏器指数的影响Fig.2 The effects of L.vaginals 1F-6 on body weight and organ index of the mice
2.3 L.vaginals 1F-6降草酸活性体内验证
2.3.1L.vaginals1F-6对小鼠尿草酸含量的影响
利用动物模型对乳杆菌1F-6的降草酸活性进行了评价研究,结果如表2所示。在整个灌胃期间,对照组小鼠的尿草酸含量基本保持稳定,自第21天起,模型组、低剂量组、高剂量组中的尿草酸含量开始显著高于对照组(P<0.05),说明造模成功,且模型组的尿草酸含量增长更快;从28天开始,高剂量组尿草酸含量开始回落,模型组的尿草酸含量显著高于对照组(P<0.05),低剂量组、高剂量组尿草酸含量均显著低于模型组(P<0.05)。由上述结果可知,L.vaginals1F-6可有效降低小鼠尿草酸水平,从而预防因摄入过量草酸而引起的高草酸尿症。
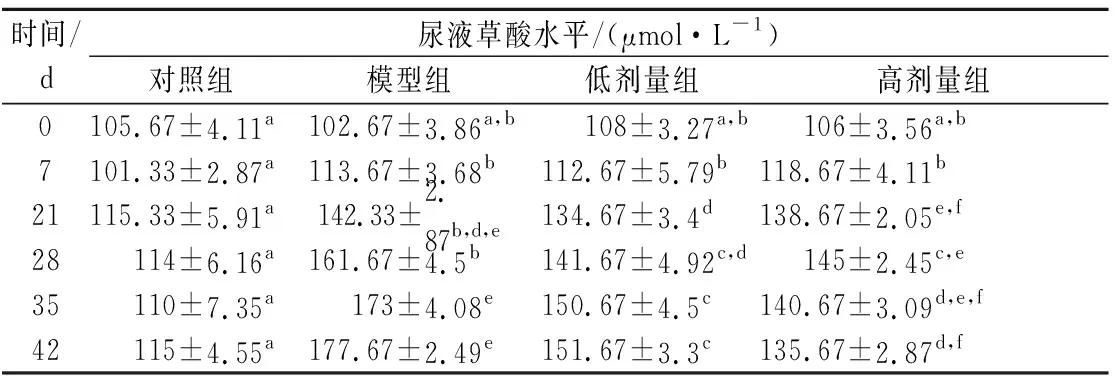
表2 实验期间小鼠尿草酸含量的变化Table 2 Change of urine oxalate concentration in mice during the experiment
2.3.2L.vaginals1F-6对小鼠尿液Ca2+、Mg2+、柠檬酸水平的影响
尿液中草酸浓度的变化,会破坏离子平衡,进一步引起尿液中其他离子的浓度变化。对乳杆菌1F-6对小鼠尿液中Ca2+、Mg2+和柠檬酸水平的影响进行研究,结果如图3所示。模型组Ca2+、柠檬酸水平显著低于对照组(P<0.05);与模型组相比,L.vaginals1F-6各剂量组的Ca2+、柠檬酸水平显著升高(P<0.05),各组Mg2+浓度无显著性差异。L.vaginals1F-6干预小鼠后,小鼠尿液中的Ca2+、柠檬酸浓度有所回升,且高剂量组和对照组没有显著性差异。这可能是由于L.vaginals1F-6降解了进入肠道的草酸,使得尿液排泄出的草酸浓度减小,尿液草酸浓度的降低又进一步影响了尿液中其他离子间的平衡。柠檬酸浓度升高,可与Ca2+结合形成可溶性盐,从而抑制草酸钙结石晶体形成[18]。上述结果表明L.vaginals1F-6有助于调控修复草酸引起的尿液离子浓度紊乱。

a-Ca2+浓度;b-Mg2+浓度;c-柠檬酸浓度图3 L.vaginals 1F-6对小鼠尿液Ca2+、Mg2+、柠檬酸水平的影响Fig.3 Effects of L.vaginals 1F-6 on urine calcium, magnesium, citric acid concentrations in mice
2.3.3L.vaginals1F-6对小鼠血清尿素氮、肌酸酐浓度的影响
草酸是二元羧酸,属于强氧化物,具有氧化毒性[17],过量的草酸极易引发肾脏损伤,影响肾小球的滤过功能,当肾脏严重受损时,肌酸酐、尿素氮的浓度也会发生相应的变化[19],因此肌酸酐、尿素氮是反映小鼠肾功能的重要指标[20]。研究L.vaginals1F-6对小鼠血清尿素氮、肌酸酐浓度的影响,结果如表3所示。与对照组相比,模型组小鼠血清中尿素氮、肌酸酐含量显著升高(P<0.05),说明草酸的连续干预使得小鼠的肾脏滤过功能受到严重损伤;与模型组相比,L.vaginals1F-6低剂量组、高剂量组小鼠尿素氮、肌酸酐水平显著降低(P<0.05)。L.vaginals1F-6可显著降低小鼠血清中的肌酸酐、尿素氮浓度,小鼠肾脏的滤过功能得到了有效改善,这与GOMATHI等[21]的实验结果一致。

表3 L.vaginals 1F-6对小鼠血清尿素氮、肌酸酐浓度的影响Table 3 Effects of L.vaginals 1F-6 on blood urea nitrogen, creatinine concentrations in mice
2.3.4L.vaginals1F-6对小鼠肾组织MDA水平及SOD、CAT活性的影响
MDA浓度,SOD、CAT活性是衡量组织氧化损伤情况的指标[20]。对L.vaginals1F-6对小鼠肾组织MDA水平及SOD、CAT活性的影响进行了研究,结果如图4所示。

a-MDA含量;b-SOD活性;c-CAT活性图4 L.vaginals 1F-6对小鼠肾组织MDA水平及SOD、CAT活性的影响Fig.4 Effects of L.vaginals 1F-6 on renal MDA level and SOD, CAT activities in mice
与对照组相比,模型组SOD、CAT活性显著降低(P<0.05)、MDA浓度显著升高(P<0.05),表明高浓度草酸的摄入使得小鼠肾组织受到严重的氧化损伤;与模型组相比,L.vaginals1F-6各剂量组的SOD、CAT活性均显著增加(P<0.05),且高剂量组SOD、CAT活性与对照组无显著性差异(P>0.05),各剂量组MDA浓度相比于模型组也得到显著降低(P<0.05)。L.vaginals1F-6通过降低进入肾脏中的草酸浓度,减弱了草酸对肾脏的氧化损伤作用,并使小鼠肾脏功能恢复到原有水平,表明L.vaginals1F-6可有效缓解由草酸过量积累导致的肾功能氧化损伤。
2.3.5L.vaginals1F-6对小鼠肾脏组织形态的影响
利用HE染色法研究了L.vaginals1F-6对小鼠肾脏组织形态的影响,结果如图5-a所示。对照组小鼠肾脏未观察到草酸钙沉积、肾小管扩张的现象;模型组小鼠肾组织结构紊乱,管腔扩张严重,管腔内可明显观察到草酸钙晶体的聚集;相比于模型组,L.vaginals1F-6低、高剂量组的肾脏损伤有所缓解,低剂量组晶体沉积明显减少,高剂量组在视野内几乎无草酸钙晶体出现。

a-HE,400×;b-Von Kossa,200×图5 不同染色法各组小鼠肾脏组织病理学检查结果Fig.5 Renal histopathological examination of mice in different groups under different stainings
Von Kossa染色法是对钙结晶的特异性染色[22],可以更直观地观察到肾组织中草酸钙的聚集情况。Von Kossa染色结果如图5-b所示,对照组未观察到钙结晶的形成,模型组、低剂量组、高剂量组均可观察到肾小管管腔中的黑色染色结晶,且模型组结晶数量明显高于L.vaginals各剂量组,高剂量组效果最好,仅有少量草酸钙结晶分布于管腔。上述结果表明,L.vaginals1F-6可有效缓解由草酸过量积累导致的肾组织损伤。
3 结论
随着中国经济的发展,人们膳食结构的改变,动物蛋白和脂肪摄入量的增多,我国高草酸尿症的发病率逐渐增加。草酸的过饱和是高草酸尿症乃至肾结石等形成的重要因素。目前针对高草酸尿症的治疗主要为利尿剂、镁剂等方法,但改善作用均为暂时性缓解,不能有效防止或预防高草酸尿症的形成。膳食补充剂干预是最简单有效的措施。本研究以草酸降解率为指标,筛选出1株草酸降解率为83.6%的乳杆菌L.vaginals1F-6,其草酸降解率显著高于现有报道,利用高草酸尿症小鼠模型进一步系统评估了L.vaginals1F-6体内降解草酸的作用功效,L.vaginals1F-6可显著降低小鼠尿草酸含量、减少小鼠肾脏内的草酸钙晶体积累,调控草酸引起的尿液离子浓度失衡,缓解草酸浓度导致的肾氧化等功能损伤,表明L.vaginals1F-6可以在肠道内定植,对摄入小鼠体内的草酸起到了降解作用,从而使进入尿液和肾脏的草酸有所减少,减少肾脏草酸钙晶体聚集,有效缓解小鼠肾功能损伤,起到保护肾脏的作用。

