优化有机氮源提高小白链霉菌发酵生产ε-聚赖氨酸效率
刘宇翔,柳天一,邓玥,王靓,张宏建,张建华,陈旭升*
1(江南大学 生物工程学院,江苏 无锡,214122)2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL),1977年由日本学者于链霉菌发酵液中首次分离到,是阳离子同型氨基酸聚合物[1],一般由25~35个L-赖氨酸残基通过ε-氨基和α-羧基间的酰胺键连接而成[2]。由于其多阳离子的性质可通过离子吸附与携带负电荷的细胞表面相互作用,故对于包括革兰氏阳性和阴性细菌、酵母菌、霉菌甚至病毒在内的多种微生物都表现出良好的抑菌活性[3]。目前,ε-PL及其盐酸盐已获得日本、韩国、美国、中国等国家和地区批准用作天然食品防腐剂[4]。此外,ε-PL还在药物载体、纳米粒、基因载体、脂质体、干扰素诱导剂、脂肪酶抑制剂和水凝胶等多个领域有着广阔的应用前景[5]。
如何提高ε-PL发酵产量并降低其生产成本一直是学术界和产业界关注的核心问题。发酵培养基组分是微生物菌体生长和产物合成的物质基础,也是影响微生物目标产物积累量的关键。同时,相比于通过育种手段提高目标产物发酵产量,培养基组分和比例优化是一种简单、有效提高目标产物浓度、降低生产成本的方式之一。为此,GUO等[6]对ε-PL发酵培养基的碳源和有机氮源进行了优化,ε-PL摇瓶产量达到0.95 g/L,较优化前提高了43.1%;5 L罐ε-PL产量提高至25.5 g/L,较优化前增加了56.4%。发酵时间由174 h缩短到120 h,显著提高了ε-PL生产强度。CHHEDA等[7]则对StreptomycesnourseiNRRL 5126发酵生产ε-PL的碳源、有机氮源和无机氮源进行了优化,使得ε-PL发酵产量提高了1倍。BHATTACHARYA等[8]开发了一种人工神经网络-粒子群算法(artificial neural network particle swarm optimization,ANN-PSO)对ε-PL发酵培养基进行改良,通过模型推演,确定了最佳的培养基组合,ε-PL产量提高了1倍,达到74 mg/L。本团队对Streptomycessp.M-Z18发酵生产ε-PL的碳源种类和用量进行了系统研究,发现以甘油作为碳源时,摇瓶ε-PL产量是以葡萄糖为碳源的近3倍,达到了2.27 g/L[9];而将甘油与葡萄糖按照质量比1∶1进行混合发酵时,最高ε-PL产量可达到35.14 g/L,分别是单独使用葡萄糖和甘油作为碳源的1.43和1.17倍[10]。PEN等[11]开发出一种基于鱼粉和玉米浆作为有机氮源的发酵培养基,该培养基富含谷氨酸、精氨酸、赖氨酸和天冬氨酸,不仅提高了菌丝体的耐酸能力,而且促进了菌体的生长和ε-PL的合成,使得Streptomycessp.M-Z18的ε-PL产量达到了35.24 g/L,并显著降低了培养基成本。因此,通过培养基优化来提高ε-PL发酵产量是一种有效手段。
前期,本团队通过传统诱变和抗性筛选手段,获得1株ε-PL高产突变株S.albulusGS114,其摇瓶ε-PL产量较出发菌株提高了70%左右。在此基础上,进一步优化培养基营养组分比例和发酵工艺条件,实现5 L发酵罐ε-PL发酵产量达到60.2 g/L,为国内外报道的最高发酵水平[12-14]。然而,ε-PL发酵过程中最大菌体量却达到62 g/L(菌体干重),造成了发酵过程需氧量增大,葡萄糖转化率下降等不良后果,损坏了发酵过程的经济性。本文以期通过改变有机氮源种类,达到降低菌体量并维持ε-PL发酵水平,从而实现S.albulusGS114发酵生产ε-PL过程的高产量和经济性相统一。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
StreptomycesalbulusGS114,由本实验室选育和保藏。
1.1.2 主要试剂与仪器
葡萄糖,山东西王药业有限公司,优级纯;酵母粉,Oxoid 公司、Biospringer公司、圣琪公司和安琪酵母公司;其他试剂,国药化学试剂有限公司,分析纯。
5 L发酵罐,上海保兴生物设备有限公司;T&J-Miniskid 1 L×4迷你平行生物反应器,迪必尔生物工程(上海)有限公司;UV-2100分光光度计,优尼科仪器有限公司;AB204-N 分析天平,瑞士梅特勒公司;GNP-9160恒温培养箱,上海光都仪器设备有限公司;高速冷冻离心机3K15,德国西格玛公司;HYL-C组合式摇床,太仓市强乐设备有限公司;Kjeltec 8400 Analyzer Unit凯氏定氮仪,丹麦福斯分析仪器公司。
1.1.3 培养基
固体培养基(BTN)(g/L):葡萄糖10,鱼粉蛋白胨2,酵母粉Oxoid 1,琼脂 20,pH 7.5。
种子培养基(M3G)(g/L):葡萄糖50,酵母粉Oxoid 5,(NH4)2SO410,K2HPO40.8,KH2PO41.36,MgSO4·7H2O 0.5,FeSO4·7H2O 0.03,ZnSO4·7H2O 0.04,pH 6.8。
发酵培养基(YP)(g/L):葡萄糖 60,酵母粉FM902 14.48,(NH4)2SO410,MgSO4·7H2O 0.5,FeSO4·7H2O 0.03,KH2PO44,ZnSO4·7H2O 0.04,消泡剂 0.2,pH 6.8。
流加培养基(g/L):葡萄糖750,氨水 6.25%或12.5%(体积分数),(NH4)2SO4375,消泡剂100。
1.2 实验方法
1.2.1 培养方法
种子培养:挑取3环孢子接种至种子培养基中,30 ℃、200 r/min,培养24 h。
摇瓶水平不同有机氮源的ε-PL发酵:将培养好的种子液以体积分数8%接种量接入装有40 mL发酵培养基的250 mL锥形瓶中,30 ℃、200 r/min,培养72 h。
摇瓶水平差异氨基酸添加的ε-PL发酵:根据相同质量浓度的FM902与FM760游离氨基酸差异,将质量浓度差异大于15%的氨基酸在浓度相对较小的发酵培养基中添加至相应浓度,具体发酵方式同摇瓶水平不同有机氮源的ε-PL发酵。
1 L发酵罐水平不同有机氮源的ε-PL分批发酵:将培养好的种子液以体积分数8%接种量接入,装液量700 mL,温度30 ℃,初始转速200 r/min,通气量1 vvm,溶氧设置为30%,转速溶氧联动控制。待pH自然下降至4.0时,用体积分数6.25%的氨水维持pH恒定4.0直至发酵结束。
5 L发酵罐ε-PL的补料分批发酵:在5 L发酵罐中装入3 200 mL发酵培养基,发酵开始前将初始pH调至6.8,温度30 ℃,初始转速200 r/min,通气量1 vvm,共发酵192 h。按照8%的接种量将280 mL种子液接入。接种后pH自然下降至6.0时,通过流加体积分数12.5%氨水维持pH预培养7.5 h。预培养结束后进行pH冲击,冲击阶段恒定转速不变,冲击至溶氧达60%时迅速调至pH 4.0,之后根据溶氧变化调节pH,使其尽量维持在10%~30%。当发酵液中葡萄糖质量浓度低于10 g/L时,根据葡萄糖的消耗速率设定补料速率,补加质量浓度为750 g/L葡萄糖溶液,维持发酵液中葡萄糖质量浓度在10 g/L左右直至发酵结束。与此同时,当NH4+-N质量浓度低于0.2 g/L时脉冲补加375 g/L (NH4)2SO4溶液,使NH4+-N质量浓度维持在0.2~0.5 g/L,如此重复直至发酵结束。
1.2.2 分析方法
发酵过程参数测定:ε-PL浓度测定采用甲基橙比色法[15]。NH4+-N 浓度测定采用靛酚蓝反应法[16]。葡萄糖浓度使用生物传感分析仪(SBA-40C)进行测定[17]。总氮含量测定采用凯氏定氮法[18]。菌体干重的测定参照刁文娇[19]的方法。
2 结果与讨论
2.1 摇瓶水平不同有机氮源对ε-PL发酵的影响
选取鱼粉蛋白胨、羽毛粉、FP103、FP320、FM760、FM408、FM502、FM803、YP600、YP601、Oxoid等11种有机氮源,并以原先使用的酵母粉FM902作为对照,控制其他有机氮源总氮含量与FM902相同,对12种有机氮源的ε-PL发酵水平进行评估,摇瓶发酵结果如表1所示。以鱼粉蛋白胨、羽毛粉、FM803、FP320、YP600和YP601作为有机氮源,ε-PL产量均在2 g/L以下,显著低于对照(FM902)。可能的原因是上述6种有机氮源均为迟效有机氮源,它们的有机氮主要以大分子蛋白形式存在,不利于ε-PL的合成。有机氮源FM760和FM408的ε-PL产量分别达到(2.60±0.02)和(2.58±0.08) g/L,较对照FM902提高了22.07%和21.13%。从单位菌体合成能力上看,除FM803、YP601和YP600外,其他8种有机氮源的单位菌体合成能力均显著高于对照FM902。综合考虑ε-PL产量和单位菌体ε-PL合成能力,有机氮源FP103、FM760和FM408均优于对照FM902。上述3种有机氮源均为酵母浸粉,其加工工艺是以酵母为原料,经自溶、酶解、浓缩、干燥等工艺制成,富含蛋白质、氨基酸、肽、多肽、核酸、维生素及微量元素等营养成分,属于速效有机氮源,更加适合S.albulusGS114的ε-PL合成。
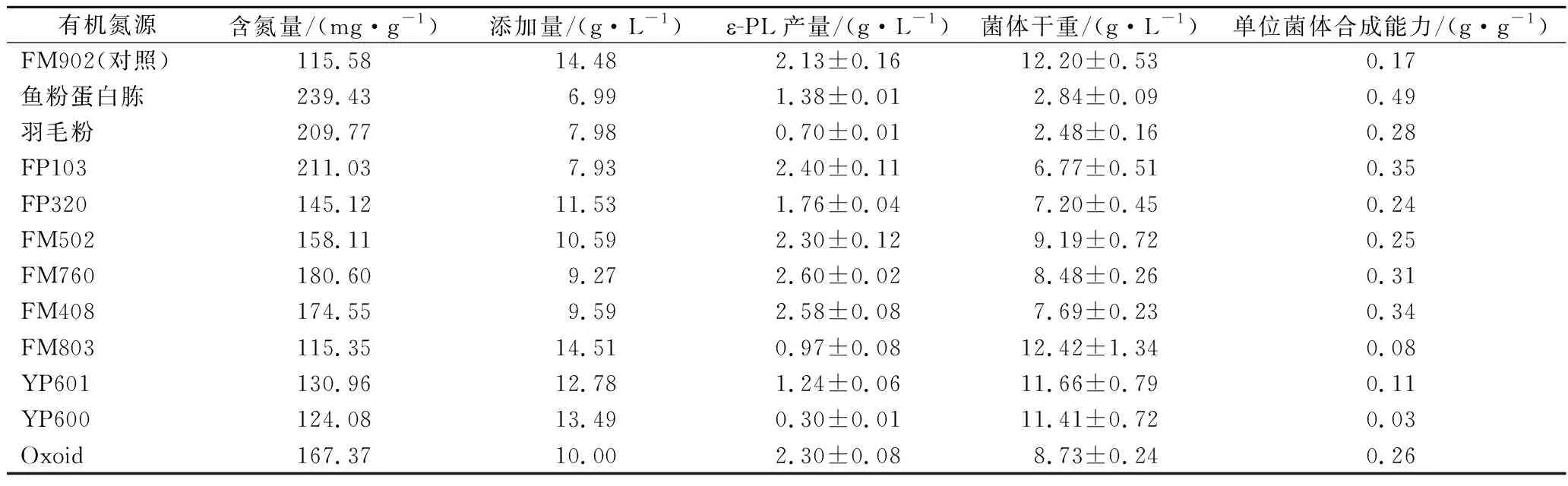
表1 不同有机氮源含氮量、添加量及发酵结果Table 1 Contents, concerntration, and fermentation results of different organic nitrogen sources
2.2 1 L发酵罐水平不同有机氮源对ε-PL分批发酵的影响
为进一步确定有机氮源种类,并考虑到pH值是影响ε-PL生物合成的最关键因素,故利用1 L发酵罐在pH 4.0条件下,评估了12种有机氮源分批发酵生产ε-PL的情况。由图1-a可知,利用FM760、FM408、羽毛粉、FM502、Oxoid和FP320作为有机氮源发酵生产ε-PL,分批发酵ε-PL产量较对照FM902分别提高了42.62%、28.37%、19.37%、16.57%、19.88%和20.22%。有机氮源FM502和YP601实现最大菌体干重达到29.45和29.50 g/L,较对照FM902分别提高了28.32%和28.54%。从图1-b可知,以FM760、FM408、FM502、YP601和Oxoid为有机氮源的分批发酵,ε-PL产率较对照FM902分别提高了28.57%、14.29%、21.43%、7.14%和2.35%,达到了0.18、0.16、0.17、0.15和0.14 g/(L·h)。然而,从图1-c可知,仅有以FM760、FM408、Oxide和FP302为有机氮源的发酵,葡萄糖转化率较对照FM902有所提高,其中FM760的葡萄糖转化率最高(11.93%),提高了39.53%。从图1-d可知,除FM502、YP601和YP600外,其他有机氮源的分批发酵,单位菌体合成能力均较对照FM902(0.20 g/g)有所提高。综合摇瓶和1 L发酵罐分批发酵的结果,可以确定有机氮源FM760是S.albulusGS114发酵生产ε-PL的最佳选择。
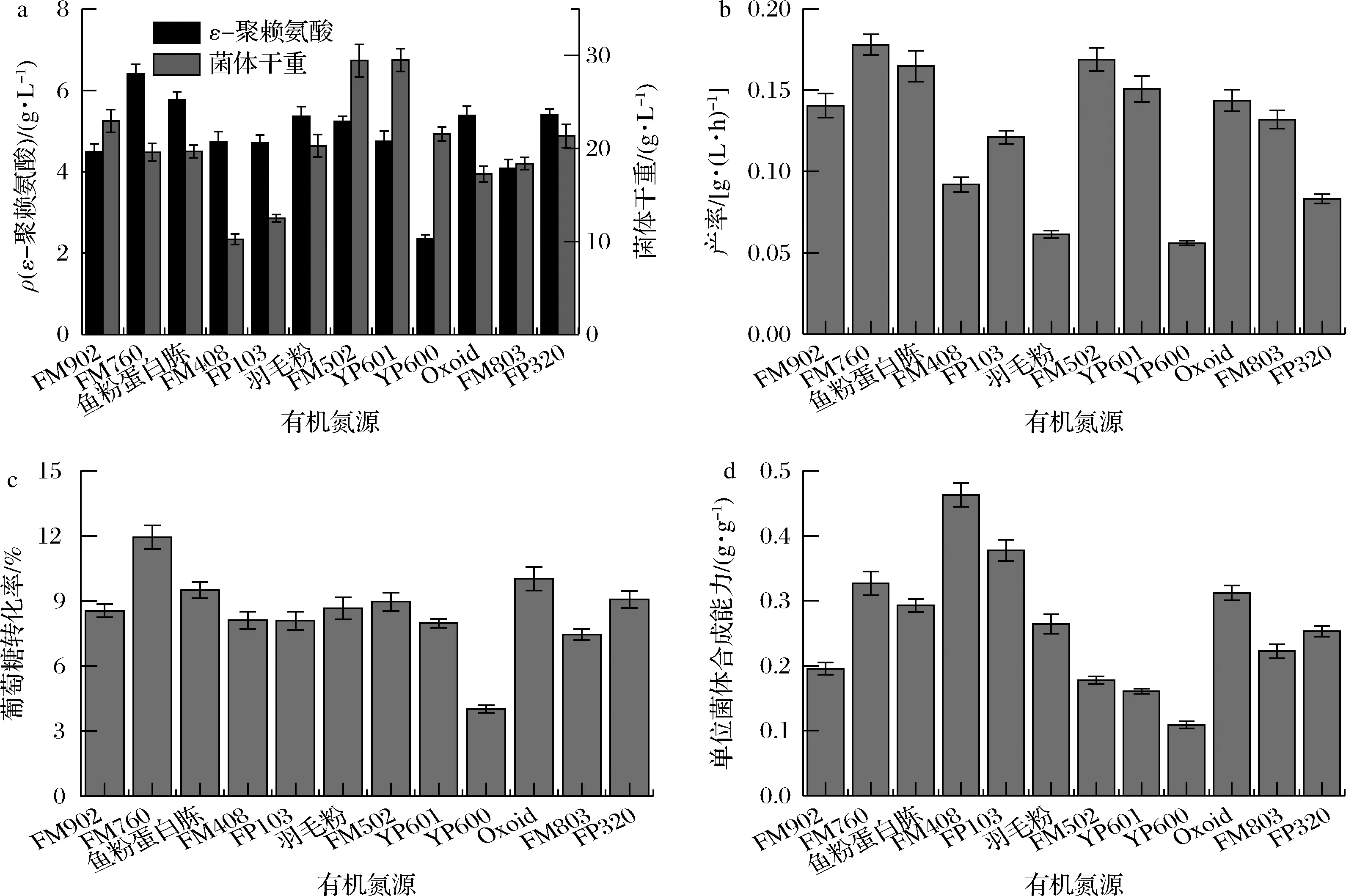
a-ε-聚赖氨酸与菌体干重;b-产率;c-葡萄糖转化率;d-单位菌体合成能力图1 不同有机氮源对ε-PL分批发酵的影响Fig.1 Effect of different types of organic nitrogen sources in the batch fermentation of ε-PL
2.3 最佳有机氮源FM760促进ε-PL发酵效率提升的关键氨基酸分析
为从氨基酸角度解释有机氮源FM760较对照FM902提升ε-PL发酵效率的原因,本研究将相同质量浓度的有机氮源FM760和FM902分别进行了游离氨基酸和水解氨基酸种类及含量的测定,由于2种酵母粉溶于水中呈酸性,且大部分的发酵时间发酵环境处于酸性,天冬酰胺、谷氨酰胺以及色氨酸在酸性条件下被破坏,无法被检测,故检测了其余17种常见氨基酸。在游离氨基酸含量方面(图2-a),除了天冬氨酸、丙氨酸和半胱氨酸外,FM760其余的游离氨基酸含量均高于对照FM902,其中甘氨酸含量是对照组的4.8倍,但丙氨酸只有FM902的84.51%;在水解氨基酸方面(图2-b),2种有机氮源的大部分氨基酸含量均无显著差异,只有FM760的甘氨酸含量较FM902高出82%,丙氨酸与半胱氨酸分别低了20.02%与81.81%。2种有机氮源的水解氨基酸总量基本一致(图2-c),而FM760的游离氨基酸总量较FM902高出33.08%。因此,FM760拥有更加丰富的游离氨基酸,有助于菌体生长和代谢,进而有利于ε-PL合成。
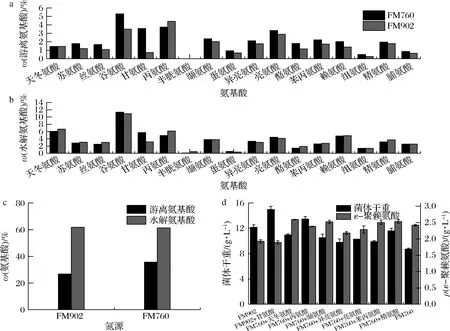
a-游离氨基酸;b-水解氨基酸;c-氨基酸总量;d-摇瓶发酵结果图2 FM760与FM902氨基酸比较以及摇瓶发酵结果Fig.2 Comparison of amino acids between FM760 and FM902 and shake flask fermentation results
综上,有机氮源FM760促进ε-PL合成的原因很可能与这些差异氨基酸的含量有关。为进一步确认造成2种有机氮源的ε-PL发酵效率差异,本研究将上述分析中差异较大的氨基酸(质量浓度差异大于15%),在质量浓度较少的有机氮源中进行外源添加发酵,结果如图2-d所示。当FM902中添加甘氨酸,ε-PL产量无明显变化;当FM760中添加天冬氨酸、缬氨酸、苯丙氨酸和精氨酸,ε-PL产量均有所上升,其中添加了天冬氨酸的ε-PL产量提高幅度最大(7.2%);而当FM760中添加丙氨酸、亮氨酸和异亮氨酸,ε-PL产量均表现出下降,其中添加了异亮氨酸的ε-PL产量下降幅度最大(10.9%),接近FM902的ε-PL产量。因此,有机氮源FM760提升ε-PL发酵效率很可能与异亮氨酸有关,其次与丙氨酸和亮氨酸有关。
2.4 不同含量FM760对ε-PL补料分批发酵的影响
由2.1可知,按照总氮相同的原则,FM760的质量浓度为9.27 g/L,为确定此浓度是否为最佳浓度,分别考察了3个质量浓度梯度(4.27、9.27和14.27 g/L)对补料分批发酵条件下菌体生长和ε-PL产量影响。当FM760质量浓度为9.27 g/L时,ε-PL产量达到了62.38 g/L,较FM902(52.51 g/L)提高了18.80%(图3-a);最大菌体干重达到了55.52 g/L,较对照(48.31 g/L)提高了20%(图3-b);单位菌体ε-PL合成能力达到了1.12 g/g,较对照提高了2.75%(图3-c);葡萄糖转化率达到了9.76%,较对照提高了25.77%(图3-d),显示出选择9.27 g/L FM760作为有机氮源不仅能够获得超过60 g/L的ε-PL产量,还可以显著提高底物转化率,实现了发酵产量和发酵经济性统一。当FM760质量浓度下降至4.27 g/L时,ε-PL产量大幅下降,只有46.24 g/L,原因可能是有机氮源不足导致了菌体未能正常生长,限制了ε-PL的产生。而当FM760质量浓度提高至14.27 g/L时,ε-PL产量达到了67.02 g/L,但是菌体量达到了73.24 g/L,且在发酵中出现了供氧不足现象。因此,有机氮源FM760的最佳使用质量浓度为9.27 g/L。

a-ε-聚赖氨酸;b-菌体干重;c-单位菌体合成能力;d-葡萄糖转化率图3 不同含量FM760对ε-PL补料分批发酵的影响Fig.3 Effect of different concentrations of FM760 in the fed-batch fermentation of ε-PL
在发酵过程中监控了不同浓度FM760发酵过程中发酵液中17种游离氨基酸的变化情况,结果如图4所示。在发酵前24 h,菌体处于对数生长期,17种氨基酸均迅速被消耗至较低水平。在剩余发酵时间内,谷氨酸、丝氨酸、甘氨酸、苏氨酸、精氨酸、酪氨酸、蛋氨酸、苯丙氨酸、脯氨酸和L-赖氨酸含量均处于较低水平,但会有一定上升趋势,这可能和有机氮源中的大分子蛋白或多肽水解有关。值得注意的是,异亮氨酸浓度在发酵的大部分时间几乎为零且未有上升趋势,可能意味着异亮氨酸是限制发酵过程中菌体生长或ε-PL合成的因素。丙氨酸与亮氨酸在发酵中期的含量有上升趋势,并在发酵后期降至低水平。ZHEN等[20]发现丙氨酸的添加会增加细胞内活性氧的产生,而本团队前期研究表明高水平活性氧会导致生产菌氧化损伤,进而影响ε-PL的合成[12];支链氨基酸亮氨酸会产生代谢反馈抑制[21],一定程度上抑制了中间体丙酮酸的产生,影响ε-PL的产生。结合2.3中的差异氨基酸添加的实验结果,较低含量的亮氨酸与丙氨酸可能更有利于ε-PL合成,但需要进一步实验验证。

图4 不同含量FM760对ε-PL发酵过程中胞外游离氨基酸的影响Fig.4 Effect of different concentrations of FM760 on the extracellular free amino acids during ε-PL fermentation
3 结论
本研究通过对有机氮源种类及含量进行系统的优化,最终从11种常见有机氮源中筛选出了一种最佳有机氮源——酵母浸粉FM760,最佳添加质量浓度为9.27 g/L。利用此有机氮源,在摇瓶自然发酵中,ε-PL产量达到(2.60±0.02) g/L,较对照提高22.07%;在分批发酵中,ε-PL产量达到(6.41±0.23) g/L,较对照提高42.64%;在补料分批发酵中,ε-PL产量达到了62.38 g/L,相比于对照提高了18.80%,葡萄糖转化率也提高了25.77%。通过分析FM760中氨基酸组成并结合氨基酸添加实验,初步确定了FM760提高ε-PL产量可能与异亮氨酸、亮氨酸与丙氨酸含量有关,结果与廖丽娟等[22]研究相似。下一步,将围绕3种氨基酸单独或协同对ε-PL合成的影响,进一步揭示其促进ε-PL产量提高的原因。该研究结果对工业发酵生产ε-PL的有机氮源选择具有重要指导意义。

