荭草苷调控Wnt/β-catenin信号通路对小鼠七氟烷麻醉手术后认知功能及大脑β淀粉样蛋白、Tau蛋白水平的影响
杨乾舸 周雨桦 龙飞宇
(西南医科大学附属医院 1麻醉科,四川 泸州 646000;2心脏大血管外科;3西南医科大学研究生院)
七氟烷是常用的吸入麻醉药,麻醉手术后认知功能障碍是临床常见的并发症,患者出现认知功能损害〔1〕,认知功能的障碍与Wnt/β-catenin信号通路被抑制有关〔2〕,荭草苷能够改善转基因小鼠认知功能,减少海马β淀粉样蛋白(Aβ)表达,增加自噬溶酶体自我降解〔3〕。相关研究表明,AD等神经退行性疾病的发生于Wnt/β-catenin信号通路关系密切,激活该通路不仅可以保护神经元,还可以促进神经干细胞分化,改善AD〔4〕。阿尔茨海默病(AD)患者脑内出现大量的老年斑(SP)和Aβ沉积,进而出现神经细胞的突触功能异常、神经元数目减少。研究表明,Wnt/β-catenin信号通路与AD等神经退行性疾病的发生密切相关,阻断该通路会引起Aβ诱导的神经退行性疾病及突触功能障碍。Aβ、微管相关蛋白Tau蛋白在AD患者中表达异常,其与AD发病密切相关〔5〕。本文拟分析红草苷调控Wnt/β-catenin信号通路对小鼠七氟烷麻醉手术后认知功能及大脑Aβ、Tau蛋白水平的影响。
1 材料与方法
1.1实验动物 50只成年SPF级雄性C57BL/6小鼠,体重20~25 g,由四川省疾病预防控制中心提供,许可证号:SYXK(川)2021-043。在实验前适应性饲养7 d后开展实验,所有动物在实验过程中自由饮食。
1.2药物与主要试剂 荭草苷(纯度>98%,曼思特,成都);Aβ、磷酸化Tau(p-Tau)抗体(万类生物,沈阳);Morris水迷宫(正华生物,安徽);电泳仪(Bio-Rad,美国)。
1.3动物分组及模型构建 将60只成年雄性C57BL/6小鼠饲养于室温条件下,不限制其水食,适应性喂养2~3 d,将成年雄性C57BL/6小鼠随机分为对照组、麻醉手术组、低剂量荭草苷组、中剂量荭草苷组、高剂量荭草苷组、高剂量荭草苷+Wnt/β-catenin信号通路抑制剂(IWR-1)组,对照组不做处理,其余各组在七氟烷麻醉后行腹腔探查术,低、中、高剂量荭草苷组分别于术前1 h经腹腔注射5、10、20 mg/kg荭草苷,高剂量荭草苷+IWR-1组于术前1 h经腹腔注射20 mg/kg荭草苷和5 mg/kg IWR-1。对照组、麻醉手术组腹腔注射同剂量的生理盐水,其余6只用于补充各组死亡的小鼠〔6〕。
1.4Western印迹检测各组小鼠海马相关蛋白水平 将小鼠海马组织放于冰水浴中进行充分匀浆,采用RIPA裂解缓冲液分离总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)实验,并转移到聚偏氟乙烯(PDVF)膜上。在室温下用脱脂牛奶封闭1 h后,加入抗Wnt3a(1∶2 000)、抗β-catenin(1∶2 000)、Aβ抗体(1∶800)及p-Tau抗体(1∶500)一抗。在4℃下孵育过夜后,用1×TBST冲洗膜,然后与辣根过氧化物酶(HRP)标记的IgG(1∶3 000)二抗在室温下孵育1 h。以GAPDH作为内参(1∶3 000)。最后用ECL进行曝光,扫膜仪进行成像〔7〕。
1.5Morris水迷宫实验 用一个半径为60 cm,水深30 cm的圆形水池和一个平台作为迷宫人为分为4个象限,记为NE、SE、SW、NW,平台直径6 m,高14 cm,置于距SE象限正中距池壁约25 cm处,淹没于水下1 cm。迷宫周围一切标志保持不变,水温保持在(23±1)℃。正式试验前先让小鼠熟悉环境,实验前1天将小鼠放在不放平台的水迷宫中熟悉环境1 min,然后进行4 d的逃避潜伏期训练:每天训练4次,每次间隔30 min,每天随机从4个入水点让小鼠面向池壁放入,从入水到找到水下平台所用时间记为逃避潜伏期。训练结束后进行正式测试,先记录逃避潜伏期,然后撤除平台让小鼠进行空间探索实验。记录小鼠60 s内穿越平台的次数及目标象限游泳时间〔8〕。
1.6qRT-PCR检测各组小鼠海马白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α mRNA水平 采用Trizol提取小鼠海马组织中总RNA 10 μg,按照RT-PCR试剂盒进行实验操作。引物序列:上游5′-CACCTGCTGCTACTCATTCACT-3′,下游5′-GTCTCTGTC ATACTGGTCACTTC-3′,GAPDH上游5′-CACCCGCGAGTACAACCATC-3′,下游5′-CTAGAAAGTGTGGTGCCAA-3′。反应条件:48℃反转录45 min,94℃进行灭活,引物变性2 min,然后94℃ 30 s,各退火1 min,68℃ 2 min,循环40次,68℃ 7 min,4℃冷却。凝胶成像分析系统进行成像,以GAPDH为参考,计算IL-6、TNF-α水平〔9〕。
1.7酶联免疫吸附试验(ELISA)检测各组小鼠海马IL-6、TNF-α水平 对小鼠海马组织进行分离后取出上清液,并在-20℃下进行冻存,在组织标本中加入50 μl的样本分析缓冲液,将其加入相应的孔中,并在室温下孵育2 h,洗涤板5次,加入100 μl抗体工作液,在室温下孵育1 h,加入酶结合物100 μl,避光孵育20 min,加入显色剂后,避光孵育20 min,加入50 μl终止液,混匀后使用分光光度计测量450 nm处光密度(OD)值,设置6个空白孔进行平行对照,根据标准曲线得到各指标浓度〔10〕。
1.8统计学方法 采用SPSS26.0软件进行单因素方差分析及t检验。
2 结 果
2.1Western印迹检测各组海马Wnt/β-catenin信号通路水平 与对照组相比,麻醉手术组海马Wnt3a及β-catenin水平显著降低(P<0.05),与麻醉手术组相比,低剂量荭草苷组、中剂量荭草苷组、高剂量荭草苷组显著升高(P<0.05),与高剂量荭草苷组相比,高剂量荭草苷+IWR-1组显著降低(P<0.05),见图1,表1。
2.2Morris水迷宫实验检测各组逃避潜伏期、穿越平台次数和目标象限游泳时间 与对照组相比,麻醉手术组逃避潜伏期显著升高,穿越平台次数明显减少,目标象限游泳时间显著降低(P<0.05);与麻醉手术组相比,低剂量、中剂量、高剂量荭草苷组逃避潜伏期显著降低,穿越平台次数和目标象限游泳时间显著增加(P<0.05);与高剂量荭草苷组相比,高剂量荭草苷+IWR-1组逃避潜伏期显著升高,穿越平台次数显著减少,目标象限游泳时间显著降低(P<0.05),见表2。
2.3Western印迹检测各组海马Aβ、p-Tau蛋白水平 与对照组相比,麻醉手术组海马Aβ、p-Tau蛋白水平显著升高(P<0.05),与麻醉手术组相比,低剂量、中剂量、高剂量荭草苷组显著降低(P<0.05),与高剂量荭草苷组相比,高剂量荭草苷+IWR-1组显著升高(P<0.05),见表2,图2。
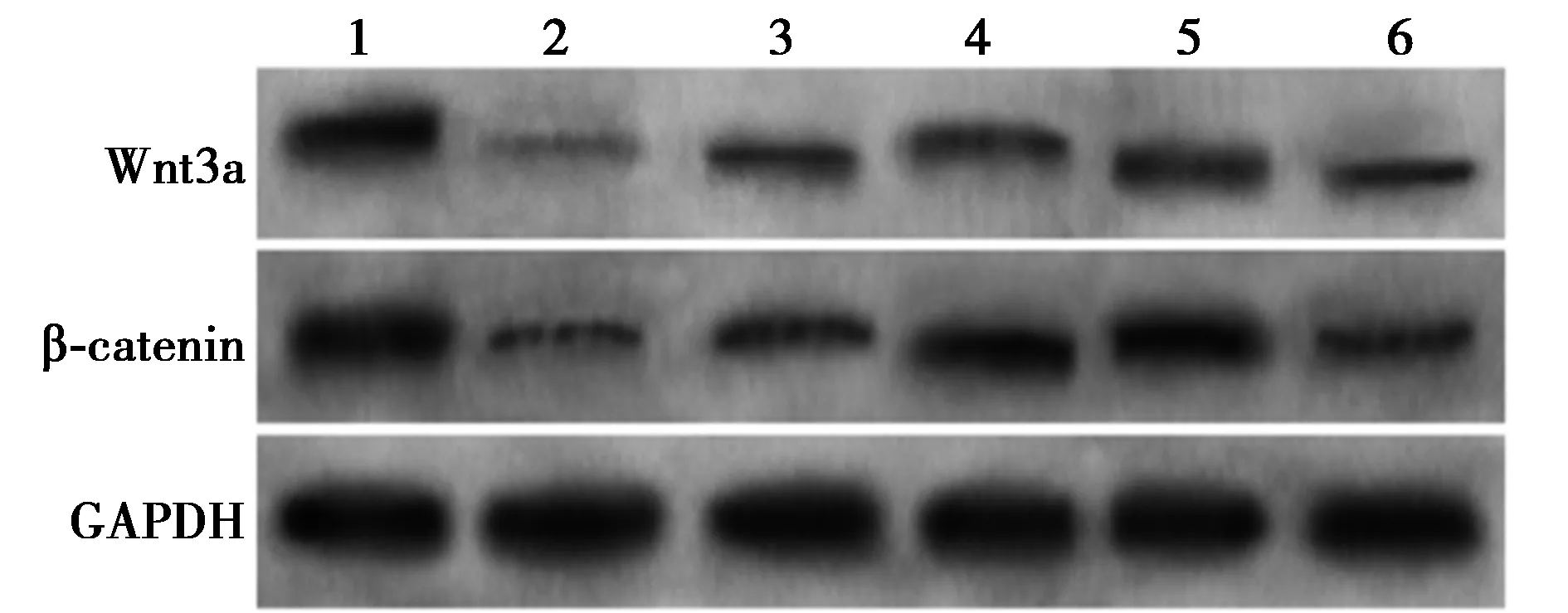
1~6:对照组、麻醉手术组、低剂量荭草苷组、中剂量荭草苷组、高剂量荭草苷组、高剂量荭草苷+IWR-1组;图2同图1 Western印迹检测各组海马Wnt/β-catenin信号通路水平
表1 Western印迹检测各组海马Wnt/β-catenin信号通路水平
表2 各组逃避潜伏期、穿越平台次数、目标象限游泳时间、Aβ及磷酸化Tau蛋白水平比较
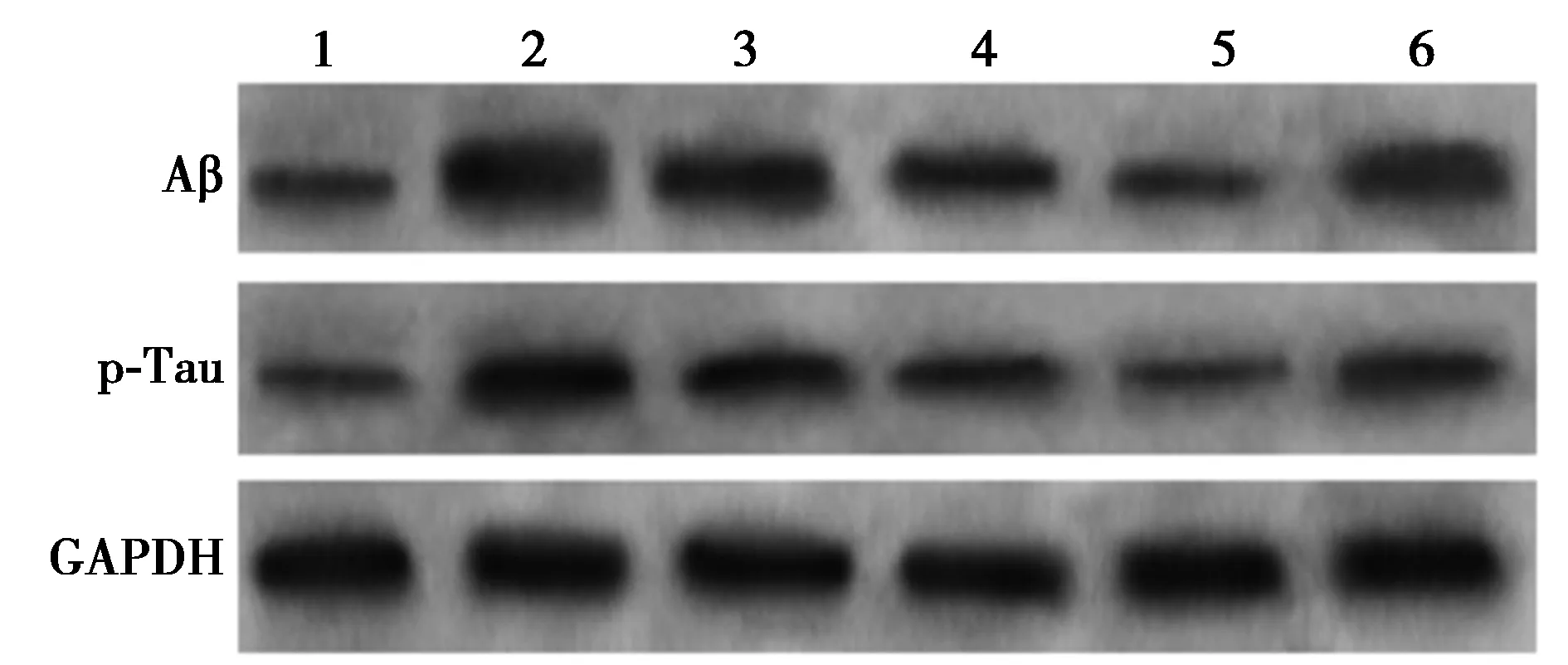
图2 Western印迹检测各组海马Aβ、p-Tau蛋白水平
2.4qRT-PCR检测各组海马IL-6、TNF-α mRNA水平 与对照组相比,麻醉手术组海马IL-6、TNF-α mRNA水平显著升高(P<0.05),与麻醉手术组相比,低剂量、中剂量、高剂量荭草苷组显著降低(P<0.05),与高剂量荭草苷组相比,高剂量荭草苷+IWR-1组显著升高(P<0.05),见表3。
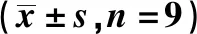
表3 qRT-PCR检测各组小鼠海马IL-6、TNF-α mRNA水平
2.5ELISA检测各组小鼠海马IL-6、TNF-α水平 与对照组相比,麻醉手术组海马IL-6、TNF-α水平显著升高(P<0.05),与麻醉手术组相比,低剂量、中剂量、高剂量荭草苷组显著降低(P<0.05),与高剂量荭草苷组相比,高剂量荭草苷+IWR-1组显著升高(P<0.05),见表4。
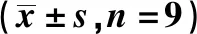
表4 ELISA检测各组小鼠海马IL-6、TNF-α水平
3 讨 论
荭草苷是荭草、竹叶、金莲花的主要活性成分,具有抗抑郁、抗衰老、抗氧化应激、抗炎、抗凋亡等作用〔11〕。以往研究表明,荭草苷可以改善Aβ诱导的痴呆小鼠,但是其作用机制还不清楚〔12〕。研究表明,荭草苷能够改善Aβ及噪音诱导的痴呆小鼠的认知功能,因此,荭草苷可能是一个潜在的多靶点作用的AD防治药物,但荭草苷治疗AD的确切机制仍不清楚〔12〕。本研究显示,不同剂量的荭草苷(5、10、20 mg/kg)均改善小鼠的学习记忆功能。
Aβ是由β淀粉样前体蛋白(APP)水解产生的一种广泛分布于体内各组织的蛋白质,有很强的自聚性,很容易形成极难溶的沉淀〔13〕。Tau蛋白是一种磷蛋白,Tau蛋白过度磷酸化假说认为在AD形成早期,过度p-Tau蛋白发挥重要作用,AD患者的Tau蛋白磷酸基比正常人高3~4倍〔13~15〕。大鼠的转基因(Tg)模型研究显示,Aβ在神经细胞内积累能够改变细胞外调节蛋白激酶(ERK)/反应元件结合蛋白(CREB)信号传导途径,从而影响Tau蛋白磷酸化状态和雄性大鼠诱发的行为障碍〔16〕。本研究结果说明荭草苷可以降低Aβ和p-Tau蛋白水平。
在神经系统的发育中Wnt/β-catenin信号通路起关键作用,参与突触形成及神经细胞增殖、分化、凋亡等过程〔17〕。突触结构损伤会导大鼠发生AD。Wnt3a和β-catenin是Wnt/β-catenin信号通路中的关键蛋白,都参与神经系统发育和突触可塑性形成过程〔18〕。
综上,荭草苷可明显改善小鼠七氟烷麻醉手术后的认知功能,其机制可能与激活Wnt/β-catenin信号通路有关,大脑Aβ、Tau蛋白水平也具有一定的影响。

