CO2浓度升高对谷子干旱胁迫缓解的机制研究
冯雅楠 王迎宾 任宏芳 张东升 宗毓铮 史鑫蕊 李 萍 郝兴宇*
(1.山西农业大学 农学院/科技部与山西省共建有机旱作农业国家重点实验室(筹),太原 030031;2.辽宁农业职业技术学院 农学园艺学院,辽宁 营口 115009)
受人类活动影响大气CO浓度持续升高,导致全球气温升高、水资源分布极不平衡、局部干旱频繁发生。干旱胁迫已经成为限制作物生产的主要因素。有关CO浓度升高可以缓解作物遭受干旱胁迫不利影响的研究已经在C作物上有报道。相比C作物,C作物在抗旱方面有巨大优势。研究CO浓度升高对C作物抗旱性的综合影响,对干旱半干旱地区农业生产具有重要意义。
干旱胁迫对C作物生理生化和基因表达等方面的影响已有报道。干旱胁迫下作物细胞水势升高,气孔导度(G
)下降,活性氧(ROS)不断积累引起膜脂过氧化,超氧化物歧化酶(SOD)、过氧化物酶(POD)、谷胱甘肽-S-转移酶(GST)和过氧化氢酶(CAT)等活性增强,游离脯氨酸(Pro)和可溶性糖(SS)等渗透调节物质含量升高以缓解干旱胁迫对植株造成的伤害。干旱胁迫下,作物体内脱落酸(ABA)含量升高,作物通过ABA受体、钙受体等质膜受体来传递干旱胁迫信号,并通过ROS等第二信使激活ABA信号通路、丝裂原活化蛋白激酶级联通路和Ca依赖信号转导通路,使丝裂原活化蛋白激酶(MAPK)和钙依赖蛋白激酶(CDPK)等蛋白激酶含量升高。进而通过蛋白磷酸化作用调控下游脱落酸、胁迫及成熟诱导蛋白(Abscisic acid-, stress, and ripening-induce, ASR)、脱落酸响应元件结合因子(ABA-responsive element binding factors, ABF3)及Lin-Isl-Mec结构域蛋白(Lin-Isl-Mec domain, LIM)等转录因子活化以参与调节作物响应干旱胁迫,诱导与光合电子传递相关的NADP
基因和调控脯氨酸合成的Δ1-吡咯-5-羧酸酯还原酶(P5CR
)基因等抗旱相关基因表达上调,热休克蛋白等应激蛋白合成增多,以增强植物的抗旱性。ASR、ABF3和LIM等转录因子主要参与调节作物对非生物逆境胁迫的响应,在调节胁迫/活性氧(ROS)相关基因表达和调控ABA信号对渗透压的反应方面有重要作用。CO是光合作用的原料,CO浓度升高会促进作物光合作用,这将有利于作物产量的提升,但由于C作物光合结构的限制,CO浓度升高对其光合作用的增效作用远不及C作物显著。干旱胁迫会使C作物叶片CO同化率和气孔导度(G
)下降,降低作物光合作用。而CO浓度升高可以改善C作物气孔导度(G
)和蒸腾速率(T
),提高其水分利用效率(WUE),进而缓解干旱对作物光合作用的负面影响。CO浓度升高可通过保持土壤水分来间接改善C作物体内水分代谢失衡,进而缓解干旱胁迫使作物光合生理(如光合电子传递减少和热耗散增加)受限和抗氧化酶活性下降等情况。对拟南芥的研究发现高CO浓度下野生型拟南芥叶片水势、叶片相对含水量和游离脯氨酸含量均高于ABA不敏感突变体。高CO浓度可以提高大豆叶片水分利用效率(WUE)和净光合速率(P
),抗氧化酶和蛋白激酶及其基因表达量也显著升高。高CO浓度能提高干旱胁迫下高粱和玉米等C作物的水分利用效率(WUE),降低干旱条件下谷子叶片光合色素含量,减轻干旱对谷子净光合速率(P
)和PSⅡ光化学效率的负效应,缓解干旱等非生物逆境胁迫对作物生长发育所产生的不利影响。谷子属禾本科(Graminee)狗尾草属(Setaria
)植物,是典型的C模式植物,具有抗旱性强、耐贫瘠和适应性广等特点,主要种植在半干旱雨养农业区,是我国主要的粮草兼用作物之一。目前,关于CO浓度升高对作物抗旱性影响的报道多为生理代谢水平的研究,缺乏干旱胁迫下高CO浓度对作物生理和基因表达等综合影响的研究报道。且高CO浓度和干旱交互作用影响的研究多在C作物上开展,二者交互对C作物谷子抗旱性影响的研究也鲜见报道。本试验通过分析高浓度CO和干旱胁迫下谷子孕穗期光合能力、光合色素积累、叶绿素荧光、抗氧化酶、渗透调节物质、激素、信号转导相关蛋白激酶和逆境相关基因表达量等指标的变化,旨在探讨干旱胁迫条件下CO浓度升高对谷子抗旱性的影响机理,以期为未来气候变化背景下谷子生产提供理论依据。1 材料与方法
1.1 试验地概况
试验地点位于山西省晋中市太谷区(37.42′ N,112.58′ E)山西农业大学试验基地。供试土壤为褐潮土,播前土壤基本理化性质为:有机质为23.7 g/kg、全氮1.12 g/kg、速效氮45.28 mg/kg、速效磷25.65 mg/kg、速效钾280.5 mg/kg。
1.2 试验设计
利用控制气室(铝合金框架玻璃结构,每个气室长8.0 m,宽3.0 m,高3.2 m)进行CO浓度控制。通过人工气候调控系统控制气室内CO传感器监测使各个气室的CO浓度保持在目标范围内。
选用谷子品种‘安04’(由安阳市农业科学院培育)为供试材料,设置2个CO浓度处理:正常CO浓度(ACO,400 μmol/mol左右)和高CO浓度(ECO,600 μmol/mol),2个水分处理:正常供水和干旱胁迫。以叶片相对含水量来衡量植株受干旱胁迫的程度,谷子叶片相对含水量的测定参照高俊凤等的方法。不同处理下谷子叶片相对含水量,见表1。
表1 不同CO浓度和水分处理下谷子叶片相对含水量
Table 1 Relative water content of foxtail millet leaves under different CO concentrations and water treatments %
处理Treatment叶片相对含水量Relative water content of leaves正常CO2浓度+正常水分ACO2+Normal water0.75±0.00 ab正常CO2浓度+干旱胁迫ACO2+Drought stress0.67±0.07 b高CO2浓度+正常水分ECO2+Normal water0.85±0.02 a高COa浓度+干旱胁迫ECO2+Drought stress0.78±0.00 ab
注:ACO,正常CO浓度(400 μmol/mol);ECO,正常CO浓度+200 μmol/mol CO (600 μmol/mol)。下同。
Note: ACO, field CO concentration (400 μmol/mol); ECO, field CO concentration+200 μmol/mol CO (600 μmol/mol). The same below.
2017年4月6日,在塑料桶中(直径28 cm,高26 cm,底部打孔)播种谷子,土壤装桶前过筛混匀。每个处理6个重复,每桶随机撒播,播完覆土1 cm左右。谷子出苗长出3片真叶后间苗,每桶留苗8株。试验于5月20日(抽穗期)进行,干旱胁迫处理在取样前10 d(5月10日)停止浇水,持续10 d,直至叶片出现萎蔫;正常供水处理,及时浇水保持土壤湿润。随机选取长势相似的植株,其中部分完全展开的倒2功能叶用于光合指标和叶片含水量的测定,剩余用锡纸包裹经液氮速冻后,于-80 ℃保存。
1.3 试验方法
1
.3
.1
气体交换参数及叶绿素荧光参数的测定在谷子孕穗期,使用便携式光合仪(Li-6400XT, Li-Cor, USA)在晴天9:00—11:00测定气体交换参数。测定时各处理叶室光合有效辐射(PAR)设为1 400 μmol/(m·s),VPD设为1 500 kPa,流速设为500 μmol/s,依气室情况设置参比室CO浓度为400和600 μmol/s,叶温稳定在26.0±0.5 ℃。每处理选择至少3株完全展开的倒2叶,测定净光合速率(P
)、气孔导度(G
)、蒸腾速率(T
)并计算叶片水分利用效率(WUE, WUE=P
/T
)。同时期测定叶绿素荧光参数,每桶选取2株,每处理共8株。于晴天9:00—11:00测定光反应参数并做好标记,将标记的叶片用锡箔纸包好,进行20 min左右暗处理,以保证叶片完全的暗适应以测定暗反应参数。测定叶绿素初始荧光(F
)、最大荧光(F
)、光下最小荧光(F
′)和光下最大荧光(F
′),并计算实际光化学效率(Φ
)、电子传递效率(ETR)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)等荧光参数,测定时CO浓度与测定气体交换参数时一致。1
.3
.2
光响应曲线及荧光光响应曲线的测定在谷子孕穗期,使用便携式光合仪(Li-6400XT, Li-Cor, USA)在晴天9:00—11:00进行光响应曲线和荧光光响应曲线测定。利用Li-6400XT自动“Light-curve”曲线测定功能,设定一系列光合光子通量密度(photosynthetic photon flux dendity, PPFD)梯度:2 000、1 800、1 600、1 200、800、600、400、200、100和0 μmol/(m·s),测定叶片净光合速率(P
)、实际光化学效率(Φ
)和实际电子传递效率(ETR),测定时CO浓度同光合参数测定的浓度一致。1
.3
.3
叶绿素含量、脱落酸含量、热休克蛋白含量、丝裂原活化蛋白激酶含量和钙依赖蛋白激酶含量的测定叶绿素含量用高俊凤等的方法测定。热休克蛋白(HSP-70)、脱落酸(ABA)、丝裂原活化蛋白激酶(MAPK)、钙依赖性蛋白激酶(CDPK)用ELISA双抗体夹心法测定(武汉默沙克生物科技有限公司)。
1
.3
.4
抗氧化酶活性和渗透调节物质含量的测定参照高俊凤等方法进行超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、游离脯氨酸(Pro)含量和可溶性糖含量等指标测定。GST活性用GSH-ST试剂盒(南京建成生物工程研究所)测定。
1
.3
.5
基因表达的相对定量检测以SiActin
为内参,测定SiMAPK
、SiCDPK1
、SiNADP
、SiASR4
、SiP5CR
、SiABF3
和SiWLIM2B
基因在谷子中的相对表达量。基因的序列信息来自NCBI(https:∥www.NCBI.nlm.nih.gov) (表2)。使用Primer 5.0软件(Premier Biosoft Int, Palo Alto, CA, USA)设计qRT-PCR引物,相关基因表达用2法计算。表2 引物序列
Table 2 The primer sequences
基因Gene引物名称Primer-name引物序列Primer sequenceSiActinSiActin-FSiActin-RGGCAAACAGGGAGAAGATGAGAGGTTGTCGGTAAGGTCACGSiWLIM2BSiWLIM2B-FSiWLIM2B-RTCGCAATCACCTGCAAAGCTTACTTCGCAATCACCTGCAAAGCTTACTSiP5CRSiP5CR-FSiP5CR-RGTTGGACGGCTAGGTGTGAACTGTATGCCACCTGATTCTGCSiNADP+SiNADP+-FSiNADP+-RTTGCTCAGCAGGTCTCAGAACAGCGGTAGTTGCGGTAAASiCDPK1SiCDPK1-FSiCDPK1-RGCCAAACATTGTCCGAGTTCAGAGCAATGATCCGGTCGAATAGSiASR4SiASR4-FSiASR4-RACCACCACCACGACAAGAACAAGCTGCGACGGCACCGACCTSiABF3SiABF3-FSiABF3-RTGAGACCGGTTACGTCCAACAGCTTTCCTTCCCCTCAGACSiMAPKSiMAPK-FSiMAPK-RCATTCCCCTCACCAGCATGTGCCACATCATTTCAGGCGGATC
1.4 数据处理
试验数据的整理及图表的绘制均使用Microsoft Excel 2010完成。使用IBM SPSS 26进行数据处理和Duncan’s多重比较分析、一般线性模型双因素方差分析。
2 结果与分析
2.1 不同水分处理下谷子光合作用对CO2浓度升高的响应
2
.1
.1
不同水分处理下叶片中光合色素含量对CO浓度升高的响应由表3可知,干旱胁迫条件下,谷子叶片叶绿素b(Chlb
)和总叶绿素含量(Tolal Chl)分别升高106.48% 和25.34%,叶绿素a(Chla
)、类胡萝卜素(Car)含量和类胡萝卜素/总叶绿素(Car/Tolal Chl)分别下降8.02%、50.00%和55.56%。而高CO浓度和干旱条件二者交互仅对Car含量和Car/Tolal Chl的影响达到了显著水平。交互作用下,谷子叶片Car含量和Car/Tolal Chl较干旱条件分别上升27.27%和42.86%(表3)。表3 不同CO浓度和水分处理下谷子孕穗期叶片的光合色素含量
Table 3 Photosynthetic pigment content of foxtail millet leaves at booting stage under different CO concentrations and water treatments
处理Treatment叶绿素a含量/(mg/g)Chlorophylla content叶绿素b含量/(mg/g)Chlorophyllb content类胡萝卜素含量/(mg/g)Carotenoidcontent总叶绿素含量/(mg/g)Total chlorophyllcontent类胡萝卜素/总叶绿素Car/Totalchlorophyll ratio正常CO2浓度+正常水分ACO2+Normal water2.62±0.04 a1.08±0.04 d0.32±0.00 a3.71±0.09 b0.09±0.00 a正常CO2浓度+干旱胁迫ACO2+Drought stress2.41±0.33 b2.23±0.35 a0.16±0.01 d4.65±0.44 a0.04±0.00 c高CO2浓度+正常水分ECO2+Normal water2.42±0.29 b1.12±0.26 c0.27±0.02 b3.54±0.54 c0.08±0.00 ab高CO2浓度+干旱胁迫ECO2+Drought stress1.63±0.35 c1.43±0.33 b0.22±0.00 c3.06±0.28 d0.07±0.01 bC0.110.190.870.050.06FD0.110.03*0.00**0.570.00**C×D0.340.170.00**0.110.00**
注:C,CO浓度;D,干旱处理。不同的小写字母表示不同处理之间在0.05水平上差异显著(<0.05)。*,**分别表示差异0.05水平显著和0.01水平显著。下同。
Note: C, CO concentration; D, drought treatment. Different lowercase letters indicate significant differences at the level of 0.05 between different treatments (<0.05). *, ** stand for significant at 0.05 level, significant at 0.01 level. The same below.
2
.1
.2
不同水分处理下谷子光合参数对CO浓度升高的响应如图1所示,高CO浓度和干旱胁迫条件均对谷子叶片光合参数有显著影响,二者对谷子光合参数也表现出极显著的交互作用。干旱胁迫条件下谷子净光合速率(P
)、气孔导度(G
)、蒸腾速率(T
)和水分利用效率(WUE)分别下降53.10%、72.86%、43.95%和16.65%。与干旱条件相比,高CO浓度与干旱交互条件下,谷子叶片P
和WUE降幅分别减少70.3%和85.76%,T
降幅为8.37%,G
无显著变化;与正常水分条件相比,高CO浓度下谷子WUE上升54.84%。这表明CO浓度升高主要通过减少干旱胁迫条件下谷子叶片T
,提高P
和WUE来缓解干旱对谷子光合作用的不利影响。2
.1
.3
不同水分处理下谷子孕穗期光响应曲线对CO浓度升高的响应由图2可知,在正常水分条件下,随着光强的增加,谷子P
逐渐增加;相同光强条件下,高CO浓度下谷子P
低于正常CO浓度下谷子P
。干旱胁迫条件下,随着光强的增加,谷子P
先增加后降低,整体低于正常水分条件;在相同光强条件下,高CO浓度使谷子P
整体高于正常CO浓度的P
,但仍小于正常水分条件的P
。这表明干旱显著降低谷子孕穗期P
,而CO浓度升高对此有缓解效果。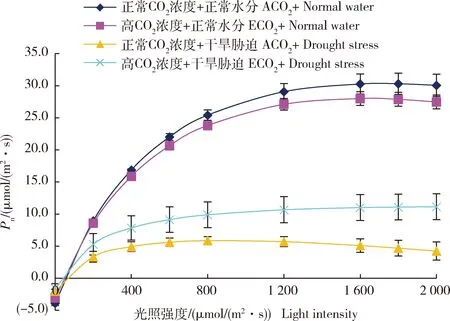
图2 不同CO2浓度和水分处理下谷子孕穗期净光合速率(Pn)对CO2浓度变化的响应曲线Fig.2 Light response curve of Pn of foxtail millet leaves at booting stage under different CO2 concentrations and water treatments
2.2 不同水分处理下谷子叶绿素荧光对CO2浓度升高的响应
2
.2
.1
不同水分处理下谷子叶绿素荧光参数对CO浓度升高的响应由表4可知,干旱胁迫处理对谷子叶绿素荧光参数的影响极显著,其中PSⅡ实际光量子效率(Φ
)、电子传递速率(ETR)和光化学淬灭系数(qP)分别下降55.56%、55.28%和50.00%,非光化学淬灭系数(NPQ)上升29.51%;CO浓度升高后,谷子ETR、qP和NPQ分别上升3.47%、7.14%和8.02%,而PSⅡ的最大光量子效率(F
/F
)、PSⅡ的有效光量子效率(F
′/F
′)和Φ
变化不显著。表明CO浓度升高可以缓解因干旱导致的谷子叶片PSⅡ光化学效率下降,但二者交互作用未达到显著水平。表4 不同CO浓度和水分处理谷子孕穗期叶片的荧光参数
Table 4 Chlorophyll fluorescence parameters of foxtail millet leaves at booting stage under different CO concentrations and water treatments
处理TreatmentFv/Fm/(μmol/(m2·s))F'v/F'm/(μmol/(m2·s))ΦPSⅡ/(μmol/(m2·s))ETR/(μmol/(m2·s))qPNPQ正常CO2浓度+正常水分ACO2+Normal water0.75±0.00 a0.32±0.01 a0.18±0.03 a120.50±21.45 b0.56±0.10 b1.83±0.07 d正常CO2浓度+干旱胁迫ACO2+Drought stress0.73±0.01 b0.29±0.01 b0.08±0.01 b53.89±9.31 d0.28±0.04 d2.37±0.13 b高CO2浓度+正常水分ECO2+Normal water0.75±0.00 a0.32±0.01 a0.19±0.02 a130.07±11.73 a0.61±0.05 a1.90±0.10 c高CO2浓度+干旱胁迫ECO2+Drought stress0.72±0.01 b0.28±0.01 b0.08±0.02 b55.83±11.34 c0.30±0.07 c2.56±0.20 aC0.540.260.650.650.540.29FD0.00**0.00**0.00**0.00**0.00**0.00**C×D0.420.640.760.760.810.64
2
.2
.2
不同水分和CO浓度处理下谷子孕穗期叶片实际光量子效率和光合电子传递效率对光强的响应曲线由图3可知,在正常水分条件下,随着光强的增加,谷子叶片PSⅡ实际光量子效率(Φ
)降低,电子传递速率(ETR)先升高后降低;相同光强条件下,高CO浓度处理谷子叶片Φ
和ETR低于正常CO浓度处理谷子叶片Φ
和ETR。在干旱胁迫条件下,随着光强的增加,谷子叶片Φ
降低,电子传递速率(ETR)先升高后降低,整体低于正常水分条件;相同光强条件下,高CO浓度处理谷子叶片Φ
和ETR高于正常CO浓度处理谷子叶片Φ
和ETR(图3)。这表明干旱胁迫显著降低谷子Φ
和ETR,而CO浓度升高对此有缓解效果(图3 和图4)。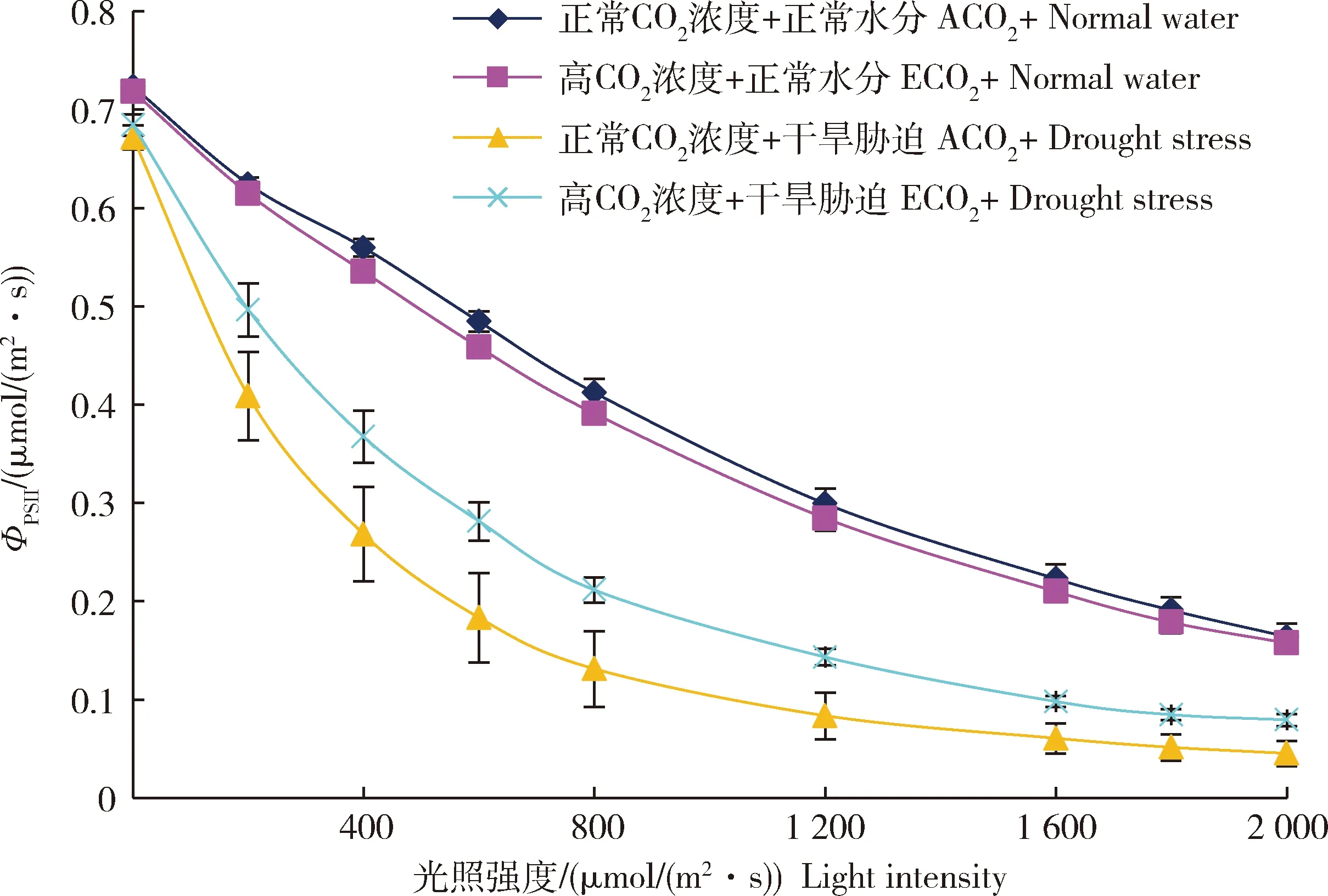
图3 不同CO2浓度和水分处理下谷子孕穗期叶片实际光量子效率(ΦPSⅡ)对光强的响应曲线Fig.3 Light response curve of actual light quantum efficiency (ΦPSⅡ) of millet leaves to light at booting stage under different CO2 concentrations and water treatments
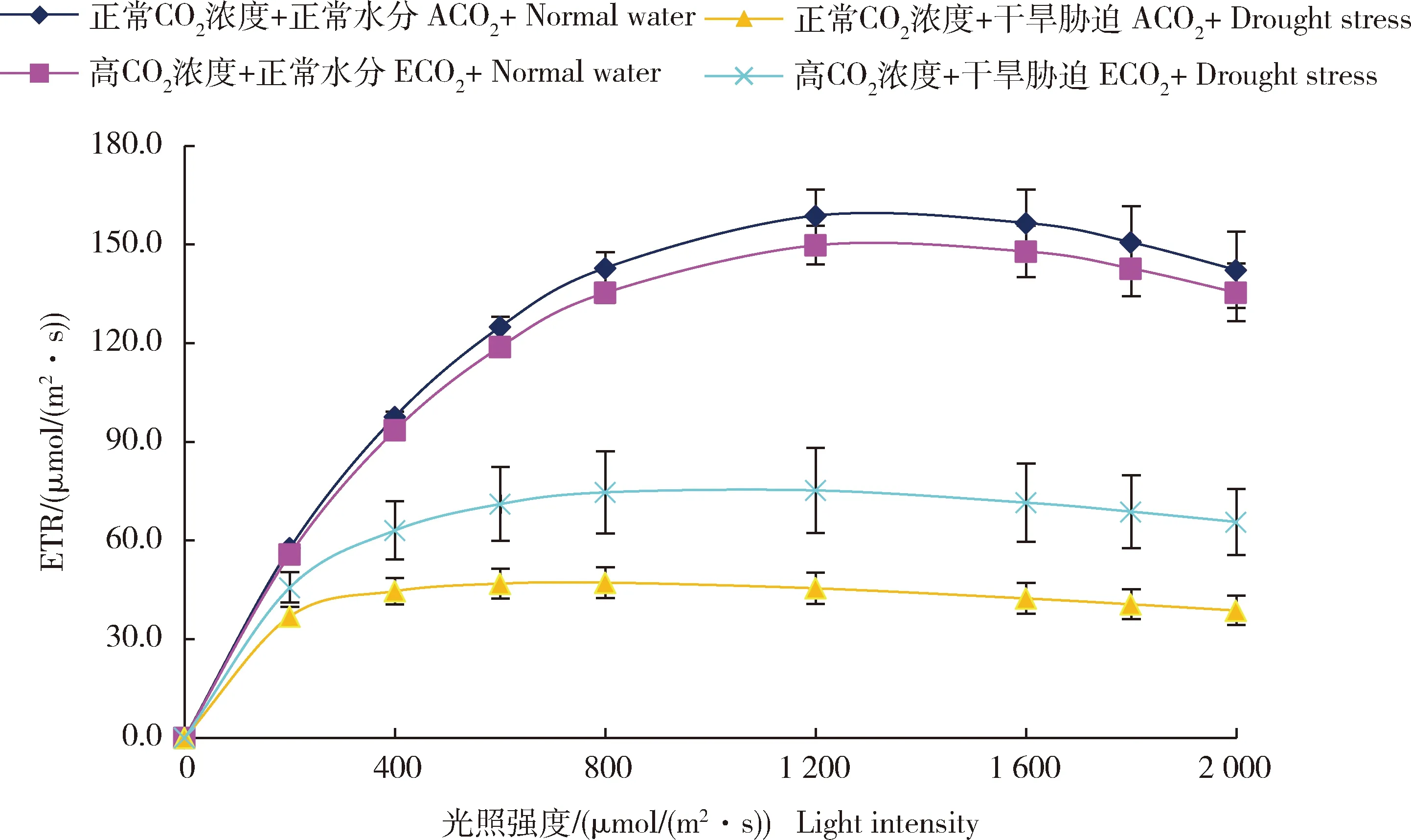
图4 不同CO2浓度和水分处理下谷子孕穗期叶片光合电子传递效率(ETR)对光强的响应曲线Fig.4 Light response curve of photosynthetic electron transport rate (ETR) of millet leaves to light under different CO2 concentrations and water treatments at booting stage
2.3 不同水分处理下谷子叶片信号转导相关蛋白激酶对CO2浓度升高的响应
由图5可知,高CO浓度和干旱胁迫处理对谷子叶片丝裂原活化蛋白激酶(MAPK)和钙依赖蛋白激酶(CDPK)含量均表现出显著的交互作用。干旱条件下,MAPK含量显著下降4.12%,CDPK含量上升1.08%;而高CO浓度处理的MAPK含量较干旱处理升高5.98%,CDPK含量较干旱处理下降0.27%。
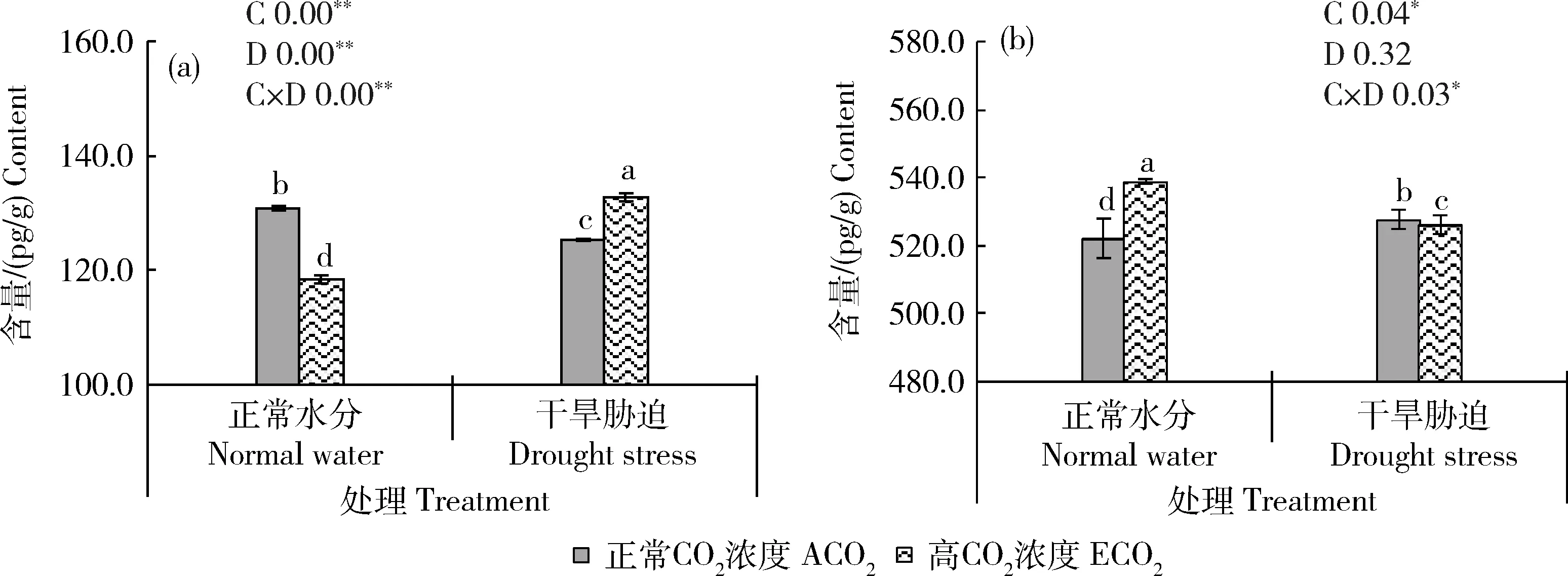
图5 不同CO2浓度和水分处理下谷子孕穗期叶片丝裂原蛋白激酶(a)和钙依赖蛋白激酶(b)的含量Fig.5 Contents of mitogen protein kinase (a) and calcium dependent protein kinase (b) of foxtail millet leaves at booting stage under different CO2 concentrations and water treatments
2.4 不同水分处理下谷子叶片抗氧化酶对CO2浓度升高的响应
由表5可知,高CO浓度和干旱条件对谷子谷胱甘肽-S-转移酶(GST)活性均表现出极显著的交互作用,而对过氧化氢酶(CAT)活性的影响没有达到显著水平。干旱条件下,谷子GST活性降低64.36%,高CO浓度处理较干旱条件升高164.86%,表明CO浓度升高对干旱条件下谷子叶片GST活性有显著的促进作用。
表5 不同CO浓度和水分处理下谷子孕穗期叶片过氧化氢酶(a)、谷胱甘肽-S-转移酶(b)、超氧化物歧化酶(c)和过氧化物酶(d)活性
Table 5 Activities of catalase (a), glutathione-S-transferase (b), superoxide dismutase (c) and peroxidase (d)of foxtail millet leaves at booting stage under different CO concentration and water treatments
处理TreatmentCAT/(U/(g·min))GST/(U/mg)SOD/(U/(g·h))POD/(U/(g·min))正常CO2浓度+正常水分ACO2+Normal water345.51±2.08 b136.01±3.44 a54.81±3.39 d25.93±1.88 a正常CO2浓度+干旱胁迫ACO2+Drought stress345.36±1.38 c48.48±10.27 d86.65±3.15 a25.72±1.19 b高CO2浓度+正常水分ECO2+Normal water343.02±1.75 d73.94±10.58 c68.84±2.88 c17.20±1.69 d高CO2浓度+干旱胁迫ECO2+Drought stress346.40±1.16 a128.41±15.50 b82.39±3.00 b22.34±4.14 cC0.630.430.350.01*FD0.300.170.04*0.00**C×D0.260.00 **0.320.13
高CO浓度处理下过氧化物酶(POD)活性降低33.67%,对超氧化物歧化酶(SOD)活性的影响没有达到显著水平;干旱胁迫显著影响了超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,但二者交互作用对SOD和POD活性的影响没有达到显著水平。与正常水分条件相比,干旱条件下谷子SOD活性升高58.09%,POD活性下降0.80%;CO浓度升高后,谷子SOD和POD活性分别下降4.92%和13.14%。
2.5 不同水分处理下谷子叶片渗透调节物质对CO2浓度升高的响应
由图6可知,高CO浓度和干旱交互处理对谷子叶片可溶性糖(SS)和脯氨酸(Pro)含量的影响没有达到显著水平。与正常水分处理相比,干旱处理下谷子SS和Pro含量分别升高36.67%和19.46%;高CO浓度与干旱胁迫交互作用下Pro含量比正常水分+正常CO浓度处理升高36.13%,SS含量没有显著变化。
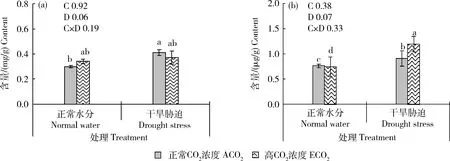
图6 不同CO2浓度和水分处理下谷子孕穗期叶片可溶性糖(a)和脯氨酸(b)含量Fig.6 Contents of soluble sugar (a) and proline (b) of foxtail millet leaves at booting stage under different CO2 concentrations and water treatments
2.6 不同水分处理下谷子叶片脱落酸(ABA)含量和热休克蛋白(HSP-70)含量对CO2浓度升高的响应
由图7可知,高CO浓度和干旱条件对谷子脱落酸(ABA)和热休克蛋白(HSP-70)含量表现出显著的交互作用。与正常水分条件相比,干旱条件下谷子叶片ABA和HSP-70含量分别降低6.39%和27.69%,而高CO浓度和干旱胁迫交互作用下ABA含量较干旱条件升高35.58%,HSP-70含量减小34.51%。
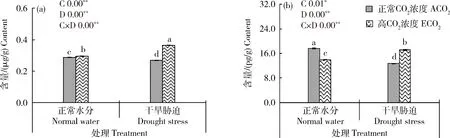
图7 不同CO2浓度和水分处理下谷子孕穗期叶片脱落酸(a)和热休克蛋白(b)含量Fig.7 Content of abscisic acid (a) and heat shock protein (b) of foxtail millet leaves at booting stage under different CO2 concentrations and water treatments
2.7 不同水分处理下抗逆相关基因表达对CO2浓度升高的响应
由图8可知,除SiASR4
外,高CO浓度和干旱条件对6个抗逆相关基因均表现出极显著的交互作用。干旱条件下,SiNADP
和SiP5CR
基因表达量分别上调31.76%和22.20%;SiCDPK1
、SiMAPK
、SiABF3
和SiWLIM2B
基因表达量分别下调62.89%、81.26%、29.23%和56.79%。二者交互作用与干旱条件相比,SiNADP
和SiP5CR
增幅分别为961.97%和388.20%,SiCDPK1
、SiMAPK
、SiABF3
和SiWLIM2B
基因表达量分别上调520.53%、441.43%、387.98%和180.82%。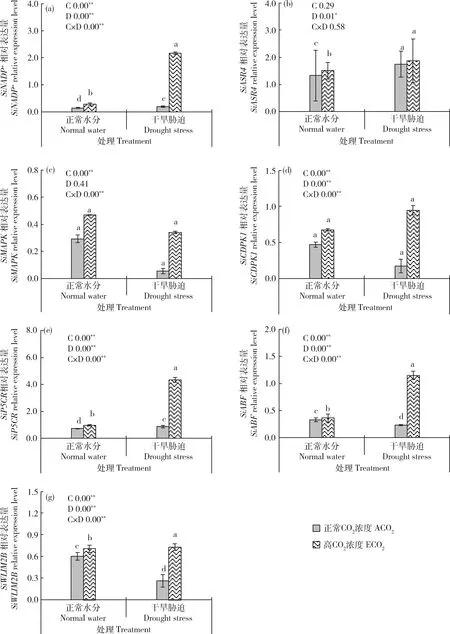
图8 不同CO2浓度和水分处理下谷子孕穗期叶片SiNADP+(a)、SiASR4(b)、SiMAPK(c)、 SiCDPK1(d)、SiP5CR(e)、SiABF3(f)和SiWLIM2B(g)基因表达Fig.8 Expression of SiNADP+ (a), SiASR4 (b), SiMAPK (c), SiCDPK1 (d), SiP5CR (e), SiABF3 (f) and SiWLIM2B (g) genes in foxtail millet leaves at booting stage under different CO2 concentrations and water treatments
仅干旱条件对SiASR4
影响显著。干旱条件下,谷子叶片SiASR4
基因表达量升高31.76%,高CO浓度和干旱胁迫交互条件下谷子叶片SiASR4
基因表达量升高但未达到显著水平。综合情况表明,CO浓度升高可以提高干旱条件下谷子叶片相关抗逆基因表达量,进而提高谷子的抗旱能力。3 讨 论
以往关于高CO浓度对谷子抗旱性的研究多集中在高CO浓度可以缓解干旱对谷子净光合速率P
的负效应,提高WUE,进而改善谷子PSⅡ光化学效率和抗氧化酶活性等生理代谢过程,但对于谷子信号转导以及级联反应对下游转录翻译水平影响的相关研究较少。本研究结果表明,高CO浓度提高了干旱条件下谷子Car含量、ETR和NPQ,缓解了干旱对谷子光合速率和PSⅡ光化学效率的负效应。高CO浓度通过上调抗逆相关基因表达量从而提高干旱条件下谷子叶片CAT、GST等酶活性和MAPK、脯氨酸、ABA等物质含量,提高HSP-70等应激蛋白的表达来增强谷子抗旱性。干旱胁迫对作物光合作用的影响主要表现在叶片气孔导度的下降、光能吸收及传递的降低和热耗散的增加等方面。本研究中,干旱胁迫抑制作物生长,使谷子叶片Chlb
和Tolal Chl含量显著升高,Chla
、Car和Car/Tolal Chl显著下降(表3),光合色素整体呈现“浓缩”趋势;而P
、G
、T
和WUE等参数也显著下降(图1和图2),叶片ETR和qP显著下降,NPQ显著上升(表4)。表明干旱胁迫对谷子叶片光合作用影响显著。而高CO浓度和干旱胁迫条件二者交互使谷子Chla
、Chlb
和Tolal Chl含量显著下降,Car含量和Car/Tolal Chl显著升高(表3),有利于谷子体内不稳定的三线态叶绿素分子和强氧化性的单线态氧的淬灭,增强类囊体膜的稳定性;CO浓度升高使干旱胁迫下谷子叶片P
、ETR和qP降幅减小,T
降幅增大,WUE和NPQ显著提高(图1、图2和表4)。由图2、图3和图4可知,高CO浓度可以减缓干旱胁迫下谷子叶片各光强点的P
、Φ
和ETR降低,但仍低于正常水分处理的指标,这可能与C作物的光合结构被破坏有关。综合来看,高CO浓度通过提高谷子PSⅡ活性,促进光能吸收和传递,提高水分利用效率,减缓干旱对谷子净光合速率乃至光合作用的不利影响。氧化应激和渗透调节是作物应对干旱胁迫的重要手段,对稳定干旱胁迫条件下细胞代谢平衡有重要作用。本研究中,干旱胁迫显著降低了CAT、GST活性,而SOD活性和SS、Pro含量显著升高。高CO浓度和干旱胁迫条件下,CAT、GST活性和Pro含量升高显著。这表明高CO浓度可以提高干旱胁迫条件下谷子多种抗氧化酶活性和脯氨酸的生物合成,加快谷子叶片活性氧清除,调节细胞水势,提高谷子抗旱性。
ABA信号通路、CDPKs和MAPKs是作物响应非生物胁迫过程中信号转导的重要途经,CDPK和MAPK可以通过蛋白磷酸化激活下游转录因子间接激活抗逆基因,使作物对干旱胁迫做出响应。本研究中,高CO浓度显著升高了干旱胁迫下谷子叶片MAPK含量、ABA含量和SiMAPK
、SiCDPK1
基因表达量,而谷子叶片中CDPK含量有下降趋势。同样在大豆中也存在MAPK含量和MAPKs基因表达量变化趋势不一致的现象,这可能是因为不同作物信号转导过程对CO浓度升高的响应存在差异,而MAPK在谷子抗旱生理中作用更大。ASR、ABF3和LIM是作物通过ABA途径和苯丙烷途径响应干旱、盐胁迫等非生物胁迫的重要转录因子。高CO浓度显著升高了干旱条件下谷子SiASR4
、SiWLIM2B
和SiABF3
基因表达量;而SiNADP
和SiP5CR
基因表达量的显著升高表明谷子光合作用和脯氨酸生物积累加强。HSP-70是基因应答的产物,高CO浓度显著升高了干旱胁迫下谷子HSP-70含量。综上所述,高CO浓度主要通过MAPKs级联途径提高抗逆相关转录因子和基因表达来增强谷子的抗旱性。4 结 论
高CO浓度(600 μmol/mol)处理显著提高干旱胁迫下谷子叶片类胡萝卜素(Car)含量、电子传递速率(ETR)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ),并显著降低叶片蒸腾速率(T
),对干旱胁迫导致的谷子叶片光合速率降低和水分利用效率下降有显著的缓解作用;同时高CO浓度(600 μmol/mol)处理显著增加谷子脯氨酸(Pro)、热休克蛋白(HSP-70)和脱落酸(ABA)含量,显著提高谷子叶片过氧化氢酶(CAT)、谷胱甘肽-S-转移酶(GST)活性和丝裂原活化蛋白激酶(MAPK)含量,促进脱落酸、逆境胁迫及成熟诱导蛋白(ASR)、脱落酸响应元件结合因子(ABF3)及Lin-Isl-Mec结构域蛋白(LIM)等转录因子基因的表达,提高与光合电子传递和脯氨酸生物合成相关的SiNADP
和SiP5CR
基因的表达。这表明CO浓度升高可通过减缓干旱胁迫对谷子叶片光合速率和水分利用效率的负效应、抗氧化酶类活性和渗透调节物质含量,通过MAPKs级联反应增强抗逆相关转录因子和基因的表达来提高谷子的抗旱性。
