甜菊素对RANKL 诱导的破骨细胞分化和功能的影响
陈莎周佳瑛储非凡林芝张伟琪朱爱芳*
(1.绍兴市柯桥区妇幼保健院,浙江 绍兴312030; 2.温州医科大学第二临床医学院,浙江 温州325035;3.温州医科大学第一临床医学院,浙江 温州325035)
骨质疏松是一种以单位体积内骨量减少为特点的代谢性骨病变,多发于中老年人,绝经后女性发病率高于男性[1]。虽然死亡率不及心脑血管疾病和恶性肿瘤,但是其并发症骨折所造成的高致残率严重影响患者身心健康[2-3]。目前已有的药物如双膦酸盐类[4]、维生素D类[5]均不能达到理想的治疗效果;雌激素类药物具有较大副作用[6]。因此,迫切需要寻找到一种安全、高效的治疗骨质疏松的新药物。
天然中药单体凭借其活性强、副作用小等优点,有望成为多种疾病的潜在治疗药物[7]。甜菊素提取自多年生草本植物甜叶菊,已有研究报道其能够抑制NF-κB 通路,起到抗炎、抗氧化作用[8]。因此,本实验将探究甜菊素是否能够通过减轻NFκB 介导的炎症和氧化应激反应,从而抑制破骨细胞的分化和功能。
中药结构较复杂,随着网络药理学和分子对接技术的兴起与成熟,能较好地深入探究其分子层面的作用机制。因此,本研究将结合网络药理学靶点预测、分子对接和Western blot 技术寻找出甜菊素的作用靶点,并通过体外实验验证甜菊素对靶点及其下游信号通路作用,以期构建一条“甜菊素-靶点-下游通路”作用逻辑链。
1 材料
1.1 动物 10 周龄C57BL/6 小鼠,体质量(20±2)g,购自上海茂生衍生物科技有限公司,实验动物生产许可证号SCXK(沪)2017-0004。
1.2 试剂与药物 甜菊素(纯度98%,CAS 号57817-89-7)对照品购自成都曼斯特生物科技有限公司。CCK-8 试剂盒(货号CA1210-500T)、抗酒石酸酸性磷酸酶(TRAP)染色液(货号G1492-4)购自北京索莱宝科技有限公司;小鼠RANK 配体(RANKL)(货号R0525)、巨噬细胞集落刺激因子(M-CSF)(货号SRP3221)购自美国Sigma-Aldrich公 司;CTSK(货 号 ab207086)、c-Fos(货 号ab222699)、IκB-α(货号ab32518)特异性抗体购自英国Abcam 公司;AKR1B1(货号67498-1-Ig)特异性抗体购自武汉三鹰生物技术有限公司;TRIzol(货号15596018)购自美国Thermo Fisher Scientifie 公司;Acp5、V-ATpase-d2、CTSK、c-Fos、NFATc-1 特异性PCR 引物、SYBR Green(货号A25742)购自美国Thermo Fisher Scientifie 公司。
1.3 仪器 SW-CJ-2F/2FD 双人净化工作台(广州万邦净化设备有限公司);Thermo 8000 系列水套式3429 CO2细胞培养箱、Sorvall ST40R 高速冷冻离心机(美国Thermo Fisher Scientifie 公司);尼康E200 生物显微镜酶标仪(日本尼康公司);K3 plus 酶标仪(北京优健萌威医药科技有限公司);GelDoc XR+凝胶成像系统(美国Bio-Rad 公司)。
2 方法
2.1 骨髓单核巨噬细胞(BMMs)提取与培养小鼠颈椎脱臼处死,75%乙醇消毒后移入超净台,用经过高压蒸汽灭菌的镊子、剪刀取下四肢,剔除皮毛和肌肉组织,分离出完整的股骨和胫骨,置于含10%胎牛血清的α-MEM 培养基中,切开长骨两端,用5 mL 注射器吸取大皿中的培养基,对准切口冲出长骨内的骨髓,直至长骨由暗红色变为通透的白色,1 000 μL 移液枪将骨髓吹打混匀,40 μm过滤器过滤,滤液1 500 r/min 离心5 min,弃上清,加入α-MEM 完全培养基(10% 胎牛血清、0.5%双抗)重悬,接种至T75 培养瓶中,置于37 ℃、5% CO2恒温箱中培养过夜,待细胞贴壁后隔天换液,直至细胞密度达90%后进行细胞传代,取1~3 代用于实验。
2.2 CCK-8 检测BMMs 细胞存活率 将原代BMMs 细胞以每孔5×103个细胞密度接种至96 孔板中,每孔加入100 μL 含50 ng/mL M-CSF 的α-MEM 完全培养基(含10% 胎牛血清、1% 双抗),置于37 ℃、5% CO2恒温箱中培养过夜,待细胞贴壁后更换相同培养基,分别加入5、10、20、40 μmol/L溶解于无菌PBS 的甜菊素,每组3 个复孔,置于恒温箱中继续培养5 d,隔天换液并补充对应浓度的甜菊素,5 d 后在每孔中加入10 μL CCK-8 试剂,继续在培养箱中孵育2 h 后取出,采用多功能酶标仪,在450 nm 波长处检测光密度(OD)值,计算细胞存活率。
2.3 TRAP 染色检测破骨细胞形成 将原代BMMs细胞以每孔5×103个的密度接种至96 孔板中,每孔加入100 μL 含50 ng/mL M-CSF 的α-MEM 完全培养基,待细胞贴壁后分为对照组、RANKL 组、甜菊素组,RANKL 组给予50 ng/mL RANKL 刺激,甜菊素组在RANKL 刺激的基础上分别给予5、10 μmol/L该成分,隔天更换培养基并补充两者,培养5~7 d 至RANKL 组出现破骨细胞后移除培养基,2.5%戊二醛固定15 min,无菌PBS 清洗3次,加入TRAP 染液,置于37 ℃恒温箱中孵育3 h,染色完成后用无菌PBS 洗去多余染液,在显微镜下观察拍照,以细胞核≥3 个的细胞为破骨细胞,统计其数量。
2.4 甜菊素预测靶点的获取及分子对接验证 从PubChem 数据库(https:/ /pubchem.ncbi.nlm.nih.gov/)中获取甜菊素结构式的sdf 文件,上传到 PharmMappper 数据库(http:/ /www.lilabecust.cn/pharmmapper/)[9]以预测甜菊素的潜在目标,设置PharmMappper 参数,Generate Conformers为Yes;Maximum Generated Conformations 为300;Select Target Set 为Human Protein Target Only,为了提高预测准确性,选取预测结果中NormFit >0.9的靶 点。再 从PDB 数据库(http:/ /www.rcsb.org/)[10]中下载筛选出的预测靶点的蛋白构象的pdb 文件,为了确保对接结果有更高可信度,选用来源于人或者小鼠。最后采用LibDock 对甜菊素和预测靶点进行模拟对接评分,得分>100 视为对接成功[11]。
2.5 RT-qPCR 检测破骨细胞溶骨相关基因和调节分化相关转录因子表达 将原代BMMs 细胞以每孔8×104个的密度接种至6 孔板中,每孔加入2 mL含50 ng/mL M-CSF 的α-MEM 完全培养基,待细胞贴壁后分为对照组、RANKL 组、甜菊素组,RANKL 组给予50 ng/mL RANKL 刺激,甜菊素组在RANKL 刺激的基础上给予10 μmol/L 该成分,隔天更换培养基并补充两者,培养5 d 后移除培养基,每孔加入600 μL TRIzol,置于冰上静置裂解5 min,吸取混合液至1.5 mL EP 管中,加入150 μL氯仿,振荡15 s 后静置5 min,4 ℃、12 000 r/min离心15 min 后取上清,加入500 μL 异丙醇,静置10 min,4 ℃、12 000 r/min 离心15 min,弃去上清,75%乙醇清洗1次,即得总RNA,使用逆转录试剂盒合成cDNA,实时荧光定量PCR 仪检测破骨细胞溶骨相关基因(Acp5,V-ATpase-d2,CTSK)和调节分化相关转录因子(c-Fos, NFATc-1)相对表达,引物序列见表1。
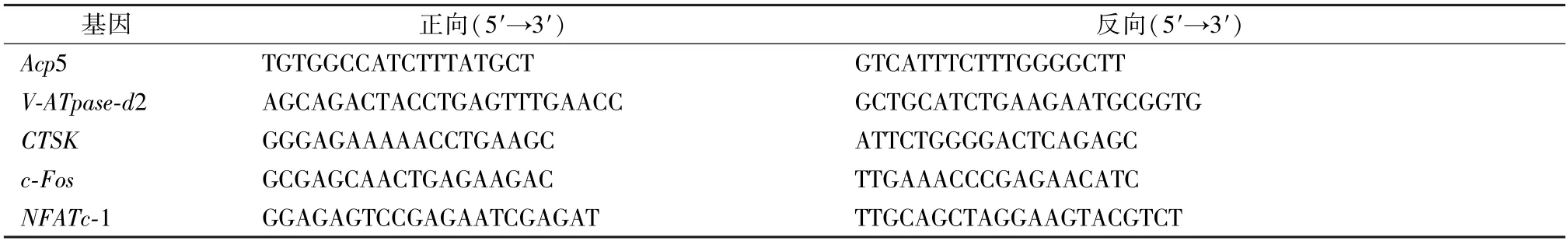
表1 引物序列Tab.1 Primer sequences
2.6 荧光素报告酶分析 将构建有NF-κB 荧光素酶基因的RAW264.7 细胞接种于96 孔板中,调整细胞密度为每孔5×103个,加入100 μL 含50 ng/mL MCSF 的α-MEM 完全培养基,细胞贴壁后按“2.5”项下方法分组及给药,置于培养箱中继续培养6 h,采用荧光素报告酶试剂盒和多功能酶标仪检测荧光素酶活性。
2.7 Western blot 检测c-Fos、CTSK、IκBα、AKR1B1蛋白表达 BMMs 细胞按“2.5”项下方法分组及给药,采用细胞总蛋白提取试剂裂解细胞提取蛋白,SDS-PAGE 电泳分离目标蛋白后转移到PVDF膜上,加入5%脱脂牛奶,在4 ℃下封闭过夜,弃去封闭液,洗膜3次,每次15 min,加入一抗,在4 ℃下孵育12 h,洗膜3次,每次15 min,加入二抗,常温孵育2 h,在凝胶成像系统下显影,Image Lab 软件对所得条带灰度值进行分析,以GAPDH为内参,计算目的蛋白相对表达。
2.8 统计学分析 通过SPSS 21.0 软件进行处理,数据以()表示,多组间比较采用单因素方差分析,2 组间比较采用Student’st检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 甜菊素对BMMs 细胞活性的影响 如图1 所示,与对照组(0 μmol/L)比较,各浓度甜菊素OD值无明显变化(P>0.05),表明该成分浓度在0~40 μmol/L 范围内对BMMs 细胞无毒性。

图1 甜菊素对BMMs 细胞活性的影响(, n=3)Fig.1 Effect of steviosin on BMMs cell viability(, n=3)
3.2 甜菊素抑制RANKL 诱导的破骨细胞分化 如图2 所示,与对照组比较,RANKL 组BMMs 细胞分化融合为多核破骨细胞;与RANKL 组比较,甜菊素组破骨细胞数量呈剂量依赖性减少(P<0.01),即10 μmol/L 时效果最强。

图2 甜菊素抑制RANKL 诱导的破骨细胞分化Fig.2 Inhibitory effect of steviosin on differentiation of RANKL-induced osteoclasts
3.3 甜菊素与AKR1B1 的分子对接 共预测得到290 个甜菊素的潜在作用靶点,其中NormFit>0.9的靶点共有26 个。经LibDock 分子对接后,共有5个靶点与甜菊素对接成功,其中AKR1B1 以200.062 的得分位居第一,见图3、表2。

表2 甜菊素与预测靶点的LibDock 对接评分Tab.2 LibDock docking scores for steviosin and predicted targets

图3 甜菊素与AKR1B1 的分子对接Fig.3 Molecular docking for steviosin and AKR1B1
3.4 甜菊素抑制RANKL 诱导的破骨细胞中AKR1B1 的表达 如图4 所示,与对照组比较,RANKL 组破骨细胞中AKR1B1 表达升高(P<0.05);与RANKL 组比较,甜菊素组破骨细胞中AKR1B1 表达降低(P<0.05)。

图4 甜菊素抑制破骨细胞中AKR1B1 表达(,n=3)Fig.4 Inhibitory effect of steviosin on AKR1B1 expressions in osteoclasts(, n=3)
3.5 甜菊素抑制破骨细胞溶骨相关基因和调节分化相关转录因子的表达 如图5 所示,与对照组比较,RANKL 组破骨细胞溶骨相关基因Acp5、VATpase-d2、CTSK以及调节分化相关转录因子c-Fos、Naftc-1 mRNA 表达均升高(P<0.01);与RANKL 组比较,甜菊素组破骨细胞中上述基因表达均降低(P<0.01)。
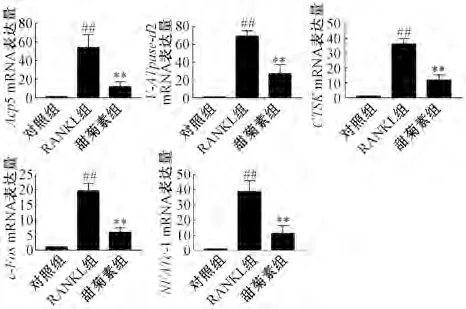
图5 各组破骨细胞Acp5、 V-ATpase-d2、 CTSK、 c-Fos、 Naftc-1 mRNA 表达(, n=3)Fig.5 mRNA expressions of Acp5, V-ATpase-d2,CTSK, c-Fos and Naftc-1 of osteoclasts in each group(, n=3)
3.6 甜菊素对c-Fos 通路的抑制作用 如图6 所示,与RANKL 组比较,甜菊素组c-Fos、CTSK 蛋白表达均降低(P<0.01)。
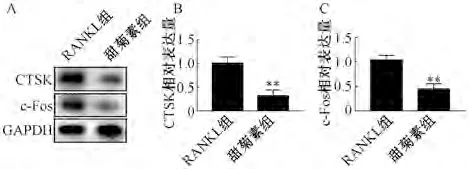
图6 甜菊素抑制c-Fos 通路激活(, n=3)Fig.6 Inhibitory effect of steviosin on c-Fos pathway activation(, n=3)
3.7 甜菊素对NF-κB 通路的抑制作用 如图7A所示,与对照组比较,RANKL 组NF-κB 的荧光素酶活性增强(P<0.01);与RANKL 组比较,甜菊素组NF-κB 的荧光素酶活性减弱(P<0.01)。如图7B~7C 所示,与对照组比较,RANKL 组NF-κB通路激活中关键的负调节蛋白IκBα 的表达降低(P<0.01);与RANKL 组比较,甜菊素组IκBα 蛋白表达升高(P<0.05)。
图7 甜菊素抑制NF-κB 通路活化(, n=3)Fig.7 Inhibitory effect of steviosin on NF-κB pathway activation(, n=3)
4 讨论
甜菊素是一种天然来源的双萜配糖体,也作为甜味剂使用,具有抗炎、抗氧化、抗糖尿病、抗肿瘤[12]等多种生物活性,本研究探讨甜菊素通过抑制破骨细胞活性从而达到治疗骨质疏松的作用。
破骨细胞的活性主要体现在能否从BMMs 细胞分化成破骨细胞,以及其溶骨功能的强弱[6]。破骨细胞的骨溶解功能主要由CTSK 行使[13],Acp5则能增强CTSK 的功能。本研究显示甜菊素降低了RANKL 诱导的破骨细胞中CTSK和Acp5 的表达,提示甜菊素对破骨细胞溶骨功能具有抑制作用。V-ATpase-d 能够促进破骨细胞分化,已有研究证明抑制V-ATpase-d2 阻止了前体细胞融合形成破骨细胞[14]。NFATc-1 是有关破骨细胞分化和功能行使关键转录因子,c-Fos 是激活蛋白-1(AP-1)的重要组成部分[15],两者均能够促进下游CTSK、Acp5 和V-ATpase-d2 的表达,抑制NFATc-1 和c-Fos 表达便能抑制下游效应蛋白的表达,从而很大程度上地抑制破骨细胞的活性,本研究结果证实这一点。
除了NFATc-1、c-Fos、NF-κB 在RANKL 诱导的破骨细胞分化中也扮演重要的角色[16-17],RANKL 和RANK 结合,通过膜受体TRAF6 激活核因子κB 激酶抑制剂(IKK),活化的IKK 进而降解IκBα[18],从而释放NF-κB,NF-κB 转位进入细胞核[19],促进了NFATc-1 和c-Fos,进而通过一系列级联反应诱导破骨细胞的分化。IκBα 作为这条通路中的关键蛋白,其表达与NF-κB 通路的活性呈负相关。本研究结果显示,甜菊素能上调破骨细胞中IκBα 表达,表明甜菊素也能够通过抑制NFκB 途径来发挥抑制破骨细胞分化的作用。
AKR1B1 是一种NADPH 依赖性酶,催化各种醛和酮还原为相应的醇[20],具有较好的抗氧化作用,有研究显示其能够激活p65 从而活化NF-κB信号通路[21-22]。根据LibDock 对甜菊素和AKR1B1对接的高评分,预测甜菊素可能通过AKR1B1 调控NF-κB 信号通路的活性。
综上所述,甜菊素可能通过抑制AKR1B1/NFκB轴,进而减少转录因子NFATc-1 和c-Fos 表达,最终起到抑制破骨细胞分化和功能的作用。本课题组后续将会对甜菊素深层机制及其在体内的作用进一步研究,为将来开发安全、高效的治疗骨质疏松的药物提供基础。

