盐酸右美托咪定注射液与给药器具的相容性研究
郭小鹏 魏俊玲
1.北京福瑞康正医药技术研究所制剂室,北京 102627;2.天泽恩源(天津)制药有限公司制剂研发部,天津 301700
盐酸右美托咪定是一种高效、高选择性的α2-肾上腺素受体激动剂。通过作用于两种肾上腺素能受体而具有抗交感、镇痛和镇静作用[1-4]。上市的剂型为注射液,规格200 μg/2 ml,2008年美国食品和药物管理局批准其新适应证:操作镇静,用于非插管患者在手术和其他操作过程的镇静[5-10]。盐酸右美托咪定注射液在给药前须用2 ml 盐酸右美托咪定注射液加入48 ml 的0.9%的氯化钠溶液中形成总体积为50 ml的溶液(浓度:4 μg/ml),轻轻摇动使其均匀混合后使用。在使用过程需要严格控制给药速度,临床上是采用微量注射泵和50 ml 注射器配合进行给药[11-12]。盐酸右美托咪定注射液药品说明书中提到了产品与天然橡胶的相容性问题,某些类型的天然橡胶可以吸附盐酸右美托咪定,建议使用由合成或含有涂层橡胶垫圈制成的注射器[13-18]。因此,本研究考察了玻璃注射器、天然橡胶活塞注射器、合成橡胶活塞注射器、无胶塞注射器以及输液管的相容性。
1 仪器与试剂
1.1 仪器
CP225D 电子天平(北京赛多利斯科学仪器有限公司);FE-20 型pH 计(梅特勒-托利多);高效液相色谱仪(LC-20AT 泵,SPD-M20A 检测器,SIL-20A 进样器,日本岛津);色谱柱(Kromasil Enternity-5-C18柱(250 mm×4.6 mm,5 m)。
1.2 试剂
盐酸右美托咪定注射液[2 ml∶200 μg(按右美托咪定计),批号17032417S,四川美大康华康药业有限公司);盐酸右美托咪定对照品(纯度99.8%,上海阿拉丁生化科技股份有限公司);磷酸二氢钠(分析纯,国药集团化学试剂有限公司);乙腈(色谱纯,Fisher Scientific);三乙胺(分析纯,北京益利化学有限公司)。
2 方法与结果
2.1 色谱条件
色谱柱为KromasilREnternity-5-C18柱(250 mm×4.6 mm,5 m),流动相为0.01 mol/L 磷酸二氢钠溶液(称取磷酸二氢钠1.56 g,加水1000 ml 使溶解,加3 ml 三乙胺,用磷酸调pH 值为6.5)-乙腈(60∶40),柱温30℃,流速1.0 ml/min,测定波长210 nm。进样体积20 μl,记录色谱图,按外标法以峰面积计算盐酸右美托咪定的含量。系统适用性要求:理论板数按盐酸右美托咪定峰计算不低于2000;盐酸右美托咪定与相邻杂质峰的分离度应符合要求;对照品溶液重复进样5 次,其峰面积的相对标准偏差应不大于2.0%。
2.2 对照品溶液的配制
取盐酸右美托咪定对照品12 mg,精密称定,置100 ml 量瓶中,加0.9%氯化钠注射液溶解并稀释至刻度,摇匀,作为对照品溶液。
2.3 供试品溶液的配制
取本品6 支分别直接进样。
2.4 含量测定方法学验证
2.4.1 专属性 以0.9%氯化钠为空白溶液,取盐酸右美托咪定注射20 ml 置25 ml 容量瓶中分别加入0.1 mol/L的盐酸2 ml、0.1 mol/L 的氢氧化钠溶液2 ml 在80℃条件下放置30 min;加0.5% KMnO4溶液2 ml 在室温放置30 min。按色谱条件取40 μl 注入液相色谱仪,记录其色谱图。专属性结果显示,主成分峰峰纯度良好,主峰与相邻杂质的分离度符合要求,降解杂质不影响主成分含量的准确测定,因此该方法作为含量测定方法专属性良好。
2.4.2 溶液稳定性 盐酸右美托咪定注射液分别于0、2、4、6、8、10、12 h 时直接取20 μl 注入液相色谱仪,按色谱方法进行分析。取每点的主峰面积,计算峰面积相对标准偏差(relative standard deviation,RSD)值,同时观察是否有其他杂质峰出现来评估溶液稳定程度。溶液稳定性结果显示盐酸右美托咪定注射液在0、2、4、6、8、10、12 h 时主成分峰面积变化RSD 值为(RSD≤2.0%),无其他色谱峰出现,供试品溶液12 h内稳定性良好。溶液稳定性结果见表1。
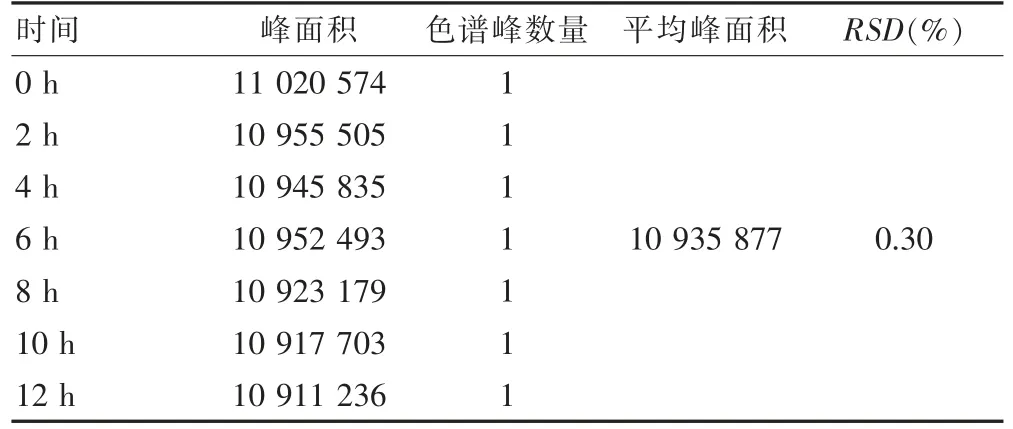
表1 溶液稳定性结果
2.4.3 线性与范围 取盐酸右美托咪定对照品适量分别配制成12.28、24.56、49.12、73.68、122.80、184.20 μg/ml 的溶液,精密量取以上溶液各20 μl 注入液相色谱仪,记录色谱图。分别以峰面积(A)为纵坐标(Y),样品浓度(C)为横坐标(x),进行线性关系分析,得到线性方程为Y=82137x+74986,相关系数R2=0.9998(n=6),盐酸右美托咪定在浓度12.28~184.20 μg/ml 的范围内,线性关系良好。
2.4.4 精密度试验 精密量取盐酸右美托咪定注射液20 μl 注入液相色谱仪,记录色谱图,按外标法以峰面积计算盐酸右美托咪定的含量,通过所得6 份供试品溶液中盐酸右美托咪定含量的RSD 值来评价精密度(重复性和中间精密度)。结果为重复性的RSD=0.44%,中间精密度的RSD=0.38%,说明该方法测定本品含量精密度良好。
2.4.5 准确度 取盐酸右美托咪定对照品适量用0.9%氯化钠注射液溶解并稀释至120 μg/ml;分别按对照品浓度的80%、100%、120%加入盐酸右美托咪定并溶解。每个浓度制备3 份,共制备9 份样品。精密量取以上溶液各20 μl 注入液相色谱仪,记录色谱图,按外标法以峰面积计算回收率。不同浓度的平均回收率99.46%,RSD=0.56%,方法准确度良好。准确度测定结果见表2。
2.4.6 耐用性试验 根据《中华人民共和国药典》(以下简称《中国药典》)2020 版通则9101[19]要求,对本品液相色谱条件进行耐用性研究。考察色谱条件在流动相不同pH 值(±0.2)、不同流速(±0.1 ml/min)、不同柱温(±5℃)、不同有机相比例(±2%有机相)及不同的色谱柱(Kromasil-C18,250 mm×4.6 mm,5 m;MN-C18,250 mm×4.6 mm,5 m)下色谱行为的变化。系统耐用性试验结果见表3。结果表明当色谱条件发生微小变动时,主峰的拖尾因子均小于2.0,杂质峰与主峰之间能达到基线分离,供试品中盐酸右美托咪定含量的RSD 值均小于2%,由此证明将色谱条件的参数作适当的变化后,如流动相pH、流速、色谱柱的柱温、有机相比例及不同批次的色谱柱等作微小调整,对测定结果不会产生显著性影响。
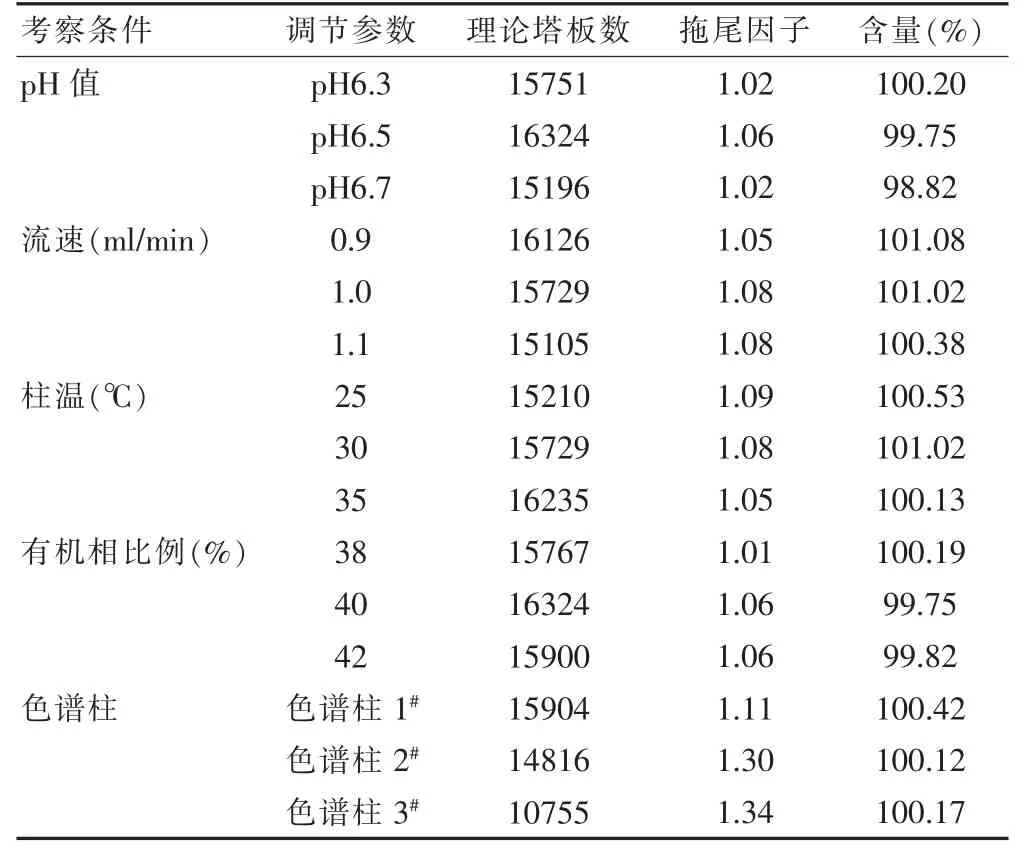
表3 系统耐用性试验结果
2.5 与给药器具的相容性测定结果
2.5.1 给药器具 根据本品在给药过程中所涉及使用到的给药器具,选择了不同厂家生产50 ml 规格的注射器(含不同材质胶垫)和一次性输液管进行了相容性研究。所用给药装置见表4。
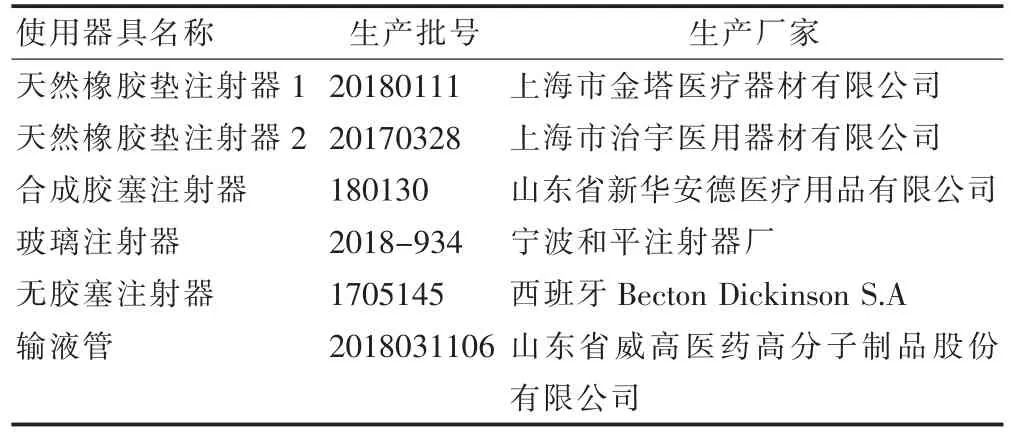
表4 试验用注射器、输液管列表
2.5.2 外观检查 取本品2 ml 用0.9%氯化钠注射液稀释至临床使用浓度(4 μg/ml),分别于各时间点从注射器中抽取5 ml 溶液,置于洁净透明的10 ml 具塞纳氏比色管中;另以生理盐水作空白对照液。在光照度为1500 Lx 的澄明度检测仪下,肉眼观察配伍液外观.均无色透明,无沉淀和气体产生,与空白对照液相比未见差异。
2.5.3 不溶性微粒 取本品2 ml 用0.9%氯化钠注射液
稀释至临床使用浓度(4 μg/ml),分别于各时间点从注射器中抽取5 ml 溶液,按《中国药典》[19]通则0903中“不溶性微粒检查法中的光阻法”检测微粒。结果每毫升溶液中含≥10 μm 微粒不超过6000 粒、且含≥25 μm 微粒不得超过600 粒时,表明配伍液在各个时间点的微粒数均符合《中国药典》规定标准。2.5.4 与给药器具的相容性测定pH 值结果 取本品2 ml 用0.9%氯化钠注射液稀释至临床使用浓度(4 μg/ml),分别于各时间点从注射器中抽取5 ml 溶液依法测定其pH 值,结果见表5,数据显示各药液的pH 值0~24 h 内未见明显变化,说明盐酸右美托咪定注射液在与0.9%氯化钠注射液配伍后在使用期间pH 值稳定。
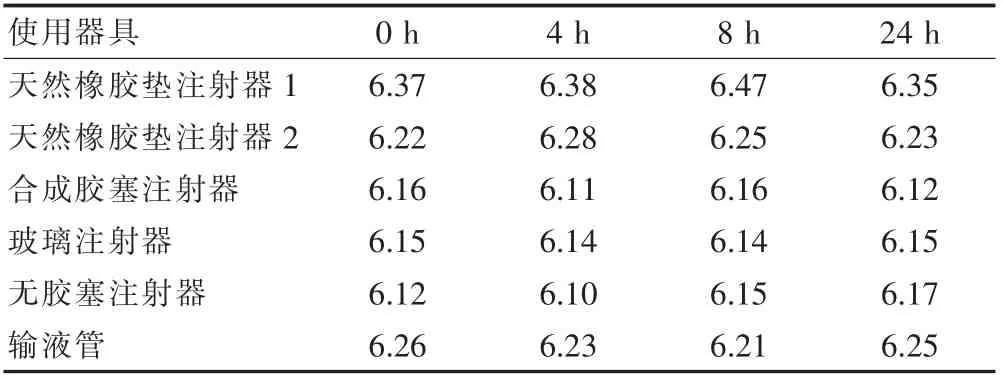
表5 盐酸右美托咪定注射液与给药器具的相容性测定pH 值结果
2.5.5 与给药器具的相容性测定含量结果 取本品2 ml用0.9%氯化钠注射液稀释至临床使用浓度(4 μg/ml),分别于各时间点从注射器中抽取2 ml 溶液依法测定其药液中主药的含量,结果见表6,数据显示采用天然橡胶垫的注射器对主药吸附明显,合成胶塞注射器同样存在吸附,采用玻璃材质注射器、无胶塞注射器、输液管对主药无吸附。
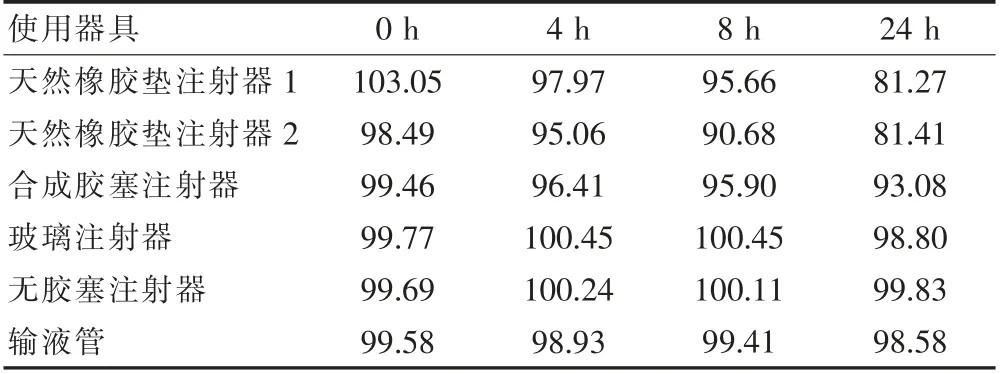
表6 盐酸右美托咪定注射液与给药器具的相容性含量测定结果(%)
3 讨论
本研究建立了盐酸右美托咪定注射液的含量测定方法,并通过对分析方法专属性、溶液稳定性、线性和范围、精密度、准确度、耐用性等试验,证明该方法回收率高,重现性好,耐用性好,能有效的测定盐酸右美托咪定的含量变化。
相关文献[10]报道了盐酸右美托咪定注射液的稳定性研究,有文献[16]报道了地佐辛注射液与盐酸右美托咪定注射液在室温下配伍的稳定性,未见关于盐酸右美托咪定注射液在用药器具中使用过程的稳定性报道。本研究通过对各种材质的注射器以及输液管模拟与盐酸右美托咪定注射液在使用过程中的相容性,主要以有效成分的含量进行了考察。结果显示盐酸右美托咪定注射液与全玻璃注射器、无胶塞注射器、输液管的相容性良好,而与天然橡胶的注射器相容性差,随着时间的延长,含量明显下降。
盐酸右美托咪定注射液药品说明书中提示某些橡胶活塞对其存在吸附性,但并没有说明吸附的程度。为避免由于用药器具对药物的吸附导致药物浓度不足而对治疗的影响,研究中考察了各种材质的用药器具对盐酸右美托咪定的吸附情况,临床使用者可以直观了解和掌握其具体吸附变化,从而保证临床用药剂量准确性,减少医院和患者造成损失,具有重要的临床意义和社会价值。

