芦笋AoAMS的表达及编码蛋白与AoTDF1间的互作分析
扶艳艳,成 钦,闻 豪,刘正杰,林 春,黄 玲,杨焕文,毛自朝
(1.云南农业大学 农学与生物技术学院,昆明 650201;2.云南农业大学 特色小宗作物研究中心,昆明 650201;3.四川省农业科学院 经济作物育种栽培研究所,成都 610300;4.云南农业大学 烟草学院,昆明 650201)
芦笋(AsparagusofficinalisL.)是一种具极高的营养和保健功能的蔬菜,享有“蔬菜之王”、“世界十大名菜之一”等美誉[1]。当前中国虽已成为世界第一大芦笋生产国和消费国[2],但优质的芦笋生产用种主要依靠进口,解除中国芦笋产业可持续发展的限制因素是培育有自主知识产权的优良品种[3-4]。芦笋是典型的雌雄异株植物,但其雄株因不结种子,营养消耗少,产品品质好,产量也比同期生长的雌株高出25%以上,且植株寿命长,抗性强,而受到广大种植者的青睐,为此培育优质全雄芦笋品种成为中国芦笋育种家们的奋斗目标[5-6]。全雄芦笋品种的培育可通过超雄株(MM)与雌株(mm)杂交获得,因此优质超雄株的获取便成为全雄品种培育的关键[7]。但又因芦笋两性株自交产生的超雄株存在自交衰退,而通过花药培养获得性状优良的超雄株的方式也十分困难,且当前认为植物性染色体起源及性别分化的机制是植物雌、雄配子发育相关基因的突变及随后同源重组修复抑制所导致的[8],因此通过对芦笋配子发育相关基因的功能研究,将实现获取超雄种质的分子育种新途径,同时也是解析芦笋性别分化及性染色体起源的有效方法之一。芦笋基因组测序组装后的基因预测及突变体研究发现,AoTDF1是芦笋雄株专一、且是Y染色体区的性别决定区域(MSY)的性别决定基因中的促雄基因[9-10]。但目前尚未有AoTDF1调控性别分化的分子机制及其下游调控靶基因的相关报道。笔者开展RNA原位杂交发现AoTDF1在芦笋雄花雄蕊发育的早期阶段表达水平高,而在雌花及雄花发育的晚期阶段表达量低[11 ],这与其同源的拟南芥TDF1基因的表达类似[12];故推测芦笋中与拟南芥AMS同源基因编码蛋白应与AoTDF1互作,共同参与芦笋花粉发育及性别分化的调控过程。
植物雄蕊花药是雄配子发育的场所,其花药壁由外至内由表皮层(epidermis)、内壁层(endothecium)、中层(middle layer)、绒毡层(tapetum)构成[13]。绒毡层作为花药壁最内层的特殊分泌细胞,通过给发育中的花粉提供营养、发送调控信号等在雄配子发育中发挥着关键作用[13-14]。目前,在拟南芥中已经克隆出与绒毡层发育相关的多个转录因子,并且确定了1条包含5种转录因子的调控绒毡层发育的调控通路(DYT1-TDF1-AMS-MS188-MS1)[15-16]。在这些关键调控因子的研究中,Sorensen等[17]发现ABORTEDMICROSPORES(AMS)是编码归属bHLH基因家族的MYC亚家族成员,调控绒毡层细胞发育及减数分裂后小孢子的发育。Xu等[18]和许杰等[19]以拟南芥ams突变体为材料系统地研究和分析了AMS基因在花药发育过程中的作用,结果发现:ams突变体在四分体(tetrad)后绒毡层细胞异常的膨大,不能完成细胞程序性死亡过程(Programmed Cell Death,PCD),最终导致花粉外壁发育异常。且AMS的功能发挥是通过特异识别其下游靶基因的启动子中E-box顺式元件,调控下游基因的表达[18-20]。Xu等[21]进一步研究发现AMS可调控孢粉素的生物合成以及花粉壁形成的前体物质的分泌。Ferguson等[22]研究发现AMS蛋白具双时期(biphasic)表达与调控特征,表现为AMS蛋白的含量在花粉发育早期的绒毡层和花粉发育晚期的花粉外壁呈双峰表达。目前在许多有花植物物种中已克隆鉴定了多个AMS的同源基因,其中水稻中OsTDR(TAPETUMDEGENERATIONRETARDATION)基因与拟南芥AMS同源,具相似的功能及表达模式[23-24]。刘辰[25]对辣椒同源基因CaAMS的功能分析表明,该基因沉默会导致植株部分花粉败育,CaAMS在发育早期的花药中表达。Sheng等[26]用甜瓜的雄性不育突变体ms-5为材料克隆了其AMS同源基因CsAMS。 Guo等[27]进一步发现辣椒CaAMS基因在绒毡层发育的四分体期和单核期强烈表达,且CaAMS表达下调会导致辣椒花丝缩短、皱缩、雄蕊不开裂,最终导致花粉败育。袁巧玲[28]发现洋葱的AcAMS定位于细胞核,且AcAMS基因具花药表达特异性。辛琪琪[29]从白桦树中克隆了BpAMS基因,亚细胞定位分析结果显示其编码蛋白定位在细胞核和细胞质中,qRT-PCR检测野生型白桦的各个组织,发现在白桦雄花中的表达量明显高于其他组织。这一系列研究预示AMS及其直系同源基因在物种演化中,其结构及功能都是相对保守的,因此推测芦笋中与拟南芥AMS同源的蛋白,应与芦笋AoTDF1互作,并且在芦笋绒毡层发育调控中发挥相似的分子功能。
本研究通过同源性及进化分析初步预测到4条芦笋的AMS同源基因,分别命名为AoAMS_L1、AoAMS_ L2、AoAMS_L3、AoAMS_L4。进一步利用转录组测序数据,对这4条候选基因进行表达量的分析,结果发现AoAMS_L1在芦笋超雄株及两性株的花蕾中表达量较高,而在雌株的花蕾以及两性株的根、茎中表达量极低或不表达,说明AoAMS_L1基因在超雄株和两性株的花蕾中专一地表达,故将AoAMS_L1基因作为首选基因进行进一步的研究。
紫芦笋‘紫色激情’是四倍体,为富含花青素的“水果型甜芦笋”,畅销于国内外。因四倍体紫芦笋的花蕾比普通二倍体芦笋花蕾大,加之本研究组多年的连续的筛选与培养获得了特殊的‘紫色激情’两性株材料,目前已通过该材料连续自交3代获得的两性株,雌株、雄株材料[30],用于芦笋花器官变异的识别及配子调控基因的原位表达分析。为此,笔者通过RT-PCR扩增‘紫色激情’中AoTDF1和AoAMS的全长编码序列(CDS),开展AoAMS亚细胞定位,与AoTDF1的互作,以及AoAMS基因在紫芦笋雌、雄以及两性株中早期花蕾发育阶段的花器官表达分析的研究。
1 材料与方法
1.1 材 料
1.1.1 植物材料 荷兰绿芦笋‘CIJNLIM’品种的双单倍体(DH,Double Haploid)雌株和超雄株的花蕾转录组数据来自NCBI(National Center for Biotechnology Information )网站SRA数据库(https://www.ncbi.nlm.nih.gov/sra/?term=SRR1642913)。本研究用的主要材料为3 a生‘紫色激情’(Purple passion)四倍体芦笋两性株自交后代的两性株、雌株、雄株,种植于云南农业大学后山农场基地(海拔1 886 m;经度102°75′;纬度25°13′)。
于芦笋开花期分别采集云南农大后山农场种植的紫芦笋‘紫色激情’品种两性株自交后代群体中的两性株和雌株的幼嫩根、嫩茎和花蕾,做好标记后迅速用液氮冷冻,随后保存在超低温-80 ℃冰箱用于转录组测序。云南农业大学特色小宗作物研究中心实验室培养的二倍体绿芦笋‘Italy’品种的雌株组培苗用于蛋白亚细胞定位分析。采集云南农大后山农场种植的紫芦笋‘紫色激情’品种两性株自交后代群体中的雌、雄和两性株早期花发育(T1~T3时期)的花蕾(其中T1:花蕾长度<1 mm,处于无雌雄发育差异的两性阶段;T2:1 mm≤花蕾长度<2 mm,处于性别发育的早期;T3:2 mm≤花蕾长度<3 mm,处于性别发育的晚期阶段),每个时期大约采 20 个花蕾放入新鲜配制的 FAA 固定液(每100 mL含 50%乙醇90 mL、冰醋酸5 mL、40%甲醛5 mL、甘油5 mL)中进行固定,随后放入4 ℃冰箱保存,用于组织RNA原位杂交试验。
1.1.2 菌株、载体及本研究中所用引物 菌株:大肠杆菌菌株(E.coli)DH5 α、农杆菌EHA105为本实验室保存;酵母菌株Y2H gold由中国科学院热带植物资源可持续利用重点实验室提供。
载体:植物瞬时表达载体pBI121-eGFP为本实验保存,酵母双杂交载体pGBKT7和pGADT7由中国科学院热带植物资源可持续利用重点实验室胡彦如博士提供,酵母双杂交阴性、阳性对照载体由广州大学分子遗传与进化创新研究中心陈丽玉博士赠送。
所有引物均用DNAMAN软件设计,并由生工生物工程(上海)股份有限公司合成。引物详细信息见表1。

表1 PCR引物Table 1 PCR primers
1.2 方 法
1.2.1AoAMS基因的筛选与分析 从phytozome 数据库网站(https://phytozome.jgi.doe.gov/pz/portal.html)获取芦笋基因组注释的蛋白序列,与NCBI(https://www.ncbi.nih.gov)下载的AMS蛋白序列(NP_179283.2),进行blastp比对,并设置E-value <0.000 001,筛选同源性大于40%,且氨基酸长度大于100的AoAMS氨基酸序列作为候选基因。用同样的方法得到了与芦笋同属物种文竹、大理天门冬以及茄科的马铃薯和番茄的AMS基因的氨基酸序列。用RaXML[31]软件将所获得的AMS同源候选基因的氨基酸序列与部分已鉴定基因功能的AMS基因的氨基酸序列以及文竹、大理天门冬、番茄、马铃薯的序列进行极大似然估计法(Maximum Likelihood Estimate,MLE)聚类构建系统发育树。
基因表达量的分析用的是笔者实验室开展的18个‘紫色激情’和6个荷兰‘GIJNLIM’品种芦笋样本的RNA测序数据(‘紫色激情’RNA测序数据数据未发表),分别经fastqc和fastp 质控和数据清洗后[32],得到Clean date;再利用hisat2[33]比对到参考基因组中获得短序列比对图谱(SAM)文件,最后用R中的Rsubread包(https://bioconductor.org/packages/ Rsubread/)提取单个样本中基因的表达量,并进行AMS候选基因表达量(Transcript Per Million Mapped Fragments,TPM)的统计分析。
1.2.2 亚细胞定位 利用在线程序(WoLF PSORT http://www.wolfpsort.org/)预测AoAMS编码蛋白的亚细胞定位。进一步利用限制性内切酶XhoI和SpeI双酶切pBI121-eGFP载体,获得线性化载体,分别设计含SalI和XbaI的AoAMS:eGFP-F和AoAMS:eGFP-R引物 ,其中AoAMS:eGFP-R反向引物删除终止密码子并加上1个编码短肽“GlyGlyGlyAla”的linker: GGG GGA GGG GCA(见表1,黑体部分显示的是linker的反向互补序列)PCR扩增目标片段,扩增产物经SalI和XbaI双酶切后,插入pBI121-eGFP载体XhoI和SpeI酶切位点的位置,随后转入DH5a感受态细胞中,挑取阳性克隆进行菌液PCR以及酶切验证,验证正确后命名为pBI121-35S:: AoAMS -eGFP。 将pBI121-AoAMS:eGFP与空载pBI121-eGFP分别转化到农杆菌 EHA105 感受态细胞中,然后利用农杆菌侵染法侵染芦笋‘Italy’品种雌株无菌苗的幼嫩茎段,具体实验操作参考张园博士的芦笋遗传转化方法[34],同时设空载质粒pBI121-eGFP 为阴性对照。侵染完成后,将侵染后的芦笋茎段平铺在MS共培养基(MS + 1.0 mg/L NAA + 1.0 mg/L 6-BA + 2.0 mg/L 2,4-D +蔗糖 3% + 琼脂粉0.6% + 200 mg/L Carb + 150 μmol/L AS)上于 19 ℃黑暗共培养 3 d后,使用激光共聚焦显微镜(OLYMP FV 1000)观察荧光蛋白信号的产生。
1.2.3AoAMS在芦笋雌、雄两性花中的原位杂交检测 紫芦笋雌、雄及两性株T1~T3时期的花蕾样品均用FAA固定液(每100 mL FAA固定液包含:50%乙醇90 mL、冰醋酸5 mL、40%甲醛5 mL、甘油5 mL)固定后,经梯度酒精(50%、60%、70%、80%、90%、100%)每次20 min脱水,用透明溶液(1∶1无水乙醇/二甲苯混合液,二甲苯,二甲苯)各自浸泡30 min,之后换纯蜡酸浸泡2次,每次2 h,完成透明;透明材料包埋后切片,切片厚度约15~20 μm。选择AoAMS序列中特异性高的区域,设计探针引物(见表1:AoAMS-ISH-F/AoAMS-ISH-R)。用德国Roche公司的DIG RNA Labeling Kit (SP6/T7)试剂盒,并按照说明书的步骤进行探针标记和组织原位杂交。
1.2.4 酵母双杂交互作分析 设计AoTDF1和AoAMS基因编码区的5′和3′引物:AoTDF1-Y2H-F/AoTDF-Y2H-R、AoAMS-Y2H-F/AoAMS-Y2H-R,引物序列见表1。通过PCR扩增分别在AoTDF1和AoAMS的CDS的5′端和3′端引入EcoRI和BamHI酶切位点后,用EcoRI和BamHI双酶切,并插入pGBKT7和pGADT7相同的酶切位点处,而分别获得AoTDF1-BD、AoAMS-BD与AoTDF1-AD、AoAMS-AD表达载体。Y2H gold酵母感受态的制备及转化参照北京酷莱博Coolaber科技有限公司酵母感受态制备与转化试剂盒(Super Yeast Transformation Kit)说明书。同时转化阳性对照(53-BD与T-AD)和阴性对照(Lam-BD与T-AD、BD与AD)。把共转化的酵母悬浮细胞涂布到二缺培养基(SD/-Leu/-Trp,百思禾Bestplant产品,南京)上,30 ℃培养2~4 d。待SD/-Leu/-Trp培养基上长出单菌落后,选取生长较好的酵母单克隆于加装有 100 μL 无菌水的 EP 管中混匀,吸取 10 μL 置于四缺培养基(SD/-Leu/-Trp/ Ade/-His,百思禾Bestplant产品,南京)上,30 ℃继续培养 2~3 d 后观察酵母生长情况以确定蛋白间的互作。
2 结果与分析
2.1 芦笋AoAMS基因的筛选与分析
NCBI 上下载的AMS蛋白序列进行Blastp比对,在芦笋中筛选出4条同源性最高的AoAMS蛋白序列后,分别命名为AoAMS_L1、 AoAMS_L2、 AoAMS_L3、AoAMS_L4。利用RaXML软件(https://github.com /stamatak/standard-RAxML/)将4条AoAMS候选基因的氨基酸序列与部分已鉴定基因功能的AMS基因的氨基酸序列、以及文竹、大理天门冬、番茄、马铃薯的序列进行极大似然估计法(Maximum Likelihood Estimate,MLE)聚类构建系统发育树。结果显示:AoAMS_L3与AoAMS_L4独立的聚为一支,与已鉴定功能的其他物种的同源序列亲缘关系较远;AoAMS_L1与同属的文竹(AsparagussetaceusJessop)以及大理天门冬(Asparagustalinensis)中的同源序列聚为一支,且与已确定基因功能的单子叶植物中的水稻(OryzasativaL.)、洋葱(AlliumcepaL.)的同源序列关系相对较近。而 AoAMS_L2则与双子叶植物中的辣椒(CapsicumannuumL.)、大麻(CannabissativaL.)、马铃薯(SolanumtubersumL.)中的同源序列亲缘关系相对较近(图1-A)。为进一步确定芦笋中AMS的候选同源基因,分析了4个AoAMS候选基因在荷兰‘CIJNLIM’芦笋品种双单倍体雌株和超雄株以及‘紫色激情’(‘Purple passion’)芦笋品种两性株自交后代的两性株(A)和雌株(F)中不同器官组织的表达变化。结果发现: AoAMS_L1在荷兰芦笋品种‘CIJNLIM’的双单倍体(DH)的超雄(SM)花蕾、以及芦笋‘紫色激情’品种(P)两性株(A)的花蕾中表达量较高,但在双单倍体(DH) 雌株和紫芦笋雌株的花蕾(F)、以及不同性别紫芦笋的根和茎中表达量均较低;AoAMS_L2在所有检测的组织和器官中表达均低; AoAMS_L3除在芦笋的茎,雌株的花蕾中有一定的表达外,在其他器官组织中表达较低或无表达;AoAMS_L4除在根中表达较低外,在所有组织中均有较高表达(图1-B)。因AoAMS_L1是唯一的在雄性和两性株花蕾中专一表达的AMS同源基因,另进化树分析它与已鉴定功能的其他物种的AMS基因亲缘关系最近(图1-A),故将定位于7号连锁群的AoAMS_L1(AsparagusV1_07.2467)命名为AoAMS,并进行蛋白的亚细胞定位、与AoTDF1的互作以及在花早期发育时期花蕾中不同器官的表达分析。
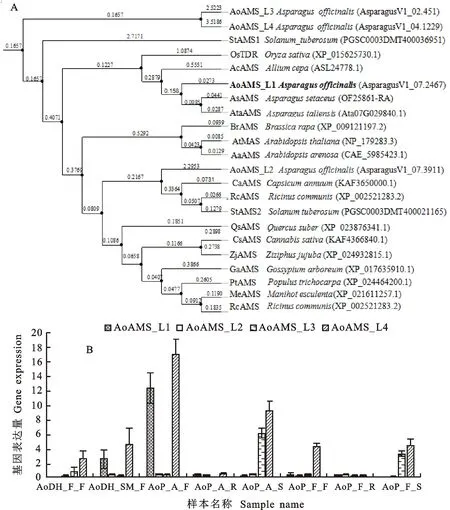
图B中AoDH_F_F 是荷兰芦笋GIJNLIM品种 双单倍体雌株花蕾;AoDH_SM_F是荷兰芦笋CIJNLIM品种 双单倍体超雄花蕾;AoP_A_F 是‘紫色激情’品种两性株的花蕾;AoP_A_R是‘紫色激情’品种两性株的根;AoP_A_S是‘紫色激情’品种两性株的茎;AoP_F_F 是‘紫色激情’品种雌株的花蕾;AoP_F_R是‘紫色激情’品种雌株的根;AoP_F_S是‘紫色激情’品种雌株的茎
2.2 AoAMS蛋白亚细胞定位分析
以AoAMS蛋白序列在WoLF PSORT网站(https://wolfpsort.hgc.jp/)进行亚细胞定位预测,结果显示该蛋白可能定位于细胞核。通过农杆菌(EHA105)介导法分别将pBI121-GFP与重组pBI121-35s::AoAMS-GFP植物表达载体(图2-A)导入二倍体绿芦笋‘Italy’品种雌株组培苗的幼嫩茎段细胞中进行瞬时表达,于共焦距荧光显微镜下观察绿色荧光蛋白( Green Fluorescent Protein ,GFP)与融合蛋白AoAMS-GFP的定位情况(图2-B~2-G)。结果显示:对照空载体GFP的荧光信号在细胞核、细胞膜、细胞质中均能检测到,而AoAMS-GFP融合蛋白的绿色荧光信号主要集中发生在细胞核中,证实了AoAMS蛋白定位与预测结果相一致,且该结果与AoAMS作为转录因子的定位特征相一致。
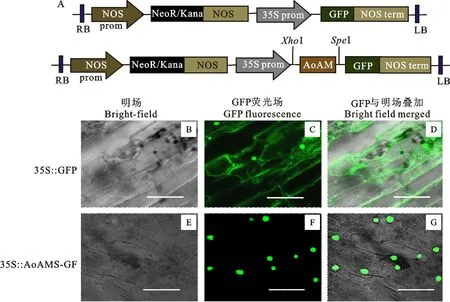
Bright-field:明场;GFP:绿色荧光信号;Merge:叠加图像,Bar=20 μm
2.3 AoTDF1与AoAMS蛋白的互作分析
AoTDF1和AoAMS的CDS 通过PCR扩增后,经EcoRI和BamHI双酶切后,分别连接到酵母表达载体pGBKT7、pGADT7 的相同酶切位点上,经酶切鉴定确定连接正确后,将这些重组载体进行测序分析,确定AoTDF1和AoAMS在构建过程中未发生突变,此时说明已成功构建了酵母醇脱氢酶(Alcohol Dehydrogenase,ADH1)启动子启动AoTDF1-BD,AoTDF1-AD、AoAMS-BD和AoAMS-AD融合表达的载体(图3-A)。试验组和对照组质粒分别转入Y2H Gold酵母感受态细胞中,2~3 d后观察发现:所有对照组及试验组的酵母菌落在二缺培养基(SD/-Leu/-Trp)上都能正常生长,表明转化成功。进一步通过观察四缺培养基(SD/-Leu/-Trp/-Ade/-His)上试验组与对照组的酵母菌落生长情况判断AoTDF1是否与AoAMS直接互作(图3-B)。结果是共同转化阴性对照组Lam-BD与T-AD、BD与AD、AoTDF1-BD与AD、AoAMS-BD与AD质粒的酵母菌落在四缺培养基上不能生长;而共同转化AoTDF1-BD与AoTDF1-AD、AoTDF1-BD与AoAMS-AD、AoAMS-BD与AoAMS-AD、AoAMS-BD与AoTDF1-AD质粒的菌落,与共同转化阳性对照53-BD/T-AD质粒的菌落在四缺培养基上均能正常生长,但转化AoTDF1-BD与AoTDF1-AD、AoAMS-BD与AoAMS-AD质粒的酵母菌落要比转化AoTDF1-BD与AoAMS-AD、AoAMS-BD与AoTDF1-AD质粒的酵母菌落相对较小。结果表明:在酵母中AoTDF1与AoAMS存在互作,且AoTDF1、AoAMS蛋白能够自激活形成同源二聚体,预示AoTDF1、AoAMS可能是以不同亚基组合形式形成复合物来调控花药绒毡层及花粉的发育。
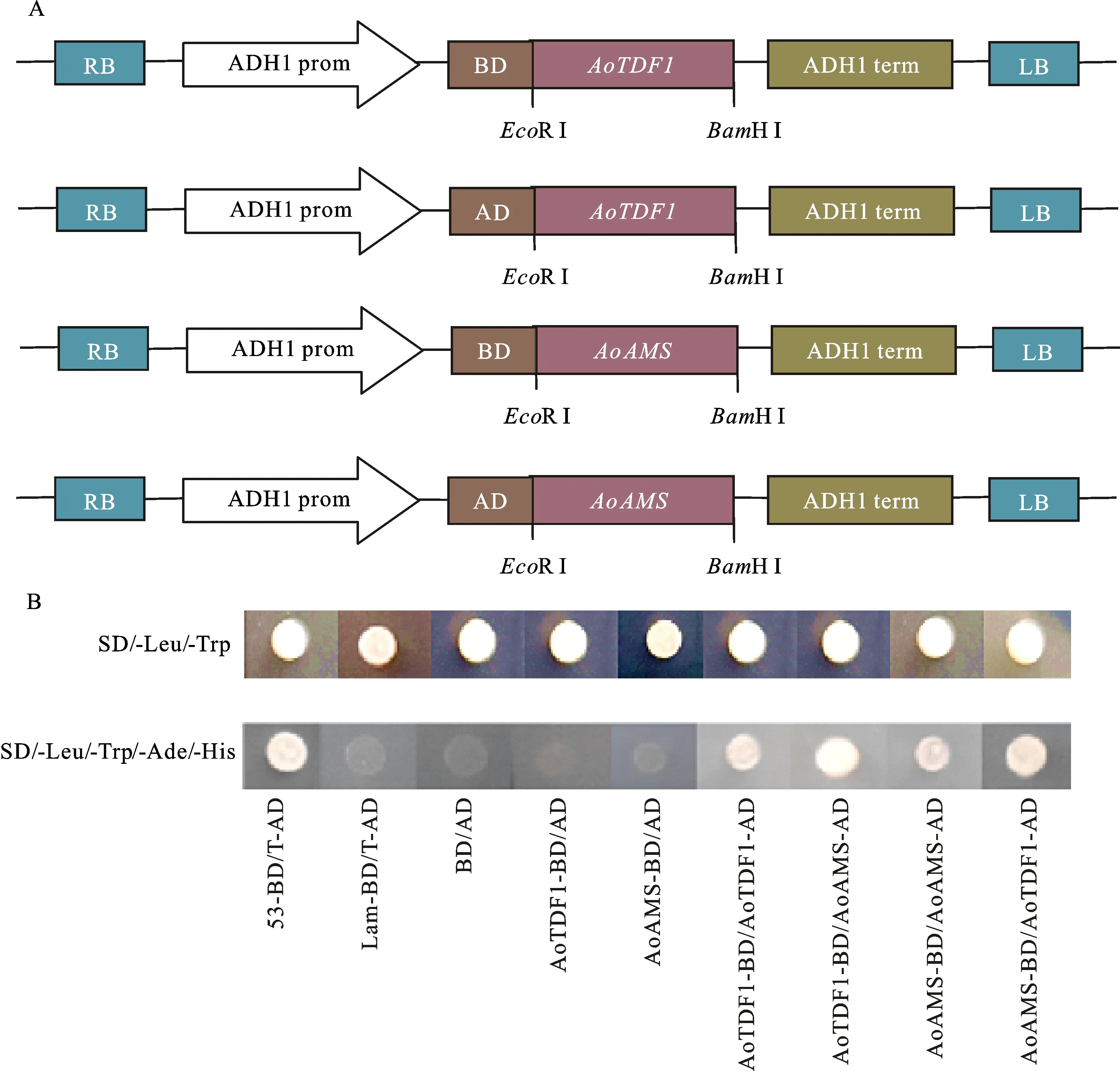
图3 AoTDF1与AoAMS表达载体构建(A)以及互作验证(B)Fig.3 Construction of expression vector of AoAMS and AoTDF1(A)and interaction validation(B)
2.4 芦笋AoAMS基因在芦笋花发育早期阶段的花器官中的表达
通过转录组测序数据分析,确定AoAMS主要在芦笋雄株和两性株的花蕾中表达(图1-B),但尚不知其在花蕾不同发育时期的花器官定位表达情况,而组织RNA原位杂交分析,将获得AoAMS基因在芦笋不同性别花发育的前3个时期的空间表达情况。试验结果显示:AoAMS基因在紫芦笋雄花发育的T1期(无性别分化期)的绒毡层和花粉中表达较低,但花被中表达较强(紫色深浅代表表达量的高低, 图4-A),T2期(性别分化早期,图4-B)的绒毡层、花粉以及花冠中均有较高表达,而到了T3期(性别分化晚期)AoAMS在花药绒毡层中高效表达,但花被表达量下降(图4-C);而在T1、T2、T3期的雌花中检测不到明显的表达信号 (图4-G~4-I)。两性花蕾的原位RNA杂交分析发现:AoAMS在T1、T2期及T3期的花粉、绒毡层中均有高的表达信号(图4-M~4-O),但表达量T1>T2>T3期,但有趣的是在雄花衰退的雌蕊和两性花正常发育的雌蕊中,也能检测到AoAMS的表达信号(图4-B、 4-C 、4-N、 4-O)。相应的sense-探针作为对照组的试验中(图4-D~4-F,4-J~4-L,4-P~4-R)均未检测到杂交信号。以上结果说明AoAMS是雄配子正常发育所必须的,但与拟南芥AMS的表达相比,AoAMS基因在正常花粉发育的雄花与两性花的雄蕊的花粉绒毡层中表达,但不具有拟南芥AMS花粉绒毡层专一性表达特征,在雄花和两性花花被,甚至在两性花正常或雄花退化发育的雌蕊中均有不同程度的表达。
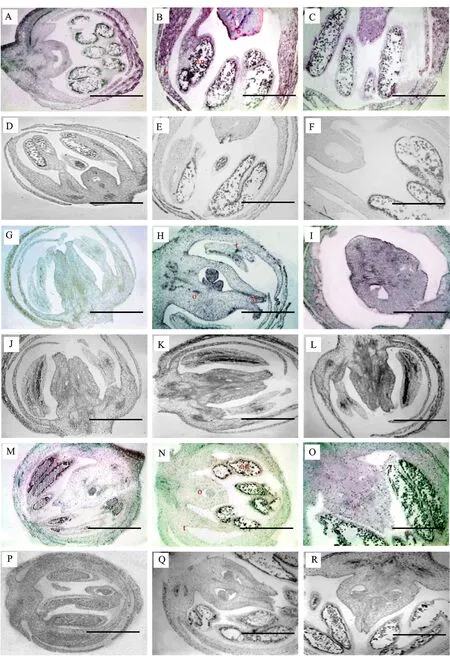
A~C:雄花发育T1~T3时期;D~F:雄花加顺式(Sence)探针对照;G~I:雌花发育T1~T3时期;J~L:雌花加顺式(Sence)探针对照;M~O:两性花发育T1~T3 时期;P~R:两性花加顺式(Sence)探针对照。bar=500 μm
3 讨论与结论
植物避免自交衰退、保持遗传新组合以适应环境变化的有效机制之一是性别分化。被子植物中有约160科的15 000个物种具有性别分化的现象,且发现这些物种的性别分化大约要经超过800余次的性别分化与性染色体独立起源[8,35]。在两性花植物分化为两性株的过程中通常认为有雄性两性花(androdioecy)和雌性两性花(gynodioecy)的途径,其中雄性两性花途径是物种群体中雌配子发育相关基因的失活导致雄株和两性株共存,而雌性两性花途径是雄配子发育相关基因的突变导致雌株与两性株共存。因雌性两性花(gynodioecy)的途径能较好地形成后代,与雄性两性花途径相比是主流的性别分化途径。芦笋作为典型的性别分化及性染色体起源较早的植株,是研究性别分化机制的优良材料[10,36]。
Daisuke等通过芦笋基因组PCR分析,发现与拟南芥TDF1同源的AoMYB35/AoTDF1基因定位于芦笋雄性专一Y染色体区(Male-specific region of the Y chromosome,MYS)仅在雄株中表达,Harkess等[10]2020年确定AoMYB35/AoTDF1是两个性别决定基因之一的促雄发育基因,并且该基因在芦笋雄花花粉及绒毡层中专一表达。预示芦笋染色体起源及两性分化应为雌性两性株转化(gynodioecy)途径,因花粉发育关键基因AoTDF1的功能失活导致花粉败育而形成雌株。为证实上述推测,需阐明AoTDF1是否参与花药绒毡测发育的调控,及其是否与芦笋AoAMS互作调控花粉及绒毡层的发育等。本研究首次通过同源比对,系统进化树以及转录组测序后基因表达量的综合分析,最终确定AoAMS_L1基因为芦笋雄花或两性花专一表达的AoAMS的候选基因(图1),进行亚细胞定位分析, 确定CaMV 35S 启动子驱动AoAMS与GFP融合蛋白(AoAMS-GFP)后的荧光主要来源于细胞核(图2-E~2-G),而CaMV 35S 驱动GFP自身表达后没有亚细胞专一性定位特征(图2-B~2-D),确定AoAMS是一个核定位特征蛋白。项目组前期用双分子荧光互补分析(Bimolecular Fluorescence Complementation,BIFC)初步确定AoTDF1与AoAMS_L1有互作[11],本研究进一步用酵母双杂交方法获得与BIFC方法相一致的AoTDF1与AoAMS互作,且AoTDF1和AoAMS自身也能互作的结果(图3-B)。
AoAMS的拟南芥同源基因AtAMS在绒毡层发育和小孢子减数分裂后期发育及花粉壁的形成中起到关键的作用[18,21]。许杰等[19]通过基因表达谱芯片技术研究发现拟南芥AMS在减数分裂前表达量很低,但在减数分裂后表达量上升;为探究芦笋AoAMS基因在不同性别花中的表达情况,经RNA原位杂交检测,得知AoAMS基因是在芦笋雄花发育的T2时期、T3时期的花粉、绒毡层中高效表达,而在T1时期(小孢子母细胞减数分裂期)表达较弱(图4-A~4-C)。两性花的AoAMS基因在花药绒毡层,T1时期有较强的杂交信号,T2时期、T3时期信号较弱(图4-M~4-O)。AoAMS基因在雌花发育早期的3个时期(T1时期、T2时期、T3时期)均无表达(图4-G~4-I)。说明AoAMS确实是在雄花和两性花的绒毡层中表达,但不具花药绒毡层专一表达特性,说明AoAMS与AtAMS具相似功能,与AoTDF1一起调控花粉的发育,但长时间的物种演化形成了新AMS基因序列的变异或其非花药绒毡抑制表达基因的失活而产生的表达模式或新的分子功能。值得注意的是雄花早期发育的花被中AoAMS的表达明显高于两性花,说明雌性的正常发育可能会抑制AoAMS基因在花被中的表达,但其调控机制还有待进一步的研究。拟南芥TDF1与AMS的互作复合物是花粉发育调控所必需的,且AtTDF1可直接通过与AtAMS启动子AACCT顺式元件结合而调控AMS及其下游调控通路如AtMYB103基因的表达[37]。为此进一步的工作将可参考拟南芥和水稻中花粉发育的遗传调控通路,寻找AoAMS的下游调控基因,以及除AoTDF1外的互作蛋白及调控靶蛋白,进一步阐明AoAMS基因在芦笋绒毡层发育调控通路中的分子功能。
AoAMS在芦笋中与拟南芥AtAMS同源,其编码蛋白定位于细胞核,与芦笋性别决定促雄基因编码蛋白AoTDF1有互作,在芦笋早期发育的雄花和两性花,而非雌花中表达的基因。预示AoAMS基因在芦笋中发挥与拟南芥AMS相似的功能,其表达受AoTDF1的调控,与AoTDF1形成互作调控复合物,通过调控芦笋花粉绒毡层和花粉发育相关基因的表达,在性别分化中发挥促雄的功能。

