液相色谱—串联质谱法测定茶叶中丙硫多菌灵的残留量
杨 森
(毕节职业技术学院,贵州 毕节 551700)
丙硫多菌灵属于苯并咪唑类农药,是1975年由美国史克制药公司研制成功的一种苯并咪唑类驱虫药[1]。目前该药在茶树上用于防治茶树茶枝梢黑点病和茶饼病以及残留检测均未见相关报道。在残留检测方面,该药在动物肌肉组织中的MRL值规定为0.1mg/kg[2]。
茶叶是世界上消费最为普遍的饮用产品,国内外对茶叶的需求量日益增长,随之对质量安全也越来越严[3]。在茶叶的生产过程中,需要对残留量进行检测,最大能力满足无公害的标准[4],无公害茶有绿色茶、有机茶等[5]。但由于近年来受温度等影响病虫害加重,在防治措施上缺乏科学合理的使用农药,盲目追求产量而大量使用农药损害人类健康,目前对于该类农药的的检测方法有高效液相色谱法[6-8]、液相-色谱分析法[9-10]、免疫分析法[11-12]、LC-MS/MS检测法等[13]。目前该药于农作物只有在烟草、水稻和香蕉上见过相关研究[14-16],在茶叶中的检测分析尚未见报道。本研究在贵州省毕节市自行田间试验的基础上动态观察茶叶的各个生长周期,采用不同比例兑水施药最终得出防治茶叶的关键施药时间、稀释倍数、施药次数以及安全采收期,对最终采收(明前茶即一叶一芽)的茶叶进行残留量检测,为茶叶的常见病害防治技术和残留检测提供参考方法。
1 材料与方法
1.1 仪器与试剂 仪器:Waters ACQUITY UPLC (美国Waters公司);色谱柱: C18(2.1×50 mm,1.7μm);高效液相色谱仪:(LC-20ADXR型);质谱仪(4000QTRAP型);旋转蒸发仪(RE-3000A型);涡旋混合器(VORTEX4);氮吹仪(CM-24S型)。
试剂:甲醇、乙酸乙酯、丙酮、石油醚、二氯甲烷,超纯水,氯化钠,硅藻土,无水硫酸钠,丙硫多菌灵标准品 (纯度97.6%)。
1.2 色谱实验条件
1.2.1 液质联用仪的仪器参数 电喷雾离子源,ESI+扫描模式,离子喷雾电压5600V,离子源温度560°C,辅助气压1(N2) 365.8kPa,辅助气压2(N2) 365.8kPa,气帘气压力202.5kPa。多重反应监测(MRM)方式及具体参数(表1)。

表1 多重反应监测 (MRM)数据表
1.2.2 液相色谱的仪器参数 色谱柱:C18(2.1×50mm,1.7μm);柱温为25℃,进样量是2.0μL,流速为0.5mL/min。液相色谱梯度洗脱条件(表2)。保留时间为5.0min。

表2 液相色谱梯度洗脱条件
1.3 分析方法的建立
1.3.1 仪器的选择 丙硫多菌灵对热不稳定,因此不适用气相色谱直接分析,该药物在Aglient1100高效液相色谱仪(DAD)上有响应,但是灵敏度较低,样品分析时间过长,达不到实验要求;而在Waters Acuuity UPLC H-Class 超高效液相色谱仪(PDA)具有较高的响应,峰形好。最后采用高效液相色谱仪串联质谱仪(LC-MS/MS)探索色谱条件。
1.3.2 质谱条件的选择 采用流动注射质量浓度为0.20μg/mL的单标工作液对丙硫多菌灵的参数进行优化。对离子源温度、离子喷雾电压、碰撞能量等条件进行优化。通过Q1 MS扫描得到分子离子峰,再优化锥孔电压的数值,并得到定量和辅助定性离子,再在Product Ion模式下优化碰撞能量,然后用优化得到的质谱条件进行MRM监测。经过反复测试并优化,最终得出丙硫多菌灵杀菌剂的优化质谱条件。
1.3.3 最适色谱柱和最大吸收波长的选择 本方法在超高效液相色谱中,选用了C18(2.1×50 mm,1.7μm)色谱柱峰形好,运用全波长扫描观察得知,在波长为254nm的时候,响应高,无其他基质的影响,峰形对称呈正态分布;在高效液相色谱-串联质谱中,选用C18(2.1×50 mm,1.7μm)色谱柱不仅响应高、峰形好,还能够将分析物与杂质进行有效的分离。
1.3.4 最佳流动相组成、比例及流速的选择 分别试验了不同比例的甲醇-水、甲醇-水(0.5%冰醋酸)作为流动相进行色谱分离对比。以甲醇-水作为流动相,色谱峰拖尾且峰宽矮胖;以甲醇-水(0.5%冰醋酸)作为流动相体系,发现选用甲醇-甲醇-水(0.5%冰醋酸)作为流动相采用梯度洗脱,流动相流速为0.3mL/min,灵敏度高,峰形对称,色谱峰既不前沿也不拖尾,达到理想色谱分离效果。
1.3.5 提取剂的选择 土壤和茶叶样品中分别使用不同提取溶剂:石油醚、乙酸乙酯、二氯甲烷和甲醇,不同提取溶剂的提取结果(表3),可知二氯甲烷的提取效果最佳。
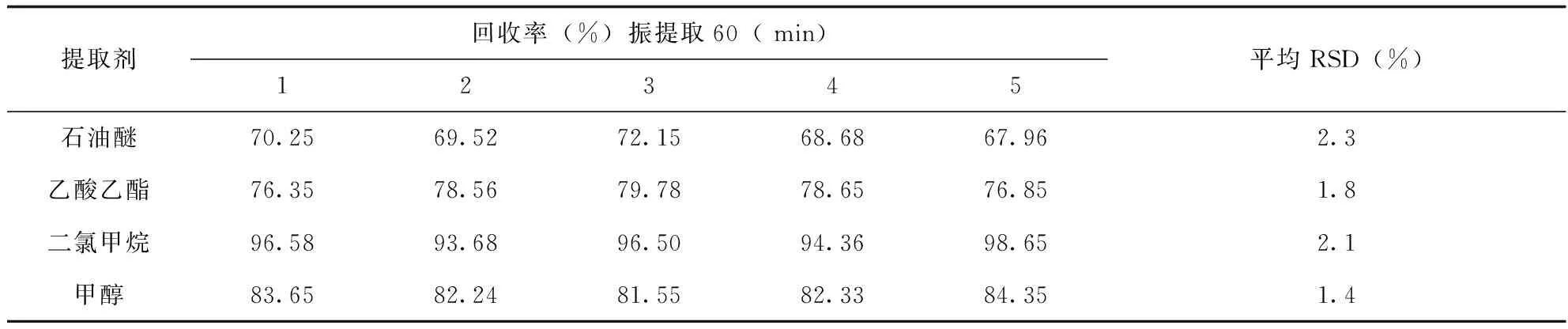
表3 茶叶样品在不同提取剂下的回收率(n=5)
1.4 分析方法
1.4.1 样品的提取 土壤提取:称取10.0g土壤样品置于100mL锥形瓶中,加入40mL二氯甲烷,振荡提取30min后在铺有Celite545的砂芯漏斗中抽滤,在45℃下旋蒸浓缩近干后用氮气吹干,最后用1mL甲醇定容,待超高效液相色谱检测。
茶叶提取:称取5.0g茶叶样品置于100mL锥形瓶中,然后加入50mL二氯甲烷,涡旋振荡3min后在铺有Celite545的砂芯漏斗中抽滤,在45℃下旋蒸浓缩,氮气吹干,待净化。
1.4.2 样品的净化 茶叶样品净化:向梨形瓶中加入0.2g C18和0.15g PSA用1mL甲醇定容,涡旋2min,经0.22μm滤膜过滤,待超高效液相色谱检测。
在上述色谱条件下,对丙硫多菌灵标准溶液、空白、土壤添加和茶叶添加进行上机检测,获得如下(图1)所示的色谱图。
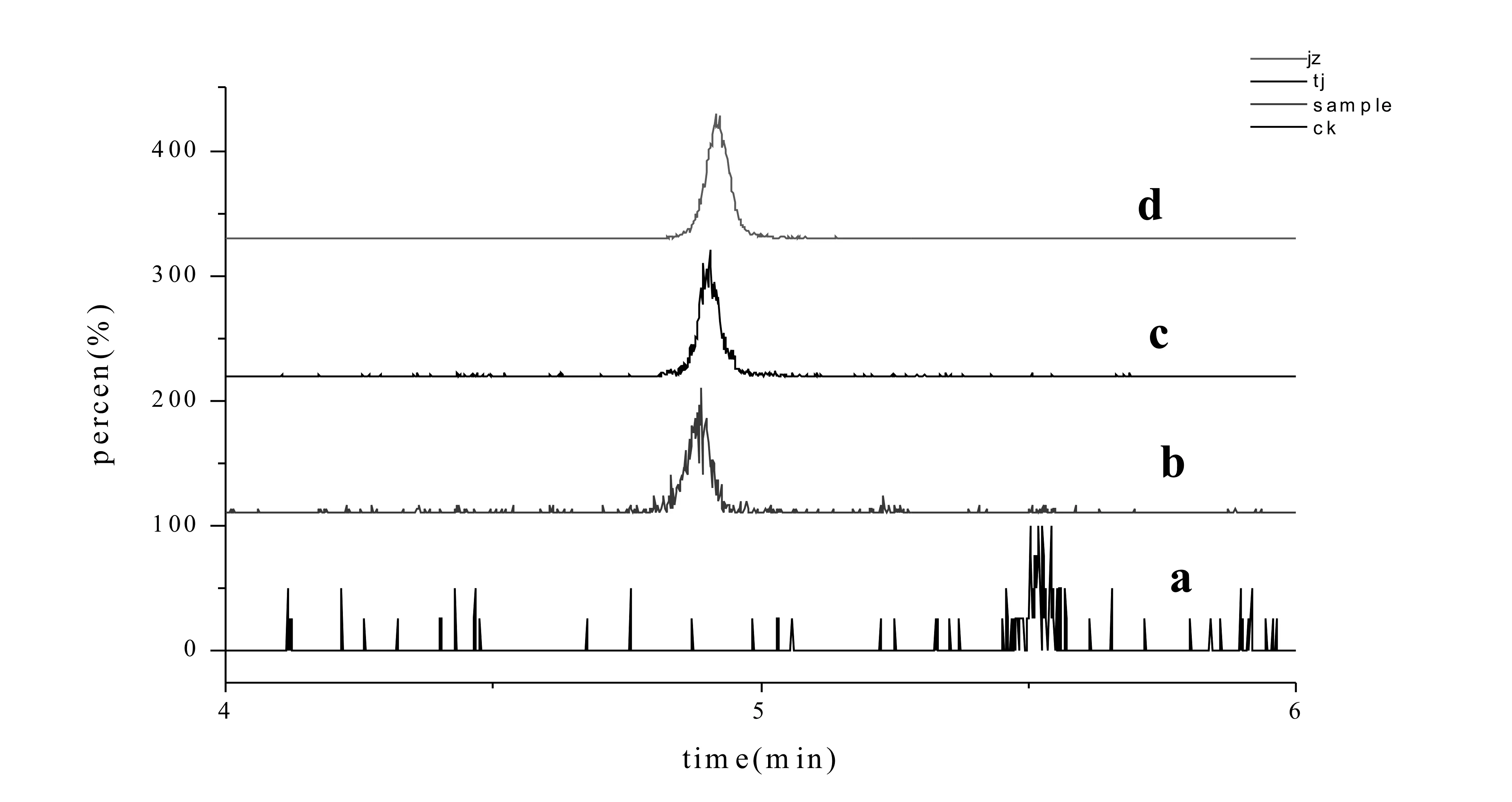
图1 丙硫多菌灵检测型色谱图(a:空白; b: 土壤添加; c: 茶叶添加0.05 mg/kg; d: 标准样品0.05 mg/kg)
1.4.3 标准曲线绘制 将已配制的质量浓度为30.0mg/L的母液依次稀释成质量浓度为0.03、0.30、1.50、7.50、15.00μg/mL 5个浓度的标准溶液,在上述色谱条件下进行测定。以浓度x为横坐标,峰面积y为纵坐标,绘制标准曲线。得线性方程y=24 670x-95.026y=30.12x-9.052,相关系数r=0.999 9,丙硫多菌灵在0.03~15.00mg/L 范围内线性关系良好。
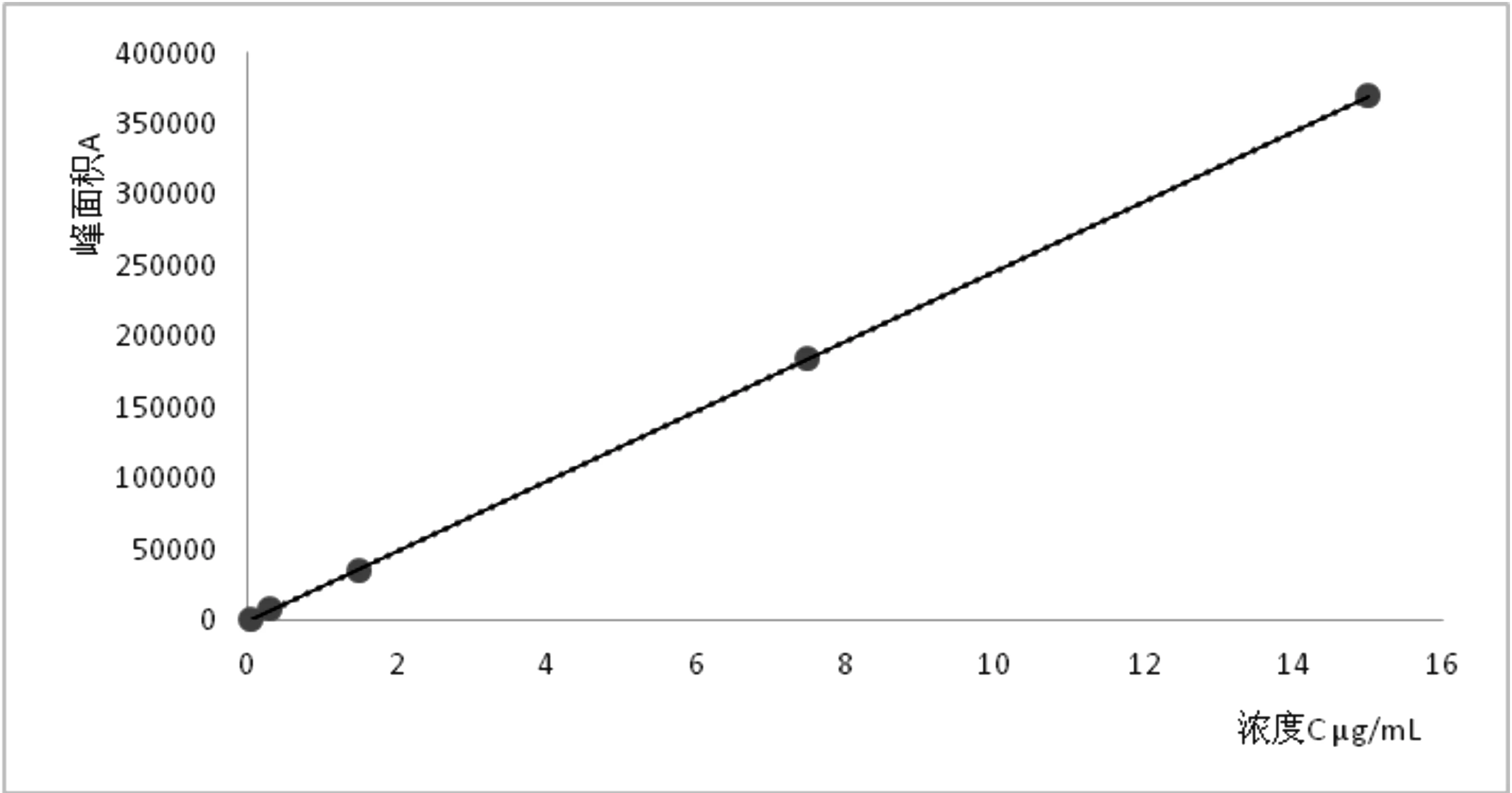
图2 丙硫多菌灵标准曲线图
1.5 田间试验 田间试验按如下方法设计:每个小区的面积为30m2,各处理设3个重复,小区间设保护行,同时设空白对照区。施药方法按试验设计施用剂量稀释药液。用10%丙硫多菌灵悬浮剂于茶叶在清明节前60d进行第1次施药,第2次喷药于第1次喷药后14d施药,第3次喷药于第2次喷药后14d施药。待清明节前21d随机采集一叶一芽鲜叶100g样品待测。
2 结果与分析
2.1 方法的回收率、精密度和定量限 丙硫多菌灵在超高效液相条件下的保留时间在8.2 min左右,最小检出量为6×10-11g,最低检出质量浓度为0.01mg/kg。丙硫多菌灵在液相色谱-串联质谱条件下的保留时间在5.0min左右,最小检出量为5.0×10-14g,最低检出质量浓度为0.005mg/kg。
准确度以平均值表示,土壤中添加试验浓度分别为0.03、0.15、3.0mg/kg 3档,茶叶中添加试验浓度分别为0.03、0.15、3.0mg/kg 3档。
由表4可知:按上述实验条件,同一色谱条件下,进行添加回收实验,土壤和茶叶样品添加水平为0.03~3.0mg/kg时,平均回收率分别为78.9%~84.5%,81.7%~87.1%,相对标准偏差 (RSD)分别为4.6%~8.2%,7.1%~8.3%,方法的定量限(LOQ)为0.03mg/kg,回收率和精密度良好,达到农药残留检测的要求。
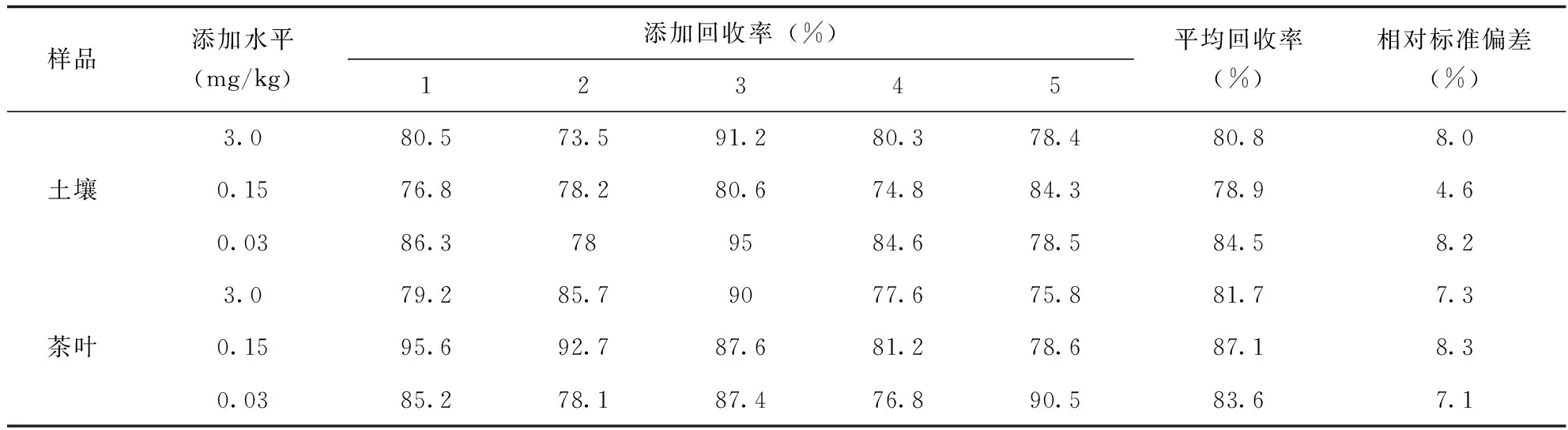
表4 丙硫多菌灵在土壤和茶叶中的添加回收率 (n=5)
3 结论
目前,我国没有规定丙硫多菌灵在茶叶中的残留限量 (MRL)值,本试验属于首次运用LC-MS/MS方法检测其残留量,方法的定量限(LOQ)为0.03mg/kg,在茶叶中进行添加回收试验,添加浓度为0.03mg/kg、0.15mg/kg、3.0mg/kg,测得其添加回收率为73.5%~95.6%,相对标准偏差为4.6%~8.3%。运用该方法操作简单、定量准确,可有效适用于茶叶中丙硫多菌灵残留的定量分析。
茶叶中的丙硫多菌灵在供试地贵州省毕节市以推荐使用高剂量的1.5倍施药,施药3次,距末次施药间隔21d采收茶叶中未检出丙硫多菌灵。依据试验结果,用10%丙硫多菌灵悬浮剂防治茶树茶枝梢黑点病和茶饼病,用药量兑水比例为1:1000(1000倍液),施药3次,效果最佳,清明节前21d采摘一叶一芽茶叶和土壤中的丙硫多菌灵的检出量均

