自发性孤立性腹主动脉夹层的治疗体会
陈 雷,李亚晶,李明轩,王华伟,邓洪儒
首都医科大学附属复兴医院血管外科,北京 100045
主动脉夹层通常影响升主动脉和降主动脉,并具有较高的发病率和病死率。相比之下,自发性孤立性腹主动脉夹层(spontaneous isolated abdominal aortic dissection,sIAAD)较为罕见,其为膈肌下腹主动脉内膜撕裂形成的假腔,发病率占主动脉夹层类疾病中的1.1%~4.0%[1-2]。由于发病率低,目前的研究结果多为病例报告形式[3-5]。sIAAD的发病机制尚不清楚,治疗策略仍不明确,且无统一规范,缺乏针对sIAAD相关临床指南。Jonker等[1]针对sIAAD的荟萃分析,使人们更好地了解了sIAAD。此外,两项单中心研究报道了sIAAD血管内治疗的中长期结果,均无患者死亡,同时具有较低的再干预率[6-7]。鉴于此,本研究总结了首都医科大学附属复兴医院收治的12例sIAAD患者的单中心治疗经验,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年1月至2021年7月首都医科大学附属复兴医院收治的sIAAD患者的临床资料。纳入标准:经主动脉计算机断层扫描血管成像(computer tomography angiography,CTA)确诊为sIAAD。排除标准:原发夹层破口位于胸主动脉并顺向撕裂累及腹主动脉的主动脉夹层;医源性、创伤性腹主动脉夹层;合并重要脏器损伤;妊娠期女性。根据纳入与排除标准,最终纳入12例sIAAD患者,其中,男性6例,女性6例;年龄58~90岁,中位年龄60.5岁;均合并高血压、高脂血症,吸烟史8例,饮酒史4例,糖尿病6例,冠心病6例,脑梗死2例,慢性肾功能不全2例;1例因胸痛、胸闷就诊,3例因腹痛就诊,8例经CTA检查时发现;肾下型10例,肾周型2例;4例夹层延伸至髂动脉,8例夹层仅局限于腹主动脉;4例CTA检查示腹主动脉瘤(abdominal aortic aneurysm,AAA),8例仅表现为夹层;4例主动脉直径≥30 mm,8例主动脉直径<30 mm。
1.2 方法
直径<30 mm的无症状sIAAD患者采用保守治疗,包括规律的检查和相关的药物治疗。根据相关研究标准[7-9],对于主动脉明显扩张,即经计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)扫描提示患者6个月内主动脉横径增大>5 mm,主动脉直径≥30 mm、存在持续症状、AAA、主动脉破裂、内脏动脉受累、下肢缺血、穿透性主动脉溃疡或壁内血肿的患者,在保守治疗的基础上,可将动脉瘤腔内修复术(endovascular aneurysm repair,EVAR)作为首选治疗方法。
1.2.1 术前处理
所有患者均进行心电监测,控制血压、心率,适度止痛等对症处理,血压控制在120/80 mmHg左右(1 mmHg=0.133 kPa),心率控制在100次/分钟以下。其中1例胸痛胸闷患者由心内科转入,期间监测生命体征稳定,行肌钙蛋白、心肌酶、脑钠肽及超声心动图检查,证实无心力衰竭及心肌梗死情况,行EVAR治疗。
1.2.2 EVAR
常规消毒后局部麻醉下经股动脉入路行主动脉造影,明确夹层破口数量、病变位置、累及范围,确定病变分型并与术前CTA进行比较。使用适当口径的主动脉覆膜支架封堵夹层破口,当远端锚定区不足10 mm时使用弹簧圈栓塞髂内动脉,置入支架后复查动脉造影,评估栓塞及隔绝效果,评估后采用Proglide血管缝合器缝合动脉穿刺点。术后于血管外科病房持续吸氧并心电监测患者生命体征,包括血压、心率、心律、血氧饱和度、呼吸等,口服β受体阻滞剂、钙通道阻滞剂,血压控制在120/80 mmHg左右,心率控制在100次/分钟以下,并积极给予对症支持治疗等。
1.3 随访
EVAR术后3、6、12个月行主动脉CTA检查,1年后每年复查1次。随访期间若患者出现腹痛等相关症状,需随时复查,必要情况下住院观察。若CTA检查发现假腔增大等,结合临床症状综合评估后判断是否需要进行外科手术或再次腔内干预。
2 结果
2.1 EVAR治疗情况
sIAAD患者术前CTA典型图像(图1~2)。经主动脉造影后,明确行EVAR的4例患者主动脉直径均≥30 mm,且4例患者均为肾下型sIAAD。4例行EVAR治疗的sIAAD患者均顺利完成手术,术后造影示夹层假腔均消失,技术成功率100%,覆膜支架显影良好,腹主动脉夹层被隔离,内脏及分支灌注良好(图3)。疾病相关症状在术后5 d内基本消失。4例置入主动脉覆膜支架患者术后均未出现发热、腹痛、臀肌跛行等症状,无感染征象。术后7 d均出院。
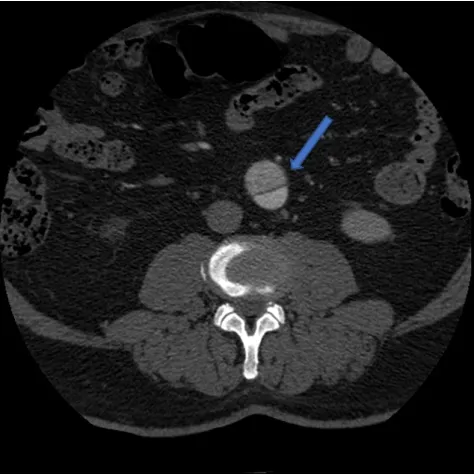
图1 sIAAD患者的术前CT图像

图3 sIAAD患者EVAR术后造影
2.2 随访情况
12例患者随访1~34个月,30 d全因病死率为0,随访过程中均未发生再干预或死亡,4例行EVAR治疗的患者均顺利出院,技术成功率100%,随访期间均未发生内漏、材料失效或支架移位情况。8例保守治疗患者中2例随访期间主动脉直径≥30 mm,但无明显症状,且因患者年龄较大,合并症较多,家属拒绝外科手术或腔内治疗,反行除保守治疗;另外6例保守治疗患者在随访期间腹主动脉夹层仍存在,但假腔范围无明显增大。
3 讨论
主动脉夹层通常起源于胸段,而sIAAD为膈肌下腹主动脉内膜撕裂形成的假腔,发病率占主动脉夹层类疾病中的1.1%~4.0%[4-5],是一种罕见的疾病,需要密切随访,若无明显临床症状,可药物治疗并密切监测;若有临床症状存在,则需要早期行外科手术或腔内治疗。Graham等[10]研究发现,70%的sIAAD为自发,15%的sIAAD由创伤性和医源性造成。但是,大部分患者发病时常无任何临床症状,因此其发病率尚不清楚。sIAAD常被CT或MRI诊断为腹主动脉退行性病变,如主动脉瘤、主动脉壁间血肿和主动脉穿透性溃疡。sIAAD大部分位于肾下主动脉,受髂股轴线的各种影响,其治疗方案仍处于有争议的讨论中。
本研究结果显示,sIAAD患者的中位年龄为60.5岁,与Farber等[4]和Graham等[10]报道相似。sIAAD的发病机制尚不清楚,针对此疾病的治疗无统一规范。大多数sIAAD具有特发性,高血压是sIAAD中最常见的危险因素,其次是血脂升高,约50%患者诊断sIAAD时无明显症状,sIAAD患者常见症状为剧烈、尖锐、撕裂的腹部或背部疼痛[3],罕见症状是脊髓缺血导致的截瘫,但脊髓缺血机制尚不清楚[11-13]。除早期并发症外,主动脉扩张作为sIAAD患者的晚期并发症,其发病率高达30%[13]。主动脉扩张与确诊为sIAAD时AAA的存在密切相关,因此,AAA是该病进展的潜在危险因素。研究显示,sIAAD主动脉扩张发生率与胸主动脉夹层发生率相当[2]。
目前,sIAAD的自然史尚不明确,预测并发症的危险因素也难以确定。一直以来,无症状性主动脉夹层主要通过药物治疗来积极控制危险因素,对于合并AAA或慢性扩张的患者行开放手术或血管内修复。随着医学技术的不断发展,EVAR已成功应用于sIAAD患者的治疗中,早期、长期随访中均展现出较好的结果。研究结果显示,EVAR治疗sIAAD,无患者出现早期死亡,术后5年生存率为95.0%,且具有较高的主动脉重建率,无需再次干预率为90.9%[7,10,14]。对于急性sIAAD患者,即使夹层假腔缩小,也需考虑对其行腔内治疗以封闭夹层破口。此外,sIAAD手术治疗产生的并发症低于降主动脉夹层手术产生的并发症[14-16]。研究结果显示,对于无症状复杂型sIAAD患者,直径>50 mm的腹主动脉是介入治疗的指征[6,17-19],而本研究及其他相关研究[7-9,20-21]建议介入治疗的阈值可能需要降低到30 mm,因为夹层动脉瘤更有可能破裂,需要更早的介入治疗。
本研究管理sIAAD策略:(1)对于无症状且无并发症的sIAAD进行保守治疗,包括药物治疗和定期随访,其中降压和镇痛治疗是保守治疗的主要组成部分。(2)对于复杂的sIAAD需进行腔内治疗,指征为持续存在的症状或复发症状、AAA形成、主动脉破裂、内脏动脉受累、下肢缺血、主动脉内径超过30 mm、伴有穿透性主动脉溃疡或壁内血肿、主动脉扩张每年大于10 mm。(3)如果基础解剖形态不允许应用腔内治疗,则需行开放手术。
本研究具有一定的局限性,属于回顾性研究且样本量较小,缺乏比较血管腔内治疗和手术治疗sIAAD的临床大型研究,需要在未来进一步行大样本、多中心、前瞻性的探索。
综上所述,sIAAD是一种罕见的疾病,男性吸烟患者伴有高脂血症和高血压是其最突出的基本特征。IAAD主要是自发性和肾下型,需密切监测无症状的IAAD,若患者符合某些干预指征,如主动脉明显扩张及主动脉直径≥30 mm、有持续症状存在、腹主动脉瘤形成、主动脉破裂、内脏动脉受累、下肢缺血、伴有穿透性主动脉溃疡或壁内血肿的患者则有必要进行外科手术或介入治疗。

