藜芦bHLH转录因子分析鉴定
寇呈熹,佟金泉,马 瑞,孙 伟,薛哲勇*,麻鹏达*
藜芦bHLH转录因子分析鉴定
寇呈熹1, 2,佟金泉3,马 瑞4,孙 伟5,薛哲勇1, 2*,麻鹏达3*
1. 东北林业大学 东北盐碱植被恢复与重建教育部重点实验室,黑龙江 哈尔滨 150040 2. 东北林业大学 黑龙江省植物天然活性物质的合成与利用重点实验室,黑龙江 哈尔滨 150040 3. 西北农林科技大学生命科学学院,甘肃 杨凌 712100 4. 吉林省农业科学院 生物技术研究所 吉林省农业生物技术重点实验室,吉林 长春 130033 5. 中国中医科学院中药研究所 中药鉴定与安全性评估北京市重点实验室,北京 100700
基于转录组数据,利用生物信息学方法鉴定藜芦bHLH转录因子基因家族,并作初步分析。通过隐马可夫模型从藜芦转录组序列中筛选基因,并使用ExPASy、MEME等在线网站及MEGA、TBtools等软件对藜芦bHLH进行理化性质、保守基序等可视化分析。在藜芦转录组中共鉴定到72条bHLH转录因子,VnbHLH转录因子氨基酸数目为105~692,等电点介于4.69~11.47,相对分子质量为11 071.2~77 795.3,亚细胞定位分析显示VnbHLH均定位于细胞核中;系统发育分析将VnbHLH转录因子分为6个亚族,VnbHLH在不同组织中表达差异显著,Vn_54312、Vn_14037在根中表达较高,推测其可能参与了藜芦植物根部某些生物碱的合成。根据转录组数据分析了药用植物藜芦中的bHLH转录因子基因家族,有助于下一步对藜芦bHLH转录因子家族功能预测及验证。
藜芦;转录组;bHLH转录因子;系统进化;基因表达
藜芦L.为百合科(Liliaeeae)多年生单子叶植物,全世界约有40种,分布于亚洲、北美和欧洲,中国约有17种,常见于高海拔、潮湿、酸性的土壤环境[1]。黎芦植物的大部分组织均可供药用,可内服治疗中风痰壅、喉痹不通、癫痫、头痛、黄疽、疟疾、骨折[2-3],外用治疥癣、灭蝇蛆[4-5]。其本品作为中医药物收载于《本草纲目》中已有一千多年历史,在当代仍作为涌吐风痰药物使用,但藜芦自身被列为中药配伍禁忌中的十八反[6],在临床应用中存在一定限制。藜芦属植物的化学活性成分包括甾体生物碱类、肽类、黄酮类等,起主要作用的是甾体类生物碱。目前,已经从藜芦植物中分离出184种[1]甾体类生物碱,如环靶明、藜芦胺、介藜芦碱等,具有抗肿瘤、抗炎镇痛、抗血栓、降血压等多种药理活性。
环靶明(环巴胺,11-去氧芥芬胺,cyclopamine)是藜芦植物中的一种甾体类生物碱,主要存在于百合科黎芦属植物的根系中。环靶明的发现源于其致畸作用,20世纪中期,Keeler等[7]研究了美国爱达荷州(Idaho)高概率的羔羊头部单眼畸形现象后,发现藜芦属植物加州藜芦L.中的一种甾体类生物碱为致畸主要成分并确定了其结构,即环靶明。直到20世纪90年代,环靶明才被发现对Hedgehog信号通路[8]有特定的抑制作用[9],并从原理上解释了它的致畸性。由于Hedgehog信号通路与多种肿瘤的生长有关联[10],故环靶明可作为一种潜在的抗癌症药物。
作为第二大类转录因子,bHLH转录因子基因家族广泛存在于动物、植物及微生物中。其家族成员在植物生长发育、次生代谢、环境胁迫应答中起调控作用[11],由碱性螺旋-环-螺旋特征结构而得名。有关bHLH转录因子的研究多以动物为对象,而在植物中主要为水稻及拟南芥等少数植物。bHLH转录因子的主要结构是一段贯穿真核生物生命的高度保守的肽序列,它为转录因子提供了2个关键的分子作用——DNA结合及转录调控[12]。bHLH结构域包含大约60个氨基酸,有2个功能不同的区域,基本区域和HLH[13]区域。碱基区有15个氨基酸长,通常包括6个碱基残基。它位于该结构域的N端,功能为DNA结合基序[14]。HLH区包含2个两亲α螺旋,中间由一个变长环区隔开。HLH区域作为二聚体区域,可以形成同型二聚体或异型二聚体。通过对拟南芥基因组序列的分析,共鉴定出162个编码bHLH的基因,根据其系统发育关系将其分为21个亚家族[15]。在水稻L.和大白菜var.Regel基因组中分别鉴定出167和230个bHLH转录因子[16-17]。它们分别被分为22亚科和24亚科。系统发育分析表明,植物bHLH蛋白包含26个亚家族,到目前为止,大多数bHLH蛋白在拟南芥中已经被鉴定出功能特征,它们的作用包括调节果实开裂、花药和表皮细胞发育、激素信号和应激反应[18]。而目前对中药植物藜芦相关转录因子分析甚少,本实验将以藜芦转录组数据为基础,对藜芦bHLH转录因子基因家族进行分析鉴定,为进一步藜芦bHLH转录因子功能研究奠定基础。
1 材料
藜芦植物样品为2017年4月26日吉林省磐石市烟筒山镇的海拔700 m山坡林下的苗期植株,经东北林业大学薛哲勇教授鉴定为藜芦L.,采集其根、茎和叶3个部位,并做3次生物学重复,备用。
2 方法
2.1 藜芦二代、全长转录组数据库获得
将植物样品进行总RNA提取,以完成二代测序;将提取的总RNA进行混合,以完成全长转录组测序。其中二代测序由Illumina平台完成,全长测序由PacBio平台完成。利用BUSCO对去冗余后的转录组进行完整性评估。
2.2 藜芦bHLH基因家族鉴定
通过NCBI在线网站(https://www.ncbi. nlm.nih.gov)下载拟南芥bHLH序列。藜芦转录组数据由本课题组对藜芦测序获得。使用perl程序提取藜芦所有蛋白序列,利用PlantTFDB(http://planttfdb.cbi.pku.edu.cn/)网站进行转录因子预测。将预测获得的藜芦bHLH基因家族成员进行筛选,去除重复转录本。在Pfam(http://pfam. xfam.org/)网站下载得到bHLH转录因子基因家族隐马可夫模型(PF00010),利用HMMER search搜索预测的藜芦bHLH基因家族。冗余序列及无bHLH结构域序列通过NCBI数据库完成,最终筛选到72个藜芦bHLH基因家族成员。藜芦bHLH蛋白相对分子质量、等电点及氨基酸数目等理化性质利用ExPASy网站(http://web.expasy.org/protparam/)进行分析。采用WoLF PSORT在线网站(http://www. gen- script.com/ wolfpsort.html),对藜芦bHLH转录因子家族成员进行亚细胞定位预测。
2.3 藜芦bHLH蛋白系统发育树的构建及Motif和保守结构域分析
利用MEGA 7.0软件内置的Clustal W程序对藜芦bHLH家族蛋白的氨基酸序列进行多序列比对分析,将比对结果采用邻接法(neigh-joining,NJ)构建系统发育树,并进行自举评估(Bootstrap),重复1000次,缺失值处理方式为配对状态删除(pairwise deletion),其他参数使用默认值[19]。通过Evolview在线工具(https://www.evolgenius.info/)对系统发育树进行美化[20],运用MEME(http://meme-suite. org/tools/meme)网站分析藜芦bHLH家族蛋白的基序,基序数量为10,其余参数为默认值[21]。
2.4 藜芦bHLH蛋白组织表达模式分析
通过Illumina平台对藜芦的根、茎和叶3个组织进行了二代转录组测序,通过RSEM软件[22]按照公式FPKM=cDNAFragments/{MappedFragments(Millions)∗TranscriptLength(kb)}计算衡量出各个基因绝对表达量的FPKM值。其中cDNA Fragments表示比对到某一转录本上的片段数目,即双端Reads数目;Mapped Fragments(Millions)表示比对到转录本上的片段总数,以106为单位;TranscriptLength(kb):转录本长度,以103个碱基为单位。对藜芦bHLH成员基因表达量(FPKM)使用log2(FPKM)+1对数转化处理,利用TBtools绘制藜芦bHLH表达模式图。
3 结果与分析
3.1 藜芦转录组测序结果分析
通过对藜芦植物样品的全长转录组测序,共获得circular consensus(CCS)read 352 009条,其中全长非嵌合(full length readsnon-chimeric,FLNC)序列308 650条。对全长非嵌合序列进行聚类得到一致序列93 217个,对一致序列进行polish得到高质量一致序列共90 756个,用二代转录组数据对低质量一致序列进行校正,校正后与高质量一致序列合并进行去冗余分析得到54 048转录本序列。利用BUSCO对去冗余后的转录组进行完整性评估,使用OrthoDB作为参考数据库,其完整覆盖率(C,complete)达到植物基因库的73.16%(图1)。将全长转录组上传到SRA数据库(https://www.ncbi. nlm.nih.gov/sra),获得转录组数据库登录号(PRJNA734486)。
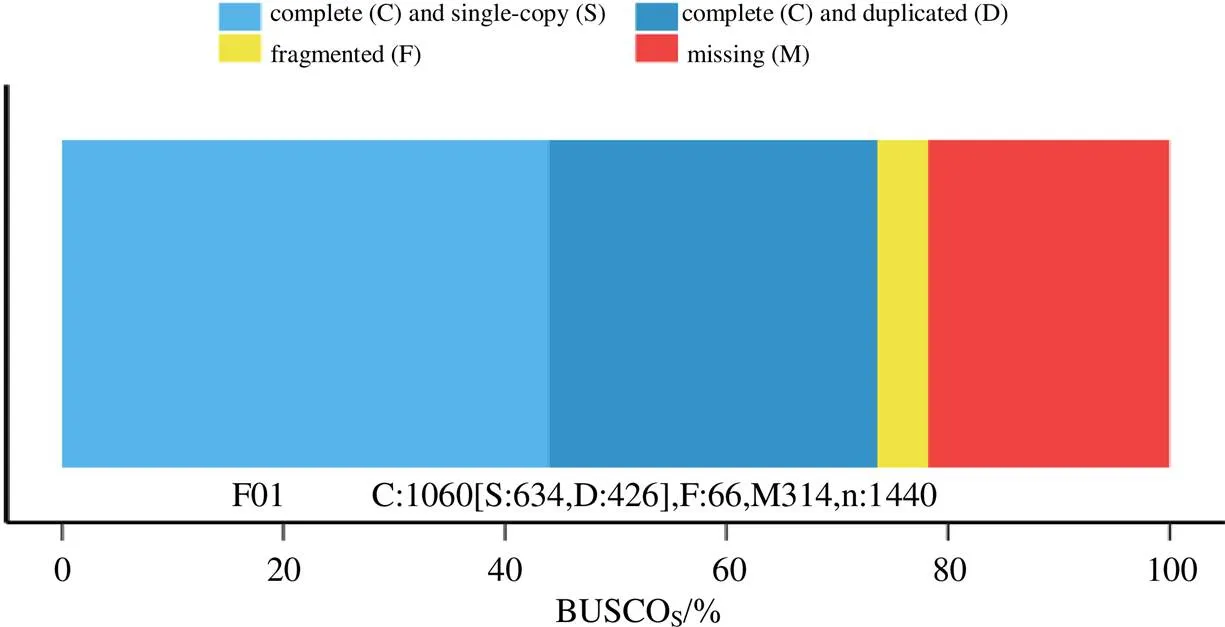
图1 转录组完整性评估
3.2 藜芦bHLH转录因子家族成员鉴定
通过2次HMMER search搜索,去除差异较大序列(1e-20)共计获得80个注释为bHLH的转录因子,经过CDD和Pfam数据库对其保守结构域进行验证,去除冗余及未获得结构域验证的8条序列,最终获得72个具有典型bHLH结构域的转录因子基因家族成员(表1)。将所得序列依次标号为VnbHLH1~VnbHLH72,最长的bHLH蛋白有692个氨基酸残基(VnbHLH70),最短的有105个氨基酸残基(VnbHLH60),等电点为4.69~11.47,相对分子质量为11 071.2~77 795.3。72个VnbHLH蛋白均定位于细胞核,推测藜芦bHLH转录因子在细胞核发挥调控功能。
表1 藜芦bHLH转录因子基因家族基本信息
Table 1 Basic information of Veratrum bHLH transcription factor gene family
编号序列名称长度/aa相对分子质量等电点亚细胞定位 VnbHLH1Vn_1023150355 088 6.23细胞核 VnbHLH2Vn_1057250354 892 6.20细胞核 VnbHLH3Vn_1091650355 088 6.23细胞核 VnbHLH4Vn_1108840644 164 6.45细胞核 VnbHLH5Vn_1217555261 523 7.22细胞核 VnbHLH6Vn_1323151455 921 6.36细胞核 VnbHLH7Vn_1403733737 436 7.13细胞核 VnbHLH8Vn_1455240543 744 8.48细胞核 VnbHLH9Vn_1468735940 041 6.38细胞核 VnbHLH10Vn_1490240543 744 8.48细胞核 VnbHLH11Vn_1514743947 910 5.09细胞核 VnbHLH12Vn_1899044648 040 4.77细胞核 VnbHLH13Vn_2008143747 911 5.64细胞核 VnbHLH14Vn_2036931334 270 7.92细胞核 VnbHLH15Vn_2040831834 753 6.17细胞核 VnbHLH16Vn_2069334736 369 6.31细胞核 VnbHLH17Vn_2080019120 94210.69细胞核 VnbHLH18Vn_2090527430 190 6.31细胞核 VnbHLH19Vn_2172832435 858 6.19细胞核 VnbHLH20Vn_2253725627 735 6.80细胞核 VnbHLH21Vn_2363324226 689 5.82细胞核 VnbHLH22Vn_3257439442 996 8.14细胞核 VnbHLH23Vn_3478618219 804 9.67细胞核 VnbHLH24Vn_3492443948 548 6.30细胞核 VnbHLH25Vn_3771757763 849 7.35细胞核 VnbHLH26Vn_3901765271 076 5.05细胞核 VnbHLH27Vn_3913220022 74611.47细胞核 VnbHLH28Vn_4003231234 299 5.92细胞核 VnbHLH29Vn_4074341946 005 5.31细胞核 VnbHLH30Vn_4091732735 906 7.32细胞核 VnbHLH31Vn_4357764169 727 6.96细胞核 VnbHLH32Vn_4516115917 98210.51细胞核 VnbHLH33Vn_4552032836 240 6.38细胞核 VnbHLH34Vn_4626533136 130 6.19细胞核 VnbHLH35Vn_4640827830 549 6.31细胞核 VnbHLH36Vn_467225227 233 9.25细胞核 VnbHLH37Vn_4717723625 602 8.52细胞核 VnbHLH38Vn_4758830032 079 6.72细胞核 VnbHLH39Vn_4784037941 720 7.15细胞核 VnbHLH40Vn_487964169 727 6.96细胞核 VnbHLH41Vn_5149912414 18510.08细胞核 VnbHLH42Vn_5151255261 509 7.22细胞核 VnbHLH43Vn_5365449053 100 5.91细胞核 VnbHLH44Vn_5388818620 213 8.65细胞核 VnbHLH45Vn_5431232736 308 7.41细胞核 VnbHLH46Vn_5644031734 682 6.17细胞核 VnbHLH47Vn_588369377 795 6.40细胞核 VnbHLH48Vn_5955027831 111 6.07细胞核
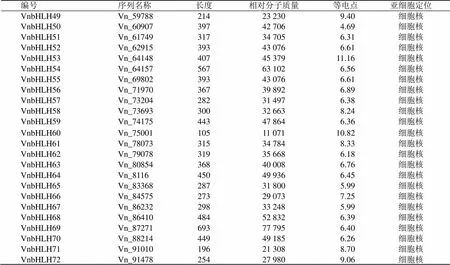
续表1
3.3 藜芦bHLH转录因子蛋白保守基序分析
对藜芦bHLH转录因子保守氨基酸Motif进行MEME SUITE分析(图2),共获得10个Motif:Motif 1(YIHVRARRGQATDSHSLAERVRREKIS- ERMKYLQELVPGCNK)、Motif 2(TGKASMLD- EIINYVQSLQRQVEFLSMKLA)及Motif 3(LNHVEAERQRREKLNQRFYALRAVVPNISKM- DKASLLGDAISYIKELQRKIKELESE)等。结果(图3、4)表明50个转录因子都含有Motif 1,49个转录因子包含Motif 2,在17个转录因子中发现了Motif 3,有7个转录因子蛋白含有Motif 4,有6个转录因子蛋白含有Motif 5,有5个转录因子蛋白含有Motif 6,有5个转录因子蛋白含有Motif 7,10个转录因子蛋白含有Motif 8,仅有4个转录因子包含Motif 9,5个转录因子包含Motif 10。
利用clustal W对所有的藜芦bHLH结构域进行多序列比对,然后采用WebLogo 3作图(图3),藜芦的bHLH结构域由53个氨基酸组成,包含2个不同的功能区域其N端的Basic区该区域氨基酸数量较少(13个氨基酸),第10、11位的精氨酸高度保守,碱性区域是转录因子的DNA结合区域,其作用可能是识别DNA的顺式作用位点,该序列对靶基因启动子上游的E-box识别结合必不可少;在C端的HLH区域第21、49位的亮氨酸保守度很高,第39、43位的亮氨酸、异亮氨酸也非常保守,这些氨基酸残基对于二聚体的形成和功能非常重要。

图2 MEME预测的藜芦bHLH 10个Motifs Logo

图3 藜芦bHLH转录因子家族的保守结构域
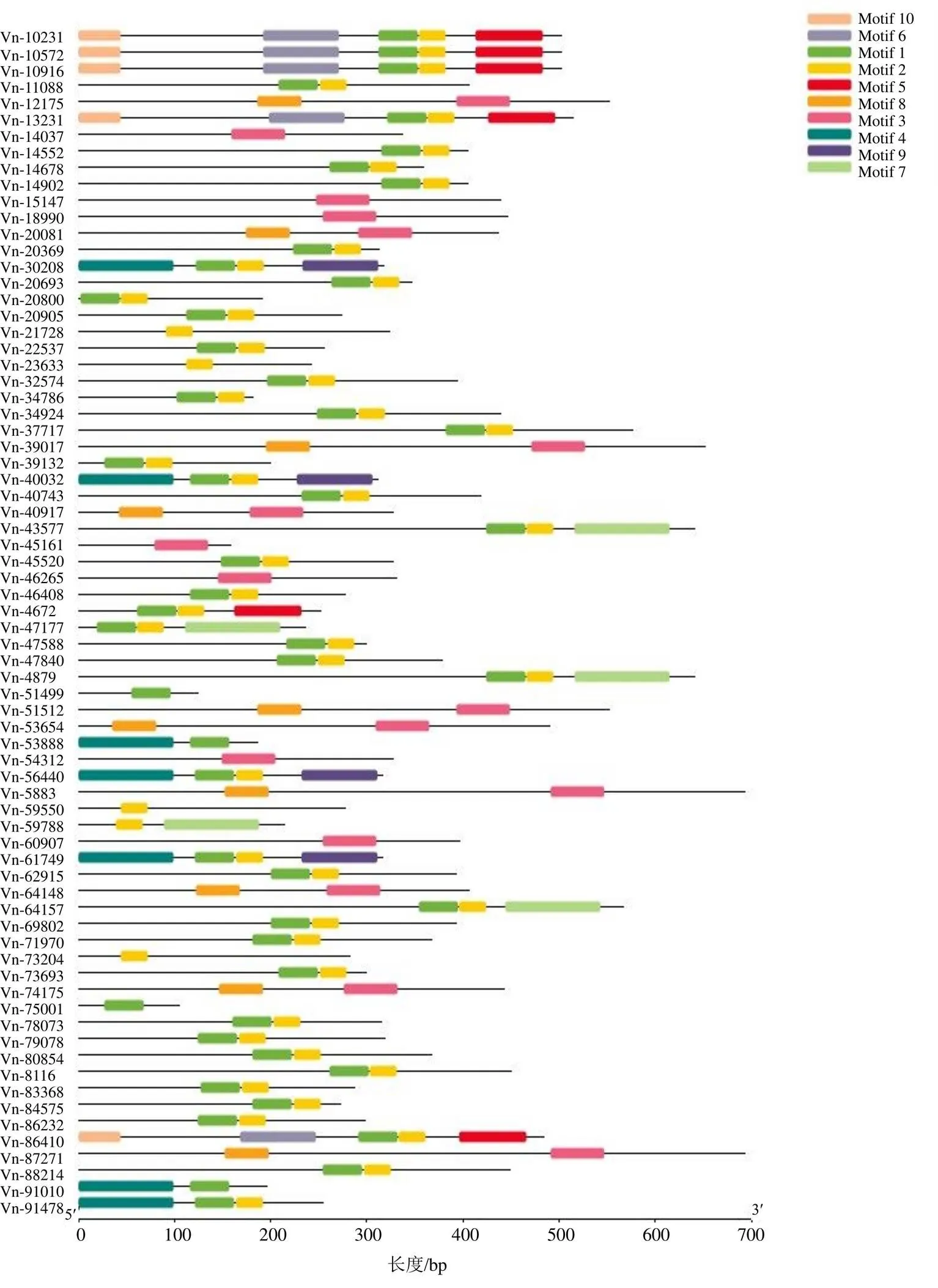
图4 藜芦bHLH转录因子保守基序分布
3.4 藜芦bHLH转录因子蛋白家族系统进化分析
使用MEGA 7.0软件对72个藜芦bHLH转录因子和部分拟南芥bHLH转录因子蛋白进行建树(图5)。经比对发现,bHLH转录因子和同源性较近的拟南芥bHLH序列交错分布。依据拟南芥bHLH蛋白家族分类[23],藜芦bHLH蛋白被分为6个大族,分别为Ⅲ、Ⅳ、Ⅶ、Ⅷ、Ⅸ和Ⅻ。其中Ⅲ族包含12个成员,Ⅳ族包含9个成员、Ⅶ族包含9个成员,Ⅷ族包含5个成员,Ⅸ族包含6个成员,Ⅻ族最多,含有31个成员,共计72个。根据进化树分类结果,可将Ⅲ组与Ⅳ组细分为Ⅲb、Ⅲd、Ⅲe、Ⅳa、Ⅳb和Ⅳc几个亚族,分别含有3、6、3、3、5和1个成员。几乎所有藜芦bHLH蛋白都与拟南芥bHLH蛋白聚在相同亚组上,同一亚族的藜芦bHLH蛋白与拟南芥bHLH蛋白具有较高的相似性,藜芦bHLH蛋白与相近的拟南芥bHLH蛋白可能具有相同或相似的功能。

图5 藜芦与拟南芥bHLH系统发育分析
3.5 不同组织藜芦bHLH表达模式分析
对藜芦bHLH转录因子基因在藜芦转录组数据上的表达模式进行分析发现,72个基因在根、茎和叶3个不同组织中表达模式有差异(图6),大部分bHLH转录因子都参与表达,少部分未表达或部分表达:5条bHLH(Vn_20080、Vn_14687、Vn_8116、Vn_40032、Vn_43577)在根中未达;2条bHLH(Vn_54312、Vn_14037)在根中表达较高,而在叶中表达量极低,结合藜芦内的生物碱集中在根部,推测其可能参与了藜芦植物根部某些生物碱的合成;还有些基因未参与表达,如Vn_79078。Vn_78073、Vn_83368 2条基因在茎中表达量明显高于根部和叶片,可能在茎的发育过程中起重要作用;Vn_20800、Vn_14687和Vn_8116在叶片中表达显著,可能参与叶的生长发育调控。此外一些bHLH(如Vn_53654、Vn_23633等)在藜芦3个不同组织部位均有较高表达,说明其可能参与藜芦整个生长发育周期中多种生理生化转变的转录调控。总体上看,藜芦bHLH的基因表达具有多样性,一些基因能够在某一或多种组织中发挥特定作用。
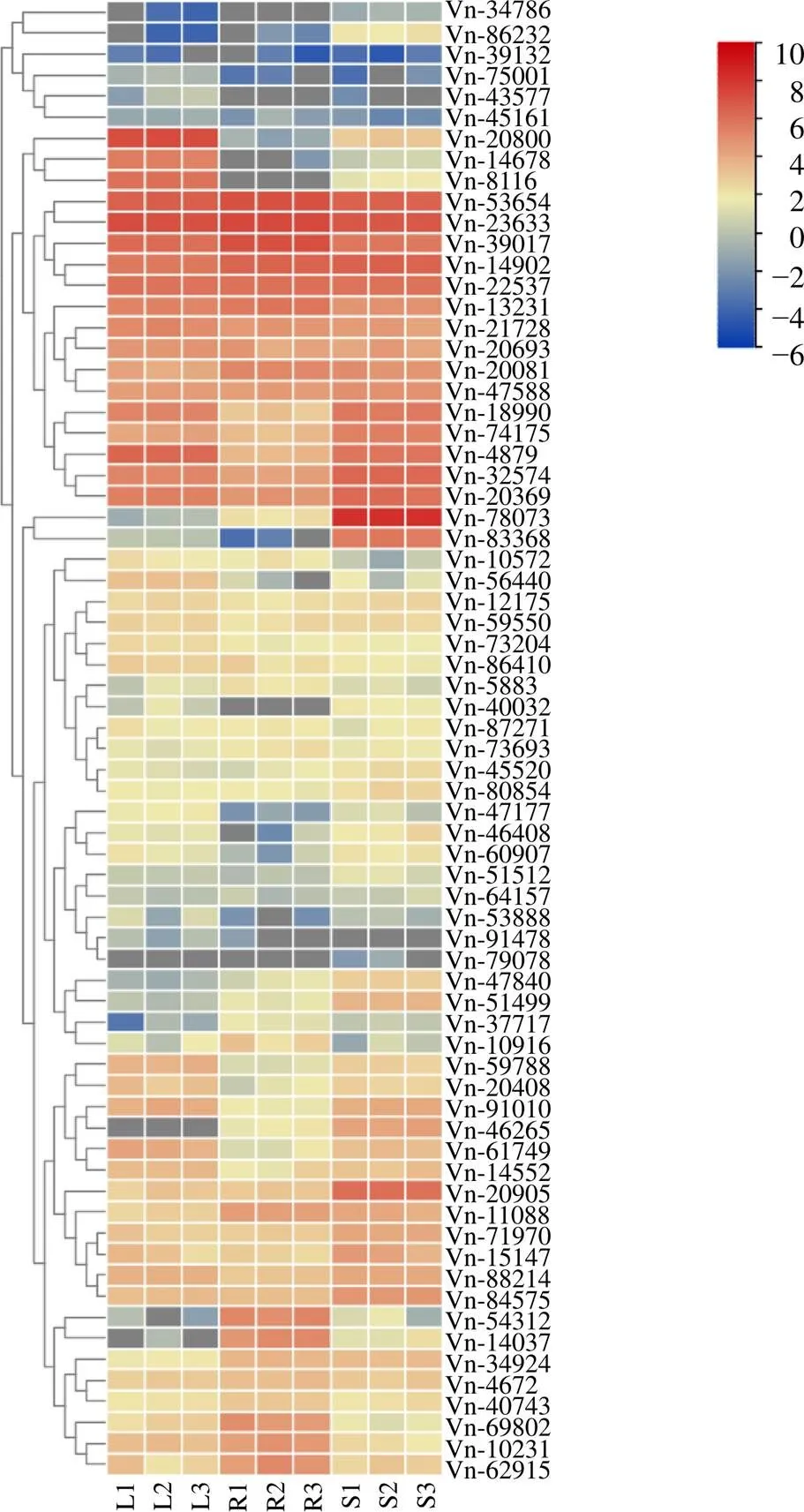
图6 不同组织中藜芦bHLH基因表达模式
4 讨论
目前对基因家族的鉴定分析普遍使用基因组或基因组与转录组结合的方式,但藜芦基因组尚未被报导,本实验通过二代转录组测序完成转录本定量分析,使用全长转录组测序获得一致性转录本。在此基础上完成了对bHLH转录因子基因家族的模型筛选、结构预测和表达分析。在没有参考基因组的情况下,二代、全长转录组联合测序可作为替代策略进行基因挖掘[24],完成对基因家族的鉴定及部分分析。转录组测序停留在组织表达层面,缺少对基因的结构及染色体定位、对蛋白及代谢物的调控也需要代谢组学提供帮助。因此,对基因的完整鉴定及功能挖掘需要基因组、转录组及代谢组的联合分析来完成。
bHLH是真核生物中一类广泛存在且数量众多的转录因子,因具有螺旋-环-螺旋结构而得名,其通过特定的氨基酸残基与靶基因结合来调节相关基因的表达[25]。与其他植物相比,藜芦属植物由于含有特殊的甾体类生物碱,成为该方向的研究热点。SlbHLH114参与了番茄甾体生物碱的合成,可被甾体生物碱合成关键调控因子SlMYC2激活,从而显著提高番茄内甾体生物碱代谢途径基因的表达[26-27]。Vn_39017、Vn_53654和Vn_74175 3个基因与SlbHLH114、SlMYC2关系较近,在根中表达较高,且与甾体生物碱的聚集部位吻合,可能参与了藜芦甾体生物碱环靶明的生物合成。植物bHLH转录因子参与各种信号转导及合成代谢途径的调控,如光信号转导、激素合成、腺毛和根毛发育及逆境胁迫及枝条分枝等[28-30],而且越来越多的研究表明bHLH转录因子对调节植物逆境具有重要作用。在拟南芥中,AtbHLH122对干旱、盐胁迫和渗透胁迫具有正向调控作用[31],此外,bHLH115可参与调节铁的稳态[32]。根据与其他已验证功能的bHLH基因建树结果,可初步推测藜bHLH在信号转导或代谢途径调控中发挥的作用。
bHLH在不同组织部位的表达模式预示着bHLH蛋白功能的多样性。烟草bHLH93具有明显的组织特异表达[33],在不同生长阶段的侧根和花期子房中有较高表达,这与植物甾醇合成的集中性特征相吻合;银杏bHLH91的表达存在季节与组织性差异[34]。作为的靶基因,bHLH74能调控拟南芥根部的生长发育[35]。这些表达差异在72个藜芦bHLH中也有体现,在根中表达量高或特异表达的bHLH对甾体生物碱的代谢可能具有调控作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 张蒙珍, 高丽娟, 徐世芳, 等. 藜芦属植物甾体生物碱及其药理活性研究进展 [J]. 中国中药杂志, 2020, 45(21): 5129-5142.
[2] Zheng B J, Wang C H, Song W W,. Pharmacokinetics and enterohepatic circulation of jervine, an antitumor steroidal alkaloid fromin rats [J]., 2019, 9(5): 367-372.
[3] Li W, Wang L S, Zhao D Q,. Steroidal alkaloids from[J]., 2012, 48(5): 919-920.
[4] 王冬梅, 戴爱梅, 刘新兰, 等. 藜芦碱对棉蚜防治效果分析 [J]. 新疆农业科学, 2019, 56(1): 46-51.
[5] 章斌. 基于化学物质基础和代谢组学方法的中药藜芦毒性及藜芦与人参配伍禁忌机制研究 [D]. 上海: 第二军医大学, 2012.
[6] 张娴勰. 中药“十八反”:白芍、丹参与藜芦配伍相互作用及药理作用研究 [D]. 北京: 中国人民解放军军事医学科学院, 2015.
[7] Keeler R F, Binns W. Teratogenic compounds of(Durand). I. Preparation and characterization of fractions and alkaloids for biologic testing [J]., 1966, 44(6): 819-828.
[8] 王凡, 徐凌, 郭传勇. Hedgehog信号通路在肝癌发生中的作用 [J]. 同济大学学报: 医学版, 2013, 34(2): 120-124.
[9] Cooper M K, Porter J A, Young K E,. Teratogen-mediated inhibition of target tissue response to Shh signaling [J]., 1998, 280(5369): 1603-1607.
[10] Hammerschmidt M, Brook A, McMahon A P. The world according to hedgehog [J]., 1997, 13(1): 14-21.
[11] Lu J, Webb R, Richardson J A,. MyoR: A muscle-restricted basic helix-loop-helix transcription factor that antagonizes the actions of MyoD [J]., 1999, 96(2): 552-557.
[12] Sailsbery J K, Dean R A. Accurate discrimination of bHLH domains in plants, animals, and fungi using biologically meaningful sites [J]., 2012, 12: 154.
[13] Jones S. An overview of the basic helix-loop-helix proteins [J]., 2004, 5(6): 226.
[14] Atchley W R, Terhalle W, Dress A. Positional dependence, cliques, and predictive motifs in the bHLH protein domain [J]., 1999, 48(5): 501-516.
[15] Bailey P C, Martin C, Toledo-Ortiz G,. Update on the basic helix-loop-helix transcription factor gene family in[J]., 2003, 15(11): 2497-2502.
[16] Li X X, Duan X P, Jiang H X,. Genome-wide analysis of basic/helix-loop-helix transcription factor family in rice and[J]., 2006, 141(4): 1167-1184.
[17] Song X M, Huang Z N, Duan W K,. Genome-wide analysis of the bHLH transcription factor family in Chinese cabbage (ssp. pekinensis) [J]., 2014, 289(1): 77-91.
[18] Feller A, Machemer K, Braun E L,. Evolutionary and comparative analysis of MYB and bHLH plant transcription factors [J]., 2011, 66(1): 94-116.
[19] Hall B G. Building phylogenetic trees from molecular data with MEGA [J]., 2013, 30(5): 1229-1235.
[20] He Z L, Zhang H K, Gao S H,. Evolview v2: An online visualization and management tool for customized and annotated phylogenetic trees [J]., 2016, 44(W1): W236-W241.
[21] Bailey T L, Johnson J, Grant C E,. The MEME suite [J]., 2015, 43(W1): W39-W49.
[22] Li B, Dewey C N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome [J]., 2011, 12: 323.
[23] Heim M A, Jakoby M, Werber M,. The basic helix-loop-helix transcription factor family in plants: A genome-wide study of protein structure and functional diversity [J]., 2003, 20(5): 735-747.
[24] 郑志琴. 青海钩虾细胞色素P450家族成员的鉴定及主要水体污染物的诱导表达 [D]. 西宁: 青海大学, 2020.
[25] Massari M E, Murre C. Helix-loop-helix proteins: Regulators of transcription in eucaryotic organisms [J]., 2000, 20(2): 429-440.
[26] Li Y, Chen Y, Zhou L,. MicroTommetabolic network: Rewiring tomato metabolic regulatory network throughout the growth cycle [J]., 2020, 13(8): 1203-1218.
[27] Cárdenas P D, Sonawane P D, Pollier J,. GAME9 regulates the biosynthesis of steroidal alkaloids and upstream isoprenoids in the plant mevalonate pathway [J]., 2016, 7: 10654.
[28] Roig-Villanova I, Bou-Torrent J, Galstyan A,. Interaction of shade avoidance and auxin responses: A role for two novel atypical bHLH proteins [J]., 2007, 26(22): 4756-4767.
[29] Friedrichsen D M, Nemhauser J, Muramisu T,. Three redundant brassinosteroid early response genes encode putative bHLH transcription factors required for normal growth [J]., 2002, 162(3): 1445-1456.
[30] Ohashi-Ito K, Bergmann D C. Regulaion of theroot vascular initial population by LONESOME HIGHWAY [J]., 2007, 134(16): 2959-2968.
[31] Liu W W, Tai H H, Li S S,. bHLH122 is important for drought and osmotic stress resistance inand in the repression of ABA catabolism [J]., 2014, 201(4): 1192-1204.
[32] Liang G, Zhang H M, Li X L,. bHLH transcription factor bHLH115 regulates iron homeostasis in[J]., 2017, 68(7): 1743-1755.
[33] 武明珠, 李锋, 王燃, 等. 烟草转录因子bHLH93基因的克隆及表达分析 [J]. 烟草科技, 2015, 48(3): 1-7.
[34] 何昌文, 朱丽, 沈珊, 等. 银杏bHLH91转录因子基因的克隆及表达分析 [J]. 广西植物, 2018, 38(2): 202-209.
[35] Bao M. miR3 96 a Mediated basic Helix-Loop-Helix transcription factor bHLH74 repression acts as a Regulator for Root Growth in Arabidopsis Seedlings [J]., 2014, 55(7): 1343-1353.
Analysis ofbHLH transcription factor based on transcriptome
KOU Cheng-xi1, 2, TONG Jin-quan3, MA Rui4, SUN Wei5, XUE Zhe-yong1, 2, MA Peng-da3
1. Key Laboratory of Saline-alkali Vegetation Ecology Restoration Ministry of Education, Northeast Forestry University, Harbin 150040, China 2. Heilongjiang Key Laboratory of Plant Bioactive Substance Biosynthesis and Utilization, Northeast Forestry University, Harbin 150040, China 3. College of Life Sciences, Northwest A&F University, Yangling 712100, China 4. Jilin Provincial Key Laboratory of Agricultural Biotechnology, Jilin Academy of Agricultural Sciences, Changchun 130033, China 5. Key Laboratory of Beijing for Identification and Safety Evaluation of Chinese Medicine, Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
To identify and analyze the Veratrum () bHLH transcription factor gene family of Veratrum veratrum by bioinformatics based on transcriptome data.The bHLH gene was screened from the transcriptional sequence of Veratrum by hidden Markov model, and the physical and chemical properties and conserved motif of Veratrum bHLH were visually analyzed by online websites such as ExPASy and MEME and software such as MEGA and TBtools.A total of 72 bHLH transcription factors were identified in Veratrum transcriptome. The amino acid number of VnbHLH transcription factors was 105—692, the isoelectric point was 4.69—11.47, and the relative molecular weight was 11 071.2—77 795.3. Subcellular localization analysis showed that VnbHLH were all located in the nucleus. According to phylogenetic analysis, VnbHLH transcription factors were divided into six subgroups. The expression of VnbHLH was significantly different in different tissues, while Vn_54312 and Vn_14037 were highly expressed in roots. It is speculated that they may be involved in the synthesis of some alkaloids in the roots of Chenopodium.The analysis of bHLH transcription factor gene family inbased on transcriptome data is helpful to predict and verify the function of bHLH transcription factor family in..
L.; transcriptome; bHLH transcription factor; phylogenetic evolution; gene expression
R286.12
A
0253 - 2670(2022)14 - 4476 - 10
10.7501/j.issn.0253-2670.2022.14.026
2021-12-02
吉林省农业科技创新工程项目(CXGC2017ZY029)
寇呈熹,硕士研究生,从事中药活性物质代谢途径解析。E-mail: 905546738@qq.com
薛哲勇,教授。E-mail: xuezhy@126.com
麻鹏达,副教授。E-mail: mapengda@163.com
[责任编辑 时圣明]