盆腔脏器联合切除术在局部晚期直肠癌和局部复发直肠癌中的应用现状
陆立,任东林
中山大学附属第六医院肛肠外科 广东 广州 510655
尽管新辅助放化疗联合全直肠系膜切除术(total mesorectal excision,TME)可使部分中晚期直肠癌患者有机会获得肿瘤病灶的完整切除,提高了患者的生存率,但仍有约6%的直肠癌初诊即为局部晚期 直 肠 癌 (locally advanced rectal cancer,LARC)[1],此外,局部复发直肠癌(locally recurrent rectal cancer,LRRC)的发生率(5%~18%)亦不可小视[2-4],这些患者的治疗给结直肠外科带来巨大的挑战。LARC及LRRC的临床表现包括持续盆腔痛、里急后重、癌灶出血、直肠异常分泌物等,严重影响患者的生活质量[2,5]。LARC及LRRC的生物学特征、自然转归规律尚未阐明,单纯新辅助治疗效果不理想,外科手术在LARC及LRRC治疗中的价值仍不可忽视[6]。
盆腔脏器联合切除术(pelvic exenteration,PE)是指整块切除盆腔多脏器及其邻近组织的外科技术,最早在1948年由时任康奈尔大学外科教授Alexander Brunschwig[7]首次报道,经过70余年的发展,该术式的适应证及手术技术在结直肠外科、妇科、泌尿外科、骨科等学科领域均有了长足进步。传统PE切除范围大,技术难度高,围手术期并发症发生率及死亡率较高,在一定程度上限制了其在直肠癌领域的推广应用[8],但这一现象近年来已经发生转变。谨慎选择合适的患者,术前进行全面的影像学和病理学评估,多学科协作完成PE,完备的围手术期监护治疗等措施,使PE成为部分LARC及LRRC的选择性、挽救性治疗手段[9];其术后近期及远期并发症发生率有所降低[10]、无瘤生存率[11]大大提高,逐渐得到患者及结直肠外科医师的认可。
1 LARC及LRRC的定义
目前国际上对LARC尚未形成统一的定义,笔者将比较常用的LARC定义整理列出,详见表1[12-13]。本文所采纳的LARC定义主要参照超TME切除协作研究(Beyond TME Collaborative)的定义[13]。
目前关于LRRC的定义有:既往有明确的直肠癌手术史,出现吻合口位置或肿瘤床复发癌灶,可合并肠系膜或侧方淋巴结转移[14];合并腹股沟淋巴结转移,但不包括腹主动脉旁淋巴结转移;原手术腹壁/皮下引流通道肿瘤种植亦可归为LRRC[15];尤指初次直肠癌根治术后2年内复发的病例,如初次手术联合放化疗或新辅助治疗的患者,LRRC复发年限可放宽至初次手术后10年[15]。
2 PE的相关概念
2.1 PE的种类
盆腔按照解剖部位一般分为四个部分(图1),PE指切除两个以上部分的盆腔脏器或结构[16]。
依据病变性质及手术切除范围,PE又可细分为三种手术方式。(1)全盆腔脏器联合切除术(total pelvic exenteration,TPE),切除范围包括直肠及远端结肠,泌尿系统器官(膀胱为主要切除器官,必要时需切除前列腺及尿道),病变引流区域淋巴结,盆腔壁层腹膜,女性患者需切除子宫、附件以及阴道。如病变累及骶骨,还需行骶骨切除术(sacrectomy)并重建盆腔骨性结构,则为TPE+骶骨切除重建术。(2)前盆腔脏器联合切除术(anterior pelvic exenteration,APE),切除范围包括上段直肠,女性生殖器官,泌尿系统器官。(3)后盆腔脏器联合切除术(posterior pelvic exenteration,PPE),切除范围包括整段直肠,女性生殖器官[11]。临床上,需依据恶性肿瘤所在位置、肿瘤大小及肿瘤累及脏器情况施行具体术式[8,17]。
2.2 PE的适应证和禁忌证
综合现有文献,PE在直肠癌治疗中的总体适应证有:(1)诊断为LARC及LRRC的患者;(2)肿瘤病变经过多学科团队讨论形成治疗决策可实施PE;(3)经MRI检查或体检发现需要广泛切除的情形,例如病变侵犯肛提肌复合体,存在侧方淋巴结转移,病变侵犯肠壁外组织等情形[6]。
PE的绝对禁忌证包括:(1)患者心理状态不能承受手术及术后创伤打击;(2)不可切除的转移癌灶;(3)癌灶侵犯S1或S2神经根以上部位;(4)患者营养状态不能耐受手术。相对禁忌证包括:(1)肿瘤远处转移;(2)腹主动脉旁淋巴结转移;(3)肿瘤生长固定在盆底多个部位;(4)癌灶难以达到R0切除;(5)癌灶侵犯盆腔侧壁[6]。
3 PE的术前评估和术前准备
3.1 LARC及LRRC可否施行PE的评估
临床上如遇到LARC及LRRC患者,该如何决策是否能开展PE?笔者认为1950年Whipple等[18]对PE的述评完美地回答了这一问题(表2),临床医师应通过综合评估患者病情、心理状态及手术团队自身能力进行判断,当各项目评估结果均为正性内容时可施行PE,反之则不建议行PE。不仅如此,笔者认为这一建议对临床其他复杂及疑难病例的治疗方案决策同样具有重要的借鉴价值。
根据参考文献[18]的表格进行翻译。
3.2 LARC施行PE的术前评估流程
LARC施行PE的术前评估流程见图2[12]。
3.3 LRRC施行PE的术前评估流程
LRRC施行PE的术前评估流程见图3[13]。
3.4 PE总体设计和术前准备
PE不仅切除范围广,而且术中需要重建尿液及粪便流出通道,患者术后监护、康复等围手术期管理对手术、护理及多学科团队协作要求甚高,因此非常考验手术决策者的总体设计能力(表3)[19]。也因如此,PE的独特魅力吸引了高水平团队致力于此领域研究。LARC及LRRC患者一旦决定施行PE,术前需完善以下准备:(1)需要经验丰富的麻醉医师全程监护;(2)组建以结直肠外科医师为核心,视情况邀请泌尿外科、妇科、血管外科、骨科、整形科、放疗科医师组成多学科手术合作团队;(3)提前与手术室护士沟通,至少需要两组巡回及器械护士,并告知术中备物及材料[20]。
4 PE技术难点
施行PE需依据病变情况,个体化完成病变切除,遵循达到病变及其邻近脏器R0整块切除的总原则。
表格中的内容依据参考文献[19]制定。
4.1 PE切缘判定( R 0/R 1/R 2)及生存预后
R0切除:病理结果切缘阴性,是最为理想的PE目标,患者可以获得长期无瘤生存。R1切除:表现为肉眼完全切除病灶,病理结果显示局部残留(切缘1 mm或1 mm外肿瘤残留)。R2切除:病理结果显示切缘外2 mm,甚至3 mm肿瘤残留[21]。结合现有文献,直肠癌行PE的R0切除率见表4[2,22-25]。
R0切除是患者获得长期无瘤生存的最重要因素[26]。综合现有文献研究结果,LRRC患者施行PE的R0切除率为55%~81%,5年总体生存率为28%~50%[2,22-25]。Bhangu等[27]曾对100例LARC及LRRC患者施行PE,结果显示LARC组R0切除率高于LRRC组(91%vs.62%,P<0.001);R0、R1及R2切除患者3年无瘤生存率存在明显差异(67%vs.49%vs.0%,P<0.001);R0切除患者中,LARC组无瘤生存率与LRRC组比较差异无统计学意义(76%vs.57%,P=0.212);多因素分析结果显示手术切缘阳性(HR=4.04,P<0.001) 及淋巴结阳性 (HR=2.43,P=0.022)均为影响患者无瘤生存率的高危因素;R0切除的LARC和LRRC患者3年局部无复发生存率(local recurrence free survival, LRFS)分 别 为86%、84%(P=0.817);手术切缘阳性是降低局部无复发生存率的高危因素(HR=5.48,P=0.002)。
4.2 PE术后尿液流出通道重建方式及相应问题
PE中对于粪便流出通道重建方案的选择相对恒定,但尿液流出通道重建选择存在多样化,这给手术团队带来一定程度的困惑[28]。PE开展的最初阶段,输尿管乙状结肠种植是尿液流出通道重建的仅有选择[7],1950年Bricker[29]首次报道以回肠代膀胱作为尿液流出通道,其后陆续有文献报道双筒乙状结肠湿造口(double-barrelled wet colostomy,DBWC)、自行插管可控储袋及回肠原位新膀胱等尿流改道术式,详见表5[30-33]。
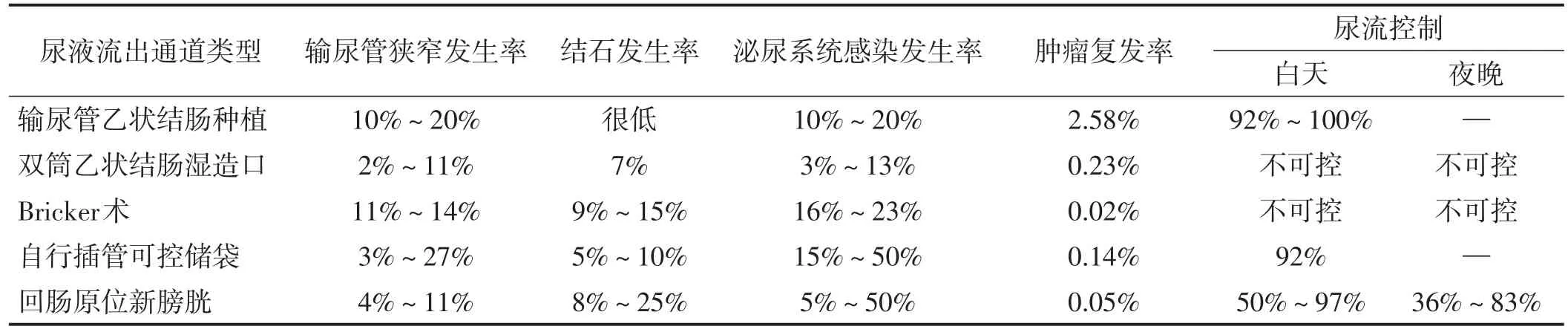
表5 现有文献报道的PE后尿液流出通道重建术式及相应问题
最近的研究结果显示,LARC及LRRC患者施行PE的围手术期死亡率较初始阶段明显降低,但尿液流出通道重建相关并发症发生率却有所增加[28]。除术式本身的原因外,手术医师对术式的熟悉程度,患者是否为肿瘤复发、是否行放化疗、输尿管吻合方式、住院周期及术中失血量等因素均是尿液流出通道重建术后发生并发症的影响因素[28]。如何选择合适的PE术后尿液流出通道重建术式?建议结合术中病灶切除范围,患者小肠或结肠健康情况,更重要的是手术团队需考虑对上述术式的熟悉程度进行综合决策[18]。
4.3 PE术后盆腔重建方式
PE如何选择恰当的盆腔重建手术方式至今为止仍无共识,目前报道的几种重建方式见表6[34-40]。
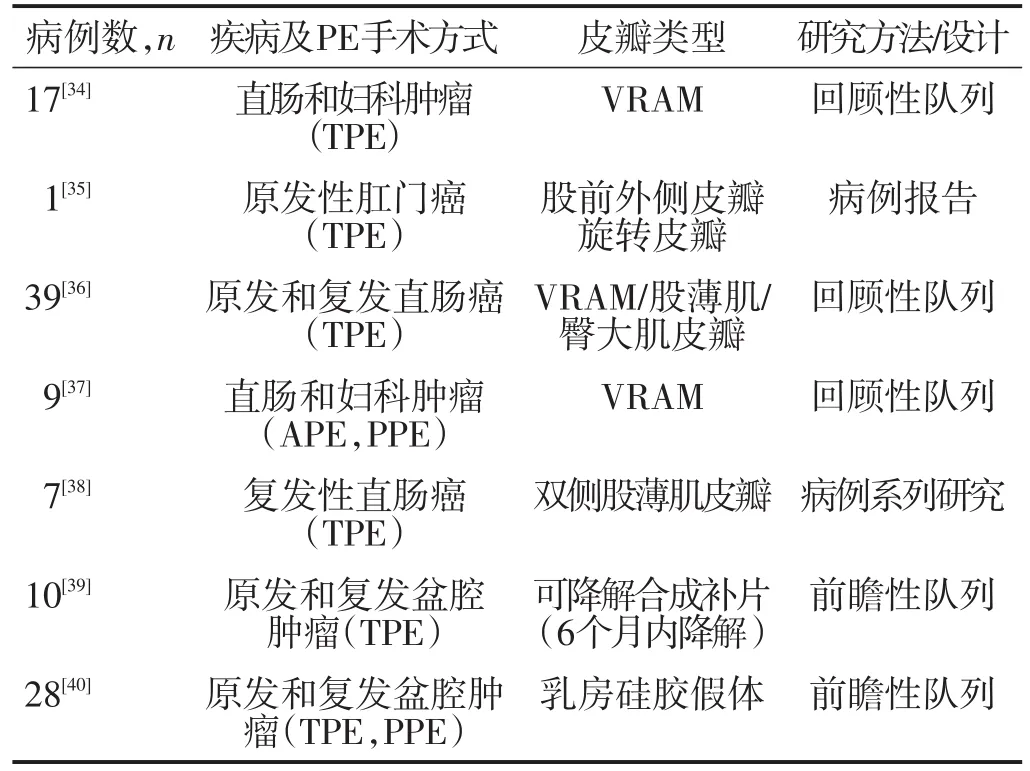
表6 LARC及LRRC施行PE的盆腔重建方式
5 PE术后并发症
就LARC及LRRC患者施行PE而言,文献报道其术后严重并发症发生率为37%~100%,围手术期死亡率0~25%(中位数2.2%),术后30天内死亡率为0~12%(中位数0.55%)[5-6]。
相对于LARC,LRRC施行PE的术后并发症发生率更高,术后因并发症再次住院率高达45%,非计划再次手术率为32%[41]。有文献报道盆腔肿瘤施行PE早期严重并发症(需要再次外科干预或因此延长住院时间)发生率为25%~50%[42]。施行后盆腔脏器切除及骶尾骨切除术者并发症发生率更高[43-44]。相对于近期并发症,术后远期并发症发生率亦不可忽视。远期并发症中尤其需要注意泌尿系统感染(40%)[45]和尿瘘(16%)[46],营养不良发生率更是高达51%[47]。约有1/3的PE患者可并发瘘、肠梗阻、泌尿系梗阻、肾功能衰竭、肾盂肾炎,部分更为少见的并发症包括静脉血栓、肺栓塞、皮瓣坏死及造口坏死等[48]。其他并发症发生率情况详见表7[49-51]。

表7 PE术后其他并发症发生率情况
PE术后空盆腔综合征(empty pelvis syndrome,EPS)是近年来临床上较为关注的PE手术并发症,包括小肠梗阻、腹腔内疝形成或盆腔脓肿。EPS可长期表现为慢性腹痛、不完全性肠梗阻及慢性盆腔痛,甚至影响患者营养吸收导致营养不良等问题。针对PE术后EPS的预防,可采用的方法有使用生物补片、肌皮瓣、腹膜或者硅胶假体进行盆腔重建,都能在一定程度上降低EPS的发生率,需要注意的是使用肌皮瓣及腹膜进行盆腔重建的方式有较高的切口感染发生率及死亡率,需谨慎选择[52]。
6 小结
恶性肿瘤施行根治性手术的目标在于最大程度获得肿瘤控制和保功能,维护患者的尊严和生活质量。PE正逐步成为部分LARC及LRRC患者存在全身多处转移且进展为恶病质状态前的挽救性根治手术,但施行PE势必以牺牲患者躯体器官完整功能以及术后生活质量为代价[47]。因而在手术前,手术团队需与患者及其家属坦诚沟通,反复权衡手术利弊,评估手术风险及手术获益,谨慎完成决策[5]。
关于如何选择适用的患者以及施行手术的时机目前尚无规范,术后管理策略、术后并发症及患者生活质量等诸多问题也未有统一的答案。随着现代影像学技术、监护治疗技术及外科技术的发展,我们对恶性肿瘤生物学行为的认识较PE最初发展年代已有很大的进步,但临床上对LARC及LRRC患者真正施行PE仍需持谨慎态度。PE由于其复杂性、系统性及不可预知性让其显现出独特的魅力,相信未来会有越来越多的高水平团队开展高质量研究,逐渐规范和推动PE在直肠癌诊疗领域的应用,造福更多患者。
利益冲突声明 全体作者均声明不存在与本文相关的利益冲突。