博落回提取物猪耐受性评价及其抗结肠炎机制
刘梦婷,吴聪明,彭旋,曾建国*
博落回提取物猪耐受性评价及其抗结肠炎机制
刘梦婷1,2,吴聪明3,4,彭旋5,曾建国1,2*
(1.中兽药湖南省重点实验室,湖南 长沙 410128;2.湖南农业大学动物医学院,湖南 长沙 410128;3.中国农业大学动物医学院,北京 100193;4.国家兽药残留基准实验室,北京 100193;5.湖南美可达生物资源股份有限公司,湖南 长沙 410331)
将健康的50头长大白杂交猪均分为5组,试验Ⅰ、Ⅱ、Ⅲ、Ⅳ组分别按每千克饲料添加博落回散30、150、300、600 mg混饲给药,相当于推荐临床剂量的1、5、10、20倍,对照组(CK)饲料中不添加博落回散,连续饲喂60 d,研究不同剂量博落回散对猪的生长性能、血液学指标、血清生化指标及组织病理学的影响,基于网络药理学探讨博落回提取物(MCE)抗结肠炎的潜在机制。结果表明,与CK相比,饲料中添加30 mg/kg的博落回散可显著提高试验猪的平均日增质量,显著降低料肉比,其他所用剂量的博落回散对试验猪的生长性能均无显著影响;饲料中添加30~600 mg/kg的博落回散的试验猪血液学和血清生化指标均无显著变化,且各脏器组织未见异常病理性损害。可见,饲料中添加30~600 mg/kg博落回散连续饲喂60 d,试验猪具有较好的耐受性。通过SwissTargetPrediction、Genecards、STRING等工具和数据库初步揭示了MCE可能是通过作用于ESR1、BCL2L1、MTOR、MCL1、PTGS2、MAPK8、MMP9、MAPK1、ERBB2和PIK3CA等靶点,并通过ErbB和TNF等信号途径发挥抗炎作用的。
猪;结肠炎;博落回散;博落回提取物;血根碱;白屈菜红碱;耐受性;生长性能;血液学指标;血清生化指标;组织病理学;网络药理学
博落回散是以原料药博落回提取物(MCE)制成的散剂,主要效用物质是血根碱(SAN)和白屈菜红碱(CHE),是中国首个可在商品饲料中长期添加的中兽药饲用替抗产品[1],具有抑菌消炎、开胃促生长的功能[2–4],目前广泛用于畜禽的健康养殖。大量饲养试验[5–6]表明,猪饲料中添加博落回散可提高猪的生长性能,降低机体炎症,改善肠道健康,其促生长效果与饲用抗生素相当。李长虹[5]研究表明,断奶仔猪饲料中添加博落回散(30 mg/kg)可显著提高仔猪的生长速度,降低料肉比,节约饲养成本;育肥猪饲料中添加博落回散(30 mg/kg)可提高育肥猪的血清抗氧化水平,提高屠宰性能,改善猪肉的颜色、pH值、失水率和系水力等胴体品质指标。夏超笃等[6]研究表明,断奶仔猪饲料中添加约50 mg/kg博落回提取物(SAN含量约1.6%)可提高断奶仔猪平均日增质量,降低料肉比和腹泻率。博落回散于2011年批准为新中兽药,并在饲用替抗和动物养殖过程中广泛应用。结合多年博落回散临床应用经验,将此前根据农业部第1596号公告发布的《兽用中药、天然药物临床试验技术指导原则》进行的相关试验结果公开,并结合网络药理学技术对已有信息进行挖掘,筛选出潜在的关键作用靶点和信号通路,分析博落回提取物潜在的抗结肠炎机制,旨在为开发MCE临床治疗药物制剂产品提供依据。
1 材料与方法
1.1 试验材料
博落回散由湖南美可达生物资源股份有限公司提供,其中100 g博落回散(总生物碱含量以SAN、CHE之和不低于2.25%,其中SAN不低于1.5%)中含3.75 g MCE(总生物碱含量以SAN、CHE之和不低于60%,其中SAN不低于40%);批号为20100315。饲料中添加使用,推荐添加剂量为30 mg/kg(以博落回散质量计)。
1.2 供试动物及分组
健康的50头长大白杂交猪,体质量(25±2) kg,由北京市昌平区苏三四养猪场提供。将试验猪随机分为5个组,每组10头(雌、雄各半)。Ⅰ、Ⅱ、Ⅲ、Ⅳ组分别给予添加30、150、300、600 mg/kg博落回散(以散剂含量计)的饲料;对照组(CK)给予不含博落回散的饲料。
1.3 试验饲料与饲养管理
饲料参考NRC(1998)标准[7]自行配制,不含任何饲用促生长抗生素。试验猪采用封闭式圈养,每组1圈,共5圈。自由采食和饮水。消毒和防疫按照猪场常规程序进行。连续喂养60 d。
1.4 测量指标及方法
1.4.1生长性能测定
整个试验期间,观察记录试验猪的健康状况及临床表现。分别称量各组猪在试验第1、31、61天早晨投料前的体质量。计算各组猪在1~30、31~60、1~60 d的平均日增质量。记录试验期间试验猪的投料量,计算各组猪在1~30、31~60、1~60 d的平均日采食量,并计算试验猪在各阶段的料肉比。
1.4.2血液学与血清生化指标测定
分别在第1、31、61天称量猪体质量的同时,对全部试验猪进行前腔静脉采血(10 mL/头),分装成2管,每管5 mL,其中1管加枸椽酸钠抗凝,采用血细胞分析仪(型号KX–21,SYSMEX)测定红细胞数(RBC)、白细胞数(WBC)、血红蛋白(HGB)、红细胞压积(HCT)、血小板计数(PLT)等血液学指标;采用全自动生化分析仪(型号7150,HITACHI)测定丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)活性和总蛋白(TPRO)、白蛋白(ALB)、尿素氮(UN)、肌酐(CRE)、血糖(GLU)含量等血液生化指标。
1.4.3大体剖检及组织病理学检查
试验结束时,对添加600 mg/kg博落回散组(Ⅳ组)和对照组(CK)的猪进行屠宰,剖检观察大体病变;同时采集肝、心、肺、脾、肠等主要脏器进行组织病理学检查。
1.5 网络药理学分析
1.5.1确定研究对象
已有研究[8]表明,MCE的主要活性成分为SAN和CHE,选择SAN和CHE为网络药理学的研究对象可较好反映MCE的分析结果。由于研究的疾病为肠道炎症,本研究不考虑口服利用度。化合物的SMILES从PubChem(https://pubchem.ncbi.nlm. nih.gov/)中获取[9–10]。
1.5.2靶点预测与疾病靶点获取
运用SwissTargetPrediction(http://www.swisstarg etprediction.ch/)对活性成分的潜在靶点进行预测[11]。结肠炎的靶点从GeneCards数据库(https://www. genecards.org/)中获取[12]。基因标签的获取和核对从UniProt数据库(http://www.uniprot.org/)获得,物种为智人()。
1.5.3蛋白互作分析与网络可视化
将化合物的预测靶点与结肠炎靶点取交集,将交集靶点基因导入STRING数据库(https://cn.string- db.org/)中进行蛋白质互作网络分析(PPI),物种为智人,并且剔除孤立节点,根据节点的度值进行评价。运用Cytoscape 3.7.1构建“药物–化合物–靶点–疾病”网络、蛋白质互作网络。使用CytoHubba插件的MCC算法筛选核心靶点。
1.5.4基因本体功能(GO)及京都基因与基因组百科全书(KEGG)通路富集分析
将得到的核心靶点录入David平台(https:// david.ncifcrf.gov),物种设置为“”,分析主要的生物学过程与代谢通路并进行富集分析。选取GO每个分类下的0.05的前10个条目及KEGG的前20个条目进行可视化处理。
1.6 数据统计分析
运用SPSS 12.00处理试验数据,采用ANOVA单因素方差分析法比较各组间的差异。
2 结果与分析
2.1 博落回散对猪生长性能的影响
从表1可知,与CK相比,试验Ⅰ组试验猪1~30、31~60、1~60 d的平均日增质量显著提高,料肉比显著降低,日采食量无显著变化;试验Ⅱ、Ⅲ、Ⅳ组试验猪1~30、31~60、1~60 d的日采食量、平均日增质量和料肉比则无显著变化。

表1 饲料中添加博落回散的猪的生长性能
“*”示与CK间的差异有统计学意义(<0.05)。
2.2 博落回散对猪血液学指标的影响
从表2可知,试验0、30、60 d时,试验猪各项血液学指标均在正常范围内,且各试验组间的差异均无统计学意义。
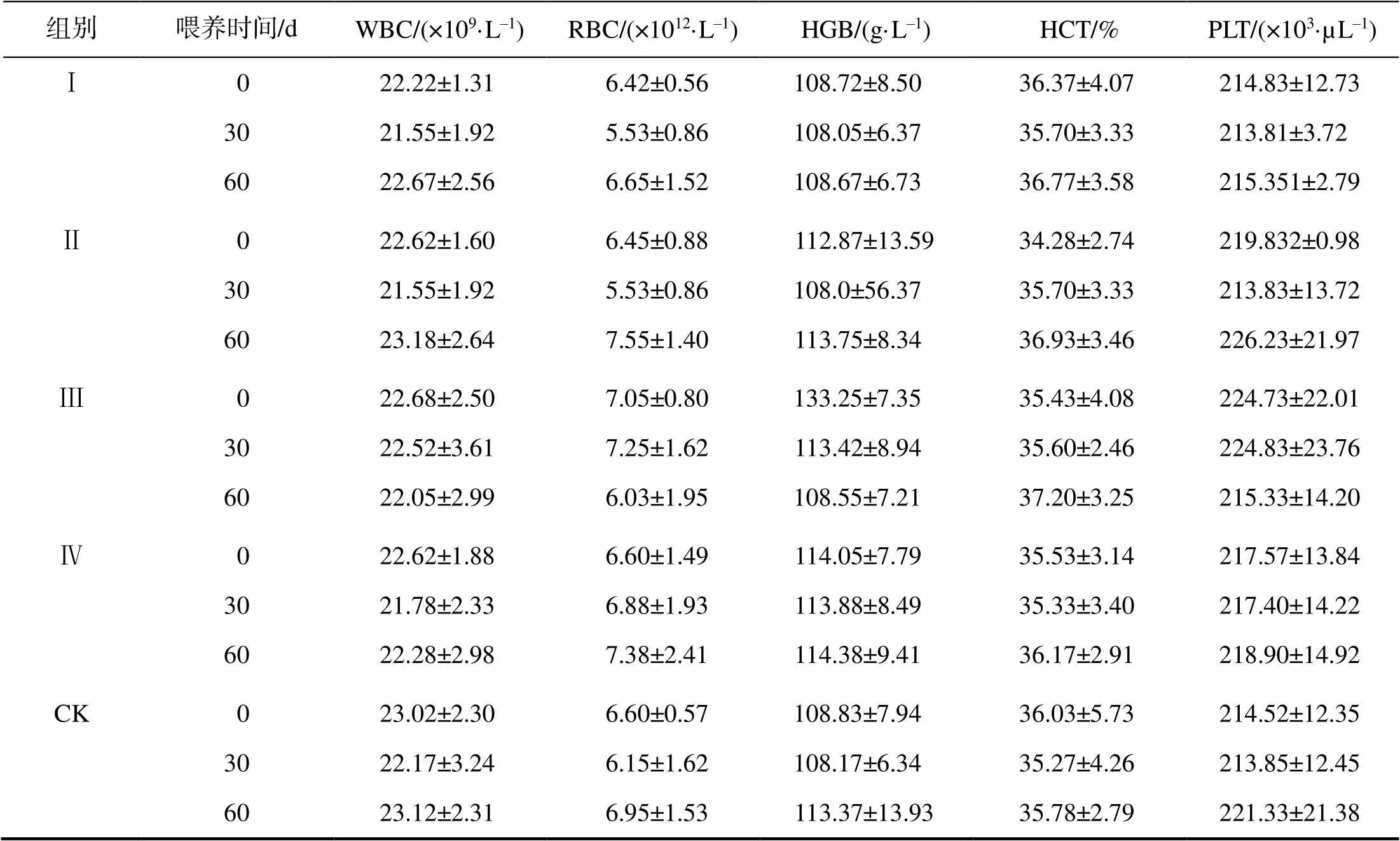
表2 饲料中添加博落回散的猪的血液学指标
2.3 博落回散对猪血清生化指标的影响
从表3可知,试验0、30、60 d时,试验猪各项血清生化指标均在正常范围值内,且各试验组间的差异均无统计学意义。

表3 饲料中添加博落回散的猪的血清生化指标
2.4 大体剖检及组织病理学检查结果
对各组试验猪进行大体剖检发现,试验组和CK猪主要脏器均未见明显病变。对猪进行组织病理学镜下检查,发现试验组和CK猪心肌细胞之间均无炎性细胞浸润;肝细胞核大且圆,核膜清楚;脾脏未见结缔组织增生;肺泡上皮细胞核、质清晰,肺泡腔清晰饱满;肠绒毛完整,排列整齐(图1)。可见,饲料中添加30~600 mg/kg的博落回散,对试验猪的脏器组织不产生任何病理性损害。

2.5 网络药理学分析结果
2.5.1靶点预测与疾病靶点获取结果
通过对SAN和CHE进行预测,分别获得了21和88个靶点;从GeneCards数据库中获得了5433个结肠炎相关靶点,筛选得到相关性分数大于1的靶点为1313个;SAN和CHE共有26个与结肠炎相关联的交集靶点。
2.5.2PPI分析与网络可视化结果
通过Cytoscape 3.7.1将MCE中的活性成分、结肠炎和交集靶点构建成“药物–成分–靶点–疾病”网络图(图2)。将交集靶点导入STRING数据库进行蛋白质互作分析,结果导入Cytoscape 3.7.1绘制PPI网络(图3);再利用Cytohubba插件中的MCC算法得到了网络中排名前10的核心靶点,即雌激素受体1(ESR1)、B淋巴细胞瘤–2样蛋白1 (BCL2L1)、哺乳动物雷帕霉素靶蛋白(MTOR)、髓样细胞白血病蛋白1(MCL1)、前列腺素内过氧化物合酶2(PTGS2)、丝裂原激活蛋白激酶8(MAPK8)、基质金属蛋酶–9(MMP9)、丝裂原激活蛋白激酶1(MAPK1)、表皮生长因子受体2(ERBB2)、磷脂酰肌醇–3–激酶催化亚单位α(PIK3CA)。

图2 MCE抗结肠炎作用的“药物–成分–疾病–靶点”网络

图3 MCE抗结肠炎作用靶点的PPI网络
2.5.3GO和KEGG富集分析结果
MCE富集得到84条抗炎信号通路(<0.05),根据值显著性选取前20条通路。GO富集显示,MCE参与45个生物过程、7个细胞定位和13个分子功能(<0.05)。图4显示了MCE相关生物富集下3个分类中的前10个条目(细胞定位不足10个),包括对一氧化氮生物合成过程的正向调节、对平滑肌细胞增殖的正向调节等生物过程,蛋白主要处于胞浆和细胞液等细胞环境,具有蛋白丝氨酸/苏氨酸激酶活性、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性等分子功能。图5显示了前20的信号通路,涉及了表皮生长因子受体(EGFR/ErbB)信号传导途径和肿瘤坏死因子(TNF)等炎症相关信号传导途径。

1~10为生物过程(1 失巢凋亡的负向调节,2 蛋白质磷酸化,3 内在凋亡信号通路的负向调节,4 细胞对活性氧的反应,5 细胞对镉离子的反应,6 细胞对氨基酸饥饿的反应,7 一氧化氮生物合成过程的正向调节,8 自噬的负向调节,9 凋亡过程的正向调节,10 对平滑肌细胞增殖的正向调节);11~17为细胞定位(11 胞浆,12 细胞液,13 线粒体外膜,14 Bcl 2家族蛋白复合物,15 线粒体,16 细胞膜穴样内陷,17 大分子复合体);18~27为分子功能(18 相同的蛋白质结合,19 蛋白丝氨酸/苏氨酸激酶活性,20 蛋白丝氨酸/苏氨酸/酪氨酸激酶活性,21 BH3结构域结合,22 ATP结合,23 激酶活性,24 MAP激酶活性,25 蛋白质异构化活性,26 酶结合,27 蛋白激酶结合)。

图5 MCE的KEGG分析结果
3 结论与讨论
博落回散的主要功能为抗菌消炎、开胃、促生长。CHEN等[13]研究了博落回散(SAN含量为1.5%)对断奶仔猪生长性能、免疫应答、抗氧化能力、肠道形态和微生物区系的影响,与CK相比,饲料中添加50 mg/kg MCE对断奶仔猪的生长性能、免疫状态、抗氧化能力和肠道健康都有一定的促进作用。ZHAO等[14]在仔猪饲料中添加100、500、1000 mg/kg博落回提取物(SAN含量1.5%),发现MCE组的猪体质量、采食量和日增质量等与CK的差异均无统计学意义,说明仔猪能够耐受饲料中添加1000 mg/kg博落回散。KANTAS等[15]在仔猪断奶期饲料中添加15、50 mg/kg博落回提取物(SAN含量1.5%),与CK相比,50 mg/kg组显著增加了猪体质量和平均日增质量,并降低了料肉比。本研究的结果与以上研究结果相似。秦克蕊[16]研究母猪攻胎期和哺乳期饲料中添加博落回散对母猪繁殖性能、机体炎症及后代仔猪生长性能的影响,发现在基础饲料中添加50 mg/kg博落回散(SAN含量1.5%)饲料可降低怀孕母猪血清中炎性因子水平,提升免疫球蛋白的浓度,改善母猪的免疫水平,同时对断奶仔猪的生长性能具有促进作用。杜莉等[17]研究了博落回及其提取物对哺乳母猪生产性能的影响,发现40 mg/kg MCE(SAN含量2%)可增加哺乳期母猪日采食量,提高母猪窝产仔数和仔猪窝重,降低仔猪腹泻率。以上母猪饲养试验再次说明博落回提取物不仅能促进动物生长,还能增强机体免疫,预防炎症引起的相关疾病。本研究中,在猪饲料中补充30 mg/kg博落回散(推荐给药剂量)安全性高,并可促进猪生长,连续60 d补充30~600 mg/kg博落回散(相当于1.125~22.5 mg/kg MCE)猪表现为较好的耐受性和安全性。
血液学和血清生化指标不仅与动物机体免疫功能、组织器官功能等有关,也与机体营养物质消化代谢、抗氧化能力等有密切联系;因此,血液学和血清生化指标可直接或间接反映动物的生长、发育和机体健康状态。本研究中,饲料中添加30~600 mg/kg的博落回散,对试验猪的血液学及血清生化指标均无显著影响。可见,试验猪饲料中添加30~600 mg/kg博落回散对猪无负面影响,在此范围内具有较好的耐受安全性。ZHAO等[14]在仔猪饲料中添加100、500、1000 mg/kg MCE(SAN含量1.5%),发现大多数血液学和血清生化指标及组织病理学结果在CK和MCE组之间没有显著变化。KOSINA等[18]评估了2、100 mg/kg MCE(SAN含量64%)在猪体内的安全性,结果发现连续饲喂60 d的试验猪的血液学、血清生化结果与CK无明显差异。本试验结果与其一致。
本研究中,基于网络药理学技术初步探究MCE发挥抗结肠炎效果的潜在作用机制。MCE可能是通过作用于ESR1、BCL2L1、MTOR、MCL1、PTGS2、MAPK8、MMP9、MAPK1、ERBB2和PIK3CA等靶点,并通过ErbB和TNF等信号途径发挥抗炎作用。雌激素通过靶向软骨细胞内ESR1,能够改变相关酶活性,如MAPK发挥生物学功能[19],ESR1被认为是IBD患者骨质疏松症的敏感标志物[20]。抗凋亡因子BCL–2和BCL–XL在克罗恩病的发病机制中起重要作用[21]。MTOR是一类丝/苏氨酸激酶,其稳定性影响T细胞中细胞因子的表达,参加调节细胞的生长、凋亡、自噬等,对炎症具有重要的调节作用[22]。增强mTOR依赖性自噬可抑制肠道炎症和氧化应激损伤[23]。PTGS2,即COX–2(诱导型)是前列腺素生物合成途径中重要的限速酶,在炎症反应中具有特殊作用,也是非甾体类抗炎药重要的作用靶点之一[24]。结肠炎症的特征是MAPK1,MAPK3和MAPK9的表达显著增加[25]。PIK3CA在细胞的吞噬作用中起调节作,用且与COX–2表达密切相关[26]。GO富集分析结果表明,核心靶点的生物学功能富集于胞浆和细胞液,并发挥着正向调节一氧化氮生物合成和平滑肌细胞增殖等作用。KEGG富集到的ErbB信号途径可促进炎性巨噬细胞凋亡,维持上皮细胞生存,并在抑制肠道炎症中发挥重要作用[27]。TNF在体内介导了广泛的细胞反应,在肿瘤、炎症、感染、免疫等多种生理病理过程中发挥着关键作用,TNF受体TNFR1下游涉及的信号通路中MAPK和NF–κB信号通路会引起炎症的发生[28]。
[1] 侯博,曾建国.血根碱的生物学活性及博落回提取物在动物生产中的应用[J].动物营养学报,2018,30(2):413–420.
[2] 王曼,敖翔,张立泰,等.博落回提取物对动物体的作用效果及机理[J].养猪,2020(3):30–32.
[3] 孙晓蛟,金海峰,闫研,等.不同抗生素替代品组合对断奶仔猪生长性能、腹泻及抗氧化能力的影响[J].中国畜牧兽医,2020,47(2):460–468.
[4] 周文,曲湘勇,刘华.博落回散和金霉素对白羽肉鸡生长性能、血液生化指标、肠道健康影响的比较研究[J].湖南饲料,2018(6):28–32.
[5] 李长虹.博落回散替代硫酸黏菌素在仔猪和育肥猪中的应用效果研究[D].长沙:湖南农业大学,2017.
[6] 夏超笃,黄彦,湛穗璋,等.博落回提取物对断奶仔猪生长性能、血清免疫指标及抗氧化指标的影响[J].中国畜牧兽医,2018,45(11):3070–3076.
[7] 李长忠,张宏福.NRC(1998)第十版猪营养需要量表[J].国外畜牧学(饲料),1998(3):37–48.
[8] 欧阳文,满意.博落回提取物中血根碱和白屈菜红碱的含量测定[J].化学工程师,2008,22(10):21–22.
[9] KIM S,THIESSEN P A,BOLTON E E,et al.PubChem substance and compound databases[J].Nucleic Acids Research,2015,44(D1):D1202–D1213.
[10] O'BOYLE N M.Towards a Universal SMILES represen- tation-A standard method to generate canonical SMILES based on the InChI[J].Journal of Cheminformatics,2012,4(1):22.
[11] DAINA A,MICHIELIN O,ZOETE V.Swiss Target Prediction:updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Research,2019,47(W1):W357–W364.
[12] STELZER G,ROSEN N,PLASCHKES I,et al.The GeneCards suite:from gene data mining to disease genome sequence analyses[J].Current Protocols in Bioinformatics,2016,54:1.30.1–1.30.33.
[13] CHEN J S,KANG B J,YAO K,et al.Effects of dietaryextract on growth performance,immune responses,antioxidant capacity,and intestinal development in weaned piglets[J].Journal of Applied Animal Research,2019,47(1):349–356.
[14] ZHAO L,VON ALVENSLEBEN S,FUSCONI G,et al. Safety evaluation of a standardizedextract in a ninety day feeding study in weaned piglets[J]. Open Journal of Animal Sciences,2017,7(2):213-231.
[15] KANTAS D,PAPATSIROS V G,TASSIS P D,et al. Efffect of a natural feed additive (Macleaya cordata),containing sanguinarine,on the performance and health status of weaning pigs[J].Animal Science Journal,2015,86(1):92–98.
[16] 秦克蕊.博落回散对母猪繁殖性能及后代仔猪生长性能的影响[D].长沙:湖南农业大学,2020.
[17] 杜莉,夏双双,汪德中,等.博落回及其提取物对哺乳母猪生产性能的影响[J].家畜生态学报,2017,38(4):44–47.
[18] KOSINA P,WALTEROVÁ D,ULRICHOVÁ J,et al. Sanguinarine and chelerythrine:assessment of safety on pigs in ninety days feeding experiment[J].Food and Chemical Toxicology,2004,42(1):85–91.
[19] 刘敏,谢巍伟,郑维,等.雌二醇与ESR1靶向结合通过ERK信号通路调控软骨细胞的增殖[J].南方医科大学学报,2019,39(2):134–143.
[20] KRELA-KAŹMIERCZAK I,SKRZYPCZAK- ZIELIŃSKA M,KACZMAREK-RYŚ M,et al.ESR1 gene variants are predictive of osteoporosis in female patients with Crohn’s disease[J].Journal of Clinical Medicine,2019,8(9):1306.
[21] LI Y,TIAN Y,ZHU W M,et al.Triptolide induces suppressor of cytokine signaling-3 expression and promotesmononuclear cells apoptosis in Crohn’s colitis[J].International Immunopharmacology,2013,16(2):268–274.
[22] COSIN-ROGER J,SIMMEN S,MELHEM H,et al. Hypoxia ameliorates intestinal inflammation through NLRP3/mTOR downregulation and autophagy activation[J]. Nature Communications,2017,8(1):98.
[23] ZHOU M X,XU W M,WANG J Z,et al.Boosting mTOR-dependent autophagy via upstream TLR4- MyD88-MAPK signalling and downstream NF-κB pathway quenches intestinal inflammation and oxidative stress injury[J].EBioMedicine,2018,35:345–360.
[24] ZHAO L J,YANG L D,ZHANG J,et al.Bmal1 promotes prostaglandin E 2 synthesis by upregulating Ptgs2 transcription in response to increasing estradiol levels in day 4 pregnant mice[J].American Journal of Physiology(Endocrinology and Metabolism),2021,320(4):E747–E759.
[25] QUAGLIO A E V,CASTILHO A C S,DI STASI L C. Experimental evidence of MAP kinase gene expression on the response of intestinal anti-inflammatory drugs[J]. Life Sciences,2015,136:60–66.
[26] PUUSTINEN P,KELDSBO A,CORCELLE-TERMEAU E,et al.DNA-dependent protein kinase regulates lysosomal AMP-dependent protein kinase activation and autophagy[J].Autophagy,2020,16(10):1871–1888.
[27] SCHUMACHER M A,HEDL M,ABRAHAM C,et al. ErbB4 signaling stimulates pro-inflammatory macrophage apoptosis and limits colonic inflammation[J]. Cell Death & Disease,2017,8(2):e2622.
[28] 苏萌,谭福雄,吕洁,等.基于网络药理学、分子对接及实验验证研究知母–黄柏药对抗炎的物质基础[J].天然产物研究与开发,2022,34(4):687–698.
Evaluate on pigs’ tolerance and anti-colitis mechanism ofextract
LIU Mengting1,2,WU Congming3,4,PENG Xuan5,ZENG Jianguo1,2*
(1.Hunan Key Laboratory of Traditional Chinese Veterinary Medicine, Changsha, Hunan 410128, China; 2.College of Veterinary Medicine, Hunan Agricultural University, Changsha, Hunan 410128, China; 3.College of Veterinary Medicine, China Agricultural University, Beijing 100193, China; 4.Reference Laboratory for the Test of Veterinary Drug Residues, Beijing 100193, China; 5.Hunan Micolta Biresource Co. Ltd, Changsha, Hunan 410331, China)
50 healthy Landrace×Large White pigs were randomly divided into 5 groups. The groups Ⅰ, Ⅱ, Ⅲ, Ⅳ were supplemented respectively with 30, 150, 300, 600 mg of Boluohui Pulvis per kilogram of feed, which were equivalent to 1, 5, 10, 20 times of the recommended clinical dose. While the control group(CK) was treated without Boluohui Pulvis. All groups were then fed for 60 days continuously and collected the effects of different doses of Boluohui Pulvis on growth performance, hematological indexes, serum biochemical indexes and histopathology of pigs. The potential mechanism ofextract(MCE) against colitis was explored based on network pharmacology at the same time. The results showed that 30 mg/kg of Boluohui Pulvis could significantly increase the average daily gain and reduce the feed conversion rate of the experimental pigs, and no significant effect on growth performance in other groups pigs were observed. The hematological and serum biochemical indexes of the experimental pigs in the 30-600 mg/kg group were not significantly changed, and no abnormal pathological damage was found in the organs and tissues of pigs. Therefore, pigs fed with 30-600 mg/kg Boluohui Pulvis for 60 days had good tolerance. With SwissTargetPrediction, Genecards, STRING and other tools and databases, it was revealed that MCE might play roles using ESR1, BCL2L1, MTOR, MCL1, PTGS2, MAPK8, MMP9, MAPK1, ERBB2 and PIK3CA and other signaling pathways such as ErbB and TNF exert anti-inflammatory effects.
pig; colitis; Boluohui Pulvis;extract; sanguinarine; chelerythrine; tolerance; growth performance; hematological index; serum biochemical index; histopathology; network pharmacology
S828.5
A
1007-1032(2022)03-0326-09
10.13331/j.cnki.jhau.2022.03.012
2022–04–07
2022–06–10
湖南省重点研发计划(2020NK2031)
刘梦婷(1997—),女,湖南益阳人,博士研究生,主要从事中兽药代谢残留及安全性评价研究,1907962477@qq.com;*通信作者,曾建国,博士,教授,主要从事中药资源研究与植物提取物、饲料添加剂与中兽药创制研究,zengjianguo@hunau.edu.cn
刘梦婷,吴聪明,彭旋,曾建国.博落回提取物猪耐受性评价及其抗结肠炎机制[J].湖南农业大学学报(自然科学版),2022,48(3):326–334.
LIU M T,WU C M,PENG X,ZENG J G.Evaluate on pigs’ tolerance and anti-colitis mechanism ofextract[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(3):326–334.
http://xb.hunau.edu.cn

责任编辑:邹慧玲
英文编辑:柳正

