银杏叶提取物通过JAK2/STAT3信号通路调控食管癌细胞EC9706增殖、凋亡、侵袭、迁移的研究
照日格吐,孙志刚,焦杰,刘悦
[1.内蒙古自治区人民医院胸外科,内蒙古 010020;2.湖北文理学院附属医院(襄阳市中心医院)消化内科,湖北襄阳 441021]
食管癌是临床常见的消化道恶性肿瘤。外科手术是早期患者主要的治疗方法,中晚期患者以放化疗为主,但效果欠佳,且毒副作用会加重患者痛苦;中医药治疗可帮助食管癌患者术后的调理和恢复,并能配合西医,改善患者的生活质量、延长生命,且毒副作用小,有相辅相成之效[1-4]。银杏叶提取物是从银杏叶中提取的有药理活性的混合物,主要成分包括黄酮类、萜内脂类、有机酸类等,具有保护神经系统、抗氧化和抗肿瘤等作用[5-6]。有研究报道银杏叶提取物能诱导乳腺癌MCF-7 细胞凋亡,抑制肿瘤细胞增殖[7];还可能通过抑制核转录因子-κB(nuclear factor-κB, NF-κB)信号通路抑制神经胶质瘤U87 细胞的增殖和侵袭,促进细胞凋亡[8];可能通过抑制胞外信号调节激酶(extracellular signal-regulated kinases, ERK)/NF-κB/基质金属蛋白酶-2(matrix metalloproteinase, MMP-2)信号通路抑制胃癌的侵袭转移[9]。然而银杏叶提取物对食管癌细胞的增殖、侵袭、迁移、凋亡的影响及机制尚不清楚。
信号转导子和转录激活子3(signal transducer and activator of transcription 3, STAT3)是一种细胞内重要的转录因子,在体内可被其最常见的上游激酶——酪氨酸激酶(tyrosine kinase, JAK)磷酸化激活,JAK/STAT3 信号通路的异常活化能促进肿瘤的发生、发展,JAK/STAT3 信号通路的靶向抑制剂可抑制肿瘤发展[10-11]。有研究[12]报道LINC01535 通过激活JAK/STAT3 通路促进食管鳞状细胞癌增殖并抑制凋亡。还有研究报道缺血性脑卒中后银杏叶提取物可通过抑制JAK2/STAT3 通路抑制星形胶质细胞脂质2(lipocalin-2, LCN2)表达并减轻神经炎症损伤[13]。然而银杏叶提取物是否通过JAK2/STAT3 信号通路影响食管癌细胞的增殖、凋亡、侵袭、迁移尚不清楚。基于此,本实验研究银杏叶提取物对食管癌细胞EC9706 的增殖、凋亡、侵袭、迁移的影响及其机制是否与JAK2/STAT3 信号通路有关,为中药治疗食管癌提供参考。
1 材料与方法
1.1 细胞、试剂和仪器
食管癌细胞EC9706 购自上海北诺生物科技有限公司。胎牛血清、RPMI 1640 培养基购自美国Gibco 公司,银杏叶提取物(纯度> 98%)购自上海彩佑实业有限公司,白细胞介素-6(Interleukin-6,IL-6)购自上海沪震实业有限公司,RIPA 蛋白裂解液、二辛可宁酸(BCA)试剂盒、细胞计数试剂盒8(CCK-8)购自北京凯瑞基生物科技有限公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙锭(PI)凋亡检测试剂盒购自上海信裕生物科技有限公司,Transwell 小室、Matrigel 胶购自美国BD 公司,一抗、二抗购自武汉维诺赛生物技术有限公司。CytoFLEX 流式细胞仪购自贝克曼库尔特公司。
1.2 细胞处理与分组
食管癌细胞EC9706 用含10%胎牛血清的RPMI 1640 培养液在37℃、5%二氧化碳培养箱培养,取对数生长期细胞进行实验。将EC9706 细胞以每孔10×104个细胞接种到6 孔板中,每孔体积100 μL,分别用100 mg/L、200 mg/L、400 mg/L 的银杏叶提取物培养,记为不同浓度银杏叶提取物组,用等量基础培养液培养的细胞作为对照组,用400 mg/L银杏叶提取物和20 ng/mL IL-6 培养的细胞为银杏叶提取物+IL-6 组。
1.3 CCK-8法检测细胞增殖活性
对照组,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组,银杏叶提取物+ IL-6 组,5 组细胞以2×104个/孔接种在6 孔板中,细胞培养48 h,每孔添加10 μL CCK-8 溶液,在酶标仪450 nm 波长处检测光密度(OD)值,代表细胞增殖活性。
1.4 流式细胞术检测细胞凋亡
对照组,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组,银杏叶提取物+IL-6 组,5 组细胞以2×104个/孔接种在6 孔板中,细胞培养48 h,室温下1 000 r/min 离心5 min,收集细胞;用预冷的PBS重悬细胞2 次,1 000 r/min 离心5 min,洗涤细胞;加入300 μL 的1×Binding Buffer 悬浮细胞;重悬后加入10 μL Annexin V-FITC,混匀后4℃避光孵育10 min, 再加入5 μL PI, 避光染色5 min。CytoFLEX 流式细胞仪检测细胞凋亡率。
1.5 Western blotting 检测Ki-67、Cleavedcaspase-3、MMP-2、MMP-9、p-JAK2、p-STAT3蛋白相对表达量
细胞裂解液提取对照组,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组,银杏叶提取物+IL-6 组的细胞总蛋白,用BCA 试剂盒定量。分别取50 μL 各组蛋白,煮沸10 min 变性后,进行聚丙烯酰胺凝胶电泳分离,电泳结束后通过电转移法将蛋白质转移至PVDF 膜上,封闭1 h;分别加稀释的一抗,4℃孵育过夜,次日取出PVDF 膜,PBST 充分漂洗(5 min×3 次),加入稀释的二抗,室温孵育60 min,PBST 充分漂洗(5 min×3 次)后,加入化学发光试剂显影。β-actin 为内参。用Image J 软件分析各蛋白条带的灰度值,蛋白相对表达量=目的条带/β-actin条带。其中,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组检测Ki-67、Cleaved-caspase-3 蛋白相对表达量;对照组、400 mg/L 银杏叶提取物组、银杏叶提取物+IL-6 组检测MMP-2、MMP-9、p-JAK2、p-STAT3 蛋白相对表达量。
1.6 Transwell实验检测细胞迁移和侵袭
采用8.0 μm 聚碳酸酯膜Transwell 小室进行实验。迁移实验:对照组、400 mg/L 银杏叶提取物组、银杏叶提取物+IL-6 组细胞用无血清培养基以1×104个/mL 的密度悬浮,将100 μL 悬浮液添加到上室,将600 μL 含血清的RPMI 1640 培养液添加到下室,温育48 h 后,用棉签小心地擦去聚碳酸酯膜表面上未迁移的细胞;4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,用PBS 轻轻清洗2 次。倒置显微镜下观察细胞计数。侵袭实验:用Matrigel胶包被Transwell 小室的上室,其余与细胞迁移实验步骤相同。
1.7 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较行t检验或方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组EC9706细胞OD值比较
对照组,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组,银杏叶提取物+IL-6 组,5 组细胞的OD 值分别为(1.246±0.08)、(1.015±0.09)、(0.602±0.05)、(0.418±0.04)及(1.108±0.11),5 组比较,经方差分析,差异有统计学意义(F=181.344,P=0.000);进一步两两比较,与对照组比较,不同浓度银杏叶提取物组EC9706 细胞的OD 值均降低(P<0.05),细胞活性降低,且呈浓度依赖性;银杏叶提取物+IL-6 组与400 mg/L 银杏叶提取物组比较,银杏叶提取物+IL-6组EC9706 细胞活性升高(t=17.895,P=0.000)。见图1。
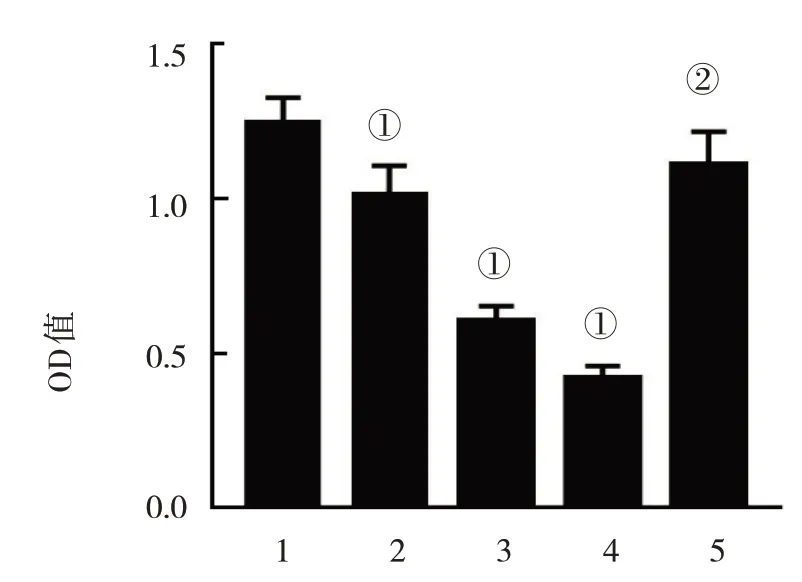
图1 各组EC9706细胞OD值的比较
2.2 各组EC9706细胞凋亡率的比较
对照组,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组,银杏叶提取物+IL-6 组,5 组的细胞凋亡率分别为(6.29±0.52)%、(10.03±0.91)%、(19.12±1.72)%、(25.09±2.13)%及(9.13±0.82)%,5 组比较,经方差分析,差异有统计学意义(F=301.217,P=0.000)。进一步两两比较,与对照组比较,不同浓度银杏叶提取物组EC9706 细胞凋亡率升高(P<0.05),且呈浓度依赖性;银杏叶提取物+IL-6 组与400 mg/L 银杏叶提取物组比较,银杏叶提取物+ IL-6 组EC9706 细胞凋亡率降低(t=21.639,P=0.000)。见图2。
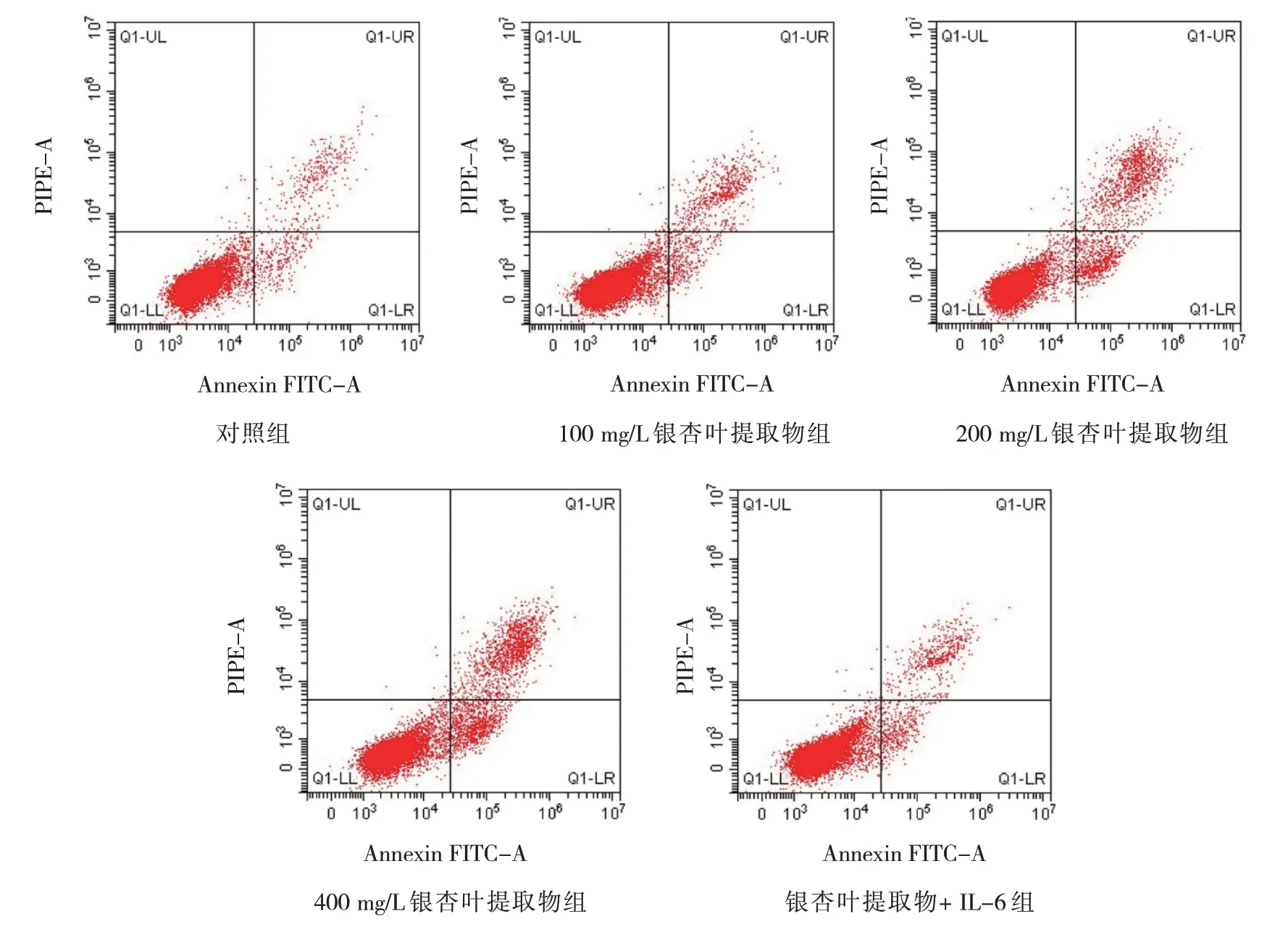
图2 各组EC9706细胞凋亡的流式细胞图
400 mg/L 银杏叶提取物能显著抑制EC9706 细胞增殖和促进细胞凋亡,故选取400 mg/L 银杏叶提取物为后续实验浓度。
2.3 各组细胞Ki-67、Cleaved-caspase-3、MMP-2、MMP-9、p-JAK2、p-STAT3 蛋白相对表达量的比较
对照组,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组,银杏叶提取物+IL-6 组细胞的Ki-67、Cleaved-caspase-3 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组Ki-67 蛋白相对表达量较对照组均降低(P<0.05),银杏叶提取物+IL-6 组Ki-67 蛋白相对表达量较400 mg/L 银杏叶提取物组升高(t=23.255,P=0.000);100 mg/L、200 mg/L、400 mg/L 银杏叶提取物组Cleaved-caspase-3 蛋白相对表达量较对照组均升高(P<0.05),银杏叶提取物+ IL-6 组Cleavedcaspase-3 蛋白相对表达量较400 mg/L 银杏叶提取物组降低(t=15.363,P=0.000)。对照组、400 mg/L银杏叶提取物组、银杏叶提取物+ IL-6 组细胞MMP-2、MMP-9、p-JAK2、p-STAT3 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,400 mg/L 银杏叶提取物组较对照组均降低(P<0.05),银杏叶提取物+IL-6 组较400 mg/L 银杏叶提取物组均升高(P<0.05)。见图3、4 和表1、2。

图3 对照组及不同浓度银杏叶提取物组细胞Ki-67、Cleaved-caspase-3、MMP-2、MMP-9、p-JAK2、p-STAT3蛋白的表达
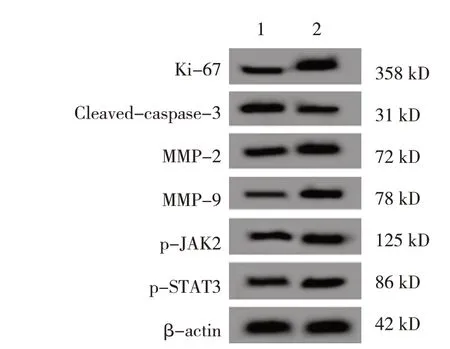
图4 400 mg/L银杏叶提取物组与银杏叶提取物+IL-6组细胞Ki-67、Cleaved-caspase-3、MMP-2、MMP-9、p-JAK2、p-STAT3蛋白的表达
表1 各组细胞Ki-67、Cleaved-caspase-3蛋白相对表达量的比较 (±s)

表1 各组细胞Ki-67、Cleaved-caspase-3蛋白相对表达量的比较 (±s)
注:①与对照组比较,P<0.05;②与100 mg/L 银杏叶提取物组比较,P <0.05;③与200 mg/L 银杏叶提取物组比较,P <0.05;④与400 mg/L银杏叶提取物组比较,P<0.05。
Cleaved-caspase-3 0.29±0.02 0.39±0.03①0.62±0.05①②0.79±0.07①②③0.37±0.03④200.719 0.000组别对照组100 mg/L银杏叶提取物组200 mg/L银杏叶提取物组400 mg/L银杏叶提取物组银杏叶提取物+IL-6组F 值P 值Ki-67 0.92±0.09 0.82±0.08①0.52±0.05①②0.35±0.03①②③0.88±0.06④130.856 0.000
表2 3组细胞MMP-2、MMP-9、p-JAK2、p-STAT3蛋白相对表达量的比较 (±s)
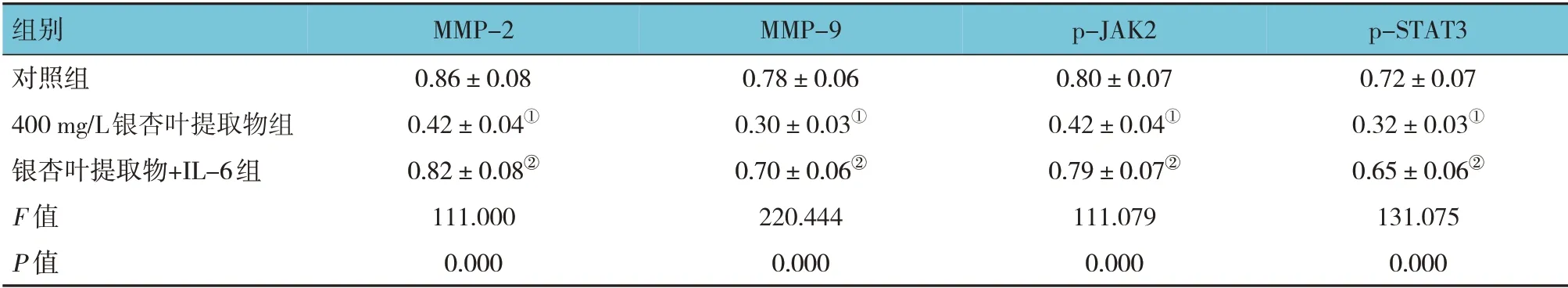
表2 3组细胞MMP-2、MMP-9、p-JAK2、p-STAT3蛋白相对表达量的比较 (±s)
注:①与对照组比较,P<0.05;②与400 mg/L银杏叶提取物组比较,P<0.05。
组别对照组400 mg/L银杏叶提取物组银杏叶提取物+IL-6组F 值P 值p-STAT3 0.72±0.07 0.32±0.03①0.65±0.06②131.075 0.000 MMP-2 0.86±0.08 0.42±0.04①0.82±0.08②111.000 0.000 MMP-9 0.78±0.06 0.30±0.03①0.70±0.06②220.444 0.000 p-JAK2 0.80±0.07 0.42±0.04①0.79±0.07②111.079 0.000
2.4 3组EC9706细胞迁移数和细胞侵袭数的比较
对照组、400 mg/L 银杏叶提取物组及银杏叶提取物+ IL-6 组EC9706 细胞迁移数、细胞侵袭数比较,差异有统计学意义(P<0.05);进一步两两比较,400 mg/L 银杏叶提取物组EC9706 细胞迁移数、细胞侵袭数较对照组减少(t=19.004 和15.264,均P=0.000),银杏叶提取物+ IL-6 组EC9706 细胞迁移数、细胞侵袭数较400 mg/L 银杏叶提取物组增多(t=18.264 和10.619,均P=0.000)。见表3和图5。
表3 3组EC9706细胞迁移数和细胞侵袭数的比较(个,±s)
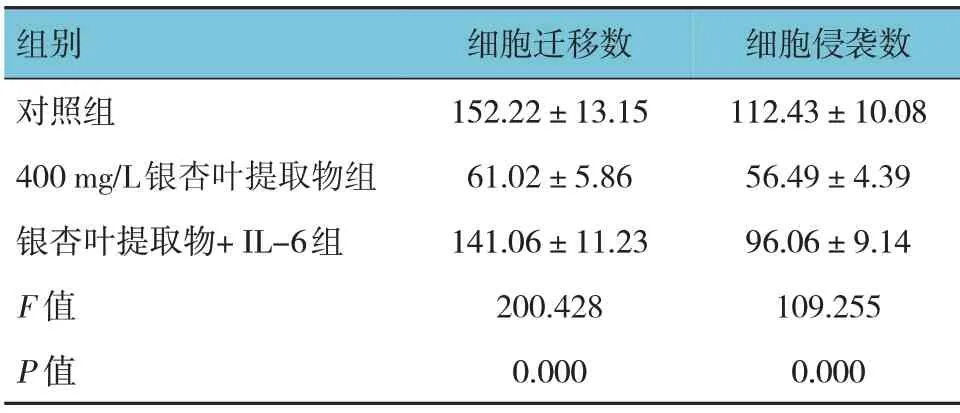
表3 3组EC9706细胞迁移数和细胞侵袭数的比较(个,±s)
组别对照组400 mg/L银杏叶提取物组银杏叶提取物+IL-6组F 值P 值细胞迁移数152.22±13.15 61.02±5.86 141.06±11.23 200.428 0.000细胞侵袭数112.43±10.08 56.49±4.39 96.06±9.14 109.255 0.000
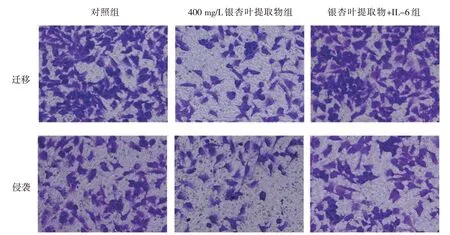
图5 3组EC9706细胞的迁移和侵袭 (倒置显微镜×200)
3 讨论
中医药在防治食管癌术后的并发症、减轻放化疗的毒副作用等方面起重要作用,能延长患者的生存期、提高患者的生活质量,提高患者的综合治疗效果[14-16]。有研究[17]报道银杏叶提取物能够抑制甲状腺癌细胞的增殖、侵袭、迁移能力,还能通过调控凋亡相关蛋白p53、Bcl-2、Bax 的表达而促进细胞凋亡,且呈现浓度依赖性。银杏叶提取物还可通过调控PI3K/Akt 信号通路抑制甲状腺癌TPC-1 细胞株的增殖[18]。银杏叶提取物可抑制小鼠黑素瘤B16 细胞增殖,使细胞周期阻滞于G0/G1期,并诱导细胞凋亡[19]。银杏叶提取物可能通过抑制蛋白激酶B(protein kinase B, Akt)和p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases, p38 MAPK)通路下调热休克蛋白27(heat-shock protein 27, HSP27)的表达,从而降低非小细胞肺癌细胞系A549 和H441 的迁移能力[20]。本研究结果显示,不同浓度银杏叶提取物组食管癌细胞EC9706 与对照组比较,Ki-67、MMP-2、MMP-9 蛋白表达降低,Cleavedcaspase-3 蛋白表达升高,细胞活性降低,细胞凋亡率升高,细胞迁移数和细胞侵袭数降低。表明银杏叶提取物可抑制食管癌细胞EC9706 增殖、侵袭、迁移,并促进细胞凋亡。
JAK/STAT3 信号通路是细胞信号通路中重要的信号传导通路之一,对细胞凋亡和增殖有关键作用,影响肿瘤的发生发展[21]。有研究[22]表明中医药可通过调节JAK/STAT3 信号通路影响肿瘤的进展,如姜黄素可以通过抑制JAK/STAT3 信号通路促进骨巨细胞瘤的凋亡,抑制其迁移、侵袭。竹节香附素通过抑制JAK/STAT3 信号转导通路抑制人子宫内膜癌HEC-1-B 细胞的侵袭转移[23]。黄芪多糖可能通过沉默JAK2/STAT3/c-myc 信号通路抑制口腔鳞癌细胞SCC-25 移植瘤的生长[24]。本研究结果显示,银杏叶提取物处理的食管癌细胞EC9706 中p-JAK2、p-STAT3 蛋白表达降低,这提示银杏叶提取物可抑制JAK2/STAT3 信号通路的激活。有研究[25]表明IL-6可激活JAK/STAT3 信号通路,因此本研究用IL-6 和银杏叶提取物同时作用食管癌细胞EC9706,研究激活JAK/STAT3 信号通路是否影响银杏叶提取物对食管癌细胞EC9706 的作用。本研究结果显示,经过IL-6 处理后,EC9706 细胞活性升高,凋亡率降低,细胞迁移数、细胞侵袭数增多,表明IL-6 可以逆转银杏叶提取物对EC9706 细胞增殖、凋亡、迁移、侵袭的影响。经过IL-6 处理后,细胞中Ki-67、MMP-2、MMP-9 蛋白表达均升高,Cleaved-caspase-3、p-JAK2、p-STAT3 蛋白表达均降低,表明IL-6 可通过激活JAK2/STAT3 信号通路作用于食管癌细胞EC9706。
综上所述,银杏叶提取物可能通过阻断JAK2/STAT3 信号通路抑制食管癌细胞EC9706 增殖、侵袭、迁移,促进细胞凋亡。

