缺血性脑卒中后认知障碍患者血清肺腺癌转移相关转录因子-1及硫氧还蛋白互作蛋白水平的变化及意义*
谭双,李相华,刘春芹,李永秋
(唐山市工人医院神经内科,河北唐山 063003)
缺血性脑卒中又称脑梗死,是由血管阻塞、痉挛等原因造成脑部血流不畅诱发的脑组织缺氧缺血性坏死,可伴有不同程度的偏瘫、神经功能损伤、失语等功能丧失[1-2]。认知障碍是缺血性脑卒中最常见的精神并发症之一,发生率高达50%~75%,常导致患者的社交能力、神经功能、日常活动能力降低,影响康复进程[3]。因此,如何早期识别缺血性脑卒中后认知障碍的高危人群是临床亟待解决的问题。目前,脑卒中后认知障碍的具体发病机制尚不明确。主流学说包括血管内皮细胞功能障碍、氧化应激反应、神经元凋亡等[4-5]。有动物实验[6]证实,肺腺癌转移相关转录因子1(metastasis-associated lungadenocarcinoma transcript 1,MALAT1)可通过激活PI3K/Akt 信号通路发挥抑制脑微血管内皮细胞凋亡、促进细胞自噬与存活的作用。硫氧还蛋白互作蛋白(thioredoxin-interacting protein, TXNIP)属于一种硫氧还蛋白调节蛋白,可促进活性氧产生,抑制硫氧还蛋白的活性,加重氧化应激反应,从而促进细胞凋亡。国内研究发现[7],TXNIP 水平升高可能是2 型糖尿病患者认知障碍的危险因素。但目前尚不清楚血清MALAT1、TXNIP与脑卒中后认知障碍的关系。本研究拟分析缺血性脑卒中后认知障碍患者血清MALAT1、TXNIP 水平与认知障碍的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年2月—2021年4月就诊于唐山市工人医院的150 例缺血性脑卒中患者。其中,男性91 例,女性59 例;年龄43~72 岁,平均(64.15±4.38)岁;发病至入院时间为(47.96±6.34)h;体质量指数(BMI)为(23.59±1.46)kg/m2;受教育时间为(10.37±2.24)年;糖尿病50 例,高血压105 例;脑梗死分型:前循环81 例,后循环62 例,前后循环7 例。纳入标准:经头颅MRI 或CT 等证实为新发缺血性脑卒中,且符合《中国急性缺血性脑卒中诊治指南2018》[8]的诊断标准;发病至入院时间<72 h;患者或家属自愿并签署知情同意书。排除标准:伴有进行性中枢神经系统疾病,如脑卒中后出血等;合并中枢神经系统脱髓鞘疾病、精神疾病、精神发育迟缓、癫痫、颅脑外伤等可引起认知功能变化的疾病;合并肝肾疾病、恶性肿瘤、系统性红斑狼疮;伴有感觉障碍、交流障碍。本研究经医院医学伦理委员会审核批准。
1.2 样本量计算
样本量的估算参照文献[9],两单样本均数检验或均数的配对检验时样本含量的估算方法如下:n=[(Zα/2+Zβ)σ/δ]2,计算得出单组最小样本量(n=35),考虑20%的剔除或脱落,单组最小样本量预计42 例。
1.3 认知障碍评定及分组
根据蒙特利尔认知评估量表(MoCA)[10]进行认知障碍评定。MoCA 共8 个认知领域的11 个检查项目,满分30 分,包括视空间/执行功能、命名、记忆、注意力、语言、抽象、延迟回忆、定向力,在校正受教育程度偏倚情况下,MoCA< 26 分视为认知障碍。根据MoCA 评分结果将患者分为研究组(缺血性脑卒中后认知障碍)58 例和对照组(缺血性脑卒中未伴有认知障碍)92 例。两组的性别构成、年龄、发病至入院时间、BMI、受教育时间、糖尿病、高血压、脑梗死分型比较,差异无统计学意义(P>0.05)。见表1。
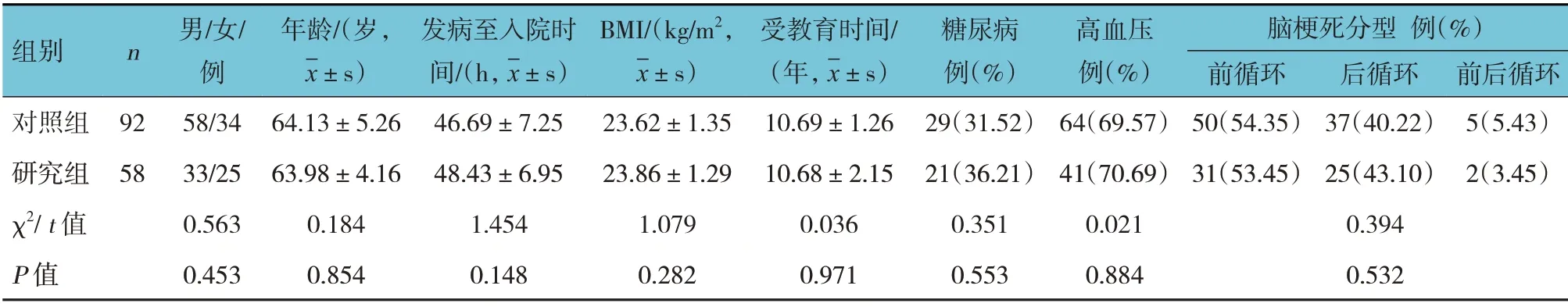
表1 两组一般资料比较
1.4 酶联免疫吸附试验检测血清MALAT1、TXNIP水平
采集所有患者治疗前空腹静脉血3 mL,Allegra X-15R 台式冷冻离心机(贝克曼库尔特公司)3 000 r/min 离心5 min,离心半径为6 cm,分离血清,取上清液置于-86℃ARCTIKO 生物医学制冷系统(森西科技有限公司)冷冻保存待测。采用酶联免疫吸附试验测定血清MALAT1、TXNIP 水平,试剂盒购自上海江莱生物科技有限公司。
1.5 磁共振波谱水平
治疗前,通过美国GE signa Hi-Speed 1.5T 超导型MRI 系统及配套的正交头线圈,点解析波谱序列,选择T2 加权像。磁共振波谱感兴趣范围涉及双侧额叶白质在内的侧脑室体部前方层面,扫描前机器自动匀场,抑水,获得波谱谱线。通过波谱高级分析软件分析谱线,自动检测高信号区(1)与对侧相应部位(2)的肌酸(Cr)、N-乙酰天门冬氨酸(NAA)、胆碱复合物(Cho)、乳酸(Lac)及各谱下面积(相对信号强度),由于Lac 在梗死灶对侧相应部位缺如,Lac 变化由高信号区中Lac 面积与对侧相应部位Cr 面积比值Lac1/Cr2 来表示,并计算Cr1/Cr2、NAA1/NAA2、Lac1/Cr2、Cho1/Cho2 值。
1.6 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以构成比或率(%)表示,比较采用χ2检验;相关性分析采用Pearson 法;绘制ROC 曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前血清MALAT1、TXNIP水平比较
两组治疗前血清MALAT1、TXNIP 水平比较,经t检验,差异有统计学意义(P<0.05),研究组高于对照组。见表2。
表2 两组治疗前血清MALAT1及TXNIP水平比较(pg/mL,±s)
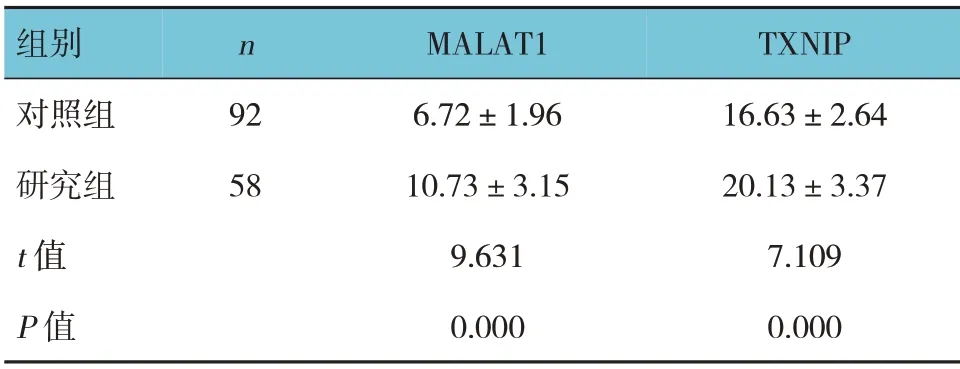
表2 两组治疗前血清MALAT1及TXNIP水平比较(pg/mL,±s)
组别对照组研究组t 值P 值n 92 58 MALAT1 6.72±1.96 10.73±3.15 9.631 0.000 TXNIP 16.63±2.64 20.13±3.37 7.109 0.000
2.2 两组治疗前MoCA评分比较
两组治疗前MoCA 各维度及总评分比较,经t检验,差异有统计学意义(P<0.05),研究组MoCA各维度及总评分低于对照组。见表3。
表3 两组治疗前MoCA评分比较 (分,±s)
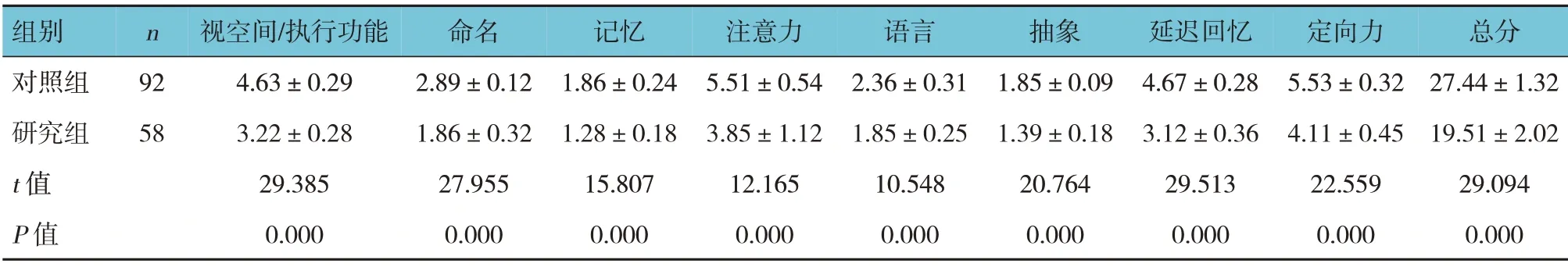
表3 两组治疗前MoCA评分比较 (分,±s)
组别对照组研究组t 值P 值n 92 58视空间/执行功能4.63±0.29 3.22±0.28 29.385 0.000命名2.89±0.12 1.86±0.32 27.955 0.000记忆1.86±0.24 1.28±0.18 15.807 0.000注意力5.51±0.54 3.85±1.12 12.165 0.000语言2.36±0.31 1.85±0.25 10.548 0.000抽象1.85±0.09 1.39±0.18 20.764 0.000延迟回忆4.67±0.28 3.12±0.36 29.513 0.000定向力5.53±0.32 4.11±0.45 22.559 0.000总分27.44±1.32 19.51±2.02 29.094 0.000
2.3 两组治疗前磁共振波谱水平比较
两组Cr1/Cr2 比较,经t检验,差异无统计学意义(P>0.05);两组NAA1/NAA2、Cho1/Cho2、Lac1/Cr2比较,经t检验,差异有统计学意义(P<0.05),研究组NAA1/NAA2 低于对照组,Cho1/Cho2、Lac1/Cr2 高于对照组。见表4。
表4 两组治疗前磁共振波谱水平比较 (±s)
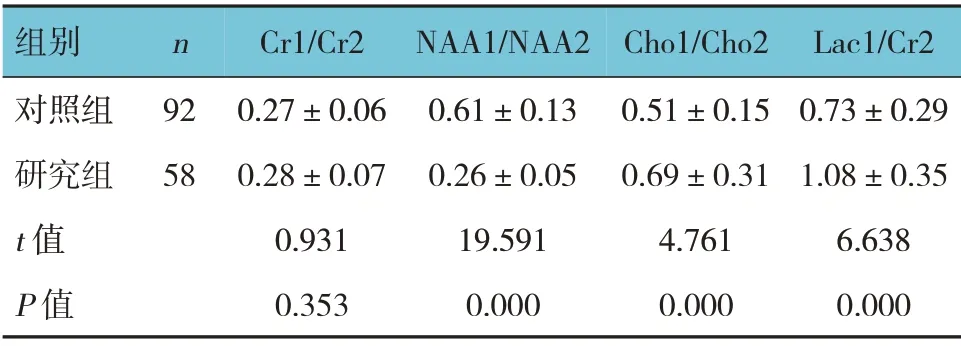
表4 两组治疗前磁共振波谱水平比较 (±s)
组别对照组研究组t 值P 值n 92 58 Cr1/Cr2 0.27±0.06 0.28±0.07 0.931 0.353 NAA1/NAA2 0.61±0.13 0.26±0.05 19.591 0.000 Cho1/Cho2 0.51±0.15 0.69±0.31 4.761 0.000 Lac1/Cr2 0.73±0.29 1.08±0.35 6.638 0.000
2.4 缺血性脑卒中后患者血清MALAT1、TXNIP水平与MoCA评分、磁共振波谱水平的相关性
双变量Pearson 直线相关性分析结果显示,缺血性脑卒中后患者血清MALAT1、TXNIP 水平与MoCA 总分(r=-0.623 和-0.512,均P=0.000)、NAA1/NAA2(r=-0.459 和-0.413,均P=0.000)呈负相关,与Cho1/Cho2(r=0.569 和0.496,均P=0.000)、Lac1/Cr2(r=0.523 和0.475,均P=0.000)呈正相关。见表5。
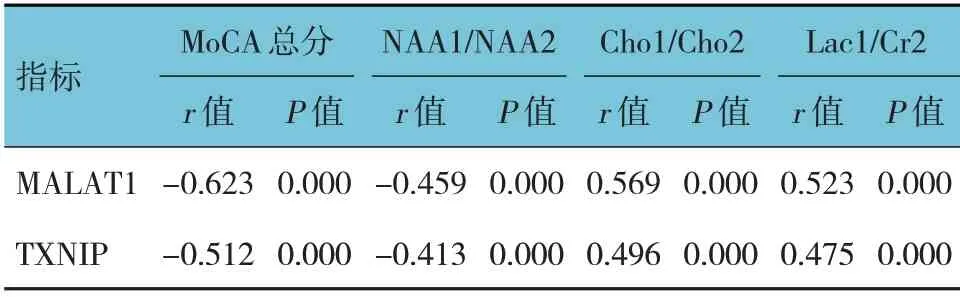
表5 缺血性脑卒中后患者血清MALAT1、TXNIP水平与MoCA评分、磁共振波谱水平的相关性
2.5 血清MALAT1、TXNIP水平对认知障碍发生的预测效能
ROC 曲线结果显示,血清MALAT1、TXNIP 及两者联合预测缺血性脑卒中后认知障碍发生的AUC 分别为0.860(95% CI:0.796,0.924)、0.780(95% CI:0.703,0.856)及0.890(95% CI:0.834,0.945),敏感性分别为86.7%(95% CI: 0.776,0.933)、78.3%(95%CI:0.711,0.863)、90.2%(95% CI:0.839, 0.951),特异性分别为79.7%(95% CI:0.702, 0.869)、71.2%(95% CI: 0.612, 0.798)、85.1%(95%CI:0.736,0.915)。见图1和表6。
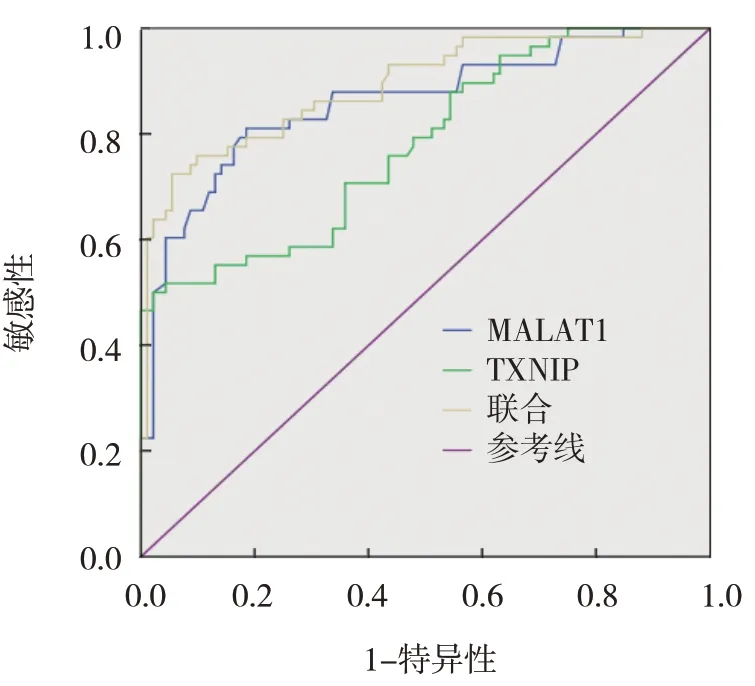
图1 血清MALAT1、TXNIP水平及两者联合预测缺血性脑卒中后认知障碍发生的ROC曲线
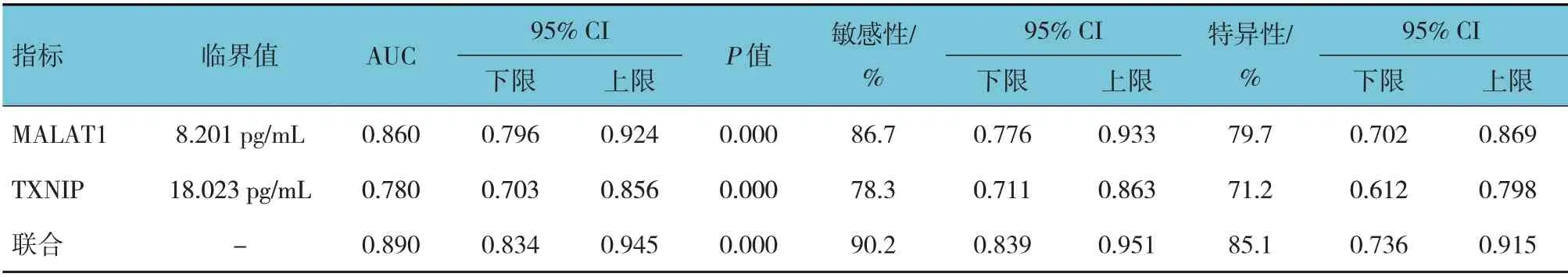
表6 血清MALAT1、TXNIP水平及两者联合对缺血性脑卒中后认知障碍发生的预测效能分析
3 讨论
缺血性脑卒中出现认知障碍不仅是由脑血管血流动力学改变造成颅内缺氧缺血所致,也可能与氧化应激反应、血脑屏障受损及慢性炎症反应等原因造成的细胞凋亡坏死、颅内神经元损伤有关[11]。认知障碍主要是指机体认知与获取知识的智能加工过程中的精神、语言、记忆、情感等社会行为出现异常而诱发的病变过程[12]。缺血性脑卒中血管闭塞、血流量降低,常诱发脑细胞营养、氧气缺乏性疾病,故伴有认知障碍的风险较高,若未及时治疗,最终可进展为血管性痴呆[13]。因此,早期识别缺血性脑卒中后认知障碍的高危人群在制订治疗方案、改善预后中尤为关键。
MALAT1 可调控其他转移相关基因的表达和功能来发挥生物学功能。CHEN 等[14]研究发现,MALAT1 在脑组织中表达上调,其通过激活细胞外信号调节激酶(ERK)/丝裂原活化蛋白激酶(MAPK)信号通路抑制细胞凋亡,促进神经突向外生长,在神经元分化早期阶段发挥关键作用。FANG 等[15]研究报道,MALAT1 高表达可通过海绵作用降低miR-429 表达,造成海马神经元凋亡,减轻右美托咪定对缺氧缺血性脑损伤的脑保护作用。WANG 等[16]发现,小鼠脑微血管内皮细胞IR 模型中MALAT1 水平异常上升,且MALAT1 可通过下调miR-26b 水平而抑制自噬激活激酶-2(ULK2)表达,从而促进脑微血管内皮细胞存活、自噬。由此可见,MALAT1可能通过调控离子浓度、mRNA 表达等途径而参与神经系统疾病发生、发展过程,但不同的神经系统相关疾病中MALAT1 表达高低和作用机制存在差异。本研究中,研究组血清MALAT1 水平比对照组高,与MoCA 总分、NAA1/NAA2 呈负相关,与Cho1/Cho2、Lac1/Cr2 呈正相关,可见缺血性脑卒中后认知障碍患者血清MALAT1 水平异常升高,且MALAT1 水平与磁共振波谱水平、认知功能有关。
硫氧还蛋白具有维持体内细胞内外氧还原平衡、清除自由基等作用,可通过抑制凋亡信号调节激酶(ASK-1)及转录因子等途径参与抗凋亡细胞内信号传导、抗氧化应激等过程[17-18]。LOVELL 等[19]于2000年首次将硫氧还蛋白用于神经系统领域,用硫氧还蛋白培养海马区神经元细胞,结果发现,神经元细胞存活率提升至60%,证实硫氧还蛋白可保护神经元细胞。TXNIP 介导氧化应激反应,生成丙二醛等大量氧化应激物质,从而消耗硫氧还蛋白。NAGARAJ 等[20]研究发现,TXNIP 过表达可增加活性氧簇(ROS)的产生,导致细胞的氧化损伤。TSUBAKI 等[21]报道,TXNIP 通过与核苷酸结合域、NOD 样受体蛋白3(NLRP3)炎症复合物相互作用,直接参与炎症激活过程,且与阿尔茨海默病等神经退行性疾病的炎症反应、氧化应激及血管功能障碍有关。由上述研究发现,TXNIP 通过抑制硫氧还蛋白系统的功能而发挥介导氧化应激及炎症反应、抑制细胞增殖、诱导细胞凋亡等作用,故推测TXNIP 可能与认知功能有关。杨波等[22]研究发现,急性轻中度脑梗死患者血清TXNIP 水平上升,且水平与MMSE 评分呈负相关。本研究中,研究组血清TXNIP 水平均比对照组高,血清TXNIP 水平与MoCA 总分、NAA1/NAA2 呈负相关,与Cho1/Cho2、Lac1/Cr2 呈正相关,部分结论与上述研究相似,再次证实血清TXNIP 水平与缺血性脑卒中后认知障碍的发生及磁共振波谱水平密切相关。其原因可能在于TXNIP 与硫氧还蛋白相结合致ASK-1 从硫氧还蛋白分离,激活其下游促凋亡基因Caspase-3,从而诱导细胞凋亡,加重脑血管功能损伤程度,不利于脑发育;TXNIP 高表达可加剧炎症反应,而炎症反应可诱导神经毒性物质大量产生,经ROS、MAPK 等途径而对海马长时程产生影响,损伤神经元,增加血脑通透性,从而降低患者认知功能。本研究进一步绘制ROC 曲线发现,血清MALAT1、TXNIP 及两者联合预测缺血性脑卒中后认知障碍发生的AUC 分别为0.860、0.780 和0.890,可见监测血清MALAT1、TXNIP 水平变化可能是缺血性脑卒中后认知障碍发生防治、药物研发新的作用靶点。
综上所述,缺血性脑卒中后认知障碍患者血清MALAT1、TXNIP 水平呈高表达,两者水平与患者的认知功能、磁共振波谱水平密切相关,且两者联合可有效预测认知障碍的发生。但本研究仍存在一定局限性,如样本来源单一、数量少,未随访统计患者预后,且未分析血清MALAT1 和TXNIP 之间的相关性,未动态监测治疗后MALAT1、TXNIP 水平变化,故后期应将此作为研究重点,进一步阐明MALAT1、TXNIP 在认知障碍中的功能及分子机制。

