SFBR联合贝伐珠单抗对结肠癌脉管系统的影响*
岳宏程,祝德,许加华,何海林,张洪洋,岳兴家,张建文,熊良庚
(1.巴中市中心医院肿瘤科,四川巴中 636000;2.西南医科大学附属医院肿瘤科,四川泸州 646000;3.重庆市巴南区人民医院肿瘤科,重庆 401320)
结肠癌是我国常见的恶性肿瘤[1],该肿瘤组织中微血管(Microvessel, MV)、淋巴管(lymphatic vessel, LV)、血管生成拟态(vasculogenic mimicry,VM)等脉管系统丰富,肿瘤通过其获取营养,并发生侵袭和转移。贝伐珠单抗为传统的抗血管生成分子靶向药物,其通过抑制肿瘤MV 生成,从而阻断肿瘤血液供应,达到抑制肿瘤生长的目的。但贝伐珠单抗对LV、VM 无效。肿瘤对贝伐珠单抗的敏感性随治疗时间的延长逐渐降低。探索抑制结肠癌的综合治疗方式成为当前结肠癌治疗的研究热点。放疗联合贝伐珠单抗在乳腺癌、大脑胶质瘤的治疗中获得了理想的疗效,毒副作用较轻[2-3]。但尚未见二者联合治疗结肠癌的报道。本实验通过复制结肠癌移植瘤模型,观察单次近距离放疗(singlefraction brachytherapy, SFBR)联合贝伐珠单抗对结肠癌脉管系统和肿瘤生长的影响,为结肠癌治疗方案的设计提供理论依据。
1 材料与方法
1.1 材料
结肠癌CT26 细胞株由西南医科大学附属医院肿瘤科提供;BALB/c 小鼠36 只,雌性,4~5 周龄,体重16~22g,购自重庆腾鑫华阜实验动物销售有限公司(合格证编号:11401300024918),饲养于西南医科大学附属医院肿瘤科动物房;Ir192三维后装近距离治疗机(荷兰Nucletron 公司);贝伐珠单抗注射液(山东齐鲁制药有限公司,规格:100 mg/4 mL);抗小鼠CD31、D2-40 单克隆抗体、过碘酸-雪夫(PAS)染色试剂盒(美国Bio World 公司)。
1.2 方法
1.2.1 模型复制及处理取对数生长期的CT26 细胞接种于BALB/c 小鼠右侧后腿皮肤,约8~10 d 后成瘤(可以触及直径约5 mm 瘤结节)。成瘤后隔天检查移植瘤生长状态,测量移植瘤长短径,计算其体积(V)。待移植瘤直径达8~10 mm 时将小鼠随机分为4 组。①空白对照组:经尾静脉注射生理盐水0.2 mL,注射1 d;②SFBR 组:将放疗插植针沿肿瘤长轴插入肿瘤内,对小鼠进行CT 扫描,并勾画靶区GTV,制定放疗计划。连接后装放疗机,释放放射源进入插植针中,对肿瘤进行近距离放疗,剂量(Dt)=10 Gy/F×1 d。③贝伐珠单抗组:经尾静脉注射贝伐珠单抗5 mg/kg,0.2 mL,注射1 d。④联合组:在同一天分别进行SFBR 和贝伐珠单抗的注射,方法同前。治疗后第14 天处死小鼠,剥去肿瘤,切取部分肿瘤组织用于流式细胞术检测,其余部分立即用10%中性甲醛溶液固定,常规石蜡包埋、切片,用于免疫组织化学检测。
1.2.2 移植瘤体积检测从肿瘤接种后第10 天开始,每2 天测量小鼠移植瘤的长径(a)与短径(b),按公式计算移植瘤体积:V=1/2(a×b2),并求各组肿瘤体积平均值。待移植瘤直径达8~10 mm 时将小鼠随机分组并进行治疗,治疗后第14 天计算肿瘤生长抑制率(tumor growth inhibition rate, TGIR)。TGIR=(对照组肿瘤V-实验组肿瘤V)/对照组肿瘤V×100%。
1.2.3 肿瘤最大标准摄取值(maximum standard up‐take value,SUVmax)检测先通过尾静脉注射利多卡因将小鼠麻醉,再进行18F-FDG micro PET/CT 扫描(电压80 kV;电流500 μA;层距1.5 mm)。采用2D FBP 重建技术获取肿瘤18F-FDG 分布融合图像并计算SUVmax。
1.2.4 肿瘤微血管密度(microvessel density,MVD)检测按免疫组织化学SP 法进行CD31 染色,结果由两位高年资的病理医师在光学显微镜下进行判读,内皮细胞染成棕黄色或棕褐色的管腔结构为肿瘤MV,每张切片随机选取5 个高倍视野,计数每个视野MV 个数,计算5 个视野MV 的平均值即为MVD。
1.2.5 肿瘤淋巴管密度(lymphatic vessel density,LVD)检测按免疫组织化学SP 法进行D2-40 染色,结果由两位高年资的病理医师在光学显微镜下进行判读,内皮细胞染成棕黄色或棕褐色的管腔结构为肿瘤LV,每张切片随机选取5 个高倍视野,计数每个视野LV 个数,计算5 个视野LV 的平均值即为LVD。
1.2.6 肿瘤血管生成拟态密度(vasculogenic mimicry density, VMD)检测先按免疫组织化学SP 法进行CD31 染色,再用浓度为0.5%的过碘酸氧化10 min,蒸馏水清洗后,用雪夫液(PAS)于避光条件下染20 min,吸取0.5%偏重亚硫酸钠冲洗2 次,每次持续2 min。结果由两位高年资的病理医师在光学显微镜下进行判读,VM 为CD31 阴性而PAS 阳性(红色)的管腔结构。每张切片随机选取5 个高倍视野,计数每个视野VM 个数,计算5 个视野VM 的平均值即为VMD。
1.2.7 肿瘤细胞Ki-67阳性表达率检测按免疫组织化学SP 法进行Ki-67 染色,结果由两位高年资的病理医师在光学显微镜下进行判读,细胞核呈黄色或棕黄色为Ki-67 阳性细胞,每张切片随机选取5 个高倍视野,计数每个视野Ki-67 阳性细胞占该视野肿瘤细胞的比例,计算5 个视野Ki-67 阳性细胞所占比例的平均值,即为肿瘤细胞Ki-67 阳性表达率。
1.2.8 肿瘤细胞凋亡率检测取新鲜的肿瘤组织研磨、离心制成悬浮液。悬浮液中加入200 μL 的Binding Buffer 缓冲液,调整细胞密度为1×106个/mL。吸取195 μL 细胞悬液到流式细胞管中,向管中加入5 μL Annexin V-FITC 试剂。5 min 后向管中加入10 μL 碘化丙啶(PI)试剂,室温下避光孵育10 min。孵育结束后向流式细胞管中加入300 μL 无菌PBS液,当管中液体充分混匀后将流式细胞管放置流式细胞仪上检测。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 治疗后不同时间点各组小鼠移植瘤体积比较
治疗后不同时间点小鼠移植瘤体积比较,采用重复测量设计的方差分析,结果:①不同时间点的移植瘤体积有差异(F=11 813.804,P=0.000)。②各组的移植瘤体积有差异(F=398.226,P=0.000),联合组移植瘤体积最小。③各组移植瘤体积在不同时间点的变化趋势有差异(F=393.829,P=0.000)。见表1和图1。
表1 治疗后不同时间点各组小鼠移植瘤体积的比较 (n=8,mm3,±s)
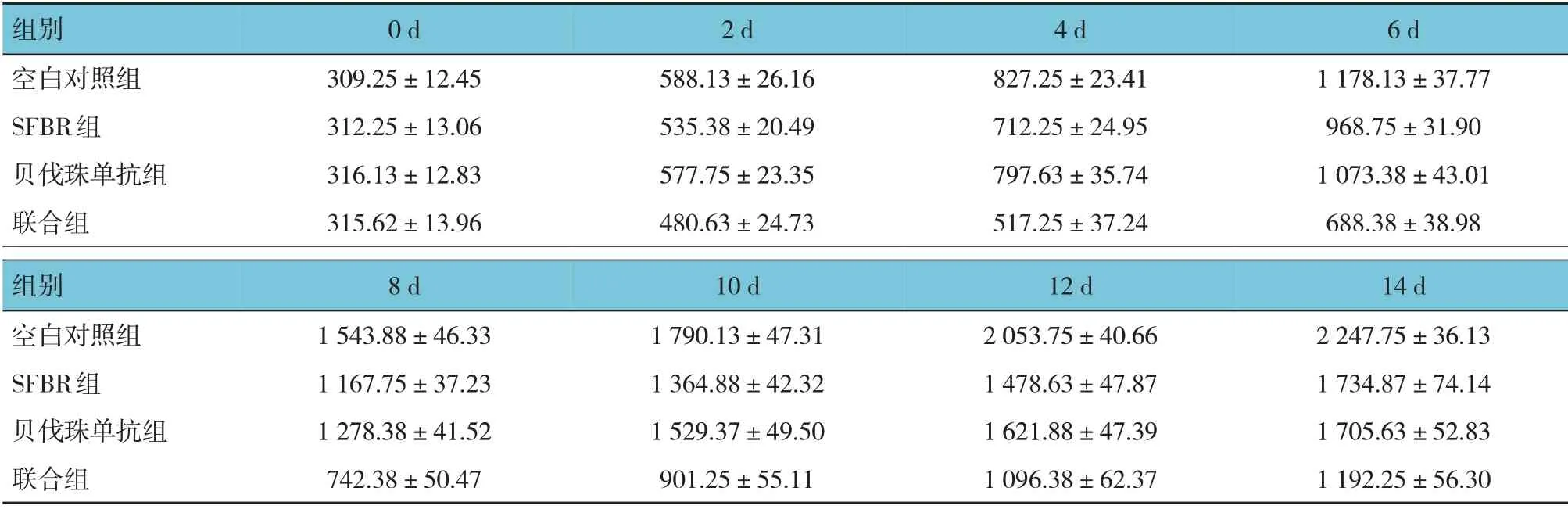
表1 治疗后不同时间点各组小鼠移植瘤体积的比较 (n=8,mm3,±s)
组别空白对照组SFBR组贝伐珠单抗组联合组0 d 309.25±12.45 312.25±13.06 316.13±12.83 315.62±13.96 2 d 588.13±26.16 535.38±20.49 577.75±23.35 480.63±24.73 4 d 827.25±23.41 712.25±24.95 797.63±35.74 517.25±37.24 6 d 1 178.13±37.77 968.75±31.90 1 073.38±43.01 688.38±38.98组别空白对照组SFBR组贝伐珠单抗组联合组8 d 1 543.88±46.33 1 167.75±37.23 1 278.38±41.52 742.38±50.47 10 d 1 790.13±47.31 1 364.88±42.32 1 529.37±49.50 901.25±55.11 12 d 2 053.75±40.66 1 478.63±47.87 1 621.88±47.39 1 096.38±62.37 14 d 2 247.75±36.13 1 734.87±74.14 1 705.63±52.83 1 192.25±56.30

图1 各组肿瘤体积随时间的变化趋势
2.2 各组小鼠移植瘤终体积、TGIR及SUVmax的比较
各组小鼠移植瘤终体积比较,经单因素方差分析,差异有统计学意义(F=428.948,P=0.000),联合组移植瘤终体积小于SFBR 组和贝伐珠单抗组(P<0.05),SFBR 组与贝伐珠单抗组间无差异(P>0.05)。各治疗组TGIR 比较,经单因素方差分析,差异有统计学意义(F=180.086,P=0.000),联合组TGIR 高于SBRT 组和贝伐珠单抗组(P<0.05),SFBR组与贝伐珠单抗组间无差异(P>0.05)。各组SUVmax阳性表达率比较,经单因素方差分析,差异有统计学意义(F=46.586,P=0.000),联合组SUVmax低于SFBR 组和贝伐珠单抗组(P<0.05),SFBR 组与贝伐珠单抗组之间无差异(P>0.05)。见表2和图2。
表2 各组移植瘤终体积、TGIR及SUVmax比较(n=8,±s)
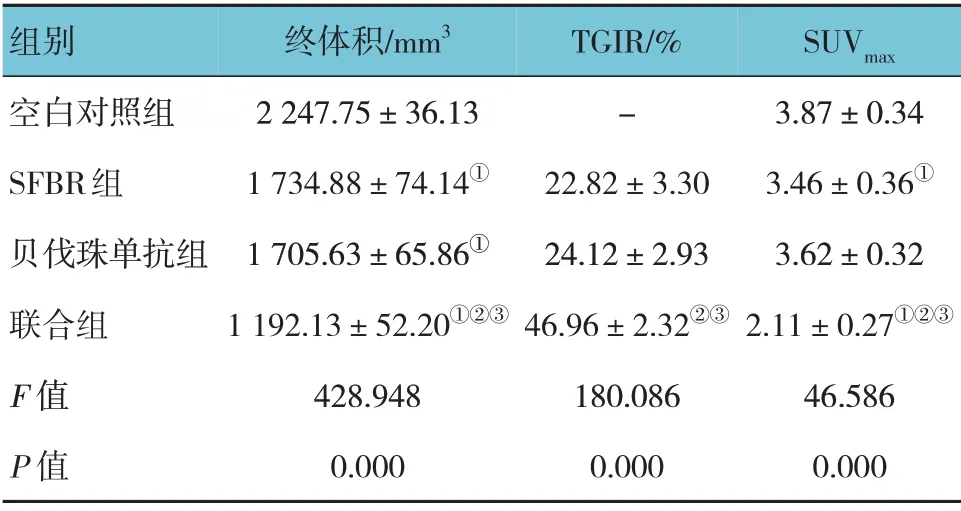
表2 各组移植瘤终体积、TGIR及SUVmax比较(n=8,±s)
注:①与空白对照组比较,P<0.05;②与SFBR组比较P<0.05;③与贝伐珠单抗组比较,P<0.05。
终体积/mm3 2 247.75±36.13 1 734.88±74.14①1 705.63±65.86①1 192.13±52.20①②③428.948 0.000 SUVmax 3.87±0.34 3.46±0.36①3.62±0.32 2.11±0.27①②③46.586 0.000组别空白对照组SFBR组贝伐珠单抗组联合组F 值P 值TGIR/%-22.82±3.30 24.12±2.93 46.96±2.32②③180.086 0.000
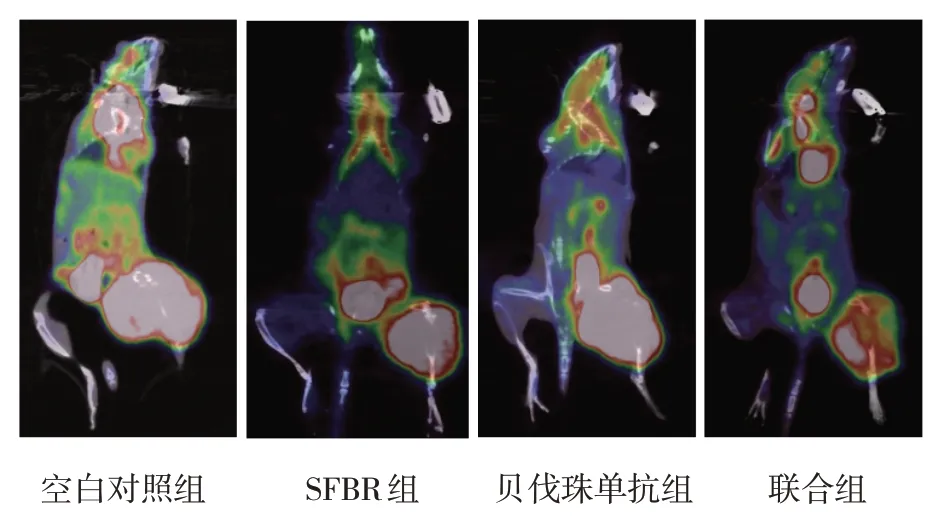
图2 各组18F-FDG micro PET/CT扫描图
2.3 各组移植瘤组织MVD、LVD及VMD比较
各组移植瘤组织MVD 比较,经单因素方差分析,差异有统计学意义(F=39.269,P=0.000),联合组MVD 低于SFBR 组和贝伐珠单抗组(P<0.05),贝伐珠单抗组MVD 低于SFBR 组(P<0.05)。各组移植瘤组织LVD 比较,经单因素方差分析,差异有统计学意义(F=39.587,P=0.000),联合组LVD 低于SFBR 组和贝伐珠单抗组(P<0.05),SFBR 组LVD 低于贝伐珠单抗组(P<0.05)。各组移植瘤组织VMD比较,经单因素方差分析,差异有统计学意义(F=23.789,P=0.000)。联合组VMD 低于SFBR 组和贝伐珠单抗组(P<0.05),SFBR 组VMD 低于贝伐珠单抗组(P<0.05)。见表3和图3、4。
表3 各组移植瘤组织MVD、LVD及VMD比较(n=8,个/视野,±s)
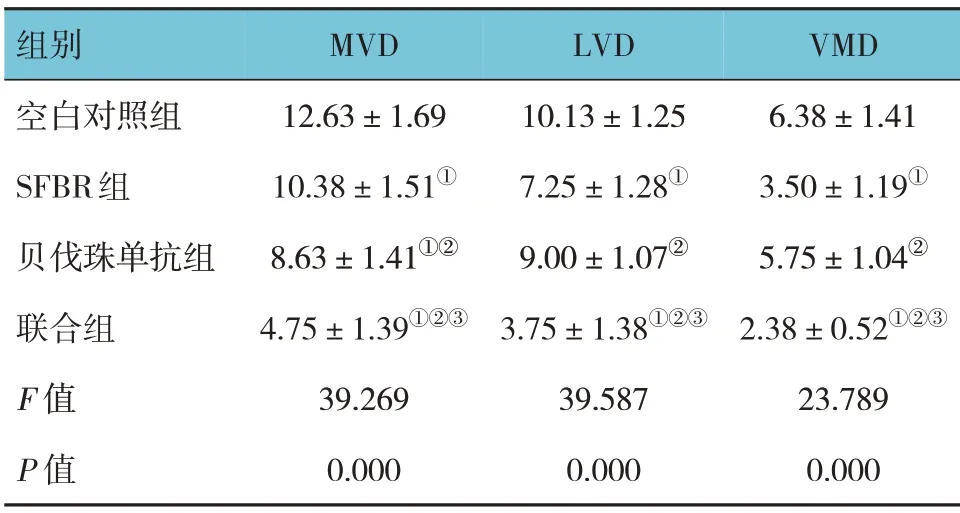
表3 各组移植瘤组织MVD、LVD及VMD比较(n=8,个/视野,±s)
注:①与空白对照组比较,P<0.05;②与SFBR组比较P<0.05;③与贝伐珠单抗组比较P<0.05。
VMD 6.38±1.41 3.50±1.19①5.75±1.04②2.38±0.52①②③23.789 0.000组别空白对照组SFBR组贝伐珠单抗组联合组F 值P 值MVD 12.63±1.69 10.38±1.51①8.63±1.41①②4.75±1.39①②③39.269 0.000 LVD 10.13±1.25 7.25±1.28①9.00±1.07②3.75±1.38①②③39.587 0.000
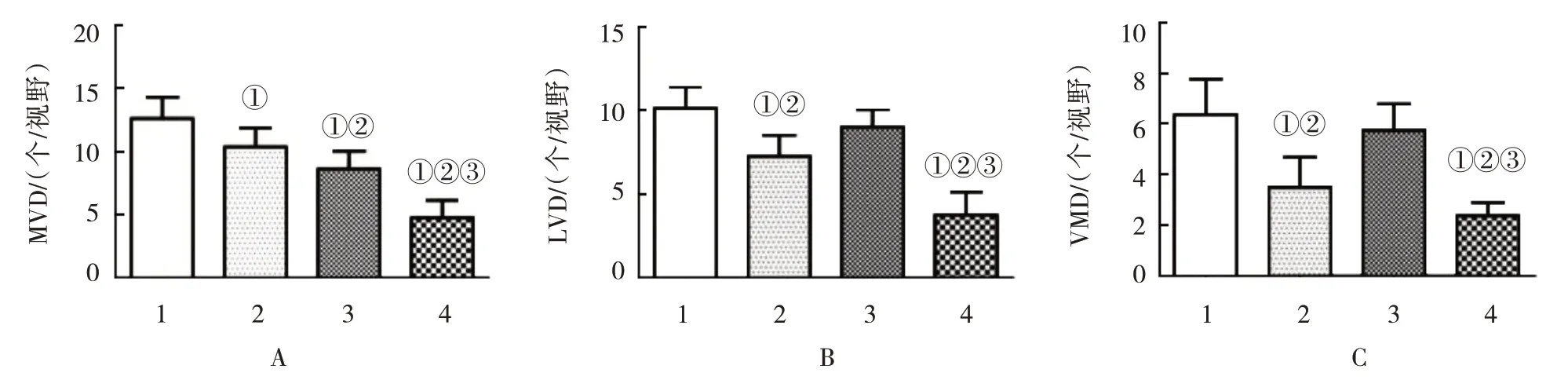
图3 各组移植瘤组织脉管系统比较
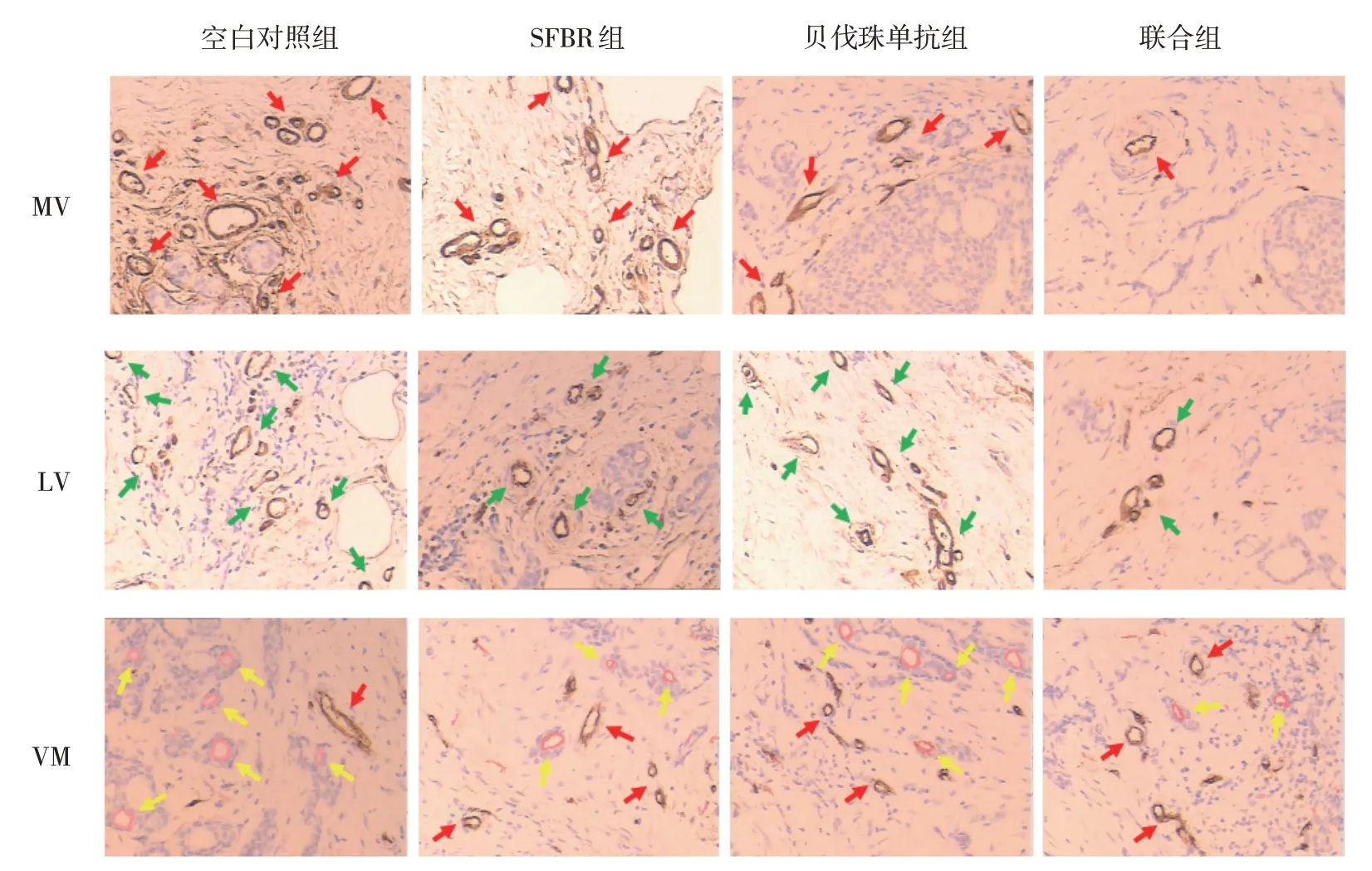
图4 各组脉管系统表达情况
2.4 各组移植瘤细胞Ki-67阳性表达率比较
各组移植瘤细胞Ki-67 阳性表达率比较,经单因素方差分析,差异有统计学意义(P<0.05),联合组Ki-67 表达率低于SFBR 组和贝伐珠单抗组(P<0.05),SFBR 组低于贝伐珠单抗组(P<0.05)(见表4和图5)。各组细胞凋亡率比较,经单因素方差分析,差异有统计学意义(P<0.05)。联合组肿瘤细胞凋亡率高于SFBR 组和贝伐珠单抗组(P<0.05),SFBR 组高于贝伐珠单抗组(P<0.05)(见表4和图6)。
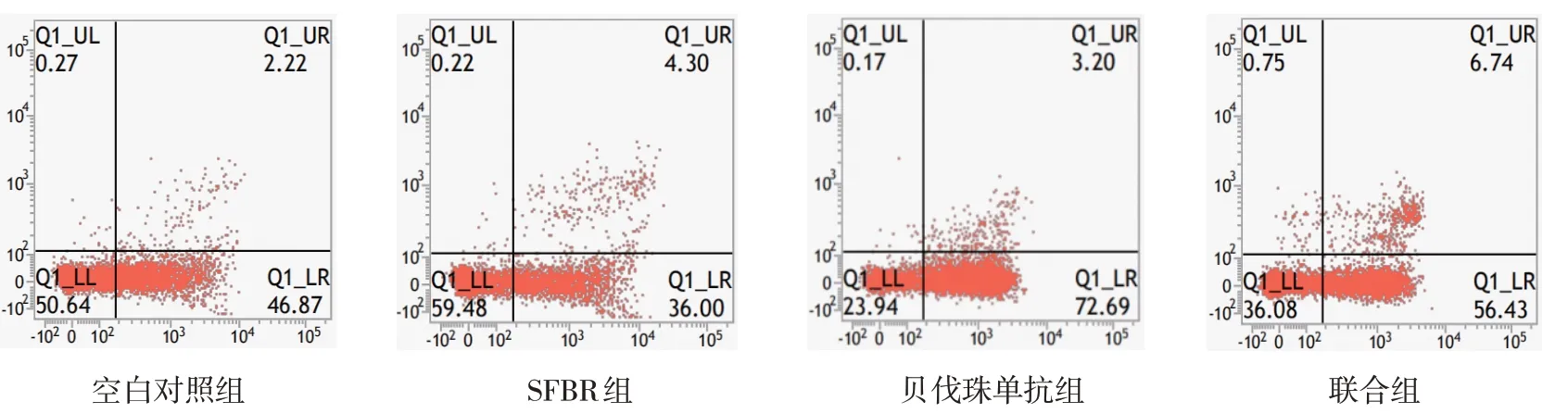
图6 各组细胞凋亡率比较
表4 各组移植瘤细胞Ki-67阳性表达率及凋亡率比较(n=8,%,±s)
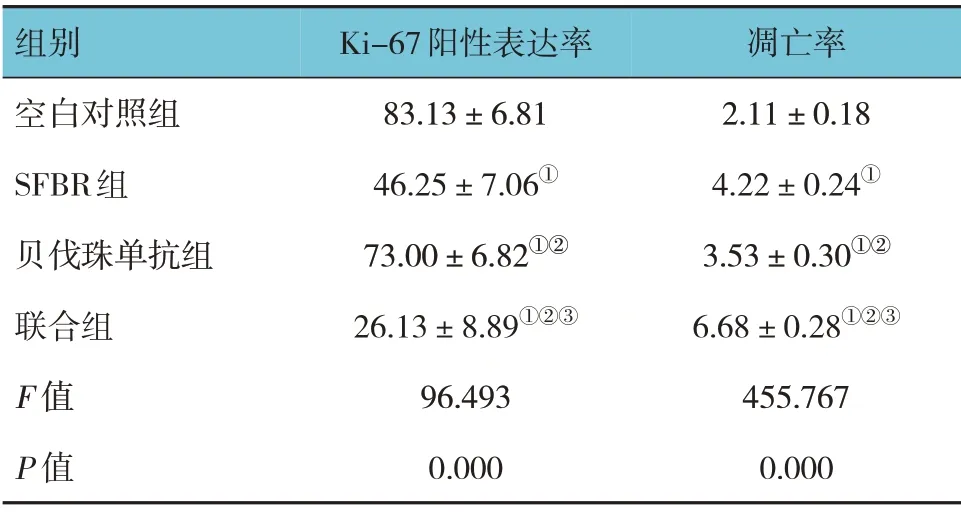
表4 各组移植瘤细胞Ki-67阳性表达率及凋亡率比较(n=8,%,±s)
注:①与空白对照组比较,P<0.05;②与SFBR组比较P<0.05;③与贝伐珠单抗组比较P<0.05。
组别空白对照组SFBR组贝伐珠单抗组联合组F 值P 值Ki-67阳性表达率83.13±6.81 46.25±7.06①73.00±6.82①②26.13±8.89①②③96.493 0.000凋亡率2.11±0.18 4.22±0.24①3.53±0.30①②6.68±0.28①②③455.767 0.000
3 讨论
结肠癌的治疗是以手术治疗为主,辅以化疗、放疗及靶向治疗的综合治疗。结肠癌易发生脉管转移,术后5年生存率仅为50%左右。传统的外照射治疗结肠癌,由于放疗时间长,肿瘤周围正常器官受到的照射剂量高,放疗后不良反应重[4]。近距离放疗是近年来受到广泛关注的新型放疗技术。它将放射源直接放置到肿瘤组织内部,在提高肿瘤放射剂量的同时,周围的正常组织接受的放射剂量却大大降低,有效地保护了周围正常器官[5],放疗相关不良反应明显减少[6-7]。目前近距离放疗已广泛应用于前列腺癌、乳腺癌、妇科肿瘤的治疗[8]。
肿瘤MV 不仅向肿瘤供应营养物质,其内皮细胞分泌的降解酶还可诱导肿瘤细胞进入MV 向远处转移。肿瘤组织中LV 与MV 呈交联短路式生长,这种结构有利于肿瘤发生LV 和MV 转移,肿瘤的进展与肿瘤组织中MVD 和LVD 密切相关[9-10]。JANI 等[11]发现单次高剂量的射线可直接杀伤MV 的内皮细胞,同时使MV 渗漏,管腔塌陷,抑制肿瘤MV 的生成。本实验以单次10 Gy 的高剂量照射肿瘤后,MVD 明显减少,符合相关研究[12]。贝伐珠单抗是一种重组人源化免疫球蛋白G1(IGG1)单克隆抗体,通过与MV 内皮细胞表面的生长因子A(VEGF-A)结合,抑制其与VEGF 受体-2(VEGFR-2)结合,从而抑制MV 生成[13]。结合本研究表明,单次10 Gy 的近距离照射对MV 内皮细胞的直接损伤作用尚不如贝伐珠单抗对MV 内皮细胞的抑制作用。同时本实验结果表明贝伐珠单抗能抑制MV 的生成,但对LVD 的生成无明显抑制作用,单次10 Gy 的近距离照射却能抑制LV 的生成。联合治疗相对于单独使用SFBR和贝伐珠单抗能有效地抑制肿瘤LV 的生成。其机制除了射线直接导致LV 内皮细胞坏死、凋亡外,射线和贝伐珠单抗同时作用于肿瘤MV,在抑制肿瘤MV 生成的同时,高剂量的射线使残存的肿瘤MV 发生塌陷闭塞,阻断了血管内皮生长因子D(VEGF-D)等促LV 生成的细胞因子进入肿瘤组织内诱导LV生成[14]。
肿瘤VM 是近年来发现的肿瘤组织中特殊的管道,是由肿瘤干细胞围成的类似于血管的管腔结构,为肿瘤提供血液供应[15]。目前的抗血管生成药物对VM 无效。当MV 的生成受到抑制时,肿瘤组织内部呈乏氧环境,可促进VM 的形成,肿瘤细胞通过VM 继续获得营养并通过其向远处转移[16-17]。肿瘤组织中VMD 与肿瘤的预后呈负相关[18-19]。TURESSON 等[20]发现射线可直接破坏肿瘤干细胞DNA 双链,导致细胞死亡。同时残存的细胞内线粒体、内质网等亚单位肿胀坏死,失去增殖能力,呈亚致死状态,若细胞亚致死状态不能逆转,将发生程序性死亡即细胞凋亡。本研究表明,单次10 Gy 近距离照射可抑制LV 的生成,而当近距离照射与贝伐珠单抗联合时效果更明显。其机制可能是高剂量的射线使VM 的干细胞发生坏死,同时联合治疗有效地抑制了肿瘤MV 与LV 的生成,使亚致死损伤的干细胞因缺乏相应原料不能自我修复进而发生凋亡。
SUVmax是评价肿瘤代谢活性的重要指标。常用来评估肿瘤治疗效果和预测肿瘤的预后,其数值的大小与肿瘤代谢活性成正比,SUVmax升高常提示预后不良[21-22]。Ki-67 是一种增殖的细胞标志物,只表达于细胞周期的活跃阶段。Ki-67 的表达反映了肿瘤的增殖率。Ki-67 高表达提示预后不良[23-24]。本研究发现,联合治疗除直接损伤肿瘤细胞外,可同时抑制肿瘤MV、LV 和VM 的生成,使肿瘤细胞能量供应不足,抑制肿瘤的代谢活性,促进肿瘤细胞的凋亡,达到控制肿瘤生长的能力。
综上所述,SFBR 联合贝伐珠单抗可有效抑制结肠癌脉管系统的生成,降低肿瘤细胞的代谢活性,促进肿瘤细胞凋亡,从而达到抑制结肠癌生长的作用,具有较高的临床应用价值。但其抑制脉管系统生成的具体机制以及SFBR 与贝伐珠单抗最佳的结合方式和时机还有待于进一步的研究。

