蚕沙中解磷菌的筛选及鉴定
周 影 薛镇海 靳向东 韩建华 康 伟
(吉林省蚕业科学研究院,吉林吉林 132000)
磷元素是植物生长所必须的营养元素之一。土壤中的磷元素是以无机化合物和有机化合物这两种形式存在,无机状态的磷在一定条件下可以释放出来,供植物吸收;土壤中的有机磷不能直接被植物吸收,必须通过微生物作用转变成无机形式才能被吸收[1]。我国耕地2/3面积的土壤缺磷[2],土壤中能被直接吸收的磷占土壤全磷含量的2%~3%[3],开发土壤中难以吸收的磷元素是现代农业急需解决的问题。随着对解磷微生物研究的深入,利用解磷微生物生产的菌肥已经在农业生产中应用推广,但是部分产品存在溶磷效果不稳定问题,因此筛选出高效、稳定的溶磷菌具有重要意义。本文从蚕沙中筛选解磷菌,以期筛选出溶磷能力强的菌株,为菌肥研究及开发提供高效解磷菌及理论依据。
1 材料与方法
1.1 试验材料
取50头柞蚕五龄幼虫,置于室内养殖,用镊子收集其新鲜粪便于无菌的采样袋中,放于-80 ℃冰箱保存。
1.2 试验方法
1.2.1 菌株分离及培养
称取蚕沙样品10 g装入250 mL的锥形瓶中,加入适量玻璃珠和100 mL无菌水,静置浸泡20 min后,在恒温摇床中200 r/min 振荡30 min,形成菌悬液母液,然后依次稀释至1×10-1~1×10-5,吸取200 μL均匀涂布于无机磷培养基上[NBRIP:葡萄糖10 g, MgCl2·6H2O 5 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,FeSO4·7H2O 0.01 g,Ca3(PO4)2 5 g,琼脂粉 20 g,蒸馏水定容至1 000 mL,pH7.0~7.4],30 ℃培养10 d。
1.2.2 解磷菌初筛
从培养基平板中挑选出具有溶磷圈的菌落,采用平板划线的方法在培养基中进行分离纯化,接种到LB斜面培养基进行保藏,将纯化后的菌株再接种于无机磷培养基中,30 ℃培养5 d,测定菌落直径(R)及溶磷圈直径(D),根据溶磷圈直径与菌落直径的比值(D/R),初步确定溶磷能力较强的菌株。
1.2.3 解磷菌复筛
1.2.3.1 解磷能力测定
采用钼锑抗比色法测定上清液中的有效磷含量。
1)绘制磷标准曲线
在容量瓶中分别加入相应体积的100 mg/L的标准磷溶液,加2滴2,6-硝基苯酚作指示剂,用稀硫酸和10%的NaOH溶液调节pH值,加钼锑抗显色剂5 mL,定容至刻度,使标准磷浓度分别为0 mg/L、0.2 mg/L、0.4 mg/L、0.6 mg/L、0.8 mg/L和1.0 mg/L,摇匀,在室温下(25 ℃左右)反应30 min后用紫外分光光度计在660 nm处比色,根据结果绘制标准曲线。
2)培养液中可溶磷含量的测定
将初筛得到的解磷菌株接种于100 mL LB液体培养基中,30 ℃、160 r/min振荡培养12~24 h,调整菌液浓度在OD600=1左右;制备好的种子液以2%比例接种于100 mL液体培养基中,于30 ℃、160 r/min振荡培养5~7 d,每株菌做3个重复,以不接菌为空白对照。培养液转移至无菌的50 mL离心管中,以4 000 r/min的转速离心20 min后取2.5 mL上清液于50 mL容量瓶中加2滴2,6-二硝基苯酚作指示剂,加1滴稀硫酸至反应液为无色,加钼锑抗显色剂5 mL,定容,发生反应。用紫外分光光度计测定上清液于660 nm处的OD值。根据标准曲线得出上清液中的有效磷含量。
1.2.4 解磷菌的形态观察
将解磷细菌接种在无机磷或有机磷固体培养基上,28 ℃培养,5 d后观察单菌落特征,记录其大小、颜色、形状、透明度、表面光泽度、边缘特征、隆起程度等。
1.2.5 菌株的分子鉴定
将解磷菌分别接种于250 mL装有100 mL LB液体培养基的三角瓶中,于30 ℃,160 r/min振荡培养过夜,离心后收集菌丝体,然后用OMEGA有限公司的细菌基因组DNA小量提取试剂盒提取菌株DNA用于PCR鉴定。选用细菌16S rDNA通用引物进行PCR扩增,其引物序列:27F( 5'-AGAGTTTGATCMTGGCTCA-3');1492R (5'-TACGGYTACCTTGTTACGACTT -3’)。扩增体系扩增采用25 μL体系:DNA模板l μ、2x Taq Mix 12.5 μL、引物各l μL、ddH2O 9.5 μL。 PCR反应条件:94 ℃预变性5 min后,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min, 35个循环,然后72 ℃延伸10 min,4 ℃保存。扩增产物经1%琼脂糖凝胶检测后,纯化回收目的条带,送上海生工生物股份有限公司测序。 将所测得的16S rDNA基因序列与GenBank数据库中的已知序列进行Blast 分析比对,确定其近缘种属关系。
2 结果分析
2.1 解磷菌的筛选结果
在培养基上具有溶磷圈的菌株共计9 株,并对其进行分离纯化。用游标卡尺测量出水解圈和菌落的直径,测量3次,取平均值计算溶磷圈直径与菌落直径的比值(D/R),结果如表1,溶磷圈直径与菌落直径的比值最大的菌株为L10,数值是4.786,比值最小的是L12,数值是2.150,具体如表1。

表1 溶磷圈直径与菌落直径的比值(D/R)
2.2 解磷菌形态特征
9 株菌都能在无机磷培养基上生长,菌落颜色呈多样性,有近白色,黄色,黄白色等,菌落的形态大多为圆形,表面光滑,不透明,湿润,边缘整齐。具体如表2。

表2 菌落形态特征
2.3 解磷能力的测定结果
平板解磷圈大小只是定性的表明菌株的解磷特性,解磷能力的测定还需结合定量的方法——液体培养法,通过测定上清液磷浓度并计算其解磷率来表示菌株解磷能力的大小。
2.3.1 磷标准曲线的绘制
溶性磷酸盐在酸性条件下可与钼酸铵结合生产磷铝酸酰胺,这种化合物经对苯二酚还原成蓝色化合物,用可见光分光光度计在波长660 nm处测定钼锑抗的吸光值,以定量分析可溶性磷的含量。标准曲线见图1。
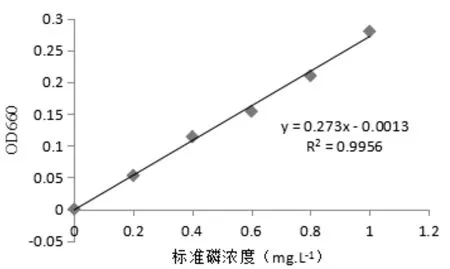
图1 磷标准曲线
2.3.2 发酵液解磷能力测定
磷钼蓝比色法测定液体培养基中磷含量,试验结果表明解磷能力最高的菌株是F6,解磷量是113.8 mg/L,其次是H6,解磷量是87.9 mg/L,如图2。总体上,菌种解磷圈大小与发酵液解磷能力二者不存在正相关关系。
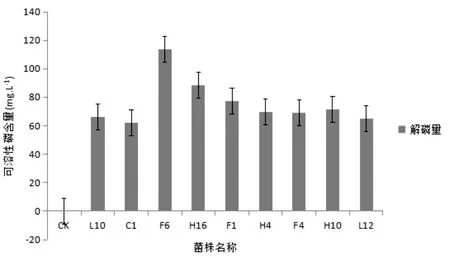
图2 解磷菌解磷效果
2.4 菌株鉴定
选取解磷能量大于50 mg/L的菌株进行16S rRNA基因测序,结果表明,L10、H10、H16为不动杆菌(Acinetobactersp.),F6、H4、L12为假单胞菌(Pseudomonassp.),F1、F4株为克吕沃尔菌(Kluyverasp.),C1株为糖多胞菌(Saccharopolysporasp.)。
3 讨 论
磷元素是土壤中吸收效率最低的营养元素之一,土壤中的磷酸盐矿物只有在理化作用和微生物作用下分解的磷才能供作物生长,溶磷微生物在磷的地球化学循环中起着重要作用[4]。 蚕沙中含有大量的有益微生物,李庆荣等[5]在发酵的蚕沙中筛选出一株具有良好解磷效果的菌株,本研究从蚕沙中筛选出9株具有解磷圈的菌株,并采用液体发酵方式对其解磷量进行测定,分别为不动杆菌、假单胞菌、克吕沃尔菌、糖多胞菌。在平板筛选时, 虽然部分菌株溶磷圈直径较大, 如菌株L10、C1, 但其在液体培养条件下的溶磷效果较差。有研究认为这种现象可能是由于培养基条件不同,菌落大小及在平板堆积情况的差异造成水解圈大小不同[6-7]。本研究筛选出一株解磷能力最高的菌株, 解磷量最高的是113.8 mg/L,然而这种溶磷条件还是试验性的,要想进一步应用到生产实际中去,还须进行田间试验。

