双阳离子型离子液体和十八烷基修饰的混合模式硅胶固定相的制备及色谱性能
季双琦, 靳钊, 观文娜, 潘翔宇, 关彤
双阳离子型离子液体和十八烷基修饰的混合模式硅胶固定相的制备及色谱性能
季双琦1, 靳钊1, 观文娜2, 潘翔宇1, 关彤1
(1. 青岛科技大学高分子科学与工程学院, 青岛 266045; 2. 中国科学院青岛生物能源与过程研究所, 青岛 266101)
通过分步键合反应制备了一种咪唑基双阳离子型离子液体和十八烷基共同修饰的混合模式硅胶色谱固定相(Sil-C18-IL-C4); 采用元素分析和红外光谱对其进行了表征. 分别评价了该固定相在反相色谱模式(RPLC)、 亲水色谱模式(HILIC)和RPLC/HILIC混合色谱模式下的色谱分离性能, 并在HILIC模式下对6种碱基核苷类化合物进行分离, 考察了流动相中有机相体积分数和水相中甲酸铵浓度对分离效果的影响. 此外, 还考察了该固定相的分离重复性. 制备的Sil-C18-IL-C4固定相的元素分析结果表明, 氮元素含量为1.65%, 碳元素含量为11.16%, 氢元素含量为2.44%. 该固定相的红外光谱中, 2928和2856 cm‒1处出现了—CH的不对称和对称伸缩振动峰, 1440 和660 cm‒1处出现了咪唑环上C=C的伸缩振动峰和C=N的弯曲振动峰, 说明十八烷基和1,5-双(咪唑-1-基)戊烷均已接枝到硅胶表面. 色谱性能评价结果表明, Sil-C18-IL-C4固定相可表现出反相色谱模式和亲水色谱模式分离性能, 对6种碱基核苷类物质能够实现完全分离, 而且在一定的色谱条件下可以在单根色谱柱单次运行中实现RPLC/HILIC混合模式色谱分离, 对于处理复杂样品中的碱基核苷类化合物等亲水物质具有良好的应用潜能.
咪唑基双阳离子型离子液体; 混合模式色谱; 固定相; 碱基核苷
高效液相色谱(HPLC)是目前应用最广泛的分离分析和纯化技术之一, 在生命科学、 材料科学和环境科学等领域都发挥着重要作用. 目前, 单分离色谱模式如反相液相色谱(RPLC)[1,2]、 离子交换色谱(IEC)[3~5]、 正相液相色谱(NPLC)[6~8]和亲水作用色谱(HILIC)[9~14]仍在HPLC中占主导地位. 然而, 随着实际样品的复杂程度不断增加, 单分离色谱模式逐渐显露出局限性, 导致其应用范围受限.
混合模式色谱(MMC)的固定相采用不同特性官能团进行修饰, 能提供与溶质的多重相互作用, 具有更强的分离选择性和更高的分离效率[15~21], 可以在单个色谱柱上实现至少两种色谱分离模式. 常见的MMC种类有: (1) RPLC/IEC模式. Bai等[22]用-甲基咪唑鎓离子液体改性硅胶固定相, 利用富电子咪唑环的-共轭作用和离子交换特性有效分离酸性蛋白质; (2) RPLC/HILIC模式. Liu等[23]将带有乙二醇末端的疏水烷基链键合到二氧化硅上, 利用长碳链的疏水作用和醇羟基的氢键作用测定非离子乙氧基表面活性剂的乙氧基化程度(EO值)和烷基链分布; (3) HILIC/IEC模式. Lin等[24]将2-(甲基丙烯酰氧基)乙基三甲基硫酸铵(META)和季戊四醇三丙烯酸酯(PETA)共聚得到新型固定相, 利用META的亲水基团和离子交换作用位点实现了对酰胺类、 核苷类和苯甲酸衍生物的有效分离; (4) NPLC/RPLC/IEC模式. Sun等[25]将喹啉接枝到氯丙基硅胶上制备了喹啉离子液体改性硅胶固定相, 利用喹啉基团的偶极作用、-作用、 疏水性、 氢键和阴离子交换作用等, 有效分离了多环芳烃、 苯胺类和无机阴离子类样品; (5) RPLC/HILIC/IEC模式. Xian等[26]将-甲基咪唑和戊烯酸修饰到硅胶表面, 利用咪唑基团的-共轭作用、 阴离子的离子交换作用及羧基的亲水作用有效分离磺酰胺、 碱基核苷和无机阴离子等样品, 并用于奶粉中三聚氰胺的检测.
离子液体(IL)常作为功能基团用于MMC固定相的修饰. 离子液体是一种具有低熔点、 高选择性和可忽略蒸汽压的有机盐[27,28]. 由于离子液体独特的理化性质、 新颖性和可设计性, 可以将其键合到硅胶填料上, 构成一类新型的表面限制离子液体(SCIL)固定相. 该新型色谱固定相已经被应用于IEC、 RPLC和HILIC等多种色谱模式, 这类固定相上的分离通常综合了多种分离机理, 包括疏水作用、 偶极-偶极相互作用、 静电作用、 氢键、-作用以及空间效应等. 合理利用多种分离机理提升固定相的分离能力已成为重要的研究点. 最常见的SCIL固定相是单阳离子型离子液体改性硅胶固定相, 主要包括两类: 一类是咪唑鎓离子液体键合的改性硅胶固定相[29~33], 另一类是喹啉类离子液体改性硅胶固定相[26]. 单阳离子型离子液体官能团只能提供一个活性作用位点, 为了增加活性位点以获得更好的分离效果, 研究者合成了多种聚合离子液体用于修饰硅胶固定相[34~41]. 然而, 由于聚合反应的可控性较差, 导致所制备的固定相重复性较差.
为了解决单阳离子型离子液体修饰硅胶提供的分离活性位点有限[42]和聚离子液体的聚合度可控性与重复性较差的问题, 本文将咪唑基双阳离子型离子液体官能团分步键合到十八烷基(C18)修饰的硅胶固定相上, 制备了RPLC/HILIC混合色谱模式硅胶固定相. 该固定相同时具有疏水作用和⁃作用等; 分别在反相色谱模式、 亲水色谱模式和混合色谱模式下探讨了其色谱保留机理.
1 实验部分
1.1 试剂与仪器
球形多孔二氧化硅(5 μm, 10 nm, 400 m2/g)购自日本Daisogel公司; 十八烷基三氯硅烷(纯度>95%)购自上海麦瑞尔化学技术有限公司; 三乙胺(分析纯)、 鸟苷(纯度>99%)和胞嘧啶(纯度>99%)购自上海麦克林生化有限公司; 3-氯丙基三乙氧基硅烷(纯度>98%)、 咪唑(纯度>99%)、 1,5-二溴戊烷(纯度>98%)、 氢化钠(纯度60%, dispersion in mineral oil)、 1-氯丁烷(纯度>99.8%)、 尿嘧啶(纯度>99%)、 尿苷(纯度>99%)、 腺苷(纯度>99.5%)、 腺嘌呤(纯度>99%)、 次黄嘌呤(纯度>99%)和胸腺嘧啶(纯度>99%)均购自上海阿拉丁试剂有限公司; 2-氯腺苷(纯度>99%)和肌苷(纯度>99.3%)购自上海安谱实验科技股份有限公司; 盐酸、 二氯甲烷、 甲苯、 无水甲醇、 丙酮、 乙腈、 异丙醇和四氢呋喃均为分析纯, 购自国药集团化学试剂有限公司; 商品化反相液相色谱柱(ZORBAX Eclipse XDB-C18, 4.6 mm×150 mm, 5 μm)购自美国Agilent公司. 所用甲苯、 乙腈、 二氯甲烷、 丙酮、 甲醇、 异丙醇和四氢呋喃等试剂均经过4A级分子筛处理.
Waters 2695型高效液相色谱仪配置Waters 2487双波长检测器, 美国Waters公司; Vario ELⅢ型元素分析仪, 德国Elementar公司; RPL-ZD10型装柱机, 大连日普利科技有限公司; R-1001VN型旋转蒸发仪, 郑州长城科工贸有限公司; AVANCE-III型核磁共振波谱仪, 德国Bruker公司; Nicolet 6700FTIR Spectormeter型傅里叶变换红外分析光谱仪, 美国Thermo公司; Maxis UHR TOF型液相色谱四极杆飞行时间质谱联用仪, 德国Bruker公司.
1.2 1,5-双(咪唑-1-基)戊烷的合成
按照Scheme 1所示路线合成1,5-双(咪唑-1-基)戊烷. 称取1.84 g咪唑分散于50 mL干燥四氢呋喃中, 在干燥氮气氛围下加入3.0 g氢化钠, 静置6 h; 再加入2.76 g 1,5-二溴戊烷, 加热冷凝回流48 h. 将反应体系用聚丙烯滤膜过滤除去固体杂质, 旋转蒸发除去四氢呋喃, 向产物中加入甲醇使其溶解, 加入正己烷萃取分液3次, 旋转蒸发除去甲醇相溶剂后得到1,5-双(咪唑-1-基)戊烷.

Scheme 1Preparation process of 1,5⁃bis(imidazol⁃1⁃yl)pentane
1.3 固定相的制备

Scheme 2Preparation process of stationary phase
按照Scheme 2所示路线制备色谱固定相.
1.3.1十八烷基键合反应取40.0 g硅胶, 加入20%盐酸(200 mL), 室温下搅拌10 h. 将硅胶用蒸馏水洗至中性, 真空干燥, 备用. 取10.0 g干燥硅胶分散于50 mL干燥甲苯中, 在干燥氮气氛围下加入 2.0 mL三乙胺和5.5 mL十八烷基三氯硅烷, 加热回流8 h. 将硅胶分别用甲苯和甲醇洗涤, 于65 ℃真空干燥, 得到十八烷基键合硅胶(Sil-C18).

Fig.1 High resolution mass spectrum of 1,5⁃bis(imidazol⁃1⁃yl)pentane

Fig.2 1H NMR spectrum of 1,5⁃bis(imidazol⁃1⁃yl)pentane
1H NMR(600 MHz, DMSO-d6),: 7.60(t,=1.2 Hz, 1H), 7.14(t,= 1.3 Hz, 1H), 6.87(t,=1.1 Hz, 1H), 3.92(t,=7.2 Hz, 2H),1.70(p,=7.3 Hz, 2H), 1.18—1.10(m, 1H).
1.3.2离子液体的接枝与封端将10.0 g Sil-C18硅胶分散于100 mL干燥甲苯中, 在干燥氮气氛围下加入1.0 mL三乙胺和10.0 mL 3-氯丙基三乙氧基硅烷, 加热回流24 h. 将硅胶分别用甲苯、 甲醇和超纯水洗涤, 于65 ℃真空干燥, 得到十八烷基和氯丙基键合硅胶(Sil-C18-MPCl).
取4.0 g Sil-C18-MPCl氯丙基键合硅胶分散于50 mL干燥甲苯中, 在干燥氮气氛围下加入0.3 g 1,5-双(咪唑-1-基)戊烷, 加热回流6 h. 用甲醇、 超纯水冲洗, 于65 ℃真空干燥, 得到十八烷基键合和离子液体接枝的硅胶(Sil-C18-IL).
将3.0 g Sil-C18-IL硅胶分散于50 mL干燥乙腈中, 加入0.2 mL 1-氯丁烷, 加热回流6 h; 用甲醇、 超纯水、 丙酮洗涤, 于65 ℃真空干燥, 得到丁基封端的十八烷基键合和离子液体接枝的硅胶(Sil-C18-IL-C4).
1.4 色谱条件
以四氢呋喃/异丙醇混合液为匀浆液, 丙酮为顶替液, 在40 MPa下将Sil-C18-IL-C4硅胶装填入 150 mm×4.6 mm不锈钢色谱柱中.
RPLC分离模式: 流动相为甲醇-水, 流速1 mL/min, 柱温25 ℃, 检测波长254 nm, 进样量5 μL.
HILIC分离模式: 流动相为乙腈-甲酸铵缓冲溶液, 流速1 mL/min, 柱温25 ℃, 检测波长254 nm, 进样量10 μL.
RPLC/HILIC混合模式: 流动相为乙腈-20 mmol/L甲酸铵缓冲溶液, 流速1 mL/min, 柱温25 ℃, 检测波长254 nm, 进样量10 μL.
2 结果与讨论
2.1 MMC色谱固定相的表征
2.1.11,5-双(咪唑-1-基)戊烷的表征合成的1,5-双(咪唑-1-基)戊烷分子式为C11H16N4, 采用液相色谱-四极杆飞行时间质谱联用仪对其进行分析, 结果如图1所示. 质谱图中103.0754的峰对应 [M+2H]2+峰,205.1438的峰对应[M+H]+峰,227.1253的峰对应[M+Na]+峰. [M+H]+峰的测量值与理论值的相对误差为4.9×10‒6, 因此高分辨质谱表征结果与化合物的分子式相符.
采用核磁共振氢谱进一步分析了所合成化合物. 如图2所示,7.6对应1,5-双(咪唑-1-基)戊烷中1号位C=N双键C上的氢核,7.14 和6.87 分别对应2号和3号位C=C双键C上的氢核,3.92对应4号位与咪唑上的N相连的亚甲基的氢核,1.70和1.18分别对应5号和6号位亚甲基的氢核, 以上数据证实合成的产物为1,5-双(咪唑-1-基)戊烷.
2.1.2Sil-C18-IL-C4硅胶固定相的表征采用傅里叶红外光谱仪分别对裸硅胶、 Sil-C18、 Sil-C18-MPCl、 Sil-C18-IL和Sil-C18-IL-C4进行了测定. 图3谱线中1100 cm‒1处的吸收峰为硅胶上Si—O键的弯曲振动峰, 3425和1628 cm‒1处的吸收峰分别为硅胶表面残留的硅羟基O—H键的伸缩振动和弯曲振动峰. 与裸硅胶相比, Sil-C18的红外光谱在2928和2856 cm‒1处出现了—CH的不对称和对称伸缩振动峰, 说明十八烷基已键合到SiO2上. Sil-C18-IL和Sil-C18-IL-C4的红外光谱均出现了1440和660 cm‒1处的吸收峰, 为咪唑环上C=C的伸缩振动峰和C=N的弯曲振动峰, 说明1,5-双(咪唑-1-基)戊烷已经通过亲核取代反应接枝到硅胶表面.

Fig.3 Infrared spectra of bare silica, Sil⁃C18, Sil⁃C18⁃MPCl, Sil⁃C18⁃IL and Sil⁃C18⁃IL⁃C4
为了进一步验证Sil-C18-IL-C4硅胶固定相的成功制备, 分别对裸硅胶、 Sil-C18、 Sil-C18-MPCl、 Sil-C18-IL和Sil-C18-IL-C4中的C, N和H元素含量进行了测定, 结果列于表1(数值为3次平行测试结果的平均值). 与裸硅胶相比, Sil-C18中C和H元素的含量分别增加至9.36%和2.28%, 证实十八烷基已键合到裸硅胶表面. Sil-C18-MPCl中的C和H元素含量分别增加至10.50%和2.29%, 证实3-氯丙基已键合到Sil-C18硅胶上. Sil-C18-IL的元素分析结果显示, 由于1,5-双(咪唑-1-基)戊烷中含有N和C原子, 使得其N和C元素的含量分别达到1.68%和11.01%, 证实1,5-双(咪唑-1-基)戊烷通过亲核取代反应接枝到Sil-C18-MPCl上. 在Sil-C18-IL-C4中, C和H元素含量分别为11.16%和2.44%, 比Sil-C18-IL有所增加.

Table 1 Elemental analysis results of bare silica, Sil⁃C18, Sil⁃C8⁃MPCl, Sil⁃C18⁃IL and Sil⁃C18⁃IL⁃C4(n=3)
根据红外光谱和元素分析表征结果, 可推断Sil-C18-IL-C4色谱固定相制备成功.
2.2 色谱柱保留机理
2.2.1反相色谱模式由于固定相上含有非极性的C18基团, 本文选择在反相色谱模式(RPLC)下即流动相为甲醇-水(体积比85/15), 利用尿嘧啶、 苯酚、 4-硝基氯苯和萘4种不同极性(从强极性到非极性)的探针分子对固定相的反相色谱性能和柱效进行评价, 并与商品化HPLC柱进行对比, 结果如图4所示.
对比图4(A)与(B)可见, Sil-C18-IL-C4柱在反相色谱条件下可以实现对4种探针分子的分离, 且对不同极性物质的保留均强于商品化HPLC柱. 由表2可以看出, 在反相色谱条件下, Sil-C18-IL-C4柱的理论塔板数比商品化HPLC柱高, 说明该条件下Sil-C18-IL-C4柱有较高的柱效. 对比图4(B)与(C)可见, 随着流动相中甲醇相比例的降低, 2种疏水物质4-硝基氯苯和萘的保留增强, 说明在上述条件下溶质在固定相上的保留遵循反相色谱模式.

Fig.4 Reversed⁃phase mode chromatographic performance evaluation chromatograms
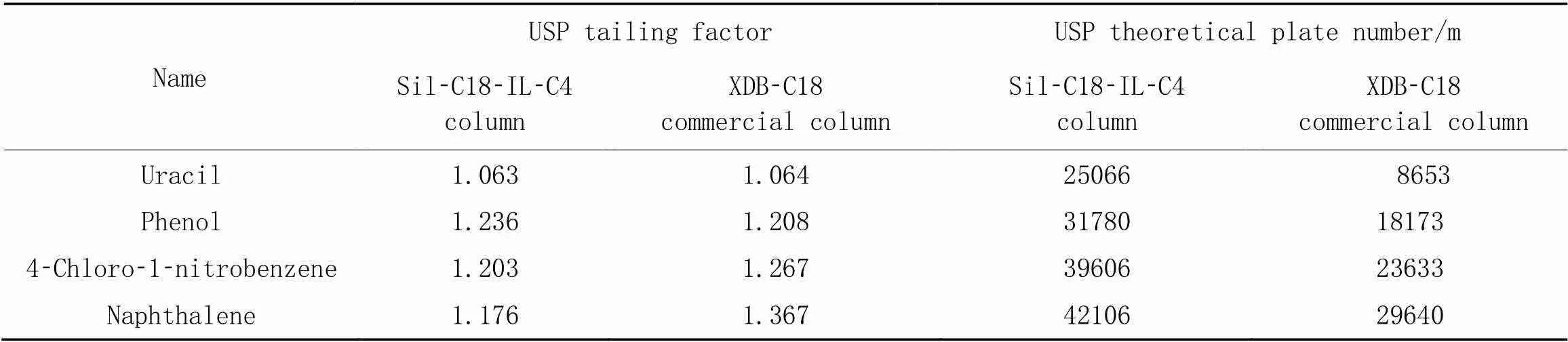
Table 2 Column efficiency data of two columns under reversed-phase conditions
2.2.2亲水色谱模式在亲水色谱模式(HILIC)下, 色谱固定相对分离物质的保留行为及选择性不仅与色谱固定相的种类有关, 还与流动相组成、 流动相中缓冲盐浓度等因素有着密切关系, 因此选择最优的流动相对物质的分离非常重要. 核苷类物质为强极性化合物, 因此本实验选择核苷类物质为待分离对象, 系统考察流动相中乙腈含量和甲酸铵浓度对待分离物保留行为的影响.
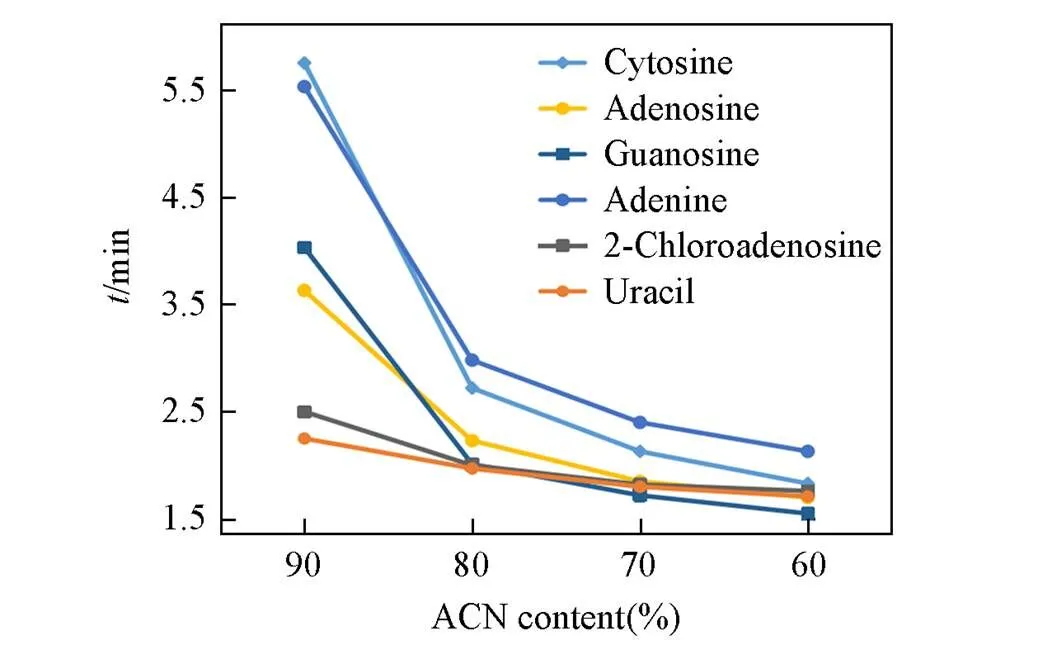
Fig.5 Effect of acetonitrile content on retention of base nucleosides in HILIC chromatography mode
首先, 在保持流动相中缓冲盐浓度为 20 mmol/L不变的前提下, 通过改变流动相中有机相乙腈的体积分数, 考察了该色谱柱在亲水色谱模式下流动相中有机相比例对待分离物质保留行为的影响. 从图5可以看出, 随着乙腈体积分数的递减, 待分离物质在固定相上的保留逐渐减弱, 证实在上述条件下合成的固定相具有典型的HILIC模式的色谱分离性能, 可以通过调节有机相的含量来改变不同待分离物质的保留行为, 从而提高各分离物质间的分离度.
在固定流动相中乙腈与甲酸铵体积比为90:10的前提下, 进一步考察了水相中甲酸铵浓度对待分离物质保留行为的影响. 如图6所示, 待分离物质在固定相上的保留能力随甲酸铵浓度的递增有不同程度的变化. 其原因如下: (1) 流动相中甲酸铵浓度越高, 在固定相表面形成的亲水层越厚, 使得待分离物质与固定相的相互作用增强, 保留时间延长; (2) 随着流动相中甲酸铵浓度的提高, 降低了流动相中水的摩尔分数, 使溶质在十八烷基长链上的保留减弱; (3) 流动相中甲酸铵浓度越高, 对离子交换相互作用抑制越明显.

Fig.6 Effect of ammonium formate concentration on retention of base nucleosides in HILIC chromatography mode
综合上述因素, 确定了分离6种碱基核苷类化合物的优化条件: 流动相A为乙腈, B为40 mmol/L甲酸铵水溶液; 流速1 mL/min; 柱温25 ℃; 梯度洗脱条件为0~1 min, 95%A, 1~11 min, 95%~90%A, 11~13 min, 90%A. 如图7所示, Sil-C18-IL-C4色谱柱对这6种碱基核苷类化合物表现出良好的分离效果.
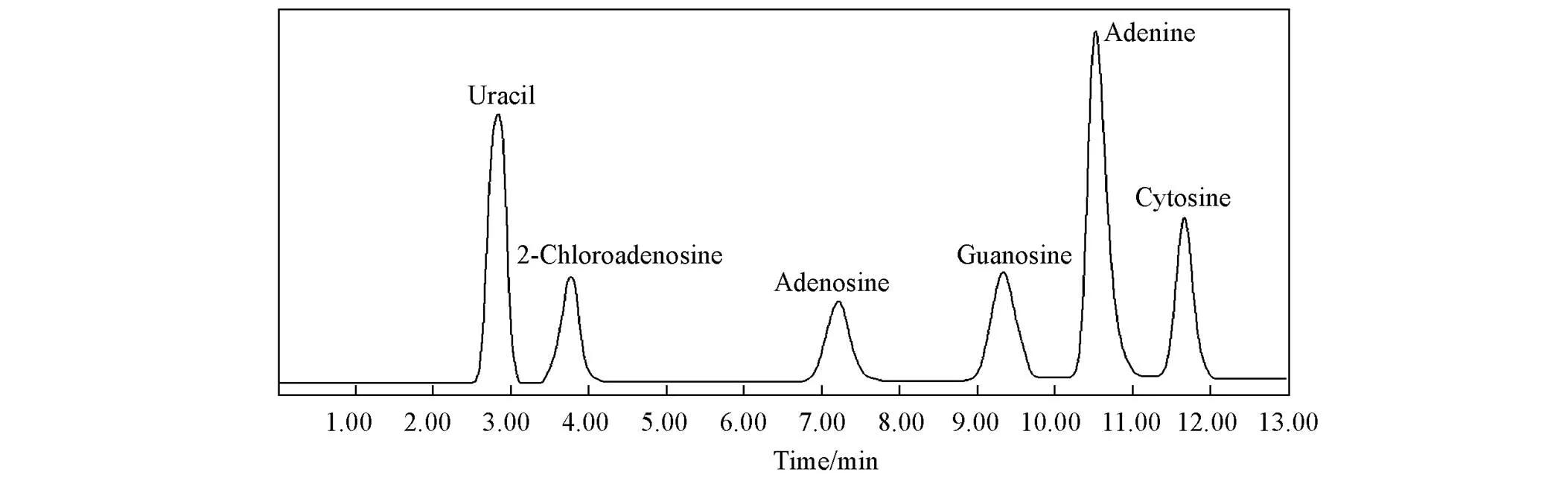
Fig.7 Chromatographic separation of 6 base nucleosides on Sil⁃IL⁃C4 column
2.2.3RPLC/HILIC混合色谱模式研究中发现, Sil-C18-IL-C4固定相在不同的流动相体系中表现出不同的分离模式. 将乙腈-20 mmol/L甲酸铵溶液作为流动相, 在改变流动相中乙腈的体积分数的情况下分离了9种不同极性的探针分子. 如图8所示, 随着流动相中乙腈含量的降低, 亲水性溶质(碱基核苷类化合物)在Sil-C18-IL-C4柱上的保留明显降低, 表现出典型的HILIC色谱模式保留特征; 与之相反, 当乙腈含量降低时, 疏水性溶质(4-硝基氯苯和萘等)的保留更强, 表现出典型的RPLC色谱模式保留特征. 这说明上述条件下在单根色谱柱上单次运行即可实现RPLC/HILIC的混合分离模式.

Fig.8 Effect of acetonitrile content on retention of nine compounds with different polarities in mixed chromatography mode
2.4 Sil-C18-IL-C4色谱柱的重复性
对图8中9种待分离样品连续进样10次, 考察了Sil-C18-IL-C4色谱柱的重复性. 结果表明, 9种待分离样品在色谱柱中保留时间的相对标准偏差(RSD)为0.27%~1.04%(=10), 证实其具有较好的分离重复性.
3 结 论
采用分步键合反应制备了新型咪唑基双阳离子型离子液体和十八烷基共同修饰的混合模式硅胶色谱固定相(Sil-C18-IL-C4); 采用元素分析和红外光谱对该固定相进行了表征, 红外光谱图能较好地描述每一阶段产物的特征峰, 结合元素分析结果可证明混合模式固定相键合成功. 分别在反相色谱模式(RPLC)、 亲水色谱模式(HILIC)和RPLC/HILIC混合色谱模式下对固定相的色谱分离性能进行了评价, 结果显示Sil-C18-IL-C4色谱固定相对碱基核苷类化合物有优异的分离选择性及良好的分离重复性, 对物质的保留能够提供疏水作用、作用、 氢键作用及偶极作用等, 且特定条件下该固定相可以在单根色谱柱单次运行实现RPLC/HILIC混合色谱分离模式. 后续工作将进一步研究该固定相的生物样品分离性能.
[1] Niu Y. L., Yang J., Dong J. B., Gong B. L.,, 2014,(3), 283—288(牛玉玲, 杨静, 董佳斌, 龚波林. 分析测试学报, 2014,(3), 283—288)
[2] Zhong H. M., Zhang H., Wang H. H.,, 2013,(4), 342—347(钟虹敏, 张华, 万慧慧. 色谱, 2013,(4), 342—347)
[3] Huang Y., Mou S. F.,, 2000,(5), 412—419(黄源, 牟世芬. 色谱, 2000,(5), 412—419)
[4] Lei G. H., Xiong X. H., Huo Y. M., Wei Y. M., Zheng X. H.,, 2008,(2), 268—272(雷根虎, 熊晓虎, 霍艳敏, 卫引茂, 郑晓晖. 高等学校化学学报, 2008,(2), 268—272)
[5] Sun Y. A., Wang C. W., Li Z. X., Yu W. H., Liu J. W., Zhu Y.,, 2018,(12), 1206—1210(孙雨安, 王超威, 李振兴, 于文浩, 刘军伟, 朱岩. 色谱, 2018,(12), 1206—1210)
[6] Zhang K., Zhi M. Y., He Z., Zhu Y., Zeng X. Q., Shou D,, 2020,(4), 445—451(张恺, 支明玉, 何艺, 朱岩, 曾秀琼, 寿旦. 色谱, 2020,(4), 445—451)
[7] Li G., Liu X., Jiang S. X.,, 2010,(6), 621—624(李广, 刘霞, 蒋生祥. 分析测试学报, 2010,(6), 621—624)
[8] Wang Y., Liang G. D., Han Q., Hu X., Zhang Q. W., He Z. Y.,, 2018,(7), 615—620(汪耀, 梁高道, 韩清, 胡迅, 张启伟, 何振宇. 色谱, 2018,(7), 615—620)
[9] Cheng X. D., Li Y. P., He Y. J.,, 2019,(7), 683—691(成晓东, 李云萍, 贺银菊. 色谱, 2019,(7), 683—691)
[10] Zhang J., Wang L. L., Shan L. G., Wei Y. M.,, 2012,(8), 804—809(张静, 王玲玲, 单联国, 卫引茂. 色谱, 2012,(8), 804—809)
[11] Buszewski B., Noga S.,., 2012,, 231—247
[12] Bernal J., Ares A. M., Pol J. Wiedmer S. K.,, 2011,, 7438—7452
[13] Yu Q. W., Zheng F., Fang M. K., Feng Y. Q.,, 2019,(9), 1857—1865(余琼卫, 郑凤, 方凯敏, 冯钰锜. 高等学校化学学报, 2019,(9), 1857—1865
[14] Yang D., Yu D.M., Dong X. F., Shen A. J., Jin G. W., Guo Z. M., Yan J. Y., Liu M. Y., Liang X. M.,, 2015,(10), 1439—1444(杨铎, 俞冬萍, 董雪芳, 沈爱金, 金高娃, 郭志谋, 闫竞宇, 刘名扬, 梁鑫淼. 分析化学, 2015,(10), 1439—1444)
[15] Qiu H. D., Zhang M. L., Gu T. N., Takafuji M., Ihara H.,, 2013,, 18004—18010
[16] Zhou D., Zeng J., Fu Q. F., Gao D., Zhang K. L., Ren X. J., Zhou K., Xia Z. N., Wang L. J.,, 2018,, 165—175
[17] Yang Y., Geng X. D.,, 2011,, 8813—8825
[18] Li Y. Y., Xu Z. G., Feng Y. Y., Liu X. Y., Chen T., Zhang H. X.,, 2011,, 523—530
[19] Qiao X. Q., Zhang L., Zhang N., Wang X., Qin X. Y., Yan H. Y., Liu H. Y.,, 2015,, 107—116
[20] Sun M., Feng J. J., Luo C. N., Liu X., Jiang S. X.,, 2013,, 135—141
[21] Ray S., Takafuji M., Ihara H.,, 2012,, 43—52
[22] Bai Q., Liu Y. Y., Wang Y. X., Zhao K. L., Yang F., Liu J. W., Shen J. W., Zhao Q. Y.,, 2018,, 89—97
[23] Liu X. D., Pohl C.,, 2008,, 83—89
[24] Lin J., Lin J., Lin X. C., Xie Z. H.,, 2009,, 801—806
[25] Sun M., Feng J. J., Luo C. N., Liu X., Jiang S, X.,, 2014,, 2651—2658
[26] Xian H., Peng H. J., Wang X., Long D. Y., Ni R. X., Chen J., Li S. Y., Zhang Z. Y., Peng J. D.,, 2019,, 104131
[27] Anderson J. L., Ding J., Welton T., Armstrong D. W. J.,., 2002,, 14247—14254
[28] Abraham M. H.,., 1993,, 73—83
[29] Liu S. J., Zhou F., Xiao X. H., Zhao L., Liu X., Jiang S. X.,, 2004,, 1060—1062
[30] Qiu H. D., Jiang S. X., Liu X.,, 2006,, 265—270
[31] Qiu H. D., Jiang S. X., Liu X., Zhao L.,, 2006,, 46—50
[32] Guo D. D., Yang C. X., Qiu R. C., Huang S. H.,, 2020,, 461330
[33] Wang X., Peng J. D., Peng H. J., Chen J., Xian H., Ni R. X., Li S. Y., Long D. Y., Zhang Z. Y.,, 2019,, 460372
[34] Ni R. X., Peng J. D., Wen M. M., Peng H. J., Zhang Z. Y., Li S. Y., Wang X., Chen J., Long D. Y., Xian H.,, 2020,, 324
[35] Zhao, X. J., Tan K. F., Xing J.,, 2019,, 197—208
[36] Zhou H., Chen J., Li H., Quan K. J., Zhang Y. S., Qiu H. D.,, 2020,, 120743
[37] Wang J., Tang Y. Q., Chu H. Y., Shen J. W., Wang C. Z., Wei Y. M.,, 2020,(14), 2766—2772
[38] Fan F. B., Pan J. J., Li Y. J., Wang L. C., Wang S., Liang X. J., Guo Y.,, 2020,(3), 746—750
[39] Zhou X., Chen J., Zhang Y. S., Zhao L., Qiu H. D.,, 2020,(4), 438—444(周行, 陈佳, 张樱山, 赵亮, 邱洪灯. 色谱, 2020,(4), 438—444)
[40] Wang J., Liu H., Wu D., Zhao B. H., Shen J. W., Wang Z. C., Wei Y. M., Chin., 2020,(4), 424—429(王婕, 刘宏, 吴丹, 赵碧红, 申继伟, 王超展, 卫引茂. 色谱, 2020,(4), 424—429)
[41] Li X. T., Liang P., Zhou Y. F., Qiao X. Q.,, 2020,(11), 1263—1269(李新庭, 梁鹏, 周玉凤, 乔晓强. 色谱, 2020,(11), 1263—1269)
[42] Shi X. Y., Han X. Y., Ma W. J., Wei J. F., Li J., Zhang Q., Chen Z. G.,, 2011,, 57—62
Preparation and Chromatographic Performance of Mixed-mode Silica Stationary Phase Modified by Double Cationic Ionic Liquid and Octadecyl Group
JIShuangqi1, JINZhao1, GUANWenna2*, PanXiangyu1, GuanTong1
(,,266045,;,,266101,)
In this paper, a mixed-mode silica chromatography stationary phase(Sil-C18-IL-C4) modified by imidazole-based double cationic ionic liquid and octadecyl group was prepared by a step-by-step bonding reaction. The stationary phase was characterized by elemental analysis and infrared spectroscopy. The chromatographic separation performance of the stationary phase in reversed-phase mode(RPLC), hydrophilic mode(HILIC) and RPLC/HILIC mixed-mode were evaluated, respectively, and 6 base nucleosides were separated in HILIC mode. The influence of the volume fraction of the organic phase and the concentration of ammonium formate in the aqueous phase on the separation effect was also investigated. In addition, the repeatability of stationary phase separation was investigated. Elemental analysis and characterization of the prepared Sil-C18-IL-C4 stationary phase show that the nitrogen content was 1.65%, the carbon content was 11.16%, and the hydrogen content was 2.44%. In the characterization results of infrared spectroscopy, the asymmetric and symmetric stretching vibration peaks of —CH appeared at 2928 and 2856 cm‒1, and the stretching of C=C on the imidazole ring appeared at 1440 and 660 cm‒1. The vibration peaks and the bending vibration peaks of C=N indicate that both octadecyl and 1,5-bis(imidazol-1-yl)pentane were grafted onto the silica surface. The chromatographic performance evaluation results showed that the Sil-C18-IL-C4 mixed-mode silica stationary phase could simultaneously exhibit reversed-phase and hydrophilic-interaction chromatographic separation performance, and could completely separate 6 kinds of base nucleosides. Moreover, under certain chromatographic conditions, the RPLC/HILIC mixed separation mode can be realized in a single run of a single chromatographic column. It has good application potential for solving hydrophilic substances such as base nucleosides in complex samples.
Imidazole-based double cationic ionic liquid; Mixed mode chromatography; Stationary phase; Base nucleoside
O657
A
10.7503/cjcu20220008
2022-01-05
2022-03-15.
观文娜, 女, 博士, 高级工程师, 主要从事高性能色谱柱制备技术的研究. E-mail:guanwn@qibebt.ac.cn
中国科学院仪器设备功能开发技术创新项目资助.
Supported by the Instrument and Equipment Function Development Technology Innovation Project, Chinese Academy of Sciences.
(Ed.: N, K)

