肾上腺素联合冰水浴制备气滞血瘀证大鼠中医症状及生物学指标的动态观察❋
赖潇筱,陈兰英△,苏博超,张 妮,罗颖颖,崔亚茹
(1.江西中医药大学中药固体制剂制造技术国家工程研究中心,南昌 330006;2.江西中医药大学岐黄国医书院,南昌 330025;3.江西中医药大学药学院,南昌 330004)
血瘀证是临床极其常见的疾病证候,通常是指因气虚、气滞、寒凝、火热等原因导致血瘀而血行不畅[1]。目前气滞血瘀证的动物造模方法繁多,有单因素造模如肾上腺素法、冰水浴法、声光电刺激法,有复合因素造模如肾上腺素加冰水浴法、肾上腺素加夹尾法等[2,3]。但目前仍未出现一种较为公认的血瘀证动物模型,究其原因主要有评价标准不一、重复应用性不强、病证符合度不高等[2]。
现今最为常用的血瘀证造模方法是短期皮下注射肾上腺素联合冰水浴[4-6],该模型一方面利用肾上腺素既能兴奋交感神经又能收缩血管的作用造成情志郁结、七情内伤而形成气滞;另一方面利用冰水浴寒凝致瘀的作用形成血瘀,共同建立气滞血瘀证动物模型。但该模型的中医症状不明显,血瘀证特征维持时间较短[7],不适用于慢性实验研究亦无法体现中医特色。
本研究采用长期皮下注射肾上腺素联合冰水浴的方法建立气滞血瘀证大鼠模型,通过动态观察其中医症状及血流动力学、血液流变学、血脂等相关生物学指标的变化进行评价,并确定模型最佳检测时间,为今后气滞血瘀证及理气活血药相关实验研究奠定基础。本研究通过江西中医药大学实验动物伦理委员会批准(批号JZSYDWLL-20200801)。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量180~220 g,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号SCXK(湘)2019-0004。将大鼠饲养于(22±1)℃的恒温环境动物房内,食物和水自由供应。
1.2 主要试剂与仪器
盐酸肾上腺素(货号E4642-5G-9),美国Sigma公司;异氟烷(货号w100),深圳市瑞沃德生命科技有限公司;乌来糖(货号S11036),上海源叶生物科技有限公司;肝素钠(货号H8060),北京索莱宝科技有限公司;肌酸激酶同工酶(creatine kinase-MB, CK-MB)测定试剂盒(货号MB7242),北京利德曼生化股份有限公司;谷草转氨酶(aspertate aminotransferase, AST)(货号ER372)、乳酸脱氢酶(lactic dehydrogenase, LDH)(货号KM174)、总胆固醇(total cholesterol, TC)(货号AH981)和甘油三酯(triglyceride, TG)测定试剂盒(批号分别为ER372、KJ918),富士胶片和光纯耀化学有限公司;低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)(批号200801)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)检测试剂盒(批号200801),重庆中元生物技术有限公司;大鼠血栓素B2(thromboxane B2, TXB2)(货号MM-0516R1)、大鼠6酮前列腺素F1α(6-keto-prostacyclin F1α、6-keto-PGF1α)(货号MM-0268R1)、大鼠纤溶酶原激活物抑制因子(plasminogen activator inhibitor, PAI)-1(货号MM-0072R17)、大鼠组织型纤溶酶原激活剂(tissue-type plasminogen activator, t-PA)(货号MM-0523R1)、大鼠内皮素(endothelin-1, ET-1)ELISA试剂盒(货号MM-0634R1),江苏酶免实业有限公司;NO一步法试剂盒(货号A012-1-2),南京建成生物工程研究所;HE染色试剂盒(货号G1120),北京索莱宝科技有限公司。
HY-96B病理大体拍摄仪,杭州数明科技有限公司;ML866 Powerlab电生理记录仪,艾德仪器国际贸易有限公司;Transonic Systems Ins TS420血流仪,艾德仪器国际贸易有限公司;F3AL250V全自动血液黏度动态分析仪,重庆南方数控设备股份有限公司;Spectra Max i3酶标仪,德国 Molec-ular Devices公司;7100全自动生化分析仪,日本日立公司;KD-TS3A组织脱水机,北京佳源兴业科技公司;YB-6LF组织石蜡包埋机,湖北孝感亚光医用电子技术公司;RM2016石蜡切片机,德国Leica公司;ECLIPSE Ni-E正置荧光显微镜,日本Nikon公司。
2 方法
2.1 动物心电图筛选
所有大鼠适应性喂养5 d后,采用Powerlab电生理记录仪筛选出心电图正常的大鼠。
2.2 动物分组与模型构建
表1示,将心电图正常的40只大鼠随机分为正常组、气滞血瘀证12 h组(以下简称“12 h组”)、气滞血瘀证24 h组(以下简称“24 h组”)、气滞血瘀证48 h组(以下简称“48 h组”)、气滞血瘀证96 h组(以下简称“96 h组”),每组各8只。

表1 各组实验大鼠处理方法比较
2.3 大鼠中医症状观察
2.3.1 大鼠体质量和日摄食量记录 每天记录正常大鼠和气滞血瘀证大鼠的体质量及摄食量。摄食量计算公式:日摄食量(g/100 g)=(投入量-剩余量)/体质量×100。
2.3.2 大鼠证候积分评价 参照文献记载方法建立气滞血瘀证大鼠模型证候积分评价量表(见表2),对各组大鼠进行证候积分评价[8,9]。

表2 气滞血瘀证大鼠模型证候积分评价量表
2.3.3 大鼠爪、尾、舌显微拍照及图像处理 20%乌拉坦以7 mL/kg的剂量麻醉大鼠,将大鼠的左后爪、尾巴中末端及舌面置于病理大体拍摄仪中同一位置、同一亮度下拍照。
将照片输入电脑,采用Image J图像分析软件对图片进行白平衡,用不规则曲线工具分别框定出大鼠舌面、足底和尾部范围,检测其RGB色彩空间的红(red, R)、绿(green, G)、蓝(blue, B)分量值。
2.4 大鼠血流动力学测定
将处于麻醉状态的大鼠仰卧固定,通过Power lab 电生理记录仪记录大鼠心电图。分离左股动脉,置入含有肝素钠溶液的PE-50聚乙烯导管监测动脉血压;分离右颈动脉,将导管插入心脏观察左心室压力变化;分离左颈动脉,将血流探头填充满超声耦合剂后套在左颈动脉上监测血流量。记录30 min内的动脉收缩压、动脉舒张压、左室收缩压、左室舒张末期压、等容收缩期左心室内压力上升的最大速率(maximum rate of rise of left ventricular systolic pressure and left ventricular pressure, +dp/dt max)、等容舒张期左心室内压力下降的最大速率(maximum rate of fall of left ventricular systolic pressure and left ventricular pressure,-dp/dt max)和血流量,并通过计算机每隔5 min采集10 s的数据,共采样6次取平均值。
2.5 大鼠血液流变学测定
腹主动脉取血,4 mL全血样本用血流仪在所有剪切速率(200/s、30/s和1/s)下测量全血黏度、红细胞压积。全血离心后获得血浆,用血流仪测量血浆黏度和纤维蛋白原。另外通过血流仪还可获取全血高、中、低切还原黏度,全血高、中、低切相对黏度,高、中、低切流阻及卡森黏度,卡森应力、红细胞电泳时间、红细胞计数、红细胞聚集指数以及血红蛋白浓度。试剂盒测定血清中的血小板聚集指标TXB2,6-keto-PGF1α及凝血纤溶系统指标t-PA、PAI-1。
2.6 大鼠血清中血脂4项、血管内皮细胞损伤指标及心肌酶水平检测
采用全自动生化分析仪检测血清中的血脂4项即TC、TG、LDL-C、HDL-C与心肌酶指标AST、LDH、CK-MB,采用相应的试剂盒测定血管内皮细胞损伤指标NO和ET-1。
2.7 大鼠腹主动脉及心肌组织的病理学观察
取大鼠腹主动脉和心脏分别置于甲醛固定液中固定24 h以上,经组织脱水、石蜡包埋切成5 μm厚的薄片HE染色,显微镜下观察大鼠腹主动脉及心肌组织的病理变化。
2.8 统计学方法
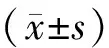
3 结果
3.1 各组大鼠中医症状变化比较
图1示,在造模过程中,气滞血瘀证大鼠体质量增长较正常组缓慢,日摄食量下降;表3示,大鼠证候积分明显升高(P<0.01)。图2~4示,分析大鼠舌面、足底和尾部发现,气滞血瘀证大鼠这3个部位均呈现紫暗色;表4示,大鼠舌面分析结果表明,12 h和24 h组的R、B值下降显著(P<0.05,P<0.01),G值下降但差异无统计学意义(P>0.05),48 h与96 h组的R、G、B值均明显下降(P<0.01);表5示,大鼠足底分析结果表明,12 h和24 h组的R值下降显著(P<0.01),G、B值下降但差异无统计学意义(P>0.05),48 h与96 h组的R、G、B值均明显下降(P<0.05,P<0.01);表6示,大鼠尾部分析结果表明,12 h、24 h、48 h、96 h组大鼠尾部的R、G值均明显下降(P<0.05,P<0.01),B值差异无统计学意义(P>0.05)。
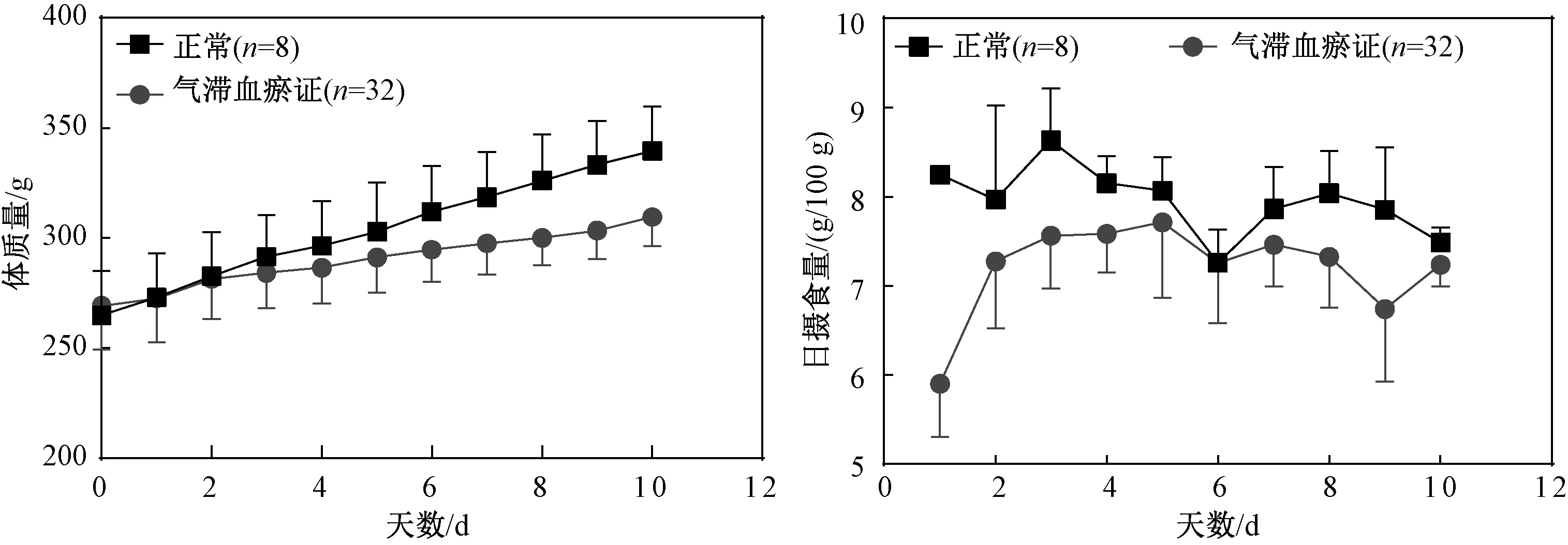
图1 造模过程中大鼠体质量及日摄食量变化情况比较

表3 大鼠血瘀模型证候积分评价结果比较(分,

表4 各组大鼠舌面图片分析结果比较

图2 各组大鼠舌面图片

图3 各组大鼠足底图片

表5 各组大鼠足底图片分析结果比较

表6 各组大鼠尾部图片分析结果比较

图4 各组大鼠尾部图片
3.2 各组大鼠血流动力学变化
图5示,血流动力学结果显示, 气滞血瘀证大鼠血流动力学出现异常。

注:等容收缩期左心室内压力上升/下降的最大速率(maximum rate of rise/fall of left ventricular systolic pressure and left ventricular pressure,±dp/dt max);与正常组比较:*P<0.05,**P<0.01
图6示,与正常组比较,气滞血瘀证大鼠动脉收缩压、动脉舒张压、平均血压、±dp/dt max、平均血流量均有不同程度的降低,左室舒张末期压有不同程度的升高,左室收缩压基本不变。其中,12 h组平均血流量降低差异有统计学意义(P<0.05),48 h组的动脉收缩压、动脉舒张压、平均血压下降明显(P<0.01),96 h组的动脉收缩压下降明显(P<0.05)。表7示,同步观察心电图结果表明,12 h组、24 h组、48 h组、96 h组的QRS时程均明显增宽(P<0.05,P<0.01),12 h组、24 h组、48 h组的Q-T间期明显延长(P<0.01),24 h组、48 h组、96 h组的R波幅度显著下降(P<0.05),12 h组、24 h组、48 h组、96 h组的ST值显著降低(P<0.05,P<0.01),12 h组心率明显加快(P<0.05)。

注:等容收缩期左心室内压力上升/下降的最大速率(maximum rate of rise/fall of left ventricular systolic pressure and left ventricular pressure,±dp/dt max);与正常组比较:*P<0.05,**P<0.01

表7 各组大鼠心电图参数变化比较
3.3 各组大鼠血液流变学变化
图7示,与正常组比较,12 h组、24 h组、48 h组的高、中、低切全血黏度显著升高,而96 h组仅高切全血黏度显著升高(P<0.05,P<0.01);血浆黏度仅12 h组、24 h组明显升高(P<0.05,P<0.01)。表8示,12 h组、24 h组的红细胞压积、红细胞电泳时间、红细胞计数、红细胞聚集指数以及血红蛋白浓度明显高于正常组(P<0.05,P<0.01),48 h组、96 h组仅红细胞电泳时间、红细胞聚集指数明显升高(P<0.05,P<0.01)。表8示,与正常组比较,12 h组、24 h组的全血低切还原黏度及全血高、低切相对黏度均明显升高(P<0.05,P<0.01);48 h组的全血低切还原黏度和全血低切相对黏度明显升高(P<0.05);96 h组的全血还原黏度与全血相对黏度趋于正常。表10示,与正常组比较,12 h组、24 h组的纤维蛋白原含量,高、中、低切流阻、卡森黏度、卡森应力明显升高(P<0.05,P<0.01);48 h组的高、中、低流阻、卡森黏度、卡森应力显著升高(P<0.05,P<0.01);96 h组高、中切流阻和卡森黏度显著增加(P<0.05)。

注:与正常组比较:*P<0.05,**P<0.01

表8 各组大鼠纤维蛋白原、流阻、卡森黏度、卡森应力变化比较

表9 各组大鼠红细胞变化比较

表10 各组大鼠全血还原黏度、全血相对黏度变化比较
表10示,12 h组、24 h组、48 h组、96 h组的TXB2含量较正常组均明显升高,6-keto-PGF1-α含量明显降低,TXB2/6-keto-PGF1-α显著升高(P<0.01)。表12示,与正常组比较,12 h组、24 h组、48 h组、96 h组的PAI-1水平均明显升高,t-PA水平均明显降低(P<0.01)。

表11 各组大鼠血清TXB2、6-keto-PGF1-α和TXB2/PGF1-α变化比较
3.4 各组大鼠血清中血脂4项、血管内皮细胞损伤及心肌酶指标的变化
表12示,与正常比较,12 h组、24 h组的LDL-C水平明显升高(P<0.05,P<0.01);96 h组的TC、HDL-C、LDL-C水平明显升高(P<0.05,P<0.01)。

表12 各组大鼠血清PAI-1和t-PA水平变化比较
表13示,与正常组比较,24 h组的血清NO含量明显降低,ET-1含量明显升高(P<0.05,P<0.01)。24 h组大鼠血清AST、LDH、CK-MB水平较正常组均显著升高(P<0.05,P<0.01)。

表13 各组大鼠血清血脂4项水平变化比较
3.5 2组大鼠腹主动脉及心肌组织病理学变化
图8示,HE染色结果显示,正常组腹主动脉结构完整,24 h组腹主动脉内皮损伤,血管壁变形,膜结构紊乱,部分血管内皮细胞从血管壁脱落。图9示,正常组心肌组织排列整齐;24 h组心肌组织结构紊乱,部分肌纤维断裂、溶解,表明造模后的大鼠心肌受损。

表14 2组大鼠血清NO、ET-1、AST、LDH、CK-MB含量比较

图8 大鼠腹主动脉病理图(HE染色×400)

图9 大鼠心肌组织病理图(HE染色×400)
4 讨论
中医认为情志郁结、气机失调、七情内伤致气滞血瘀。有研究表明,肾上腺素增多可能是中医“血瘀证”形成的原因之一[10]。血热则行,得寒则凝,寒邪入体损伤阳气,气血运行无力而致瘀。本研究通过连续10 d皮下注射2次肾上腺素0.45 mg/(kg·d)联合10 min/d的冰水浴建立气滞血瘀证模型,观察造模后12 h、24 h、48 h及96 h的中医症状及生物学指标的动态变化。结果表明,大鼠在造模后96 h内均表现出明显的血瘀证,血流动力学、血液流变性功能改变,造模24 h后的血管内皮及心肌可见明显受损。
气滞血瘀证的诊断标准[11-13]以固定性疼痛、爪甲青紫、舌质紫黯、精神异常等为外观表征依据,以微循环障碍、血流动力学障碍、血液流变性异常等为微观辨证依据。本研究以大鼠证候积分评价和舌、足、尾的RGB颜色模式分析作为模型的中医症状评价指标,结果发现造模后12 h、24 h、48 h及96 h的大鼠气滞血瘀证证候积分升高,舌、足、尾的R值均明显下降,表明该气滞血瘀证模型大鼠符合血瘀证外观表征。同时,实验检测了大鼠的动脉血压、左心室压、±dp/dt max以及心电图,发现该气滞血瘀证大鼠存在一定程度的血流动力学障碍;检测全血黏度、血浆黏度、红细胞相关指标、血小板聚集因子、凝血纤溶因子等血液流变学指标发现,12 h及24 h组的上述指标均明显升高,48 h及96 h组大部分指标明显异常;检测血清中血脂4项发现,12 h及24 h组的LDL-C水平明显升高,96 h组的TC、HDL-C、LDL-C水平明显升高。
血行于脉,输布周身。当血管内皮损伤时,NO/ET-1失衡所导致的血管舒缩功能异常,使得血阻于脉而生血瘀。研究显示,24 h组大鼠的NO含量降低,ET-1含量增多,其腹主动脉组织病理图亦显示,有部分血管内皮细胞脱落,表明气滞血瘀证大鼠的血管内皮出现损伤。心主血脉,血脉不通必影响其心。心肌损伤时细胞膜通透性增加,心肌酶如AST、LDH、CK-MB释放入血,血清酶水平异常升高[14]。实验结果显示,24 h组大鼠的血清AST、LDH、CK-MB水平均明显升高,其心肌组织病理图表明,心肌结构紊乱,肌丝溶解,表明气滞血瘀证大鼠出现心肌损伤。
综上所述,皮下注射盐酸肾上腺素0.9 mg/(kg·d),联合0~2 ℃冰水浸泡10 min,连续造模10 d可成功制备出气滞血瘀证大鼠模型,在造模后96 h仍可维持血瘀症状及大部分病理特征。此外,气滞血瘀证的发生发展可能与其血管及心肌组织受损均有关,具体机制有待进一步探讨。

