谷子GRAS 家族全基因组鉴定及表达分析
刘浩瑞,徐寅楠,任雪梅
(山西农业大学 生命科学学院,山西 太谷 030801)
谷子(Setaria italica)属于1 年生草本植物,是 禾本科狗尾草属小型二倍体(2n=18)C4粮食作物,其生命周期短,属于近交系,起源于我国[1],是亚洲和非洲部分地区广泛用作食物和饲料的一种主要作物。在其漫长的栽培历史中,已经适应了亚洲、北非、南美和北美的干旱和半干旱地区。谷子具有耐干旱、耐贫瘠、耐贮存等生物学特性[2],其籽粒中含有丰富的必需氨基酸,如赖氨酸、色氨酸、蛋氨酸等,对于成功地开发低成本、富含蛋白成分的功能性食品有很大的潜能,这些食品有助于预防和管理与生活方式相关的慢性疾病。我国作为最大的发展中国家,农业资源的匮乏加剧了蛋白质缺乏,种植谷子是保障大众营养健康的最佳方式[3]。所以,如何提高谷子的产量和品质受到人们的广泛关注。
转录因子对于调控植物生长发育具有重要意义,它们在发育和信号转导中发挥着关键作用[4-6]。比如,转录因子在调节植物对环境胁迫的反应中起着重要的作用,可能为提高作物对病害和环境胁迫的耐受性提供新的途径[7-11];转录因子在植物气孔运动中也发挥不可或缺的作用,各种转录因子共同保证了植物的生长发育[12-13]。目前,已经有许多转录因子家族的功能通过生物信息学的方法被研究报道,比如谷子bZIP 转录因子家族[1]、谷子NF-YB转录因子家族[14]、谷子和狗尾草WOX 转录因子家族[15]等。GRAS 家族蛋白是植物中广泛存在的一种转录调节因子,近年来的结构研究揭示了其在结构水平上的分子功能。大多数GRAS 蛋白包括一个N 端不保守的可变区域和一个C 端保守的GRAS 结构域[16]。GRAS 家族成员几乎均为单基因,编码蛋白质长度为360~850 个氨基酸[17],通过亚细胞定位,发现该家族的蛋白多数在细胞核、细胞质及叶绿体基质中表达,可能与腋芽的发育与光合作用有关。在其C 端发现了几个基序:亮氨酸七肽重复序列I(LHRⅠ)、VHIID、亮氨酸七核苷酸重复序列Ⅱ(LHRⅡ)、PFYRE 和SAW 基序。相比之下,GRAS 蛋白的N 末端呈现高变异性,由涉及分子识别的内在无序结构组成[18]。GRAS 家族基因参与植物的生长发育调控,在植物根及腋芽发育、分生组织形成、信号传导等过程中发挥重要作用[19]。现 阶 段,GRAS 家 族 已 经 在 拟 南 芥[20]、水稻[21]、番 茄[22]、葡 萄[23]、荷 花[24]、蓖 麻[25]、黄 瓜[26]等 多个物种中研究报道,但在谷子中还未曾研究。
谷子基因组相对较小,约为500 Mb,易于研究和观察,被认为是一种理想的模式植物[27]。本研究以xiaomi为试验材料,主要鉴定了SiGRAS基因家族成员,对其进行了基因定位、系统进化、结构域、基因表达、启动子顺式作用元件分析等系统的生物信息学分析,发现SiGRAS基因家族可能在谷子抗逆性、抗病原菌及生长发育方面发挥着重要的作用,该研究结果可为提高谷子产量及品质提供理论支持。
1 材料和方法
1.1 全基因组序列的获取
从MDSi: Multi-omics Database forSetaria italica(http://foxtail-millet.biocloud.net/page/util/extendDetail?page=species&name=xiaomi%20)数据库中获取谷子(xiaomiannotation V1.0)的基因组数据、CDS序列数据、gff基因注释文件、总蛋白序列。
1.2 SiGRAS 基因家族鉴定及定位分析
利用Pfam 数据库(http://pfam.xfam.org/)下载含有GRAS 类结构域的隐马尔可夫模型。通过TBtools 软件中的Simple HMM Search 命令对谷子全基因组蛋白数据进行搜索,筛选SiGRAS基因家族的候选基因。通过TBtools 软件中的Blast 功能对水稻和拟南芥蛋白质序列与谷子全基因组进行比对,筛选E-value<1e-5的基因为SiGRAS基因家族的候选基因。用韦恩图比较2 种方法的基因数量差别,最终鉴定出SiGRAS基因家族的候选基因。利用谷子基因组注释gff 文件,对筛选到的SiGRAS基因家族进行位置信息提取,使用TBtools 中的Graphics功能进行可视化操作,进行基因定位分析。
1.3 SiGRAS 家族的理化性质分析
通过在线网站ExPaSyProtparam(http://web.expasy.org/protparam)分析SiGRAS 家族编码的氨基酸组成及理化性质。利用PSORT Prediction数据库(http://psort1.hgc.jp/form.html)对该家族的蛋白序列进行亚细胞定位分析。
1.4 SiGRAS 家族系统进化分析
将筛选到的60 条SiGRAS 蛋白家族长度完整的氨基酸序列进行比对,利用MEGA 7.0 构建临近树(NJ)分析该家族与水稻、拟南芥同源家族的进化关系,使用iTOL 在线工具(https://itol.embl.de/login.cgi)美化进化树。
1.5 SiGRAS 家族的保守结构域和motif 分析
使用Pfam 数据库中的Batch search(http://pfam.xfam.org/search#tabview=tab1)进一步验证前几步得到的候选基因。取Blast 和HMMER 结果的交集验证蛋白序列结构域,最后用TBtools 中的Graphics 功能进行可视化操作。
利用在线工具MEME(https://meme-suite.org/)对60 个基因编码的氨基酸序列进行motif 预测,使用TBtools 进行可视化操作。
1.6 SiGRAS 家族顺式作用元件分析
在TBtools 软件中利用谷子基因组注释gff 文件、基因序列文件、CDS 序列文件提取启动子,在PlantCARE 在线数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)中对该家族的顺式作用元件进行分析,并利用TBtools 软件对得到的数据进行可视化操作。
1.7 SiGRAS 基因家族表达分析
在MDSi: Multi-omics Database forSetaria italica(http://foxtail-millet. biocloud. net/page/tools/expressionVisualization)数据库中下载并整理SiGRAS基因家族在不同器官中的表达量,包括晋谷21(JG21)在不同组织不同生长时期表达的数据,利用TBtools 软件绘制表达热图。
2 结果与分析
2.1 SiGRAS 基因家族鉴定及理化性质分析
使用HMMER 模型总共鉴定到GRAS 家族的60 个候选基因,利用Blastp 比对鉴定到了61 个候选基因,通过Pfam 数据库分析,最终筛选出含有GRAS 结 构 域 的基因60 个,如图1 所 示,除6 号 染色体外,这60 个基因不均匀分布于8 条染色体上;其中9 号染色体上分布最多,有13 个基因,依据在染色体上排列顺序,命名为SiGRAS1~SiGRAS60。
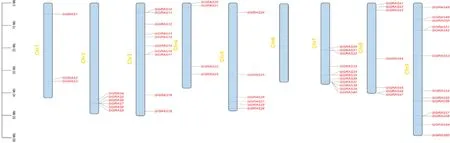
图1 SiGRAS 基因家族成员染色体定位Fig.1 Chromosome location of SiGRAS gene family members
为了更清楚该家族蛋白的性质,对其理化性质 及亚细胞定位进行了分析,结果列于表1。

表1 SiGRAS 家族理化性质分析Tab.1 Analysis of physical and chemical properties of SiGRAS family

续表1 SiGRAS 家族理化性质分析Tab.1(Continued) Analysis of physical and chemical properties of SiGRAS family
由表1 可知,不同SiGRAS 蛋白的氨基酸数目差异较大,SiGRAS46 蛋白的氨基酸数目最多,为1 394 个,SiGRAS17 蛋白的氨基酸数目最少,仅为295 个。SiGRAS 蛋白氨基酸序列的理论等电点在4.87~9.53,但是总体看SiGRAS 家族氨基酸序列的等电点大多数在酸性范围,蛋白质分子中富含酸性氨基酸。不稳定指数、脂溶指数及总平均疏水指数信息如表1 所示,该家族成员多为亲水性蛋白,在细胞质、细胞核、叶绿体基质3 个位置上的定位最多,与其他植物中的报道一致。
2.2 SiGRAS 家族进化分析
为了清楚SiGRAS 家族的进化情况,利用MEGA 7.0 中的NJ 法对谷子(60 个)、拟南芥(32 个)和水稻(53 个)3 个物种的GRAS 基因家族构建进化树,其结果如图2 所示。

图2 SiGRAS 家族系统进化树分析Fig.2 Phylogenetic tree analysis of SiGRAS family
从图2 可以看出,60 个SiGRAS基因家族成员被分为12 个亚族,命名为Ⅰ~Ⅻ,整体来看,SiGRAS基因家族与拟南芥、水稻有共同的祖先。Ⅻ亚族中,OsGRAS44 与SiGRAS49 聚为一个小支;Ⅺ亚 族 中,OsGRAS24 与SiGRAS21 具 有 很强的同源性;Ⅹ亚族中,AtGRAS1、AtGRAS7、AtGRAS14、OsGRAS1 与SiGRAS50 亲缘关系近;Ⅵ亚 族 中,SiGRAS6 与OsGRAS15 同 源;Ⅱ亚 族中,编码SiGRAS48 蛋白的基因与水稻GRAS 家族OsGRAS28基因亲缘关系更近;Ⅰ亚族中,OsGRAS37 与SiGRAS24 聚为一小支,说明谷子中该基因与水稻GRAS 家族OsGRAS37基因同源。
2.3 SiGRAS 家族的结构域分析
如图3 所示,SiGRAS 家族基因编码的蛋白均含有GRAS 结构域。值得注意的是,SiGRAS50、SiGRAS46、SiGRAS45、SiGRAS43、SiGRAS17、SiGRAS10 含有2 个结构 域,其中,SiGRAS50基 因编码产物的N 端还存在DELLA 结构域,SiGRAS43的C 端还含有NB-ARC 结构域;其余蛋白含有2 个GRAS 结构域,可能存在基因串联。

图3 SiGRAS 家族结构域分析Fig.3 Domain analysis of SiGRAS family
2.4 SiGRAS 家 族motif 分 析
利用Multiple EM for Elicitation(MEME)在线分析预测SiGRAS基因家族60 条序列的潜在功能域,共预测到8 个不同的motif。结果显示,所编码的大多数GRAS 类蛋白 中motif 以motif8、motif6、motif2、motif7、motif5、motif3、motif1、motif4 的顺序排列,其中motif5、motif7、motif6、motif2 容易发生易位,在每个GRAS 类蛋白中,motif4 都存在于C端 的 末 尾。motif1、motif2、motif5 含 有VHIID 基序,motif1、motif3、motif5、motif8 含 有PFYRE 基序,motif1、motif4 含 有SAW 基 序,可 以 看 出,motif1 保守性更好。SiGRAS46、SiGRAS10这2 个基因含有的功能域数目最多,分别含有17、15 个motif(图4),与结构域分析结果保持一致。

图4 SiGRAS 家族motif 分析Fig.4 Motif analysis of SiGRAS family
2.5 SiGRAS 家族启动子顺式作用元件分析
利用PlantCARE 网站分析SiGRAS 类基因的顺式作用元件(图5),发现该家族含有调节赤霉素(GA)相关信号通路的顺式作用元件,GA 能促进谷子茎的伸长、花的发育和籽粒的萌发;绝大多数基因含有光响应元件,参与光敏色素信号的转导;根特异性调控顺式作用元件对植物根和茎的辐射性生长起重要作用;分生组织调控元件,调节分生组织活动,促进植物体生长;生长素响应顺式作用调控元件对叶、芽的发育起促进作用;该家族还含有低温响应顺式作用元件,可以提高植物抗冷能力[28]。

图5 SiGRAS 家族顺式作用元件分析Fig.5 Cis-acting element analysis of SiGRAS family
2.6 SiGRAS 基因家族表达分析
利用SiGRAS家族(JG21)中基因在不同组织(根、茎、叶、叶肉、不同时期未成熟的籽粒和穗)基因表达量的数据绘制热图,结果如图6 所示,60 个SiGRAS基因的表达模式呈现多样化,发现SiGRAS基因家族在JG21 未成熟籽粒的5 个不同时期表达量偏低,仅有几个基因在籽粒中特异性表达,如SiGRAS25、SiGRAS6等,通过热图可以观察到SiGRAS25在籽粒中的表达量高于其他基因,且S2 期表达量高于其余4 个时期,推测该基因在谷子成熟转变过程中发挥作用,可促进籽粒营养物质的积累。SiGRAS6在根、茎、叶中均有表达,表达量大小依次为叶>茎>根;SiGRAS50、SiGRAS6、SiGRAS3在茎中表达量高,而SiGRAS50具有组织表达特异性,仅在茎中特异性高表达;其余基因在不同时期的籽粒和穗中均表现为低表达或不表达,该家族基因在根、茎、叶、叶肉中基因表达的数目较多,在籽粒和穗中表达较少,推测SiGRAS基因家族在基因表达上存在组织特异性。

图6 SiGRAS 家族基因表达谱Fig.6 The gene expression pattern of SiGRAS family genes
3 结论与讨论
GRAS 家族在植物生长发育、光信号传导等方面发挥着重要作用[28-29]。目前,许多植物中都已报道了该家族的相关功能。GRAS 基因家族成员最初被认为是植物生物学中的关键调控因子,以其最先发现的3 个成员Gibbereillin-Acid Intensive(GAI)、REPRESSOR of GAI(RGA)和SCARECROW(SCR)的特征字母命名[30-31]。本研究进化树显示,SiGRAS50 与AtGRAS1、AtGRAS7、AtGRAS14、OsGRAS1聚为一个小支。已有研究证明,AtGRAS7参与调控GA 信号通路,可有效延缓叶片衰老[32-33];OsGRAS1(SLR1)编码一个DELLA 蛋白,是GA信号传导的负调控因子,可以整合并放大水杨酸(SA)和茉莉酸(JA)介导的防卫信号、调控水稻的生长和免疫应答[34-35]。SiGRAS50 的N 端同样具有DELLA 结构域,含有赤霉素响应元件、生长素响应元件、低温响应元件,且在茎中特异性高表达。已有研究表明,DELLA 蛋白在拟南芥的GA 信号转导中起负调控作用[36];DELLA 蛋白不表达时,根茎会过度伸长[37],故推测SiGRAS50 蛋白在茎的生长发育中起关键性作用并参与GA 信号转导与调节逆境胁迫;此外,DELLA 蛋白调控的过程影响其籽粒产量或质量[38-39],也会影响作物开花时间[40]。
同样,SiGRAS6与OsGRAS15同源,OsGRAS15由CIGR2(chitin-inducible gibberellin-responsive 2)即几丁质诱导的赤霉素应答基因编码,水稻GRAS家族的2 个成员(CIGR1和CIGR2)由强效诱导子N-乙酰壳寡糖(GN)诱导,被外源GA 快速诱导。进一步表明,CIGR1和CIGR2在防御和发育中发挥作用。CIGR1和CIGR2以剂量依赖的方式对生物活性GA 产生反应[41],由此推测,SiGRAS6 在调控GA 信号转导方面发挥作用。SiGRAS6 在根、茎、叶中表达量均高,顺式作用元件和同源性分析可知,该蛋白具有生长素、脱落酸响应等顺式作用元件并参与GA 信号转导,推测SiGRAS6 通过调节激素响应影响根、茎、叶的生长发育,在谷子生长发育过程中起关键性作用,对谷子光合作用积累养分及谷子籽粒发育有调控作用。
此外,从进化树可知,SiGRAS49与OsGRAS44、SiGRAS21与OsGRAS24、SiGRAS48与OsGRAS28分别聚为一支,故推测SiGRAS49 能够与DNA 结合并发挥相应的功能[42],SiGRAS21 在耐旱方面发挥 着 重 要作用[43],SiGRAS48基 因 响应GA 及BR 信号,从而影响谷子发育和抵抗环境胁迫[44]。与SiGRAS24 同源的OsGRAS37 因位于水稻11 号染色体,预测其可能参与抵抗病原菌的侵染[45]。由结构分析可知,SiGRAS43 的C 端含有NB-ARC 结 构域,该结构域在苹果[46]、山葡萄[47]、陆地棉[48]等植物中已经被克隆到,该结构域含有抗病基因,可抵御病原菌侵染[49-50],可以通过调节SA、JA、ABA 等信号途径调节防御反应,推测SiGRAS43基因在谷子抵御病虫害方面可能发挥着重要作用。
本研究通过生物信息学对SiGRAS 家族成员进行染色体定位、进化树、结构域、基因表达、启动子顺式作用元件等的分析,共鉴定出60 个SiGRAS基因。经结构和功能分析可知,定位于9号染色体上的SiGRAS50 与OsGRAS1 亲缘关系最近,因含有DELLA 结构域,且在茎中特异性高表达,推测该蛋白对防御病虫害有关键作用并影响茎的发育。同样,位于9 号染色体的SiGRAS43 蛋白含有NB-ARC结构域,推测其参与病虫害防御。SiGRAS6在2 号染色体上,该蛋白与OsGRAS15 同源性高,在根、茎、叶中有高表达,推测该基因参与GA 信号传导并对谷子生长发育有关键作用。该家族对于谷子根、茎、叶的发育及信号通路的调控起关键性作用,可提高谷子的抗逆性、抗病原菌侵袭的能力,进而影响谷子的生长发育及光合作用过程,研究该家族可为进一步提高谷子产量及品质提供参考。

