药物临床试验中常见方案偏离及改进措施
谢江川 谢林利 曹丽亚 潘辛梅 马攀 陈勇川
关键词药物临床试验;方案偏离;质量管理;规范化;改进措施
药物临床试验指以人体(患者或健康受试者)为对象的试验,意在发现或验证某种试验药物的临床效果、药理学效果及其他药效学作用、不良反应,或者发现或验证试验药物的吸收、分布、代谢和排泄情况,以确定药物的疗效与安全性的系统性试验[1]。方案偏离(protocoldeviation,PD)是指在临床试验中,任何有意或无意偏离和不遵循经伦理委员会批准的试验方案规定的治疗规程、检查或数据收集程序的行为[2-4]。参与药物临床试验的各方在试验过程中,应该严格遵守临床试验相关要求、《药物临床试验质量管理规范》(Good Clinical Practice,GCP)和相关法律法规,遵循已获伦理委员会批准的方案,减少PD的发生,规范药物临床试验,保护受试者的权益和安全,保证临床试验数据的科学性、可靠性和真实性。笔者对负责管理的相关项目中存在的PD进行汇总和原因分析,并讨论了在药物临床试验过程中预防和减少PD 的方法和注意事项,以期为预防和减少临床试验项目管理中PD的发生提供参考。现报道如下。
1 资料与方法
以GCP(2020 局令第57 号)、《关于发布药物临床试验数据管理与统计分析的计划和报告指导原则的通告》(2016 年第113 号)、《药物临床试验伦理审查工作指导原则》(国食药监证〔2010〕436 号)、人用药品注册技术要求国际协调会议(International Conference onHarmonization,ICH)E3、ICH E6(R2)等法规为参照,笔者对2017 年3 月-2022 年2 月负责管理的相关项目中上报的PD,以及在递交材料、项目质控中发现的PD 进行梳理。本研究纳入的项目均为以注册为目的的药物临床试验。采用Excel 2019 软件对数据进行描述性统计分析。
2 结果
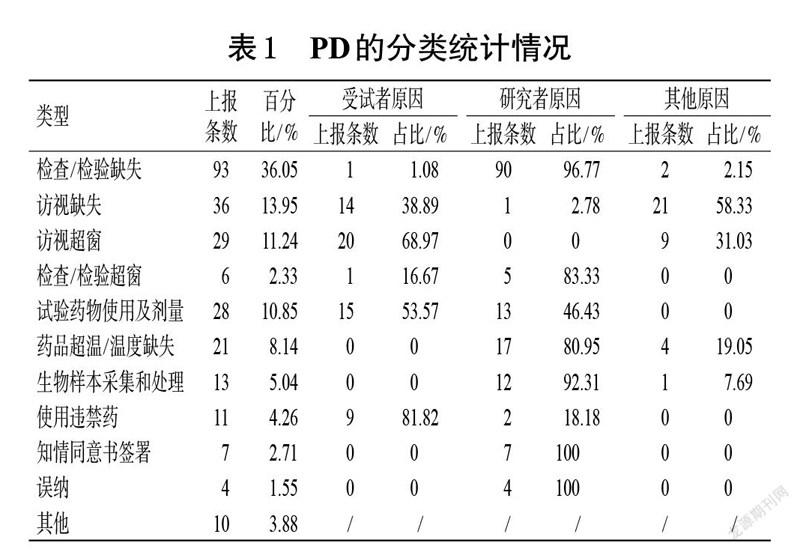
共纳入39 个药物临床试验项目,项目共筛选出了378 名受试者,其中212 名受试者纳入进行分析。经统计,在上述所有临床试验项目中共上报PD 258 條,PD上报频率较高的类型为检查/检验缺失、访视缺失、访视超窗、试验药物使用及剂量、药品超温/温度缺失、生物样本采集和处理、使用违禁药等(详见表1)。其中,重大PD包括误纳、使用违禁药、试验药物使用及剂量,共计28条,占比为10.85%;常规PD共计230条,占比为89.15%。
2.1 检查/检验缺失
检查/检验缺失是指受试者未按方案要求进行相应的检查、检验,是最常见的PD。此类PD 的严重程度视方案而定。如某慢性阻塞性肺病项目需要排除结核阳性患者,受试者未进行结核检验就已入组并用药,补测后若发现患者结核检验结果为阳性,则属于重大PD。如果为常规实验室检测,那么缺失的检查/检验不影响受试者入组、排除及随机分层等情况,则属于常规PD。在笔者管理项目上报的258 条PD 中,涉及检查/检验缺失的PD共计93 条,占比为36.05%。导致此类PD的主要原因如下:(1)受试者原因——患者在进行大便常规检查时未按要求操作,致使某些结果未检出(共计1 条,占此类PD 的1.08%)。(2)研究者原因——①研究者对方案不熟悉,漏开了相应的检查/检验(共计87 条,占此类PD的93.55%);②研究者开具了相关的检查/检验,研究护士也按方案采样,但送样时漏送,导致某结果缺失(共计3 条,占此类PD的3.22%)。(3)其他原因——血生化和血糖原本只需要1 份血样即可出具血生化和血糖检测结果,后因检验科更新系统,血生化检测和空腹血糖检测需要采集2 管血样送检,但专业科室只采血1份,导致血糖结果缺失(共计2条,占此类PD的2.15%)。
2.2 访视缺失
访视缺失是指受试者未按照试验方案要求来院随访,此类PD 的严重程度视方案而定。若此次访视需要检查/检验的某些关键指标涉及受试者中止或退出临床试验、二次随机用药等,则属于重大PD。如某卵巢癌项目需要在用药6 个周期后进行二次随机分组,若此次受试者访视缺失就属于重大PD。在笔者管理项目上报的258 条PD 中,涉及访视缺失的PD 共计36 条,占比为13.95%。导致此类PD 的主要原因如下:(1)受试者原因——患者因自身原因不能按时来院随访(共计14 条,占此类PD的38.89%)。(2)研究者原因——研究者工作疏漏致受试者访视缺失(共计1 条,占此类PD 的2.78%)。(3)其他原因——受外界不可抗力的影响,如受疫情影响,部分受试者因所处地区疫情管控封锁,不能按照窗口期时间来院随访(共计21 条,占此类PD 的58.33%)。
2.3 访视超窗
访视超窗是指受试者未按照试验方案要求的时间返院,是较为常见的PD。在笔者管理项目上报的258 条PD 中,涉及访视超窗的PD 共计29 条,占比为11.24%。导致此类PD的主要原因如下:(1)受试者原因——患者因自身原因不能按时来院随访(共计20 条,占此类PD的68.97%)。(2)其他原因——受疫情等外界不可抗力的影响,不能按照窗口期时间来院随访(共计9 条,占此类PD的31.03%)。
2.4 检查/检验超窗
检查/检验超窗是指受试者检查、检验结果超过试验方案规定的窗口期。在笔者管理项目上报的258 条PD中,涉及检查/检验超窗的PD 共计6 条,占比为2.33%。导致此类PD的主要原因如下:(1)受试者原因——因受试者访视超窗,导致规定的检查/检验不能按时完成(共计1 条,占此类PD的16.67%)。(2)研究者原因——①研究者对试验方案不熟悉,漏开了相应的检查/检验(共计4 条,占此类PD 的66.67%);②受试者虽然在入组前做过相关检查/检验,但超过了入组规定的期限,研究者出于对受试者安全性及伦理的考虑,决定直接采用已有的结果(共计1条,占此类PD的16.67%)。
2.5 试验药物使用及剂量
在笔者管理项目上报的258 条PD中,涉及试验药物使用及剂量的PD共计28 条,占比为10.85%。导致此类PD的主要原因如下:(1)受试者原因——未按试验方案规定的剂量使用药物,出现药物漏服、多服的情况(共计15 条,占此类PD 的53.57%)。(2)研究者原因——研究者对方案不熟悉(共计13 条,占此类PD的46.43%)。例如方案规定,患者出现某种不良事件(adverse event,AE)且严重程度分级为4 级时,需要停用药物,但研究者仍开具试验药物并给患者使用;又如方案规定,连续停用药物2 次以上的受试者应退出研究,但研究者在实际过程中未通知受试者出组;再如方案规定,试验过程中试验药物的剂量只能下调,但研究者在受试者AE改善后却将药物剂量调整为原始剂量。
2.6 药品超温/温度缺失
药品管理是临床试验的重要环节[5]。在笔者管理项目上报的258 条PD中,涉及药品超温/温度缺失的PD共计21 条,占比为8.14%。导致此类PD的原因主要如下:(1)研究者原因——药品管理员取药时打开冰箱的时间过长(共计17 条,占此类PD 的80.95%)。(2)其他原因——温度计损坏导致某时段温度缺失(共计4 条,占此类PD的19.05%)。
2.7 生物样本采集和处理
生物样本采集和处理为临床试验的关键环节,其采集和处理的规范性直接影响临床试验的主要、次要疗效指标结果的准确性,进而影响受试者的安全性。在笔者管理项目上报的258 条PD中,涉及生物样本采集和處理的PD共计13 条,占比为5.04%。此类PD主要包括样本离心时间过长、静置时间不符合要求、采集时间超窗、采集点漏采、超温等。导致此类PD 的原因主要如下:(1)研究者原因——①研究者安排受试者随访时没有考虑样本采集护士的排班情况,将多个受试者的随访时间安排为同一天的同一时段,导致生物样本采集超窗(共计8条,占此类PD 的61.54%);②授权的研究护士、临床研究协调员(clinical research coordinator,CRC)等对生物样本采集相关标准操作规程(standard operating procedure,SOP)及操作手册不熟悉,导致生物样本采集超窗、采集点漏采(共计4 条,占此类PD的30.77%)。(2)其他原因——样本采集后,贮藏过程中超温(共计1 条,占此类PD的7.69%)。
2.8 使用违禁药
使用违禁药是指受试者在组期间,使用试验方案中明确禁止的药物,属于重大PD。在笔者管理项目上报的258 条PD 中,涉及使用违禁药的PD 共计11 条,占比为4.26%。导致此类PD的原因主要如下:(1)受试者原因——受试者在其他科室或外院复诊,复诊医师按照诊疗常规开具相关药物(共计9 条,占此类PD的81.82%)。(2)研究者原因——研究者对试验方案不熟悉,对违禁药的范围不清楚,故开具了相关药物(共计2 条,占此类PD的18.18%)。
2.9 知情同意书签署
知情同意书签署应严格按照GCP及试验方案执行,新版本知情同意书经过伦理审查后,研究者应及时让在组受试者签署,筛选失败的受试者所签署的知情同意书也应保留在受试者文件夹中[6]。在笔者管理项目上报的258 条PD中,涉及知情同意书签署相关的PD共计7 条,占比为2.71%。导致此类PD出现的原因均与研究者有关:(1)研究者丢失了筛选失败的受试者所签署的知情同意书原件,仅留存了扫描件(共计6 条,占此类PD的85.71%)。(2)新版本知情同意书经过伦理审查后,研究者未及时与受试者签署(共计1 条,占此类PD 的14.29%)。
2.10 误纳
误纳是指受试者在不符合入组标准或者符合排除标准的条件下,被研究者错误地纳入某项研究的情况。此类PD 相对较少,但严重程度高,属于重大PD。在笔者管理项目上报的258 条PD 中,涉及误纳的PD 共计4条,占比为1.55%。导致此类PD 的原因主要与研究者相关:(1)研究者对试验方案不够熟悉,审核入组时不够仔细(共计3 条,占此类PD的75.00%)。(2)患者的外院病历在本院系统中无法查询,研究者在询问患者病史时不够仔细,导致入组后才发现受试者违背了纳入标准(共计1 条,占此类PD的25.00%)。
2.11 其他
在笔者管理项目上报的258 条PD中,还存在因形式多样无法归纳的情况:2 例受试者日记卡漏填,占比为0.78%;2 例受试者的生命体征收集超窗,占比为0.78%;2 例受试者在检验结果未出时就先获取了随机号,占比为0.78%;2 例受试者的生命体征漏采,占比为0.78%;1例受试者的日记卡丢失,占比为0.39%;1 例受试者的药物包装损毁,占比为0.39%。
3 责任方及改进措施
引起PD 的原因多样,如研究者原因、受试者原因、申办方原因、外界不可抗力因素等。PD 会降低临床试验质量,应引起各参与方的重视。减少临床试验中PD的发生,需要申办方、研究者、CRC、受试者及监管部门多方努力。笔者从各参与方角度提出改进措施,以避免或减少PD的发生。
3.1 申办方角度
申办方是指负责药物临床试验的发起、管理和提供临床试验经费的个人、组织或者机构[1]。在笔者管理项目上报的258 条PD中,虽不涉及方案不合理所致的PD,但行业内,尤其是肿瘤相关项目的此类PD并不少见[4]。申办方在制订方案时应与国家食品药品监督管理局药品审评中心、即将参与该项临床试验的各中心研究者充分讨论,充分了解该种疾病患者的基本情况。申办方应组织召开方案讨论会,听取不同区域的研究者、伦理委员会和机构办公室代表的意见,从而制定出科学、访视频率适当且可行的方案,避免因访视频率过高、过于频繁的检查导致患者访视超窗或者失访。此外,申办方不应盲目参考其他项目的方案,应针对特定项目、特定类型患者的特殊情况来设定纳入和排除标准。
3.2 研究者角度
研究者是指实施临床试验并对临床试验质量及受试者权益和安全负责的试验现场负责人[1]。在药物临床试验过程中,经授权的研究者完成受试者知情同意书签署、病历的书写和医学性判断等工作,研究者的临床试验相关水平对保障试验过程规范、结果科学可靠起关键作用[7-8]。笔者管理项目上报的PD(如违背纳入和排除标准、剂量调整、检查/检验漏开等)主要是由于研究者对试验方案、GCP、国家出台的临床试验相关文件不够熟悉导致的。故笔者建议,在项目启动前,项目组应加强对研究者的专项培训,着重强调纳入和排除标准、违禁药使用要求、试验药物剂量调整要求、访视周期该做的检查、GCP和相关法规等。在项目进行过程中,研究者应及时根据机构办质控、监察员监察、第三方稽查等反馈的PD 进行归纳总结。在容易出现PD 的环节应加强关注,展开科内学习培训,避免后续继续出现此类PD。此外,研究者应合理安排受试者的随访时间点,避免同一时段的受试者数量过多,造成研究护士时间无法协调,从而导致PD。
3.3 CRC角度
CRC是指药物临床试验的参与者和协调者,其在研究者的授权和指导下,进行非医学性判断的相关事务性工作[9-10]。CRC的专业程度及其对试验方案、相关法规的熟悉程度与药物临床试验的质量息息相关。笔者上报的部分PD(如生物样本采集超窗、生命体征漏采或超窗)与CRC未做好协助和提醒研究者的工作有关。故笔者建议,项目组应加强CRC对所负责项目的专项培训。如加强关于GCP 和相关法规的学习;加强关于CRC 生物样本采集的相关培训,合理安排受试者访视,避免漏采。此外,当CRC发现问题时,应及时通知研究者,并协助研究者按照既定的SOP进行处理。
3.4 受试者角度
受试者是指参加一项药物临床试验的试验用药品接受者,包括患者、健康受试者[1]。项目组应加强对受试者的教育和宣讲,避免因服药依从性不佳导致的PD 发生。笔者管理项目上报的部分PD(如访视超窗、受试者原因所致试验药漏服和多服等)均与受试者的依从性相关。对于受试者自身原因导致的不愿来院随访,原则上应遵循其自愿原则。对于疫情等特殊原因导致的受试者不能来院访视,研究者应及时与受试者沟通,安排受试者到就近的医疗机构进行相关检查/检验,并由申办方报销相应费用。受试者参加临床试验是自愿的,可以拒绝參加或有权在试验的任何阶段随时退出试验而不会遭到歧视或报复,其医疗待遇与权益不会受到影响[1,3,11]。研究者及申办方无权强制要求受试者必须遵循试验方案。在患者签署知情同意书时,研究者应充分告知受试者相关注意事项,并告知其按时来院随访的义务,从而最大限度地减少PD或降低PD的严重程度。
3.5 监管部门角度
3.5.1 机构办公室机构办公室负责机构的日常运作,负责承接药物临床试验,制定相关SOP,组织、指导相关专业科室临床试验项目的实施,对临床试验项目进行审查、监督和管理,是临床试验质量控制的主要监管部门[12-14]。在笔者管理项目上报的PD 中,有相当一部分为机构办公室在项目的在研质控、结题质控中发现并反馈给项目组的。机构办公室在临床试验启动前应认真审查,根据专业科室实际情况控制其承接项目的数量,审核主要研究者是否有相应资质及授权的研究者和相应人员是否满足项目需求。机构办公室在临床试验进行阶段根据项目开展情况进行质控,将在质控中发现的问题及时反馈给研究团队。当发现重大PD 时,应对研究者进行培训,督促监查员按监查计划对项目进行监查。临床试验锁库或结题阶段应做好锁库前或结题前质控工作,若有漏报的PD,机构办公室应及时反馈给研究团队。此外,机构办公室需对PD 高发的关键环节进行严格把关,从而保证临床试验质量,预防和减少PD的发生。
3.5.2 伦理委员会伦理委员会是独立审查部门,其通过独立地审查、同意、跟踪审查试验方案及相关文件,获得和记录受试者知情同意的方式和材料等,确保受试者的权益、安全受到保护[1,14]。伦理委员会应提高自身的审查能力和水平,制定完整的工作制度和审查的SOP,以便在立项环节及时发现试验方案设计的不合理。在试验进行过程中,伦理委员会应与机构办公室、研究者保持有效沟通和密切配合,以确保发生PD 时能够及时且有效地进行审查和干预。此外,伦理委员会可定期开展讲座和论坛,鼓励研究者、受试者、申办方等参与学习,以提高各参与方的临床试验相关知识和意识[14]。
4 结语
避免PD 和减少重大PD 的发生、规范药物临床试验,是保护受试者权益和安全,保证药物临床试验数据科学、可靠和真实的关键环节。避免和减少PD 的发生需要多方努力:申办方应听取多方意见后设计合理且访视频率和窗口期适宜的方案;研究者和CRC应加强自身学习和培训,熟悉方案、GCP和相应法规,加强受试者依从性教育;机构办公室和伦理委员会应在临床试验立项时、进行中、结题时进行多角度、全过程的监督和管理,保障受试者的安全权益和临床试验的质量。在此基础上,各参与方应做好有效沟通,发现PD及时上报,并针对发生的重大PD 和容易发生PD 的关键环节进行专项学习。

