无创产前检测在胎儿性染色体疾病筛查中应用的临床研究
黄晓莉,孙丽洲
1南京医科大学第一附属医院产科,江苏 南京 210029;2淮安市妇幼保健院医学遗传与产前筛查科,江苏 淮安 223002
性染色体疾病是指由X或Y染色体发生数目或结构异常导致的疾病,主要包括性染色体非整倍体(sex chromosome aneuploidy,SCA)和拷贝数变异(copy number variation,CNV),可导致胎儿性分化异常及生殖系统发育不全,不属于严重致死、致残的疾病,大部分患者表型正常,少数患者表现为发育落后、身材矮小、轻度智力低下、神经功能障碍和其他脏器功能障碍[1]。人类常见的性染色体疾病主要包括45,X、47,XXX、47,XXY 和47,XYY,产前发生率1/435左右,活产儿中的发病率约1/400~1/200,是唐氏综合征发病率的2倍[2-4]。由于胎儿性染色体疾病很难通过超声检查发现,常规孕期生化指标的血清学筛查也不适用于胎儿性染色体疾病的筛查,目前,羊水穿刺等介入性产前诊断方法是诊断胎儿性染色体疾病的有效手段。但是因为介入性产前诊断方法有导致感染、流产等并发症的风险,不少孕妇不愿意或者不敢接受羊水穿刺,使得患有性染色体疾病的胎儿很难被及时发现,导致漏诊或延迟诊断,患儿要到青春期之后通过染色体核型分析才能发现,有的甚至到生育年龄才在不孕不育门诊发现。通过产前筛查发现性染色体疾病高风险人群并及时进行产前诊断,可实现性染色体疾病早诊早治,避免严重性染色体畸变的患儿出生,减少出生缺陷;对于表型相对较轻的性染色体疾病患儿如特纳综合征(45,X)等通过早期激素治疗、物理治疗和个性化教育等,可以对其行为和神经发育产生积极影响,改善患儿生存质量[5]。无创产前检测(non-invasive prenatal testing,NIPT)技术是利用母体外周血液中少量的胎儿游离DNA,采用高通量测序的方法并进行生物信息软件分析处理,获得胎儿患有染色体畸变的风险概率,具有无创、安全、快速、准确性高等优点,作为一种新的产前检测技术,已广泛应用于临床,与血清学筛查、超声检查等共同构成产前筛查体系,推动了我国出生缺陷预防工作质量的大幅提升[6]。已有研究显示在NIPT 应用到胎儿性染色体疾病的筛查之后,大幅提高了胎儿性染色体疾病的产前检出效率,使性染色体异常胎儿的产前诊断比例上升3倍[7]。能够通过NIPT 筛查出的性染色体异常主要为45,X、47,XXX、47,XXY和47,XYY[8]。
1 对象和方法
1.1 对象
回顾分析2018年2月—2021年1月在淮安市妇幼保健院接受NIPT 检测的孕妇共19 327 例作为研究对象,要求均为单胎自然妊娠,孕妇1年内未接受过输血、移植手术或细胞治疗,夫妻双方均没有明确已知的染色体数目或结构异常。孕妇年龄18~47岁,平均(28.15±2.02)岁,孕周12~31+5周,平均(18.24±2.17)周。本研究经医院伦理委员会批准,所有参与本研究的孕妇均签署产前诊断知情同意书。
1.2 方法
1.2.1 NIPT检测
无菌条件下抽取孕妇外周血10 mL,送遗传实验室进行测序,所用仪器为北京博奥生物集团有限公司BioelectronSeq 4000新一代高通量测序仪,磁珠法DNA 提取试剂盒来自广东博奥木华基因科技有限公司。通过生物信息软件分析测序结果,获得样品染色体所占比例Z值信息,以|Z|=3 为风险截断值,|Z|<3为染色体非整倍体低风险,|Z|≥3为染色体非整倍体高风险。为NIPT 结果提示高风险的孕妇安排专业产前遗传咨询,提供侵入性产前诊断作为下一步确诊建议。
1.2.2 羊膜腔穿刺、染色体核型分析和CMA检测
通过超声确定胎盘胎儿位置,避开胎盘胎儿的位置,消毒铺巾后进针,抽取40 mL 羊水。其中一份20 mL 羊水样本按照操作标准步骤进行G 显带染色体核型分析,含羊水细胞培养、中期染色体核型制备及核型分析。另一份20 mL 羊水样本按照试剂盒的操作说明进行基因组DNA 提取,质检合格后再用Affymetrix 的CytoScan 750K 芯片胎儿染色体单核苷酸微阵列技术进行羊水染色体微阵列分析(chromosomal microarray analysis,CMA)。
1.2.3 随访
对所有接受NIPT 检测的孕妇进行电话随访。随访内容包括孕期后续检查情况、妊娠结局和新生儿出生情况(含外貌、结构、生殖系统、神经系统和运动情况等)。
1.3 统计学方法
应用SPSS24.0统计软件对所有数据进行分析,计数资料以例数和百分率表示,组间比较使用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 NIPT检出性染色体异常情况
19 327 例孕妇中,共检出性染色体异常高风险孕妇92 例,总检出率0.48%。按照NIPT 检测结果将所有孕妇分为45,X(含嵌合体)、47,XXX、47,XXY、47,XYY 和性染色体微缺失微重复共5 组进行分析。其中45,X(含嵌合体)组共检出50 例,检出率0.26%;47,XXX 组共检出11 例,检出率0.06%;47,XXY 共检出10 例,检出率0.05%;47,XYY 组共检出8 例,检出率0.04%;性染色体微缺失微重复组共检出13 例,检出率0.07%(表1)。
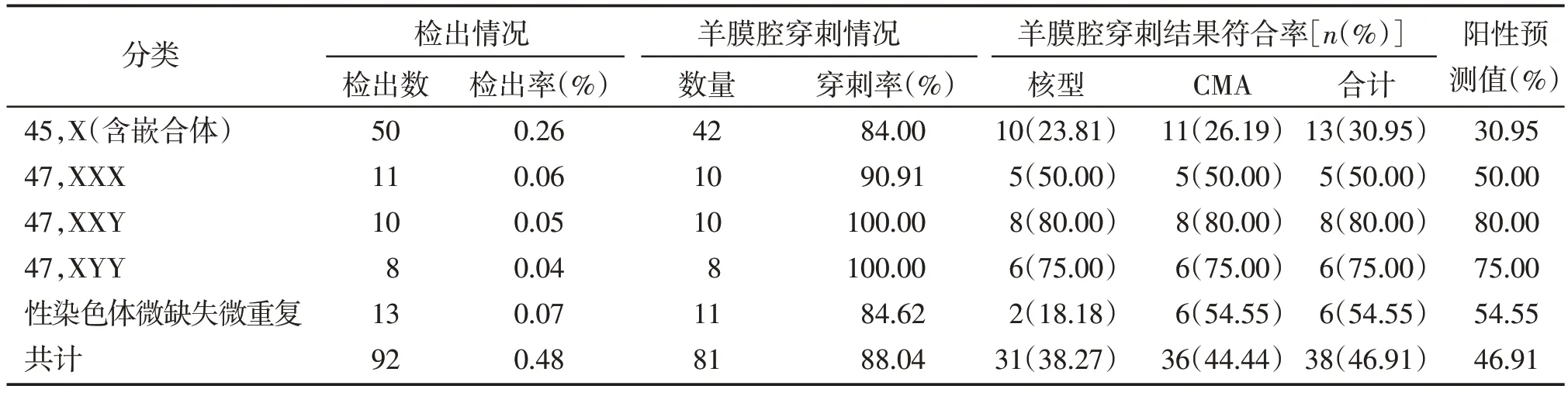
表1 NIPT性染色体异常检出情况及产前诊断结果
2.2 羊膜腔穿刺产前诊断结果
NIPT 提示性染色体异常高风险的92 例孕妇中,接受羊膜腔穿刺进一步产前诊断的孕妇共81 例,穿刺率为88.04%;与产前诊断结果相符并确诊性染色体异常病例共38 例,阳性预测值(positive predictive value,PPV)为46.91%,阴性预测值为100.00%,假阳性率为0.22%,灵敏度为100.00%,特异度为99.78%。其中45,X(含嵌合体)13 例、47,XXX 5 例、47,XXY 8 例、47,XYY 6 例、性染色体微缺失微重复6 例。NIPT 检测技术对于45,X(含嵌合体)、47,XXX、47,XXY、47,XYY、性染色体微缺失微重复不同分组孕妇的性染色体异常的PPV 分别为30.95%、50.00%、80.00%、75.00%、54.55%,按照PPV值从高到低排列依次是47,XXY组>47,XYY组>性染色体微缺失微重复组>47,XXX 组>45,X(含嵌合体)组。染色体核型分析和CMA 检测确诊性染色体异常的比例分别为38.27%和44.44%,两种检测方法在检出率方面差异最大的为性染色体微缺失微重复组,核型分析为18.18%,CMA 为54.55%;其次是在45,X(含嵌合体)组,核型分析为23.68%,CMA 为28.95%;在47,XXX、47,XXY、47,XYY 3 组中,两种产前诊断方法的检出率差异无统计学意义。
1 例NIPT 提示为45,X 与46,XY 嵌合的病例,染色体核型分析提示为45,X[22]/46,XY[78],CMA未提示异常,孕妇拒绝其他检测方法进一步确认(图1)。1例NIPT提示为45,X的病例,染色体核型分析和CMA 均未提示异常,羊水荧光原位杂交(fluorescencein situhybridization,FISH)检测的结果为nucish(DXZ1)×3[10]/(DXZ1)×2[90],即47,XXX 与46,XX 的嵌合体(图2)。1 例NIPT 提示为47,XYY的病例,核型分析结果为46,XY,CMA结果提示X染色体存在739.7 kb重复。1例NIPT提示为X 染色体存在57 Mb 重复的病例,核型分析结果为46,XY,CMA 结果提示3 号染色体存在3.7 Mb 重复。另有4 例NIPT 提示为45,X 的病例,核型分析未见异常,CMA提示分别为1、8、9、10号常染色体的微缺失微重复(表2)。
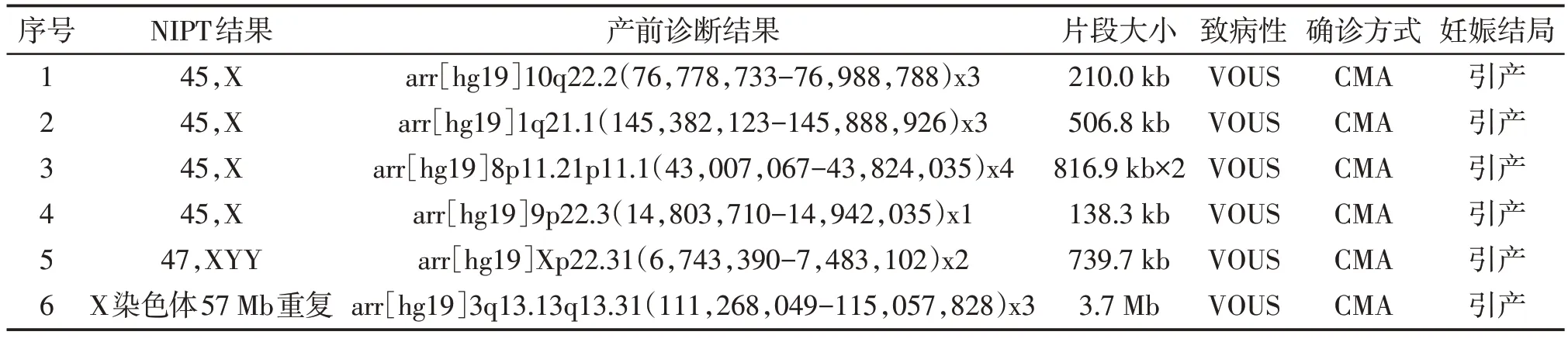
表2 NIPT和产前诊断结果均提示异常但不一致的病例情况
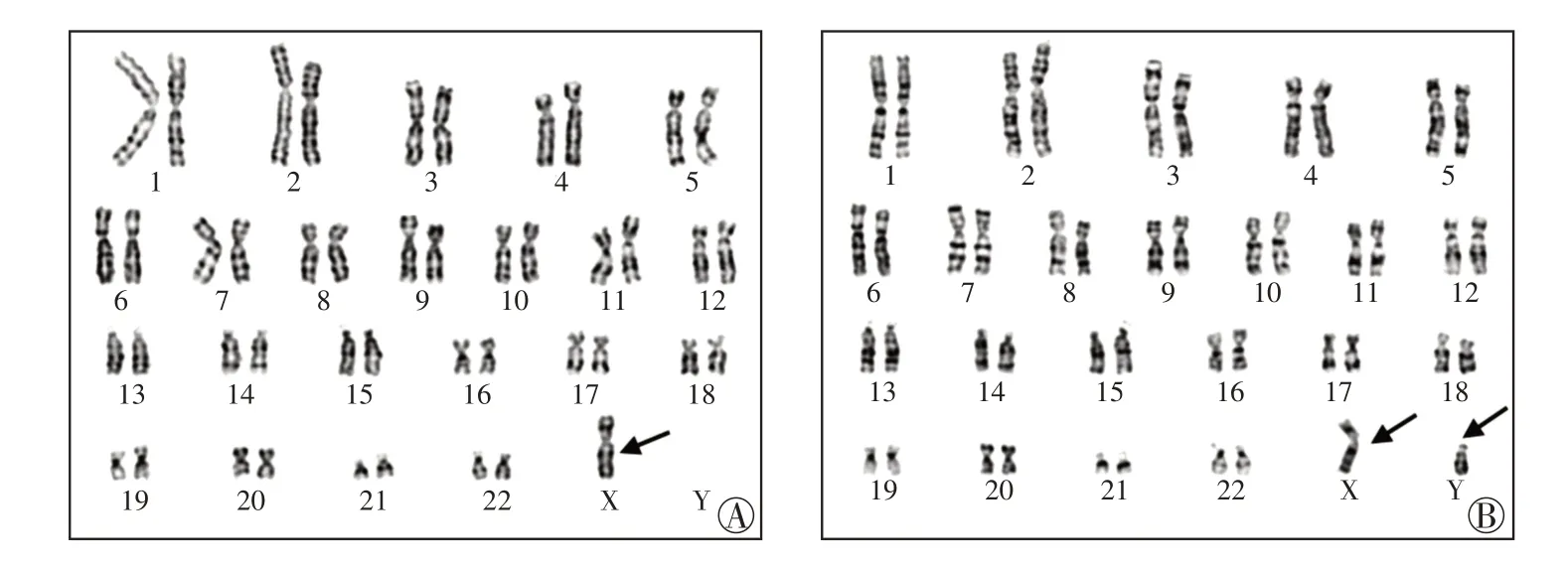
图1 病例1胎儿的羊水染色体核型45,X[22]/46,XY[78]

图2 病例2胎儿的羊水荧光原位杂交结果nucish(DXZ1)×3[10]/(DXZ1)×2[90]
NIPT 对于性染色体非整倍体(含嵌合体)和微缺失微重复的PPV分别为44.29%和54.55%,两组间的检出率差异无统计学意义(P>0.05);NIPT 对于染色体数目增多和染色体数目减少(含嵌合体)的PPV分别为67.86%和30.95%,两组间的检出率差异有统计学意义(P<0.05,表3)。
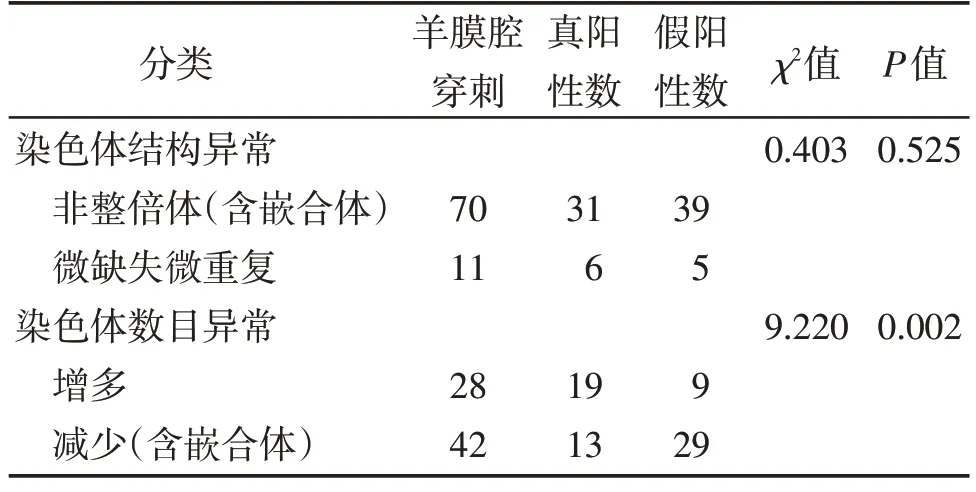
表3 不同分类的性染色体异常检出率比较
2.3 随访结果
NIPT 提示性染色体高风险并接受羊膜腔穿刺
(n)的81例孕妇全部完成电话随访,随访率100%,接受随访时新生儿为5~13 个月龄,NIPT 提示性染色体高风险但拒绝接受羊膜腔穿刺的孕妇以及NIPT 提示性染色体低风险的孕妇,随访效果不满意,部分孕妇因NIPT 结果异常直接引产。确诊为性染色体异常的孕妇均选择了终止妊娠。另有NIPT 提示为性染色体异常但检测结果为其他染色体异常的5例孕妇,也选择了终止妊娠。随访过程中未发现性染色体检测假阴性相关病例。
3 讨论
NIPT 技术应用到胎儿性染色体疾病的筛查之前,患有性染色体疾病的胎儿通常因为血清学筛查高风险或超声检查异常行产前诊断时被“意外”发现,部分表型正常的性染色体疾病患儿可能到青春期因为出现第二性征发育不良、原发性闭经、身材矮小等相关症状,但是这个时候可能已经错过性激素、生长激素等治疗的最佳时机。
3.1 NIPT应用于性染色体疾病筛查的PPV
PPV指的是经过筛查提示为阳性的人群中真实患病人数的比例[9],反映的是某项筛查方法的诊断效力,PPV的数值越高,表明此项筛查方法的准确度越高。以往对于NIPT 用于胎儿性染色体非整倍体筛查的报道较多,对于胎儿性染色体微缺失微重复筛查的报道相对较少,且不同类型研究所报道的胎儿SCA 的发生率有差异,PPV 波动范围较大[10-15]。郑芸芸等[10]发现NIPT 在45,X、47,XXY、47,XXX及47,XYY的PPV分别为44.44%、100.00%、58.33%及50.00%,其总体PPV 为54.55%。Zhang 等[11]发现可以通过大规模平行基因组测序的方法利用NIPT分析胎儿游离DNA(cffDNA)进行胎儿性染色体非整倍体产前筛查,筛查总阳性率为0.55%(57/10 275),总的PPV 为54.54%,其中45,X 的PPV 为29.41%;47,XXX 和47,XYY 的PPV 均为100%;47,XXY 的PPV 为77.8%。Petersen 等[12]经过对712 例样本的研究发现,NIPT 对于47,XXY、47,XXX 及45,X的PPV分别为87%、50%及26%。陆欣然[13]认为NIPT 对于4 种胎儿SCA 筛查的PPV 分别为45,X(12.50%)、47,XXX(51.72%)、47,XXY(66.67%)和47,XYY(83.33%)。Liang 等[14]报道NIPT 对胎儿SCA的总体PPV为55.34%,其中45,X、47,XYY、47,XXY 和47,XXX 的PPV 分别为26.09%、68.75%、85.00%和85.00%。马燕琼[15]研究NIPT在我国宁夏地区临床筛查胎儿SCA的情况,结果表明NIPT对于筛查胎儿SCA 的检出率为0.42%;PPV 为56.2%;对于45,X、47,XXX、47,XXY 及47,XYY 的PPV 分别为36.8%、80.0%、83.3%及100.0%。本研究中,经NIPT 提示性染色体异常高风险的孕妇共92 例,检出率为0.48%,高于马燕琼[15]的研究结果(0.42%),低于Zhang 等[11]的研究结果(0.55%)。本研究的总体PPV 为46.91%,低于以上研究结果。对于45,X(含嵌合体)的PPV 为30.95%,与Zhang 等[11]的结果一致;47,XXX的PPV为50.00%,与郑芸芸[10]、Petersen[12]和陆欣然[13]等的结果一致;47,XXY 的PPV为80.00%,与Zhang[11]和马燕琼[15]的结果一致;47,XYY 的PPV 为75.00%,与Zhang 等[11]的研究结果一致;性染色体微缺失微重复的PPV 为54.55%,需要更多的研究进行对照讨论。不同研究结果之间的差异,可能与实验所用实验设备、分析平台不同以及Z值、浓度值设定不同有关,而且各种研究样本量的多少和分组方式的细节差异也会对实验结果产生一定程度的影响。
3.2 NIPT对于不同性染色体疾病的PPV比较
马燕琼[15]研究发现NIPT 技术对性染色体数目偏少疾病的PPV 为36.8%,对性染色体数目偏多疾病的PPV 为84.6%。Zhang 等[11]的研究显示,NIPT对性染色体数目偏少疾病的PPV为29.41%,对性染色体数目偏多疾病的PPV 较高。Cheung 等[16]通过对307例孕妇进行研究后认为该技术对性染色体数目偏少疾病即45,X的PPV为38%,对47,XYY、47,XXY 和47,XXX 的PPV 为83%。陆欣然[13]研究发现NIPT 对性染色体单体的PPV 为12.50%,对性染色体三体的PPV 为63.75%(51/80),差异有统计学意义(P<0.05)。本研究中NIPT对于染色体数目增多和染色体数目减少(含嵌合体)的PPV 分别为67.86%和30.95%,差异有统计学意义(P<0.05),与以上研究结果一致。分析NIPT 对于SCA 数目增多较减少的PPV高,可能与以下几个因素有关[10,15,17]:①X和Y染色体上存在58个同源基因,其中29个位于性染色体的末端,而目前NIPT 只能测到36 个位点,存在X 和Y 染色体末端排序定位错误的可能;②胎盘组织中存在X 染色体非随机失活的现象,而且来自父亲的X 染色体在胎盘组织中失活倾向更高;③X 染色体上的GC 碱基含量低,导致X 染色体的扩增可变性增加;④女性白细胞中与年龄相关的X 染色体丢失,随着年龄的增加,女性染色体核型由XX 转变为X0/XX 嵌合,降低了NIPT 筛查胎儿45,X的准确性。
3.3 NIPT 对于性染色体微缺失微重复及嵌合体的筛查价值
2016年美国医学遗传学与基因组学学院提出[18],NIPT 可用于筛查胎儿SCA 和染色体微缺失微重复综合征。也有相关研究支持NIPT 技术除了适用于染色体数目异常,还可以用于染色体微缺失及微重复的检测[19-20]。Dugoff 等[21]也认为,无创产前检测可作为一种额外的辅助筛查方式对染色体微缺失微重复综合征进行筛查。李雅红等[22]在5例性染色体异常核型的研究中发现1例46,XX,del(Xq23-25)的性染色体微缺失患者,也能证明NIPT对于性染色体微缺失的检出有一定临床价值。本研究中,NIPT对于性染色体微缺失微重复的PPV为54.55%,高于SCA(含嵌合体)的PPV(44.29%),但差异无统计学意义(P>0.05),也反映出NIPT 对于性染色体微缺失微重复筛查的应用价值。
另外,NIPT对性染色体嵌合体异常也有筛查价值。NIPT 测序结束后会再对样本的游离DNA 片段进行逐一比对并拼补到染色体上相应的区域,实现对胎儿染色体数目和完整性的评估[11]。本研究中NIPT 提示嵌合体的病例分别经羊水染色体核型分析和FISH 检测确诊,证实了NIPT 对于嵌合体的筛查价值。
3.4 不同产前诊断方法对于NIPT检测结果的诊断价值
传统的G显带染色体核型分析可检出染色体非整倍体和大片段的染色体结构异常,在产前遗传学检查领域一直是首选的基础方法,但是核型分析分辨率低,只能检出染色体数量和大片段的结构异常。而染色体核型正常的病例中仍存在拷贝数变异的可能性,仅进行常规核型分析存在漏诊一些致病性CNV 的风险。CMA 技术为新型的分子遗传学检测技术,能够在全基因水平上进行扫描,分辨率高,通过CMA检测可以发现≥100 kb且缺失、重复和≥10 Mb的基因组纯合区域(regions of homozygosity,ROH),还可检出染色体不平衡的拷贝数变异或易感性位点变异,被推荐作为某些症状明确患者的一级诊断工具,对于传统的核型分析来说是有效的补充。常规核型分析检查未发现异常时,CMA 可额外再检出有临床意义的基因组变异,具有重要的产前诊断价值,有利于新生儿预后评估。近年来,有许多NIPT 检测染色体微缺失微重复综合征(microdeletion and microduplication syndrome,MMS)的报道[23-24],且在某些MMS的染色体拷贝数变异的检测结果方面表现良好。但是当NIPT 检测发现一些临床意义不明确的染色体MMS时,结果判读和临床处理有可能会面临较大的风险,所以国际产前诊断协会建议无创产前检测应局限于临床意义重大的疾病或明确定义的严重疾病[25]。本研究中,经染色体核型分析和CMA 检测确诊性染色体异常的比例分别为38.27%和44.44%,两种检测方法在检出率方面差别最大的是性染色体微缺失微重复组,核型分析为18.18%,CMA 为54.55%;在47,XXX、47,XXY、47,XYY 3 组中,两种产前诊断方法的检出率没有差别;其次是在45,X(含嵌合体)组,核型分析为23.81%,而CMA为26.19%。
然而,CMA在检测平衡重组的易位、倒位,单基因疾病、多基因疾病及染色体嵌合体方面,存在一定的局限性[26-27]。而且并不是所有的微缺失或者微重复变异都与疾病相关,有些CNV 是非致病性的,当然也有部分CNV 的临床意义是无法得知的[26]。对于临床意义不明的CNV胎儿,给予医学建议具有挑战性和风险,可能还需要增加更为精密精准的额外检测[27],孕期需要对病例进行更加密切的检测和随访。本研究中就发生了2 例CMA 在检测嵌合体时出现假阴性病例,1例NIPT提示为45,X与46,XY嵌合的病例,经染色体核型分析确诊,而CMA 未提示异常;另1 例NIPT 提示为45,X 的病例,经羊水FISH检测确诊为47,XXX 与46,XX的嵌合体,而染色体核型分析和CMA均未提示异常。
3.5 妊娠结局情况
美国医学遗传学与基因组学学院在2016 年声明,NIPT阳性结果不应该作为孕妇及家属放弃妊娠的标准,需要经过侵入性产前诊断进行证实[18]。在临床工作中,承担遗传咨询工作的医师应该尽可能客观详实地向孕妇及家属解释NIPT 对于筛查胎儿性染色体疾病的准确性和局限性,切不可盲目夸大NIPT的诊断价值,并且要为孕妇及家属提供胎儿性染色体异常预后相关的医学建议。NIPT 检测性染色体疾病发生假阳性和假阴性的原因主要有:①限制性胎盘嵌合,胎儿游离DNA主要来自滋养细胞的胎盘凋亡细胞,发生胎儿和胎盘的DNA不一致的概率约为1%~2%,而且性染色体异常的胎儿相对更容易因自救机制出现胎盘嵌合情况[23];②母体染色体异常干扰,母体循环中细胞cffDNA 含量少,当孕妇本人存在染色体异常、性染色体嵌合或者孕妇癌症等都会导致受检血浆非整倍体cffDNA含量改变,干扰分析结果;③NIPT 技术本身的局限性,X 染色体含有较多的GC 碱基,X和Y染色体高度同源且不易分辨,Y染色体存在与其他染色体有较多片段的相似;④胎儿染色体嵌合等都有可能导致测序偏移,发生假阳性或者假阴性[28]。熊诗诣等[29]对14例假阳性病例进行孕妇染色体核型分析和CMA 检测后,证实其中2 例孕妇自身就是低比例的性染色体嵌合(45,X/46,XX);另在确诊为性染色体非整倍体的病例中发现1例遗传自孕妇的胎儿性染色体微重复。SCA不属于严重的致死、致残性疾病,孕妇对于妊娠的选择主要决定于疾病类型,另外还会受医生遗传咨询方式、家庭经济水平、文化背景、受教育程度、孕妇对疾病的认识等多种因素的影响[29]。一项Meta 分析认为影响人群决定性染色体异常胎儿妊娠结局的因素有性染色体异常的类型、孕周、孕妇及家属年龄、提供咨询的医务人员类型、已育子女的数量及生育需求度[30]。本研究中经羊膜腔穿刺确诊为性染色体异常的孕妇均选择了终止妊娠,与本地区相对不发达的经济文化水平以及孕妇对于染色体疾病的认识不足有关;未发现假阴性病例与低风险孕妇电话随访效果不满意,部分孕妇后续产检转到其他医院,出现假阴性不能及时获得信息有关。
综上所述,NIPT可用于胎儿性染色体疾病的产前筛查,尤其是对于性染色体非整倍体、微缺失微重复的筛查,具有较高的准确度。通过NIPT初步筛查之后可以在减少非必要侵入性产前诊断操作的同时,及早有效识别性染色体疾病胎儿,有利于对性染色体疾病胎儿的生长发育进行严密观察,为父母提供足够的时间以做好接受性染色体疾病胎儿的心理准备及经济准备,也为早期医学干预和产后管理提供了机会,能大大改善性染色体疾病患者的生活质量。同时也要看到NIPT 检测会增加临床咨询的复杂性及终止妊娠率,当通过产前筛查或诊断发现性染色体异常胎儿时,使孕妇对于妊娠的选择处于两难境地,更对临床医生遗传咨询的水平提出了更高的要求。目前在NIPT 对于性染色体疾病的筛查效力以及NIPT 能否对性染色体异常进行常规报告方面,还存在争议。孕妇接受NIPT 检测前,临床医生应充分告知该项技术的优势及局限性,当NIPT检测提示胎儿性染色体高风险时,需要与孕妇做好沟通,安排进一步的侵入性操作,直接获取胎儿样本进行产前诊断;当NIPT检测未提示性染色体异常时,孕期及产后随访也非常重要,切不可盲目冲动地进行妊娠结局选择。
本研究通过对大样本NIPT 检测人群的研究,获得了较为可靠的胎儿性染色体疾病筛查数据,为临床遗传咨询及处理提供了重要的参考,为卫生部门制定产前筛查政策提供了医学依据。本研究的局限性在于,因为孕妇及家属配合度的原因,没有完成对所有接受NIPT 的病例尤其是低风险病例出生后的随访,也没有能够实现对所有NIPT筛查假阳性病例的胎盘检测,由于性染色体疾病表型的特殊性,还需要进一步增加研究样本量和随访时间。

