生物炭对岩溶区黄龙病脐橙园土壤N2O排放的影响
岳鹏鹏, 付 灿, 江晓雨, 王 蓉, 黄雅丹
1)桂林医学院智能医学与生物技术学院, 广西桂林 541199; 2)桂林医学院研究生院, 广西桂林 541199
温室气体排放增加导致全球气候变暖, 引发严重环境问题(Field et al., 2014)。氧化亚氮(N2O)是引起升温效应的主要温室气体之一, 其在大气中存在寿命较长, 等摩尔浓度增温潜势强(Thomson et al.,2012; Fuertes-Mendizábal et al., 2019), 已引起越来越多的关注和减排研究(Shakoor et al., 2021; Shan et al., 2021)。
土壤是大气N2O的主要排放源, 尤其是温暖区农业土壤(Liu et al., 2016)。中国柑橘的种植面积居世界第一, 其种植过程中存在氮肥输入量大、土壤酸化普遍(张影, 2014)和土壤 N2O排放量较大的特点。广西是我国最重要的柑橘种植区之一, 也是全国岩溶面积分布最广的地区之一。由碳酸盐岩发育而来的岩溶土壤具有富钙、粘重等特点, 进而其柑橘园土壤氮转化相对于其他农业土壤具有一定的特殊性(杨会等, 2020)。黄龙病是柑橘生产中最具毁灭性的病害(Das et al., 2021), 患病植株可进一步影响根系土壤微生物群落结构, 进而扰动土壤N2O排放,增加温室气体排放风险。
N2O主要产生于土壤微生物介导的硝化和反硝化过程(Huang et al., 2014; Conthe et al., 2018), 是土壤氮循环的中间产物。土壤中硝化和反硝化微生物的活动直接影响N2O通量的源汇效应。生物炭是生物质在缺氧或无氧条件下热解转化而成的固体产物(Harter et al., 2014), 输入土壤可同时实现降低土壤酸度、促进植物生长(Sheikhi et al., 2020)、增加碳封存等有益影响, 是目前在有效性和可持续性方面最受关注的土壤改良和减排措施。尽管已有研究证明生物炭输入可降低土壤N2O的排放, 这主要归因于生物炭对反硝化微生物的调节作用(Zhang et al., 2021)。但也有研究显示生物炭可通过增加氨氧化细菌(AOB)等硝化相关微生物的丰度和加速总硝化率最终削弱其N2O减排效果甚至产生负效应(Sun et al., 2021)。不同土地利用类型和不同土壤健康状况下生物炭添加对土壤 N2O排放的影响程度及其微生物调节途径存在一定差异。生物炭作为土壤改良剂常用于黄龙病柑橘园土壤的改良, 但其对岩溶区黄龙病柑橘园土壤 N2O排放的影响及微生物调节途径, 目前尚不清楚。
鉴于此, 本文拟以广西岩溶区黄龙病脐橙园土壤为研究对象, 通过土壤培育等方法, 量化生物炭对该土壤N2O排放、氮素净硝化率和矿化率、硝化和反硝化功能基因丰度的影响, 分析其相互关系并明确影响N2O排放主要因子。研究结果可为岩溶区黄龙病柑橘园土壤 N2O减排及调节机制研究提供借鉴。
1 材料与方法
1.1 土壤采集与生物炭制备
供试土壤采集于广西壮族自治区贺州市富川县6年树龄典型黄龙病纽荷尔脐橙园。富川县位于广西东北部, 属亚热带季风气候, 年均气温 19℃,年均降雨量1700 mm, 无霜期318 d, 是脐橙优势产区。春季 3月份采集样品, 在黄龙病脐橙树株滴水线四个方向分别采集0-20 cm土壤并混匀。去除树根和石头后过2 mm土壤筛, 用于土壤培育和理化参数测定。其中, pH值测定采用电位法(土水比例为1:2.5)测定; 土壤 NH4+-N、-N通过连续流动分析仪(SEAL AA3, 德国)测定(委托广西大学农学院测定); 土壤有机碳、总氮分别通过重铬酸钾氧化容量法和凯氏定氮法(FOSS KJELTEC 8420, 丹麦)测定(委托广西大学农学院测定)。田间持水量通过环刀法测定。
生物炭购自河南弘之源净水材料有限公司, 以玉米芯为原料在450°C无氧条件下热解6 h制得。过 100目筛, 按照与土壤样品相同的方法分析了生物炭的理化参数, 包括硝态氮、铵态氮、有机碳和总氮(表1)。

表1 土壤和生物炭的理化参数Table 1 Physical and chemical parameters of soil and biochar
1.2 土壤培育试验
实验室土壤培育设 5个生物添加处理, 其生物炭添加量分别为: 0(CK), 1%(B1), 2%(B2), 5%(B3),10%(B4)。各处理 3次重复、4次破坏性取样, 共5×3×4=60个培养瓶(250 mL血清瓶)。称取相当于25 g干土的土壤/土壤-生物炭混合物置于培养瓶中,根据土壤含水量和田间持水量(water capacity holding, WHC, 水/烘干土×100% =25.70%), 用去离子水调整培养土含水量为80%WHC。每瓶用带6针孔封口膜封口静置, 于 27℃生化培养箱中黑暗培养28 d, 培养过程中每2天称重法补充水分。
在0 d, 1 d, 2 d, 4 d, 7 d, 14 d, 21 d和28 d通过培养瓶顶部 N2O的浓度变化来测定 N2O排放量。每次取样前去掉培养瓶封口膜通风 1 h, 用丁基胶塞密封后立即用带三通阀的注射器抽气15 mL取得第一个气体样品, 4 h后采集第二个气体样品。使用气相色谱仪(Agilent7890B, 美国)测定样品中 N2O的浓度。N2O 排放速率计算公式为:E=P×V×(Δc/Δt)×(1/RT)×M×(1/m), 其中E表示 N2O排放速率(ug·kg-1·h-1),P表示标准大气压(pa),V表示培养瓶顶部空间的体积(V=培养瓶体积V瓶-培养土体积V土, cm3),c表示N2O的浓度(×10-6),t是两次采样之间的时间(h), R表示通用气体常数, T表示绝对空气温度(K),M是的N2O的分子量(g·mol-1),m是土壤质量(干重)(kg)(Hu et al., 2017; Deng et al.,2019)。两次测定间隔内 N2O排放量为两次平均排放速率与时间(h)的乘积, N2O累积排放量为不同时间段气体排放量的总和(ug·kg-1)(崔静雅等, 2017)。
在0 d, 7 d, 14 d, 28 d破坏性取土样置于-80℃保存, 用于测定土壤铵态氮、硝态氮, 硝化、反硝化功能基因拷贝数。氮素净硝化和氮矿化率用下列公式计算(Li et al., 2017): NNR=(Nf-N0)/T, NMR=(Nf+Af-N0-A0)/T, 其中, NNR, NMR分别为土壤培育时间内土壤氮素的净硝化率和净矿化率(mg·kg-1·d-1),Nf和N0分别代表培养结束和初始时含量(mg·kg-1),Af和A0分别代表培养结束和初始时含量(mg·kg-1),T表示培养的天数(d)。土壤DNA通过DNeasy®Power Soil®土壤DNA提取试剂盒(QIAGEN, 美国)提取。功能基因(包括AOA-amoA, AOB-amoA,nirK,nosZ)拷贝数通过实时荧光定量PCR测得(BIO-RAD CFX96, 美国)。各功能基因扩增引物情况如表2, 最后通过每克干土中所含功能基因的拷贝数表示功能基因丰度。
1.3 统计分析
土壤 N2O排放和土壤理化参数通过 Microsoft Office Excel 2007软件统计分析。差异显著性性分析通过SPSS21.0软件LSD方差分析进行。土壤N2O排放速率(三个重复)与各土壤因子(包括含量和各功能基因丰度)的关系通过除趋势对应分析(Detrended Correspondence Analysis, DCA)进行研究(PCORD 5.0)。
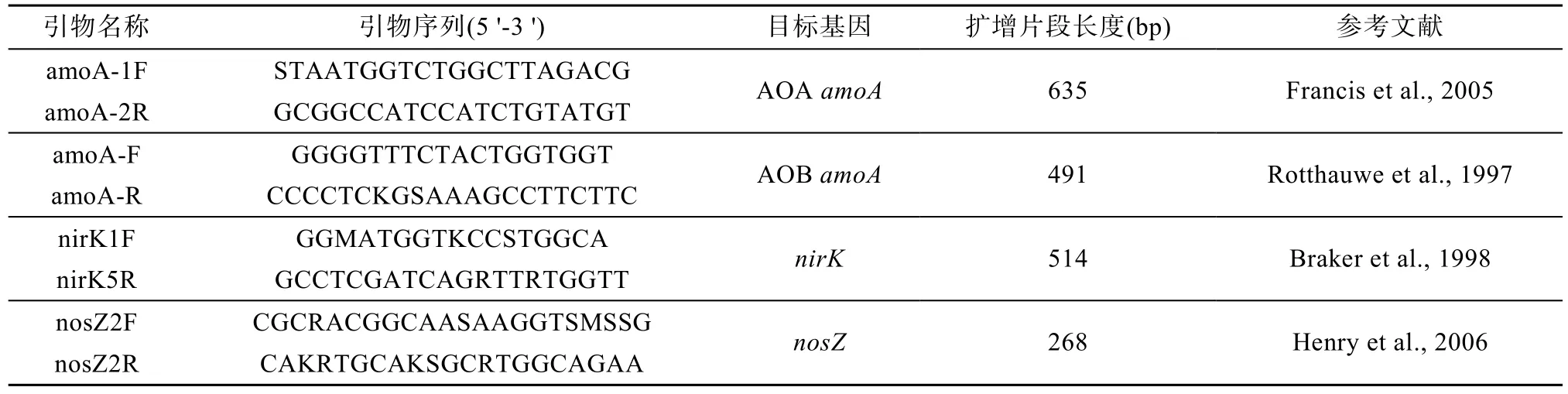
表2 功能基因qPCR扩增引物Table 2 Primers used for qPCR amplification of functional genes
2 结果与分析
2.1 生物炭对土壤 N2O排放速率和累积排放量的影响
添加生物炭可降低土壤 N2O平均排放速率和累积排放量(图1), 但各处理间无显著差异。平均降低幅度和添加生物炭的量有关, 当生物炭添加量为5%时, N2O平均排放速率和累积排放量降幅最大分别达到14.39%和37.04%。

图1 生物炭对土壤N2O排放速率(A)和累积排放量(B)的影响(CK、B1、B2、B3、B4分别代表不同的生物炭添加处理; 图中不同字母代表差异显著(P<0.05))Fig. 1 The effects of adding biochar on soil N2O emission rates (A) and cumulative emissions (B) (CK, B1, B2, B3, and B4 represent different biochar addition treatments; different letters represent significant differences (P<0.05))
2.2 生物炭对土壤氮素净硝化率和矿化率的影响
生物炭添加对土壤氮素平均净硝化率和矿化率均产生了影响(图2)。随着生物炭添加量的增加,土壤氮素净硝化率先增加后降低, 在生物炭添加量为2%(B2)时提高了196.64%, 但在生物炭添加量≧5%(B3、B4)时, 硝化率反而降低。另一方面, 添加生物炭后土壤氮素矿化率显著提高, 由 CK的负值变为正值, 且在生物炭添加量为 5%时矿化率提高达到峰值, 不同处理间存在极显著差异。

图2 生物炭对土壤净氮硝化率和矿化率的影响(CK、B1、B2、B3、B4分别代表不同的生物炭添加处理, 图中不同小写字母代表差异显著(P<0.05), 不同大写字母代表差异极显著(P<0.01))Fig. 2 The effects of adding biochar on soil net nitrogen nitrification rates and mineralization rates (CK, B1, B2, B3,and B4 represent different biochar addition treatments,different lowercase letters represent significant differences(P<0.05), and different capital letters represent extremely significant differences (P<0.01))
2.3 生物炭对功能基因拷贝数的影响
实时荧光定量 PCR结果显示(图3), 岩溶区黄龙病脐橙园酸性土壤硝化(AOA-amoA和AOB-amoA)和反硝化相关功能基因(nosZ和nirK)丰度均随生物炭添加量增加先增加后降低, 在添加量为 2%时(B2)达到峰值。其中, 氨氧化古菌AOA-amoA基因的拷贝数(3.72×1011±0.69×1011)显著高于氨氧化细菌 AOB-amoA基因(3.38×109±0.98×109) (P<0.01), 且后期降幅相对较小, 在B2、B3、B4中均维持较高拷贝数(三个处理间无显著差异)。反硝化最后一步限速功能基因nosZ拷贝数((4.28±0.82)×1011g-1干燥土壤)显著高于另一反硝化相关基因nirK((5.55±1.14)×1010g-1干燥土壤)(P<0.01)。nosZ拷贝数在B1、B2中显著高于CK,nirK拷贝数B4中低于CK且在各处理间无显著差异。

图3 生物炭对功能基因AOA-amoA(A), AOB-amoA(B), nosZ(C), nirK(D)拷贝数的影响(CK、B1、B2、B3、B4分别代表不同的生物炭添加处理; 图中不同字母代表差异显著(P<0.05))Fig. 3 Effects of biochar on the copy numbers of functional genes, including AOA-amoA(A), AOB-amoA(B), nosZ(C), and nirK(D)(CK, B1, B2, B3, and B4 represent different biochar addition treatments; different letters represent significant differences (P<0.05))
2.4 生物炭添加不同处理土壤 N2O排放速率与土壤因子排序
不同处理的 N2O平均排放速率和土壤因子变量的DCA排序结果较直观的展示了N2O排放和各因子的关系(图4)。其中,、nirK拷贝数以及nosZ拷贝数与N2O排放速率负相关, AOA-amoA拷贝数、与土壤N2O排放速率正相关。CK与B1排放速率相似, 生物炭添加量增加后, B2、B3和B4的N2O排放速率特征在排序第一轴和第二轴均显示了一定差异, 在第一轴主要受的影响, 在排序第二轴主要受nosZ拷贝数的影响。然而, AOA-amoB拷贝数在排序第一轴和第二轴均未表现出明显的排列规律。

图4 生物炭添加不同处理土壤N2O排放速率与土壤因子DCA排序图(CK、B1、B2、B3、B4分别代表不同的生物炭添加处理, NH4+-N、-N分别代表土壤中NH4+-N、-N的质量分数, AOA-amoA, nirK, nosZ代表分别代表AOA-amoA, nirK, nosZ基因拷贝数)Fig. 4 DCA ordination diagram of soil N2O emission rates and soil factors with different treatments of biochar addition (CK, B1, B2, B3, and B4 represent different biochar addition treatments, NH4+-N、-N represent the mass fractions of NH4+-N and -N in the soil, and AOA-amoA, nirK, and nosZ represent the number of copies of AOA-amoA, nirK, and nosZ genes, respectively)
3 讨论
本研究中, 生物炭添加改变了土壤氮素净硝化率/矿化率、反硝化相关功能基因nosZ和硝化相关功能基因 AOA-amoA、AOB-amoA的丰度, 且添加量为 2%时是多数指标增长的峰值, 与对照差异显著, 提示 2%生物炭添加量是其调节土壤氮转化的活跃点。
AOA和AOB驱动的氨氧化作用是硝化作用的限速步骤, 在土壤 N2O产生中起重要作用(Caranto et al., 2016)。本研究发现生物炭添加增加了AOA-amoA和AOB-amoA基因拷贝数, 这与有些研究中生物炭添加会增加硝化功能基因丰度、加速总硝化率最终削弱其N2O减排效果(Sun et al., 2021)的结果基本一致。值得注意的是随着生物炭添加量的增加, AOB-amoA拷贝数先增加后降低, 与土壤氮素净硝化率变化一致。而AOA-amoA拷贝数无显著降低, 对N2O排放速率影响更显著, 显示出本研究条件下AOA对生物炭添加的敏感性。
本研究中, 添加生物炭降低了岩溶区脐橙园土壤N2O平均排放速率和累积排放量, 但各处理间无显著差异, 可能与生物炭对反硝化和硝化相关功能基因的双向刺激有关。AOA-amoA和nosZ、nirK基因丰度反向作用于土N2O排放速率, 最终形成本文中添加生物炭后 N2O排放速率和累计排放量的差异状态。今后若要进一步提高生物炭对岩溶区黄龙病柑橘园土壤N2O减排的效应, 可以考虑通过添加硝化抑制剂等手段降低生物炭对硝化菌或硝化途径的刺激作用。
4 结论
(1)生物炭添加显著改变了土壤氮素净硝化率/矿化率, 反硝化相关功能基因nosZ和硝化相关功能基因 AOA-amoA、AOB-amoA的丰度, 且生物炭添加量为2%时是多数指标增长的峰值。
(2)添加生物炭降低了岩溶区脐橙园土壤 N2O的平均排放速率和累积排放量, 但各处理间差异不显著。这与生物炭添加对硝化相关功能基因AOA-amoA(增加N2O排放)的激发作用有关。
(3)生物炭添加不同处理 N2O的排放速率主要受含量、nirK丰度、nosZ丰度的负向影响,含量和AOA-amoA丰度的正向影响。若要进一步提升生物炭对该土壤的减排效果, 应注意提升土壤水平和反硝化相关功能基因丰度, 抑制土壤水平和硝化相关功能基因 AOA-amoA的丰度。
致谢:本文样品采集工作得到桂林医学院李剑桥同志的大力支持和帮助, 特此致谢!
Acknowledgements:
This study was supported by the Guangxi Youth Science Foundation Project (No. 2018JJB150056), and the Guangxi Science and Technology Base and Talent Special Project (No. 2020AC20045).

