生物催化惰性碳氢键的氘代反应研究进展
楼玉姣,徐鉴,吴起
(1 浙江大学化学系,浙江 杭州 310027; 2 浙江工业大学生物工程学院,浙江 杭州 310014)
随着2017 年第1 个氘代药物丁苯那嗪通过美国FDA 批准上市,并于2020 年5 月在中国批准上市,氘代药物便逐渐进入人们的视野,并不断为众多国家和医疗机构所认可[1]。丁苯那嗪是一种非典型抗精神病药物,临床上主要用于治疗运动障碍、精神病和中枢神经系统障碍相关的疾病,但该药物存在患者依存性低、半衰期短等缺陷。而经过氘化处理,将其苯环上的两个甲氧基的氢原子置换成氘原子,可以显著降低其代谢速度,延长半衰期,从而减少给药量,同时还能够抑制因药物引起的血液浓度下降而产生的戒断反应[2-3]。因此,氘代技术被认为是一种可应用于改进临床试验或已上市的不理想药物的重要手段。截至2020 年,全球已有10 余个氘代药物进入临床试验阶段,数百个氘代药物相关专利申请已获得包括美国、中国在内的国家知识产权局的授权。
由于氘代化合物的优越特性,氘代分子也被广泛应用在科学研究领域。氘标记的化合物可以作为带有稳定同位素标记的目标分子,成为液相色谱-质谱(LC-MS)分析的内标[5]。例如,氘代氨基酸已被用作核磁共振(NMR)、氢氘交换质谱(HDXMS)、X 射线晶体学和拉曼散射显微镜的蛋白质标签。此外,由于上述多种原因,氘代化合物在保持原药效力的同时,在人体内有更长的代谢周期和更少的毒性代谢物生成,所以可以应用于临床试验跟踪,为评估药物毒性提供极大帮助。另外,由于磁性和质量的不同,氘代分子与原分子被核磁共振或质谱检测分析为两个不同的实体,成为了研究和证实化学反应机理和动力学的重要工具。
由于氘代分子在化学、医药和生物科学中的重要性,制定不同的方案在有机分子中插入氘越来越受到大家的重视。到目前为止,已经报道过多种能够实现在分子中插入氘原子的反应方法,包括酸碱直接促进的氢氘交换[6-9]、金属催化[10-16],以及逐渐兴起的电化学催化[17-20]和光催化方法[21-26]。化学催化剂的发展极大提高了氘代的区域选择性[27-29]。但是在对映体选择性合成方面还有待提高[30-31],而且化学催化剂通常需要较为严苛的反应条件。例如在醛氘代反应中经常需要使用到具有复杂配体结构的铱催化剂和氘气,而且芳香环氘标记和醛羰基的氘标记是竞争性反应,很容易得到混合物[32-33]。因此近年来,探索更为高效、绿色、高选择性的氘代策略是一个具有重要科学意义和和应用价值的课题。
生物酶催化因其具有反应高效、条件温和、过程绿色等优点,在合成领域逐渐受到重视。酶具有近乎完美的立体选择性,生物催化在不对称合成领域的兴起极大拓展了不对称合成的途径[34-39]。近年来,酶催化多功能性的研究获得了突破性的进展,越来越多的酶催化非天然反应被发现[38-48],而在生物催化有机分子中引入氘元素的合成方法研究中也取得较多进展,研究人员利用天然来源或人工改造的酶,以重水作为氘源成功在一些有机分子的惰性碳氢键上引入氘原子。目前,通过生物催化的氘代合成方法主要分为氢氘交换、还原氘代、脱羧氘代三大类。本文将从以上3个方面对酶催化氘代领域的最新进展进行综述。
1 氢氘交换
直接通过催化剂活化,并用氘元素取代有机小分子中的非活泼氢原子是氘代反应中最有价值的策略,具有极高的原子经济性[49]。在化学催化领域,已有众多酸碱催化[50-52]、金属催化[53-55]的不活泼C-H 发生氢氘交换反应的研究,然而这一方法在生物催化领域依然处于起步阶段。
色氨酸酶(tryptophanase,TPase)是一类以磷酸吡哆醛(pyridoxal phosphate,PLP)为辅酶的生物酶[56],该酶的天然反应是催化微生物体内色氨酸的厌氧分解,生成吲哚、丙酮酸和氨气[57-59]。之前的研究表明,该酶可以催化吲哚与S-甲基-L-半胱氨酸的缩合反应生成色氨酸[60],于是Boroda等[61]在重水或氚水的体系中实现了α位的同位素标记(图1)。另外,Kawata课题组[62]发现这种酶会导致L-酪氨酸的α位置碳上的氢不稳定,可以与重水或者氚水发生H/D(T)交换生成标记产物。后续串联酪氨酸酶(tyrosinase)还可以发生进一步的羟基化(图2)[63-64]。
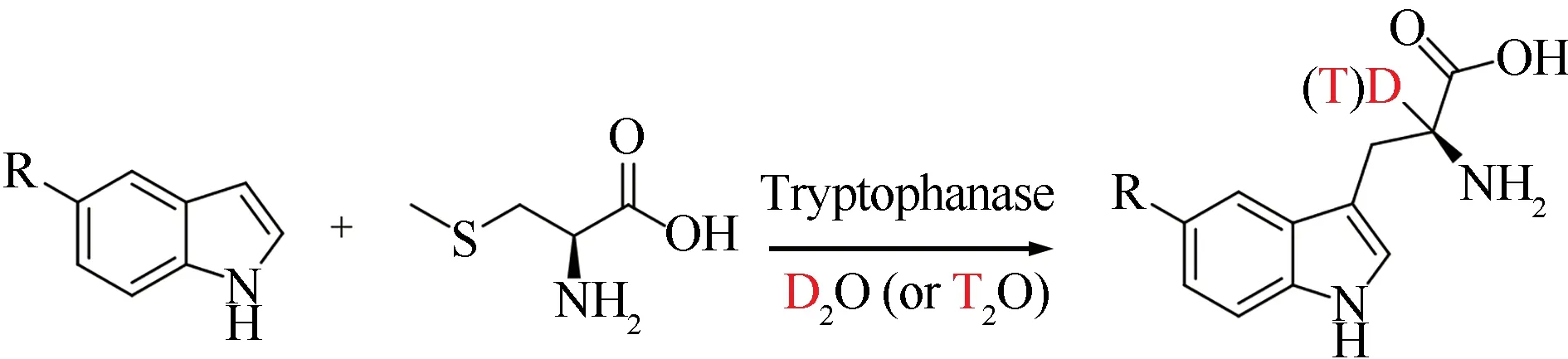
图1 吲哚与S-甲基-L-半胱氨酸合成L-TrpFig.1 Synthesis of L-Trp with indole and(S)-methyl-L-cysteine

图2 酪氨酸α位的氢氘交换Fig.2 Hydrogen deuterium exchange at the α-carbon position of tyrosine
2017 年,Rabinowitz 课题组[65]报道了一个黄素酶引发的NADPH 与黄素的氢氘交换反应(图3)。当NADPH 与D2O 共存时,氧化还原性H位置并未发生氢氘交换现象,但是当向体系中加入一种常见的黄素酶——谷胱甘肽还原酶后,NADPH 约在1 min 内被氘代。因此可以推断,NADPH 的氧化还原活性氢并不会发生自发的H-D交换,而是在黄素酶催化下发生的[66-68]。研究者尝试了其他NADPH 依赖的黄素酶[69-72],它们同样催化了NADPH 的H-D 交换反应。他们将8 种不同的人类细胞放置在含有D2O的介质中,并在细胞中寻找到了被氘标记的NADPH,证明了这一现象的普遍性。最后,通过氘代的NADPH 参与的细胞内循环成功将氘元素引入了脂肪酸中。

图3 黄素酶引发的NADPH氢氘交换反应Fig.3 Hydrogen deuterium exchange catalyzed by FAD-dependent enzyme
2020年,Narayan课题组[73]利用PLP依赖型的α-氧胺合成酶(SxtAAONS),采用D2O作为氘源制备一系列的α-D-氨基酸和酯(图4),氘代产物具有良好的区域选择性和立体选择性。传统的化学方法可以从保护的甘氨酸衍生物或者没有标记的氨基酸起始来合成α-氘代氨基酸,前者需要氨基保护和去保护等多个步骤,而后者则需要含有手性配体的贵金属铑或当量镍催化剂[图4(a)][74-76]。相对而言,α-氧胺合成酶催化合成α-氘代氨基酸的方法则具有多方面的优势:①精准的立体选择性;②不需要保护基团;③更加绿色、温和的反应条件。α-氧胺合成酶活性中心的磷酸吡哆醛(PLP)可以通过形成外部醛亚胺中间体可逆地催化α-氨基酸的去质子化。相应形成的醌式中间体可以在产物从活性位点释放前被重水或者氘代的赖氨酸所氘代,从而实现α-氘代氨基酸的生成[图4(b)]。最后,作者证明了这种操作简单的反应在制备规模上的价值,以200 mg L-Ala-OMe 为起点,通过3 个步骤,以60%的产率,大于99%的氘掺入率和96%的ee获得氘化L-Ala-OMe,以96%的最终氘代率合成了药物Safinamide——一种用于治疗帕金森病的药物。
随着我国社会的不断发展,国内城市交通压力日益变大,车辆停放问题变得越来越困难,如果停车不合理就会影响交通的正常运行,也给人们的日常生产、生活带来较大的负面影响。因此,我们必须正确的处理停车问题,这对于减少交通事故、缓解交通拥堵、提高通行能力都有积极的影响。将物联网技术融入智慧停车系统中可以有效地解决停车问题,在该系统中可以充分地发挥物联网的各项功能,尽可能地给用户提供更多的便利服务。
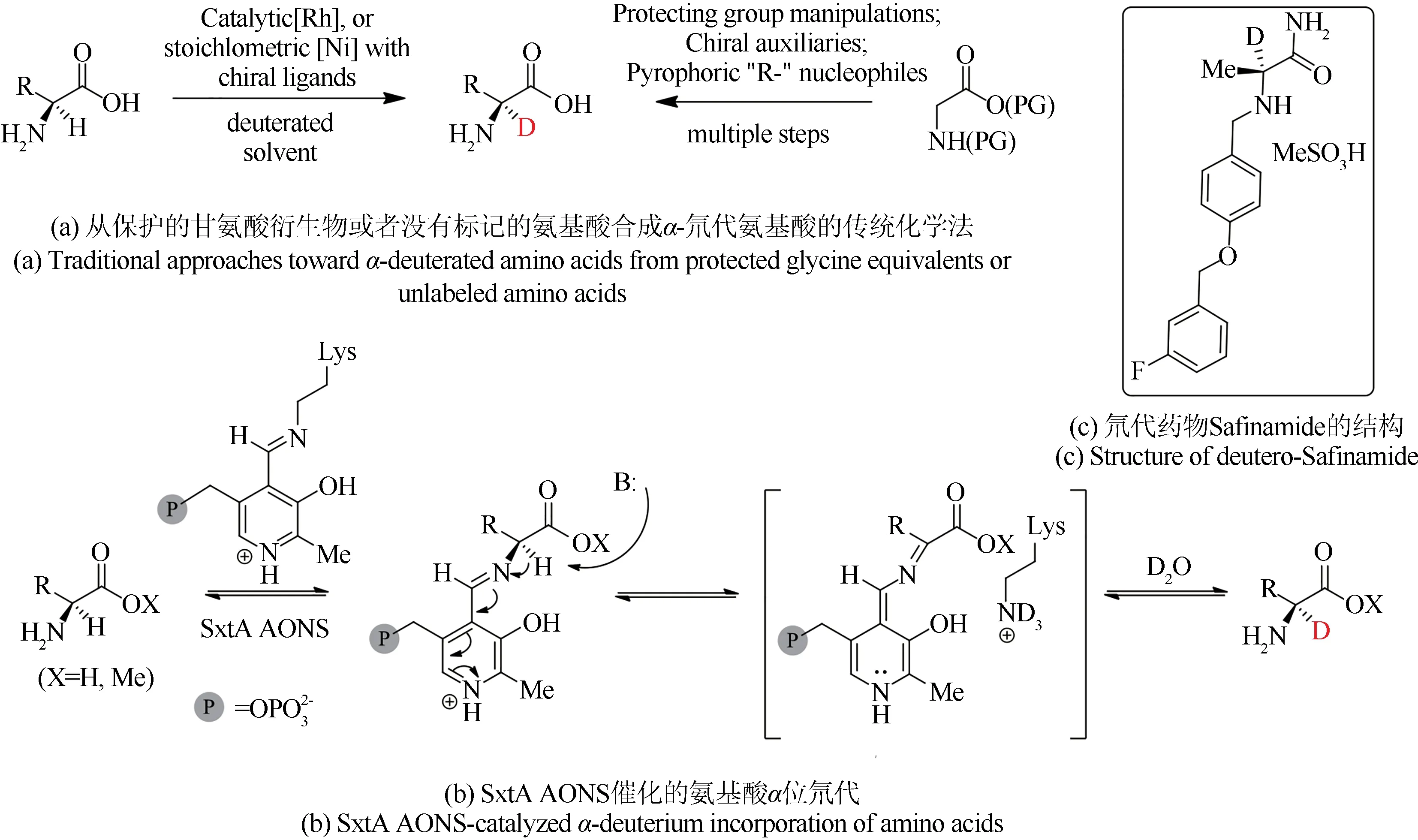
图4 氨基酸及其甲酯的α位氘代反应Fig.4 Deuterium incorporation at the α-carbon of amino acids and their methyl esters
最近,我们报道了焦磷酸硫胺素(ThDP)依赖性酶催化的氢氘交换反应合成氘代醛的工作[77]。ThDP 辅因子包含N-杂环卡宾(NHC)核心,它能够通过生成Breslow 中间体来激活醛的C-H 键,通过该中间体,ThDP 依赖性酶能够催化广泛的C-C 键形成和裂解反应。我们认为从机制上讲形成的Breslow 中间体可以在D2O 存在下进行氢同位素交换(HIE),将醛转化为其氘代类似物。然而,在相同条件下,C-C 键形成反应(例如:安息香缩合反应)在动力学上也是有利的,与醛的氘代相比,在大多数ThDP 依赖性酶的特异性结合口袋中更容易发生安息香缩合等天然反应。因此,如何实现醛通过Breslow 中间体的氘代反应同时阻断C-C 键形成,是一项挑战,我们通过对ThDP 依赖性酶的催化空腔进行理性设计,让不同大小的催化空腔能适应不同醛底物的大小,避免两个醛底物同时进入催化空腔生成竞争性的安息香缩合反应产物,从而构建了一个具有较广泛适用性的生物催化醛的氢氘代反应合成氘代醛的方法(图5)。
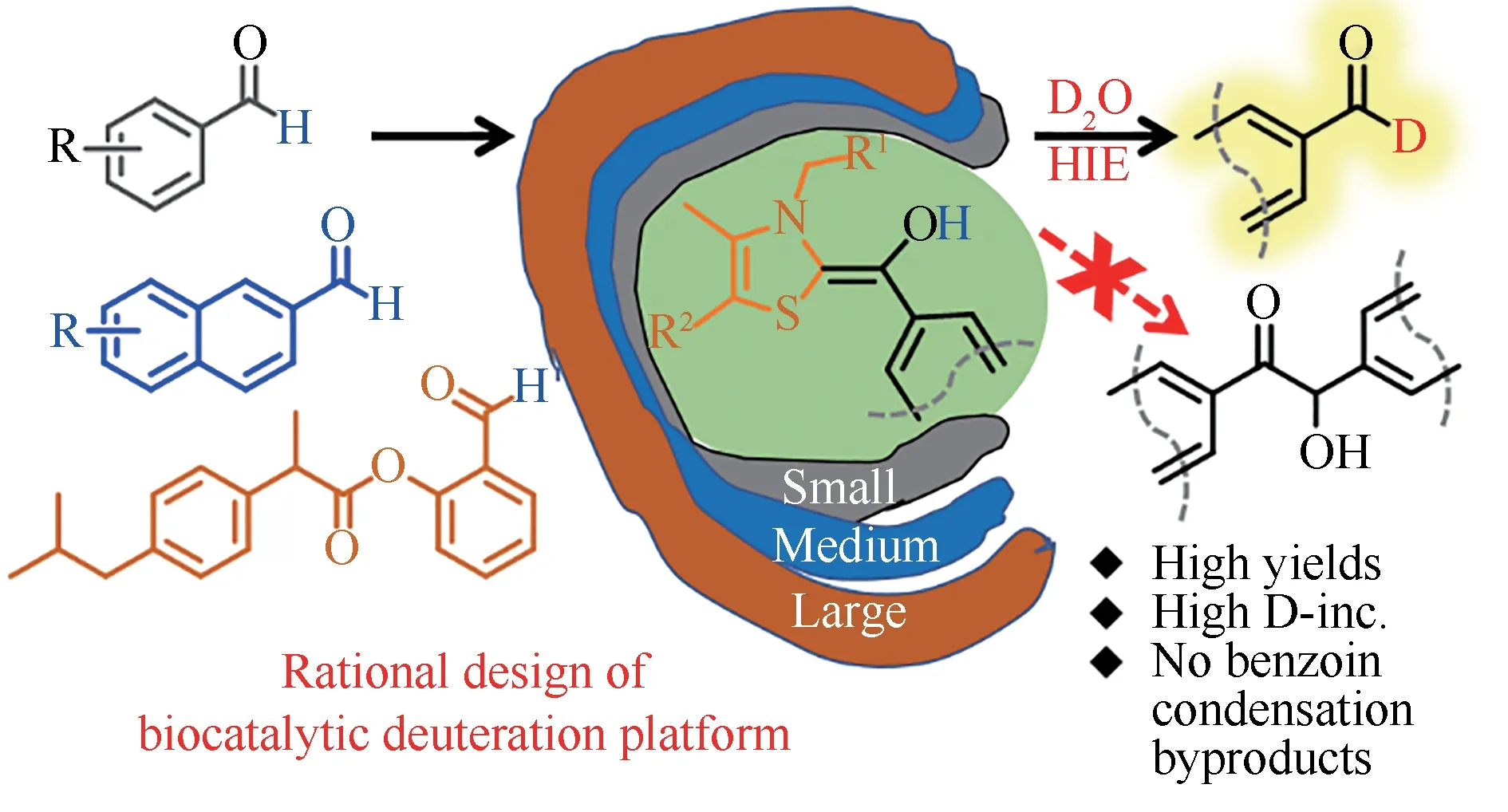
图5 ThDP依赖酶催化的氘代醛合成Fig.5 ThDP-dependent enzyme-catalyzed synthesis of deuterated aldehydes
2 还原氘代
还原酶是一种从供体分子上转移氢到催化底物上从而发生加氢反应的酶。结合所用还原酶的催化机理,通过还原步骤将氘引入特定的位点是一种巧妙的生物氘代方法。2002 年,MacDonald等[78]提出了一种使用来自Lactobacillus leichmannii的三磷酸核苷酸还原酶(ribonucleotide triphosphate reductase,RTPR)将13C/15N 标记的三磷酸核糖核苷酸(dNTPs)的2′位置羟基还原氘代的方法。当还原过程在D2O 中进行时,2′位置引入氘原子而不是通常的氢原子。后续通过串联使用脱氧尿苷5′-三磷酸核苷水解酶(dUTPase)和胸苷酸合成酶(thymidylate synthase)合成了带有13C/15N 标记的[2′-D]dATP、dGTP 和dCTP[图6(a)],产率达到95%。采用标准的酶法将dTMP 转换为dTTP[图6(b)][79],总产率达到80%。使用该方法制备的氘代核苷酸已被用于分段标记腺病毒晚期启动子的20-BPDNA螺旋。

图6 氘代三磷酸核糖核苷酸(dNTPs)的合成路线Fig.6 Synthesis of deuterated dNTPs
许多氧化还原酶都依赖于烟酰胺辅因子循环。应用氘代的还原态NAD(P)H 能够有效地将氘元素插入不饱和键中,一步构建手性氘代化合物。2006 年,Edegger 等[80]利用生物催化方法,以d8-2-丙醇为氘源,由酮一步制备了严格S-选择性的氘代仲醇,该课题组发现了1 种来自赤红球菌DSM 44541的高有机溶剂耐受性醇脱氢酶ADH,与常用的醇脱氢酶相比,ADH 对多种酮均有较高的产率和接近99%产物立体选择性。他们选择d8-2-丙醇为氘供体,利用d8-异丙醇与d6-丙酮的氧化还原循环了NADD 与NAD(图7),对一系列芳香酮和烷基酮完成了300 mg 规模的催化反应,分离产率达到70%~89%,ee均在99%以上。

图7 利用氘代NADH合成手性氘代仲醇Fig.7 Synthesis of deuterated alcohols with deuterated NADH
然而,由于还原性NADH 中的氢原子不是活泼氢,因此将氘引入NADH 并进行下一步的还原反应通常需要价格昂贵的氘代醇(氘代乙醇、丙醇、葡萄糖)作为氘源[81-82],严重影响反应的经济性。如何通过简单的策略将廉价氘源D2O中的氘元素引入NAD(P)成为研究者们重点关注的问题。2019 年,来自牛津大学的Vincent 教授课题组[83]采用了氢化酶驱动的NAD+还原策略,将氢化酶氧化过程中产生的电子通过碳载体传递至NAD+还原酶,并结合氘水将氘成功引入NADH,并串联其他NADP 依赖型的还原酶进一步构建多种手性氘代分子(图8)。值得一提的是,Vincent 教授课题组[84]通过该策略成功构建了氘代的R-3-喹核醇中间体,并将其应用于药物Solifenacin fumarate 的制备,证明了该系统在药物合成上的重要意义。

图8 利用NAD+还原酶合成氘代NADH应用于氘代仲醇的合成Fig.8 Synthesis of deuterated NADH with NAD+reductase for the subsequent production of deuterated secondary alcohols
该课题组[85]在后续工作中应用电化学策略进一步研究了这种通过氢化酶从氘水将氘引入NADH 的方法。他们通过对石墨电极的修饰构建了3 种系统用以制备氘代NADH:生物催化系统(NiFe 氢化酶和NAD+还原酶)、电生物催化系统(Pt/C 和NAD+还原酶)以及完全电化学催化系统(Pt/C),并评估了它们在驱动还原氘化反应时的化学选择性和立体选择性。结果表明,电生物催化系统的区域选择性和立体选择性与生物系统完全相同。此外,电生物催化系统与电化学催化相比具有明显优势,它只产生S构型的氘代NADH,并且无副产物产生[86-88];与单纯的生物催化系统相比,它显示出更高的催化活性。作者使用了两种对NADH 选择性相反的醇脱氢酶进行级联反应,结果发现(R)-ADH 从烟酰胺环的4S位置获取氘生成R-氘代醇(图9),但是(S)-ADH 只能从烟酰胺环的4R位置获取氢生成未氘代的S构型醇。作者进一步增加第二次辅因子循环系统,产生了双氘代的还原辅助因子NADH(图9),从而实现了S-氘代醇的合成。

图9 多酶催化合成手性构型互补的氘代仲醇Fig.9 Multi-enzymatic synthesis of deuterated secondary alcohols with complementary configurations.
流动化学因其具有操作性简便、反应可控、重现性好等优点而被广泛用于有机合成领域(图10)[89-90],近年来也越来越多地被用于生物催化中。Vincent课题组[91]将游离的氢化酶和NADH依赖型还原酶固定在碳纳米管柱上,由H2驱动,D2O为氘源,结合醇脱氢酶和亚胺还原酶,成功将氘元素引入一系列手性醇和胺中。然而,随着反应的进行,氢化酶活性逐渐丧失,反应的效率逐渐降低,后期对氢化酶稳定性的改造将进一步提升该方法的应用价值。
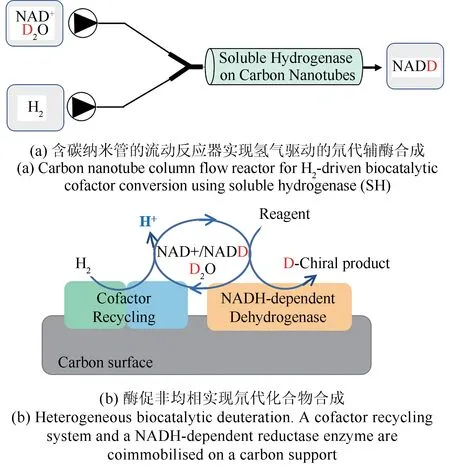
图10 碳表面固定化酶的流动反应器实现氢气驱动的氘代化合物合成Fig.10 Heterogeneous biocatalytic deuteration driven by H2 in a flow reactor containing carbon support-immobilized enzymes.
Al-Shameri 等[92]同样采用流动化学手段开发了一种体外酶级联合成反应器。在该研究中,作者将NADH依赖性的亚胺还原酶(imine reductase,IRED)PuO 的E203G 突变体与耐氧的NAD 还原氢化酶(SH)耦合,由H2驱动从二胺中产生多种哌啶衍生物,产率达到99%。当以D2O 作为氘源时,产生的氘代NADH 可以作为体系中各种NADH 依赖性还原酶的辅因子来产生氘化化合物,产物具有高达99%的氘标记率(图11)。

图11 流动化学制备氘代哌啶衍生物Fig.11 Preparation of deuteropiperidine derivatives through the flow chemistry process
3 脱羧氘代
羧酸具有结构稳定、廉价易得等优点,且在其参与的脱羧反应中,位点明确,副产物仅有无毒的二氧化碳气体。因此,长期以来都被研究者们作为构建其他功能型化合物的理想原料。脱羧氘代是将氘元素特异性引入有机小分子的一个重要策略。化学脱羧氘代反应常常需要使用钯、银等贵金属催化剂(图12)[93-94],而在一些使用廉价的铜催化剂催化的脱羧氘代反应中则需要特别高的温度和昂贵的配体[95]。近年来,一些温和的光催化脱羧氘代反应实现从游离羧酸制备氘代产物也不断被报道[96]。虽然化学催化脱羧氘代反应已经有很好的发展,但是生物催化的脱羧氘代反应仍然比较少。据我们所知,目前主要有氨基酸脱羧酶和光敏脂肪酸脱羧酶催化的两类脱羧氘代反应被报道。
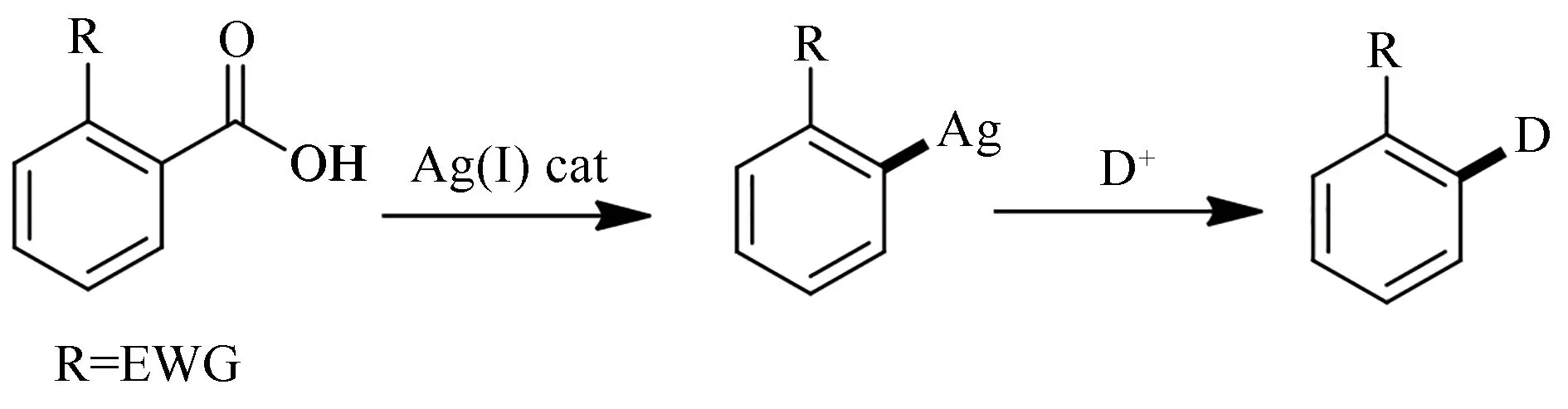
图12 银催化的苯甲酸衍生物脱羧氘代反应Fig.12 Ag(I)-catalysed deutero-decarboxylations of benzoic acids.
早 在1960 年,Belleau 等[97]就 曾 经 报 道 过L-氨基酸的酶促脱羧氘代反应,并且确认了脱羧氘代反应过程中α-C的立体结构是保持不变的。很多氨基酸脱羧酶都是磷酸吡哆醛(PLP)依赖的,它们催化脱羧反应的过程如图13 所示。以酪氨酸脱羧酶(tyrosine decarboxylase)为例,首先PLP 与酪氨酸脱羧酶的赖氨酸残基形成内部的醛亚胺,当酪氨酸进入底物结合口袋后,PLP即与酪氨酸结合形成外部的醛亚胺,然后脱羧形成醌型中间体,不稳定的醌型中间体会进一步转变为酪胺与PLP结合的醛亚胺状态,期间夺取一个氘代质子(D+)从而实现氘代,最后将产物氘代酪胺释放出来,PLP 重新生成与赖氨酸残基结合的内部醛亚胺形式[98]。波兰华沙大学的Kańska 教授对氨基酸脱羧酶催化的脱羧氘代反应进行较系统的研究。2007年Kańska课题组[63]报道了生物法合成氘代酪氨酸、酪胺的路线。首先利用色氨酸酶将氘原子引入羧基的α位置,接着酪氨酸脱羧酶催化标记的L-酪氨酸脱羧生成酪胺[图14(a)]。在脱羧过程中所有产物,均保留了S构型。

图13 酪氨酸脱羧酶催化脱羧氘代反应机理Fig.13 Mechanism of tyrosine decarboxylase-catalyzed decarboxylation deuteration
多巴胺(DA)参与了去甲肾上腺素和肾上腺素等儿茶酚胺神经递素的酶合成途径,其衍生物是治疗阿尔茨海默病、帕金森病、精神分裂症等健康问题的基本药物[99-102]。为了研究脱羧机制以及多巴胺的后续衍生机制,2009年Kańska等[64]通过控制反应体系的同位素来源分别合成了氘代、氚代、氚氘二取代的同位素标记L-酪氨酸、L-多巴和DA。将L-酪氨酸溶解在全氘化的K2DPO4缓冲液中,加入色氨酸酶进行羧基α位置氘交换,将获得的[2-D]-L-酪氨酸在酪氨酸酶催化下羟基化,生成[2-D]-L-多巴,在酪氨酸脱羧酶催化下即可获得[(1S)-D]-DA。因为脱羧反应可以保持原α-C 的立体结构[图14(b)][103-104],所以如果将L-多巴在氘水环境中用酪氨酸脱羧酶催化脱羧即可获得[(1R)-D]-DA[图14(c)]。
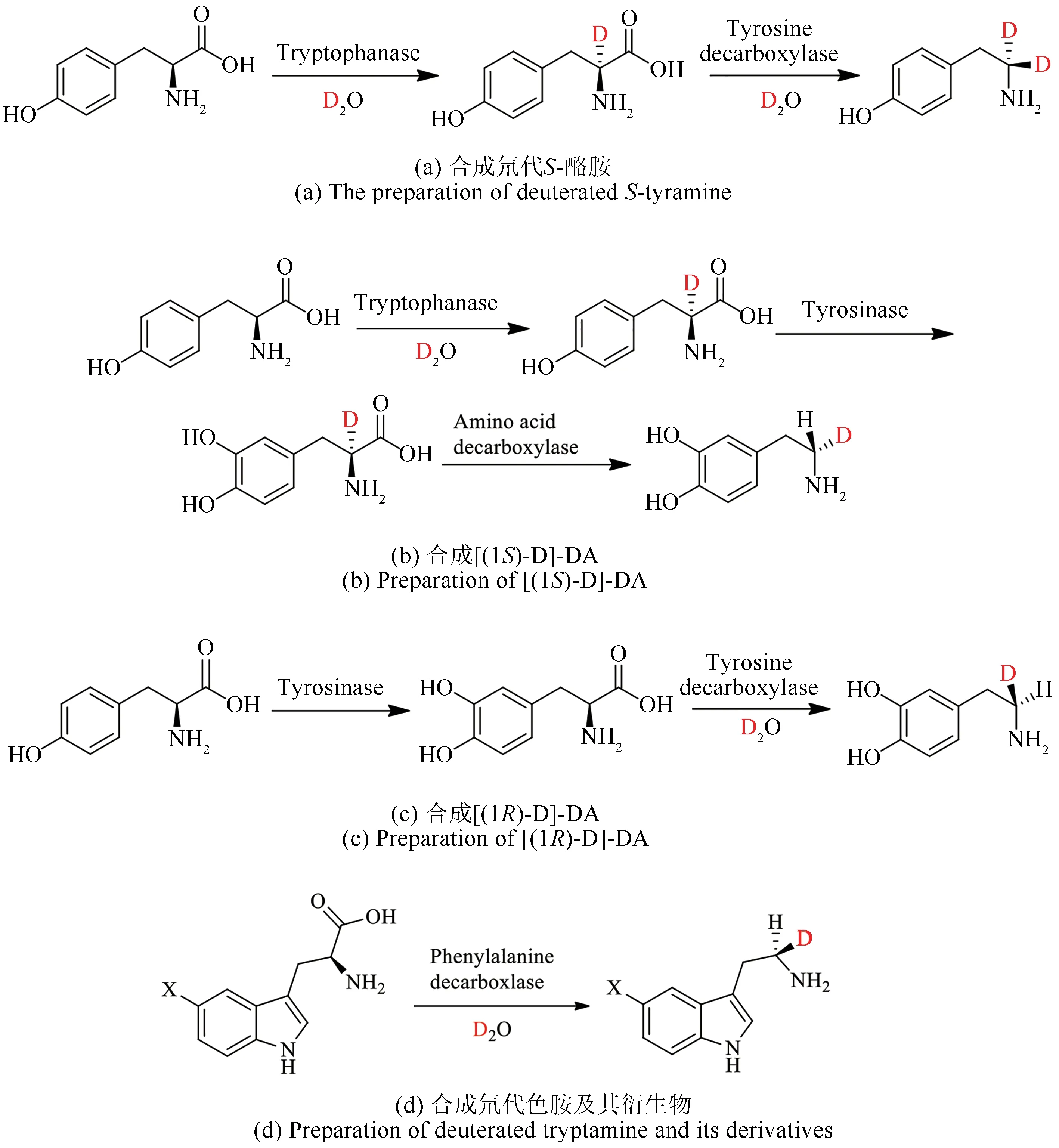
图14 氨基酸脱羧酶催化脱羧氘代反应合成氘代酪胺、多巴和色胺衍生物Fig.14 Amino acid decarboxylase-catalyzed synthesis of deuterated tyramine,DOPA,and tryptamine derivatives
色胺是哺乳动物大脑中一种内源性神经递质,在生物体内是被L-苯丙氨酸脱羧酶催化,由L-色氨酸脱羧生成的,通过生物加工还可以合成血清素、褪黑素等生物活性物质。这些活性物质中的氢很容易被卤素取代,而生物活性不发生改变,所以被卤素取代且被氘代或氚代的色胺及其衍生物被运用在许多具有重要生物意义的途径中,比如用于生产核医学放射性药物和正电子发射断层扫描。Kańska课题组[105]应用L-苯丙氨酸脱羧酶催
2021年本课题组[107]报道了一种使用光脱羧酶CvFAP 催化的脱羧氘代方法。通过利用从小球藻NC64A 中获得的光脱羧酶CvFAP,以廉价的重水作为氘源,实现了多种羧酸的脱羧氘化(图15)。CvFAP含有的黄素腺嘌呤二核苷酸(FAD)辅因子能吸收蓝光形成激发态FAD*,从而催化长链脂肪酸脱羧形成自由基,精氨酸残基含有的活泼氢被氘代从而可以提供一个氘质子,同时激发态FAD*发生单电子转移,使得该自由基生成烷烃产物并释放出来,进而生成相应的氘代烷烃或者烯烃[108-109]。但是该酶的底物谱比较窄,对长链脂肪化合成9 个色胺及其卤素衍生物的脱羧氘代方法,并且产物保留了α-碳的立体构型[图14(d)]。类似的方法还被应用于组胺的脱羧氘代反应过程中[106]。
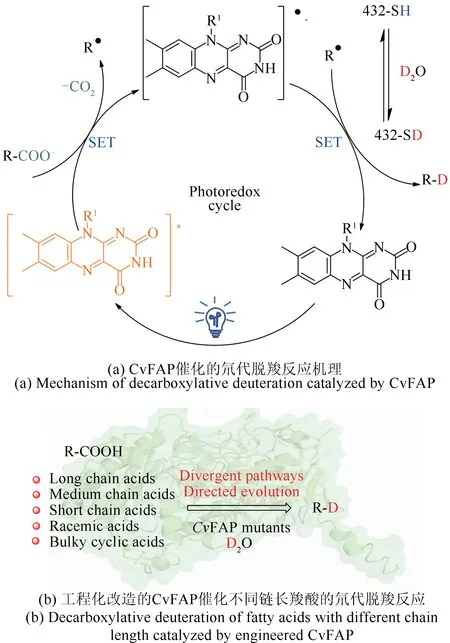
图15 光敏脂肪酸脱羧酶CvFAP催化的氘代脱羧反应Fig.15 Decarboxylative deuteration catalyzed by CvFAP
酸的活性最好,而对中短链或者芳香族羧酸的活性比较低。我们利用聚焦理性迭代定点突变(focused rational iterative site-specific mutagenesis,FRISM)的策略对WT-CvFAP实施了蛋白质工程化改造,将酶催化的底物范围从长链脂肪酸扩展到中链羧酸、短链羧酸和芳香酸。与野生型相比,得到的I398L 突变体可以将催化壬酸的反应活性提高10倍,G462A突变体可以将丙酸的产率从3%提高到78%,Y466A 突变体将3-苯基丁酸的产率从3%提高到81%,并实现了立体选择性互补的脱羧氘代反应。进一步用分子动力学模拟解释了WT-CvFAP 和突变体催化活性和立体选择性的结果。最后,将建立的方法用于4种天然产物的脱羧氘代反应中,都达到了约90%的氘代结果。
4 其他氘代方法
双键的加成也是引入同位素标记的重要方式之一。苯丙氨酸氨裂解酶(phenylalanine ammonia lyase,PAL)可以催化1-苯丙氨酸消除氨基生成E-肉桂酸,在添加铵离子的体系中也可以催化其加胺的可逆反应[110-115]。如果使用含有重水或氚水的缓冲液,即可获得S构型的同位素标记苯丙氨酸(图16)[116]。后续串联苯丙氨酸脱氢酶PheDH(phenylalanine dehydrogenase)可以得到被标记的苯丙酮酸[117]。

图16 制备氘代S-苯丙氨酸和苯丙酮酸Fig.16 Preparation of deuterated(S)-phenylalanine and phenylpyruvic acid
由于PAL 催化时的立体专一性,通过上述步骤只能获得S构型的苯丙氨酸,为了获得R构型产物,Jemielity 等[116]结合化学法和酶法解决了这个问题。首先用化学方法制备了带有同位素标记的E-肉桂酸,最后一步结合PAL 制备了R构型产物(图17)。

图17 制备氘代R-苯丙氨酸Fig.17 Preparation of deuterated(R)-phenylalanine
5 总结与展望
化学法制备氘代化合物的方法相对丰富,现在唯一上市的氘代药物丁苯那嗪就是采取了化学方法引入氘原子。而生物法制备氘代化合物的研究才刚刚起步,仍不成熟。综上所述,目前已报道的生物氘代方法主要分为酶催化的氢氘交换、还原氘代与脱羧氘代。氢氘交换方法大多在羰基的α位置引入同位素标记,适用于氘代氨基酸的制备。还原氘代多使用NADH 依赖的还原酶,通过提供氘代醇或者重水作为氘源,利用辅酶循环将氘原子引入NADH 中,经过还原步骤将氘转移到产物分子中,这个方法可以很好地保留所用酶的立体选择性,生成手性氘代分子,满足了氘代药往往需要手性中心的现状。脱羧氘代方法则是另一类高效定点引入氘元素的策略,其中包括最新报道的光脱羧酶,经过蛋白质工程改造后的突变体适用于广泛的带羧基底物的脱羧氘代反应,并且对于多种天然产物均有较高的氘代效果,显示了其在氘代药中的应用潜力。
虽然生物催化方法弥补了化学氘代方法步骤复杂、控制立体选择性困难、毒性大等缺陷,然而生物酶仍存在本身难以忽略的问题。酶虽然具有极高的催化活性,但是其对保持活性的存储温度和反应条件的需求较为苛刻,制约了其商业化所需的长距离运输和长时间储存,并且不利于在工业生产中的大规模运用。另外,酶的专一性致使即使现在出现了理性设计这一突变方法,仍很难避免寻找最优突变株过程中需要较大的工作量和时间。寻找底物适配的突变体和提高酶在反应中的稳定性是生物催化氘代反应中急需解决的两大问题。此外,氘代药的未来也存在一些需要克服的困难。首先,专利申请难度大。根据同位素效应,当分子中的氢被氘取代后,其分解速率减慢改善代谢的效果被认为是可预见的,因此缺乏创新性,所以如果药物在到氘代后没有新的意外的发现,专利申请很可能会被驳回。其次,氘代并不一定能改善药物的性能。如果代谢途径不涉及碳氘键断裂则无法减缓代谢速率,这要求氘原子需要具备精准的插入位置,将氘引入主要代谢点上。另外,由于无法预测药物在体内的代谢路径中是否会发生代谢位点的迁移,这一变量为氘代药物的设计增加了难度。因此,相关药理学及药物代谢的机理是该研究的重要基础。
即使如此,酶的生物催化方法也有其独特的优势:反应条件温和,以重水为氘源廉价无毒,能一步制备氘代分子,具有较高的区域、立体选择性,与现有的化学催化氘代策略相比是一个重大进步。由此可预见,生物催化将成为不断发展的氘代化合物合成领域的一个强大的技术补充。由于氘代分子在医药、化学中的重要地位,相信生物催化氘代反应在未来将会得到越来越广泛的应用。

