还原伴侣对细胞色素P450酶MycG功能调控的研究
杨超凡,姜玉超,桑茉莉,李盛英,张伟
(山东大学微生物技术研究院,山东大学微生物技术国家重点实验室,山东 青岛 266237)
细胞色素P450 酶能够催化包括“碳氢键选择性氧化”在内的20 余类、数以万计的氧化还原反应,其生物学功能广泛涉及人类与脊椎动物异源物质代谢与激素合成,植物与微生物天然产物生物合成以及微生物降解代谢等,其催化的反应具有高度的位点和立体选择性,是化学催化剂的重要瓶颈[1-3]。氧化还原伴侣蛋白(简称还原伴侣,redox partner)在绝大多数P450 酶催化反应中不可或缺,负责将来自辅因子NAD(P)H 的2 个电子依次传递到亚铁血红素(heme)反应中心以激活氧分子[4]。P450 酶和还原伴侣在长期进化过程中,通过基因融合与分离的方式,演化出多种不同的催化系统。根据P450酶和还原伴侣构成的电子传递链的不同,可分为3 种主要类型:第1 类为三组分系统,P450酶、铁氧还蛋白(ferredoxin,Fdx)和铁氧还蛋白还原酶(ferredoxin reductase,FdR)均以独立蛋白的形式存在,其电子传递链一般为NAD(P)H→FAD→FeS→heme,常见于细菌及线粒体P450催化系统,如铜绿恶臭假单胞菌(Pseudomonas putida)来源的PdR/Pdx[5]、牛(Bovine)来源的AdR/Adx[6]和菠菜(Spinach oleracea)来源的FdR/Fdx[7]等。第2类为双组分系统,还原伴侣由FAD和FMN双结构域融合形成细胞色素P450 还原酶(cytochrome P450 reductase,CPR)[8],常 见 于真核细胞,与P450 蛋白组成双组分系统;另外,自然界也存在P450酶与铁氧化蛋白FMN或者铁硫簇FeS融合形式的双组分系统,如来自Methylococcus capsulatus的CYP51FX(N-P450-Fe3S4-C)[9]和来自Rhodococcus rhodochrous11Y 的XplA(N-FMN-P450-C)[10]。第3 类则为单组分系统,其还原伴侣与P450 蛋白融合形成一个完整蛋白,能够在只添加辅因子NAD(P)H的条件下实现P450催化功能,因此常被称为“催化自主型”P450 酶(图1)。目前发现的天然融合单组分系统,一般采用N 端P450 酶和C端还原伴侣融合的结构组织形式,如在巨大芽孢杆菌(Bacillus subtilis)中发现的P450 BM3,即N-BM3-CPR-C(CYP102A1)[11]和 来自 于 红 球 菌(Rhodococcussp.NCIMB 9784)的P450 RhF,即N-P450-RhFRED-C(CYP116A1)[12-14]。

图1 基于还原伴侣分类的P450催化系统Fig.1 Classification of P450 systems based on redox partners
单组分P450 催化系统因其催化自主特性在近年来受到广泛关注[12]。例如,李盛英等[13]首创将委内瑞拉链霉菌(Streptomyces venezuelae)来源的P450 酶PikC 与含有21 个氨基酸残基天然连接肽(L21)的RhFRED 蛋白进行融合表达获得了“催化自主型”PikC-RhFRED,在只添加NADPH 的条件下,在体外(in vitro)成功实现了对底物12 元大环内酯YC-17 及14 元大环内酯narbomycin 的羟化反应。Misawa等[14]利用“催化自主型”的快速构建策略——“分子乐高”法(Molecular Lego),实现了将还原伴侣RhFRED 与不同P450 酶融合到一起形成“非天然”融合蛋白P450-RhFRED,通过异源宿主E.coli的体内(in vivo)反应成功重建了多种P450 酶的催化功能;并利用该系统首次成功鉴定了CYP153A 的催化功能,为多种细菌P450酶的功能鉴定提供了有效策略和开发系统。van den Berg 等[15]通过将来自Amycolatopsis orientalis的CYP105AS1 进行密码子优化和定向进化改造后,与RhFRED 融合获得P450prava-RhFRED,以该酶为基础构建了药物普伐他汀的一步发酵法生产途径。
以来自于稀有放线菌淡灰红小单孢菌(Micromonospora griseorubida)麦新米星(mycinamicin)生物合成途径中的多功能P450 酶MycG 为研究对象,构建了MycG-RhFRED单组分催化系统,在仅提供NADPH 的条件下实现了MycG 对底物mycinamicin Ⅳ(M-Ⅳ) 的 识 别 和 催 化, 产 生mycinamicinⅠ(M-Ⅰ)和mycinamicinⅤ(M-Ⅴ),后者能够被MycG继续环氧化得到终产物mycinamicinⅡ(M-Ⅱ),但M-Ⅰ则不能被MycG识别,是另一个终产物(图2,i)[16]。当MycG与还原伴侣RhFRED处于双组分系统状态时,同样可以识别和催化底物M-Ⅳ产生3种氧化产物,但同时产生了“非天然”脱甲基产物dMe-M-Ⅳ(图2,ii)[17]。该发现暗示还原伴侣在P450 酶催化过程中,不只是作为电子传递的载体,也能够影响乃至塑造P450 酶的催化功能[17]。
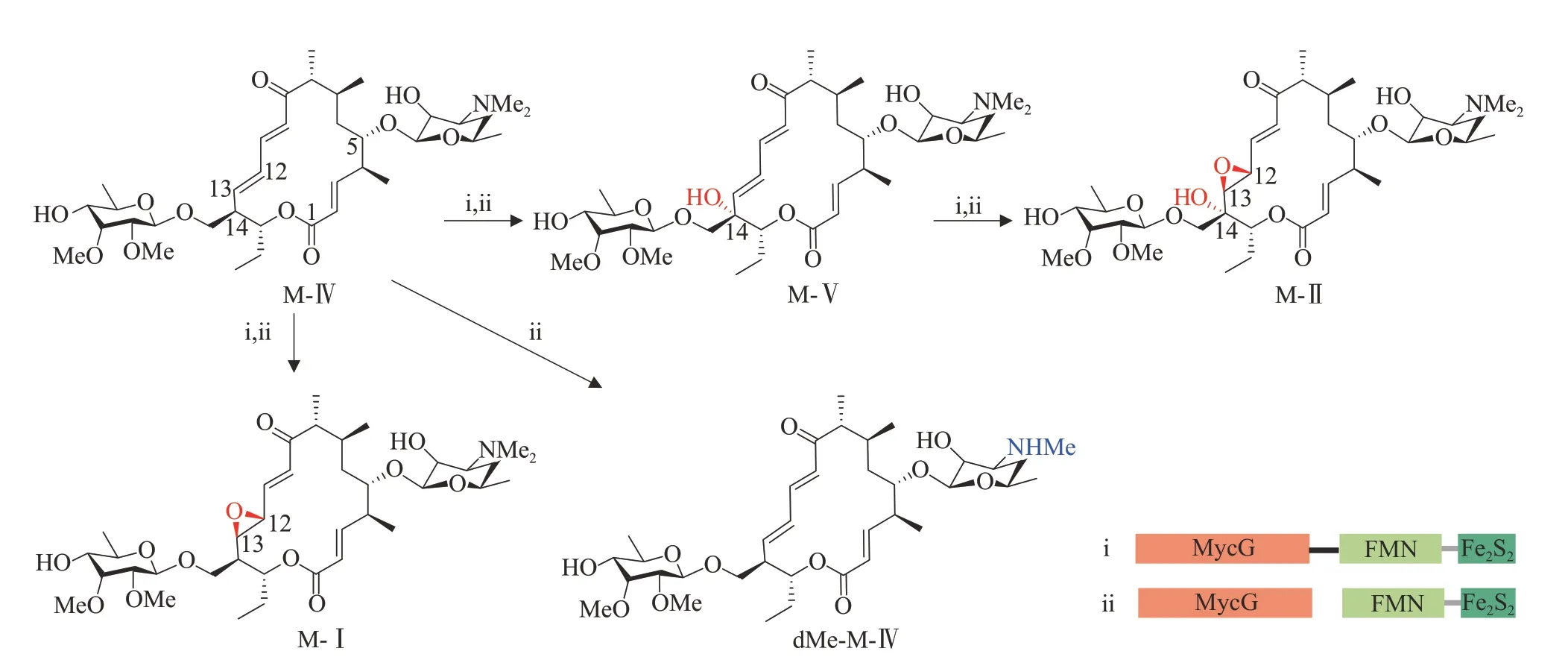
图2 多功能P450酶MycG催化的麦新米星Ⅳ的氧化和脱甲基反应Fig.2 Oxidative and demethylative reactions of M-Ⅳcatalyzed by MycG
还原伴侣RhFRED 与P450酶在融合(单组分)和分离(双组分)条件下均能够实现P450 酶的功能重建,暗示P450 酶与还原伴侣之间的适配具有一定的鲁棒性,为进一步探索和研究P450 酶与还原伴侣的蛋白组成形式(单组分对多组分)和在融合蛋白中的相对位置对P450 催化性质的影响提供了良好的研究材料。RhFRED的分子内电子传递系统是由FMN 和Fe2S2两个结构功能域组成的,两者之间通过含有9个氨基酸残基的连接肽(L9)融合形成N-FMN-Fe2S2-C[12]。本研究将FMN 和Fe2S2从L9 处拆分为两个独立蛋白,与MycG 进行融合和分离,共获得14 种组合方式。第一,两个独立表达的FMN 和Fe2S2蛋白,与MycG 组合形成三组分催化系统(图3,A1)。第二,模拟单组分系统,利用天然连接肽(L21 或L9)将MycG、FMN 和Fe2S2三个蛋白的相对位置进行搭配组合,重组“催化自主型”P450 系统的不同蛋白组织形式(图3,B1~B6);第三,模拟双组分催化系统,将FMN 和Fe2S2融合位置互换产生N-Fe2S2-FMN-C(图3,C1、C2);另外,将两个结构域分别融合在MycG 的C 端或N 端,获得N-MycG-FMN/Fe2S2-C 和N-FMN/Fe2S2-MycG-C(图3,C3~C10)。通过MycG 对底物M-IV 的底物转化率和产物分布分析,结合电子传递效率差异来研究不同组合的人工还原伴侣对MycG 催化系统功能和性质的影响。
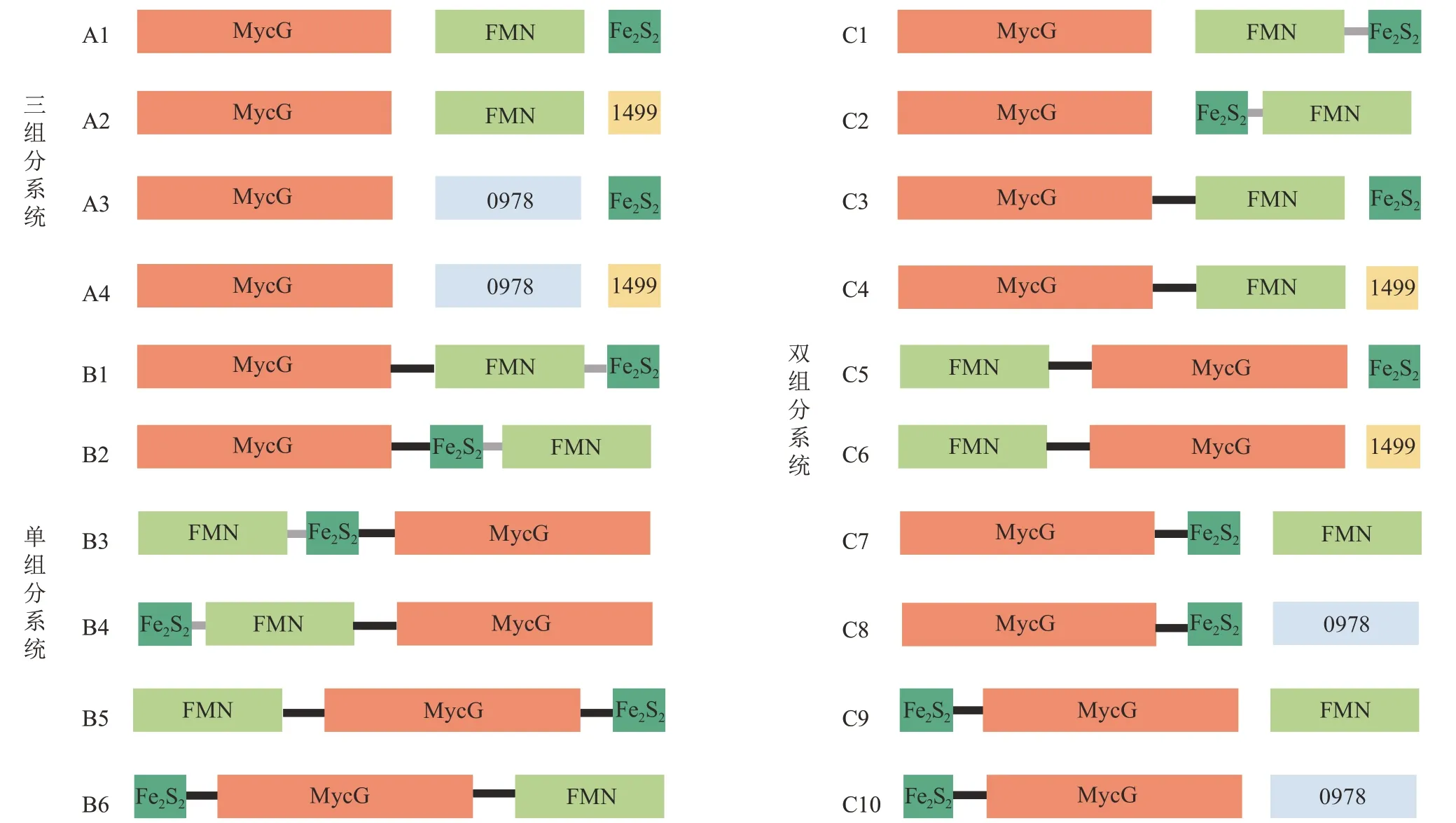
图3 P450酶MycG与还原伴侣组成的不同催化系统(0978和1499分别代表来自细长聚球藻Synechococcus elongates PCC 7942的铁氧还蛋白还原酶SelFdR0978和铁氧还蛋白SelFdx1499;黑色linker:L21,HQVAMLRDGDSFGGG PRHGAG;灰色linker:L9,GERREIRVD)Fig.3 Constructed P450 systems based on the recombination and reorganization of MycG and different redox partners(0978 and 1499 represent the ferredoxin reductase SelFdR0978 and ferredoxin SelFdx1499 from Synechococcus elongates PCC 7942,respectively;Black linker:L21,HQVAMLRDGDSFGGGPRHGAG;Gray linker:L9,GERREIRVD)
1 实验材料与方法
1.1 实验材料
1.1.1 菌株和质粒
本研究所用于分子克隆的宿主菌E.coliDH5α菌株、用于蛋白表达的宿主菌E.coliBL21(DE3)菌株均购自擎科生物技术(青岛)股份有限公司,寡核苷酸引物也由该公司合成。本研究所用的菌株和质粒见表1,本研究所用的寡核苷酸序列见表2。
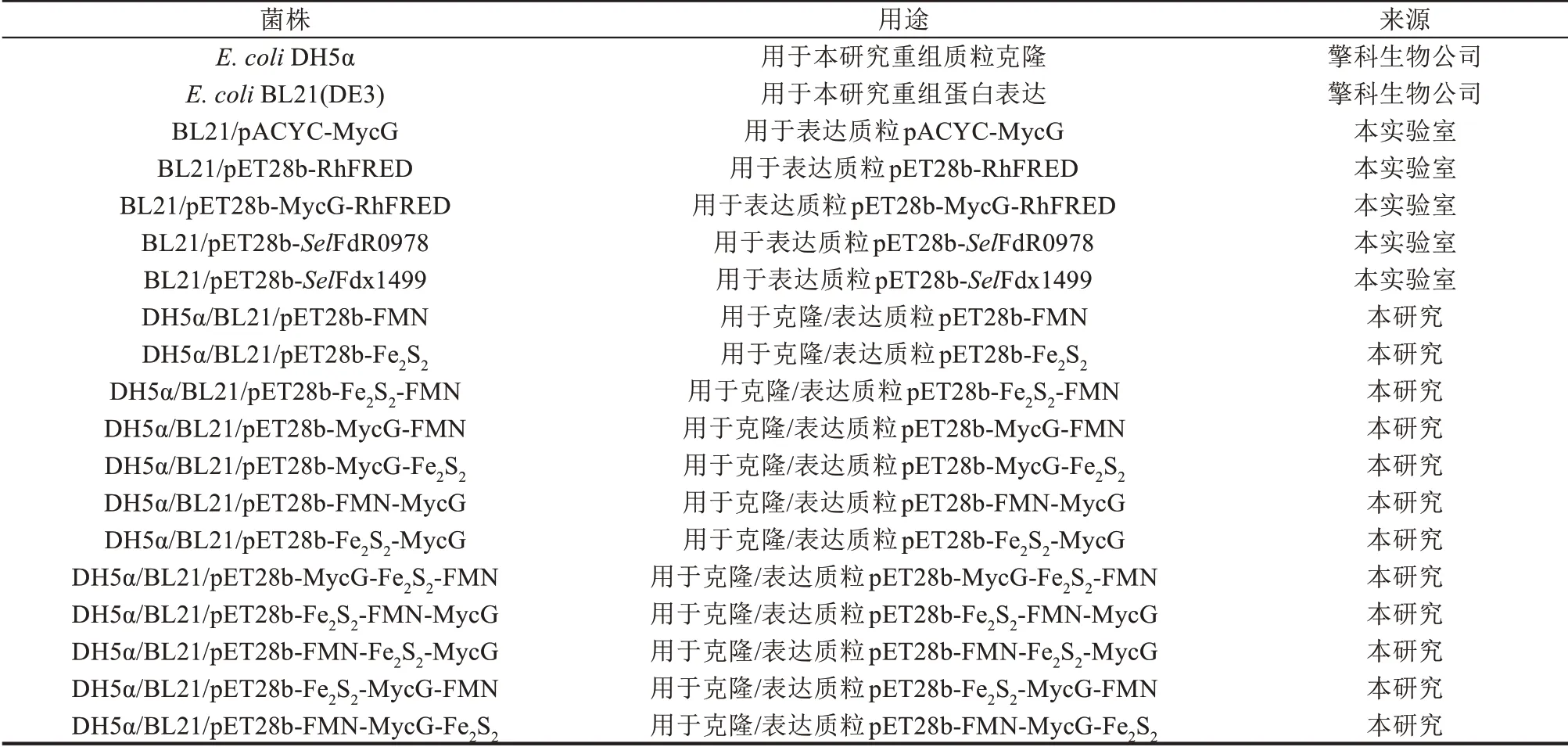
表1 本研究使用的菌株和质粒Tab.1 Strains and plasmids used in this study

表2 本研究所用的引物名称与核苷酸序列Tab.2 Oligos used in this study

续表
1.1.2 培养基和试剂
本研究所用的LB 琼脂和LB 肉汤培养基采购于青岛海博生物技术有限公司;TB 肉汤培养基采购于生工生物科技有限公司;DNA 聚合酶PrimerSTAR Max DNA Polymerase PrimerSTAR Max DNA Polymerase 和DNA Marker 购 自 宝 日 医生物技术有限公司(Takara 日本);2×TsingKe Master Mix 购自擎科生物技术有限公司;DNA 纯化试剂盒(Gel Extraction Kit D2500)购自Omega(美国);用于同源重组的Exnase Ⅱ连接酶购自南京诺唯赞生物科技股份有限公司;镍柱琼脂糖树脂Ni-NTA Sefinose Resin(G915DA0001)采购于上海生工生物工程有限公司;4S Red Plus 核酸染色剂采购于BBI 生物科技有限公司;超滤管(50/30/10 kDa)购自美国Millipore 公司;50×TAE 与10×TBE 电泳缓冲液购自北京索莱宝科技公司;所有无机盐采购于国药集团化学试剂有限公司和索莱宝有限公司。
1.2 基因克隆和表达质粒的构建
本研究中对每个基因独立片段采用两步扩增法进行PCR 扩增:首先以含有目的基因DNA 的MycG-RhFRED 质粒作为模板,用相应的引物进行PCR 扩增得到目的编码基因,将该DNA 片段用Omega Bio-tek DNA 纯化试剂盒进行纯化后作为PCR 模板,并用带有同源臂的引物再次进行PCR扩增,将用于同源重组连接的同源臂片段加到基因的两端并进行胶回收纯化。利用PCR获得含有同源臂的质粒线性片段,将两个DNA 片段用诺唯赞的Exnase Ⅱ酶进行同源重组连接后,利用化学法转化至E.coliDH5α感受态并涂布到含有50 mg/L卡那霉素的LB固体培养基,于37 ℃静置培养过夜。挑取平板生长的单克隆并以T7-P/T 为引物进行菌落PCR 验证,获得正确片段的质粒由擎科生物技术有限公司进行测序验证。
1.3 重组蛋白的表达和纯化
1.3.1 重组蛋白的表达
将测序验证正确质粒分别转化到大肠杆菌感受态细胞E.coliBL21(DE3)进行松弛培养后,离心取上清并涂布到含有50 mg/L 卡那霉素的LB平板,37 ℃培养16~18 h。挑取单克隆于50 mL含50 mg/L 卡那霉素的LB 液体培养基,37 ℃、220 r/min 摇床培养过夜。按1%接种量接种至含500 mL TB(含50 mg/L 卡那霉素)培养基的2 L 三角瓶中,37 ℃、160 r/min 培养至A600=0.6~1。如果重组蛋白为P450 酶,需在培养基中加入500µmol/L 5-氨基乙酰丙酸盐酸盐(5-aminolevulinic acid,5-ALA)和1 mmol/L VB1,随后加入终浓度为100µmol/L的异丙基硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)。培养液于16 ℃、100 r/min培养20~24 h诱导目的蛋白的表达。发酵液于4 ℃、6000 r/min离心10 min,将菌体收集后置于−80 ℃冰箱保藏备用。
1.3.2 重组蛋白的纯化
将含有重组蛋白的菌体从−80 ℃冰箱取出,置于冰上融化。加入30~40 mL Lysis buffer(50 mmol/L磷酸二氢钠,300 mmol/L氯化钠,10%甘油10 mmol/L咪唑,pH 8.0),涡旋振荡重悬菌体,倒入置于冰水混合液的烧杯中,利用JY92-IIDN 超声破碎仪(宁波新芝生物科技公司),破碎裂解细胞至菌液为清澈状态(工作5 s,停顿5 s,功率25%,工作时间30 min)。裂解后的悬液10 000 r/min、4 ℃离心60 min,将上清转至离心管中,加入1~2 mL Ni-NTA 树脂于4 ℃孵育60 min。转入Ni-NTA 重力柱,用Wash buffer(50 mmol/L 磷酸二氢钠,300 mmol/L氯化钠,10%甘油,20 mmol/L 咪唑,pH 8.0)清洗250 mL。用4 mL Elution buffer(50 mmol/L 磷酸二氢钠,300 mmol/L 氯化钠,10% 甘油,250 mmol/L咪唑,pH 8.0)对目的蛋白进行洗脱收集;收集液用合适的Millipore 超滤离心管浓缩至约1 mL;用PD-10 脱盐柱(GE Healthcare)脱盐收集目标蛋白,混匀后分装,经液氮速冻后置于−80 ℃保存备用。
1.4 蛋白浓度的测定
1.4.1 P450蛋白活性浓度测定
P450 蛋白浓度测定采用CO 差光谱进行测定[18]:取100 μL 纯化P450 蛋 白 转至1.5 mL 离心管,加入900 μL Desalting buffer;向蛋白样品中通入CO 气体约1 min,迅速转入比色皿中,利用酶标仪采集350~500 nm 吸光谱(A1);加入适量保险粉(Na2S2O4)后轻轻混匀,用酶标仪再次采集350~500 nm 吸光谱(A2)。计算不同吸光度下差值,以吸光度为横坐标、差值为纵坐标。在450 nm处有吸收峰的P450 蛋白,可以认定为活性P450酶。蛋白浓度的计算公式为:

1.4.2SelFdR0978浓度测定
将SelFdR0978 从−80 ℃冰箱取出,置于冰上融化;以Desalting buffer 做空白对照,将蛋白用Desalting buffer稀释20倍后,用酶标仪测量456 nm处吸光度。蛋白浓度计算公式为[19]:

1.4.3 含有Fe2S2结构域的还原伴侣蛋白浓度测定
将含有Fe2S2结构域的还原伴侣蛋白从−80 ℃冰箱取出,置于冰上融化;以Desalting buffer作空白对照,将蛋白用Desalting buffer 稀释20 倍后,用酶标仪测量420 nm 处吸光度。蛋白浓度计算公式为[19]:

1.4.4 含有FMN结构域的还原伴侣蛋白浓度测定
将含有FMN结构域的还原伴侣蛋白从−80 ℃冰箱取出,置于冰上融化;以Desalting buffer作空白对照,将蛋白用Desalting buffer稀释20倍后,用酶标仪测量445 nm 处吸光度。蛋白浓度计算公式为[20-21]:
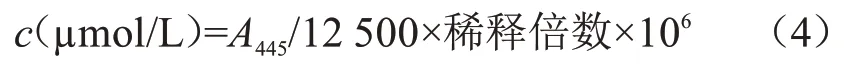
1.5 重组蛋白体外反应
1.5.1 体外反应体系和条件
反应体系中包含3 μmol/L MycG,10 μmol/L Fdx (Fe2S2),5 μmol/L FdR (FMN),0.1 mmol/L底物M-IV,2.5 mmol/L NADPH,反应缓冲液(50 mmol/L 磷酸二氢钠,10%甘油,pH 7.4)补充至100 μL;反应条件为28 ℃,水浴2 h。加等体积甲醇涡旋振荡以终止反应。
1.5.2 HPLC检测条件
反应体系经甲醇终止反应后,14 000 r/min 离心10 min 后取上清,利用HPLC 对样品进行分析。色谱柱:YMC-Triart C18,4.6 mm×250 mm,5 μm。流动相:A 相,水+0.1 %三氟乙酸;B 相,乙腈+0.1%三氟乙酸。HPLC 洗脱方法:0~12 min,40% B;12~13 min,40%~100% B;13~16 min,100% B;16~17 min,100~40 % B;17~20 min,40%B;流速1 mL/min。
1.6 测定电子传递效率
1.6.1 测定铁氰化钾的还原速率
反应体系中含有0.7 mmol/L铁氰化钾、500 μmol/L NADPH、0.01 μmol/L FdR/FMN/融合蛋白,加入反应缓冲液补充至1 mL;酶标仪记录样品在420 nm处吸光度的变化,计算铁氰化钾的还原速率[ε420=1000 L(/mol·cm)][22-23]。
1.6.2 测定细胞色素C的还原速率
反应体系中含有50 μmol/L 细胞色素C,500 μmol/L NADPH,0.1 μmol/L FdR(FMN)/Fdx(Fe2S2)/融合蛋白,加入反应缓冲液补充至1 mL;利用酶标仪记录样品在550 nm处吸光度的变化,计算细胞色素C的氧化速率[ε550=19 100 L(/mol·cm)][18,22-23]。
2 结果与分析
2.1 MycG 与还原伴侣不同组合对M-Ⅳ体外反应的影响
2.1.1 MycG、FMN和Fe2S2组成的三组分系统
在细菌Ⅰ型P450 系统中,P450 酶、FdR 和Fdx 均以独立蛋白的形式存在。为了模拟自然界中存在的三组分催化系统,将RhFRED 的两个结构域(FMN和Fe2S2)在L9处进行拆解后,构建为两个独立的蛋白表达质粒。在FMN、Fe2S2与MycG组成三组分系统中(图3,A1),以M-Ⅳ为底物进行体外反应2 h 后,HPLC 和LC-MS 检测分析发现该反应未产生任何氧化或脱甲基产物,底物M-Ⅳ未见明显消耗[图4(a)v/vi;图5,A1]。
为了证实拆解之后独立表达获得的FMN 和Fe2S2蛋白是否具有支持MycG催化功能的能力,分别选择细长聚球藻S.elongatesPCC 7942 的铁氧还蛋白还原酶SelFdR0978 和铁氧还蛋白SelFdx1499分别替代FMN 和Fe2S2[19],获得MycG+FMN+1499(图3,A2)和MycG+0978+Fe2S2(图3,A3)组合,并以MycG+0978+1499(图3,A4)组合作为阳性对照。
经HPLC 检测,MycG+0978+1499 阳性对照组合将M-Ⅳ(最大吸收波长280 nm)彻底转化为M-Ⅴ(280 nm)、M-Ⅱ(240 nm)和M-Ⅰ(240 nm)[图4(a)vii/viii],3 种产物的比例为M-Ⅰ∶M-Ⅱ∶M-Ⅴ=1.0∶1.2∶0.2(图5,A2)。这一结果说明当SelFdR0978 和SelFdx1499 存在时,MycG 倾向于催化C-14 位的羟基化反应,并以M-Ⅱ为主要产物形式。
MycG+FMN+1499 组合催化的反应在280 nm检测条件下,能够观察到M-Ⅱ的产生(4.95 min)[图4(a)ix]。由于M-Ⅴ和M-Ⅱ的保留时间非常相近,经LC-HRMS(ESI+)分析发现该产物峰包含了两个分子离子峰,分别为728.4225和712.4270,与M-Ⅱ(cald.728.4221)和M-V(cald.712.4272)分子离子峰吻合[图4(b)]。该反应产物在240 nm下能够观测到保留时间为7.97 min的产物峰[图4(a)x],LC-HRMS 分析证实该峰分子离子峰为712.4277,与M-Ⅰ(cald.712.4272)一致[图4(b)]。以上结果表明MycG+FMN+1499 组合能够催化M-Ⅳ的氧化反应,产生3个氧化产物M-Ⅰ、M-Ⅱ与M-Ⅴ,但产物生成率仅为MycG+0978+1499 组合的约50%,产物分布也产生了变化(M-Ⅰ∶M-Ⅱ∶M-Ⅴ=1.0∶0.9∶2.1)(图5,A3),虽然同样倾向于在C-14 位进行羟基化,但以中间产物M-Ⅴ为主要产物形式。
对于MycG+0978+Fe2S2组合,除了3 种氧化产物M-Ⅰ、M-Ⅱ和M-Ⅴ,同时在280 nm 检测波长下观测到保留时间为7.22 min 的产物峰,经LCHRMS分析发现该峰的分子量为682.4168,与dMe-M-Ⅳ(cald.682.4160)一致[图4(a)ix、(b)]。4种产物比例为M-Ⅰ∶M-Ⅱ∶M-Ⅴ∶dMe-M-Ⅳ=1.0∶3.6∶6.2∶0.3(图5,A4),以中间产物M-Ⅴ为主要存在形式。该结果说明Fe2S2存在时,可能通过蛋白-蛋白相互作用影响MycG 的催化构象,产生非天然的脱甲基产物,与之前的结果相符[17]。
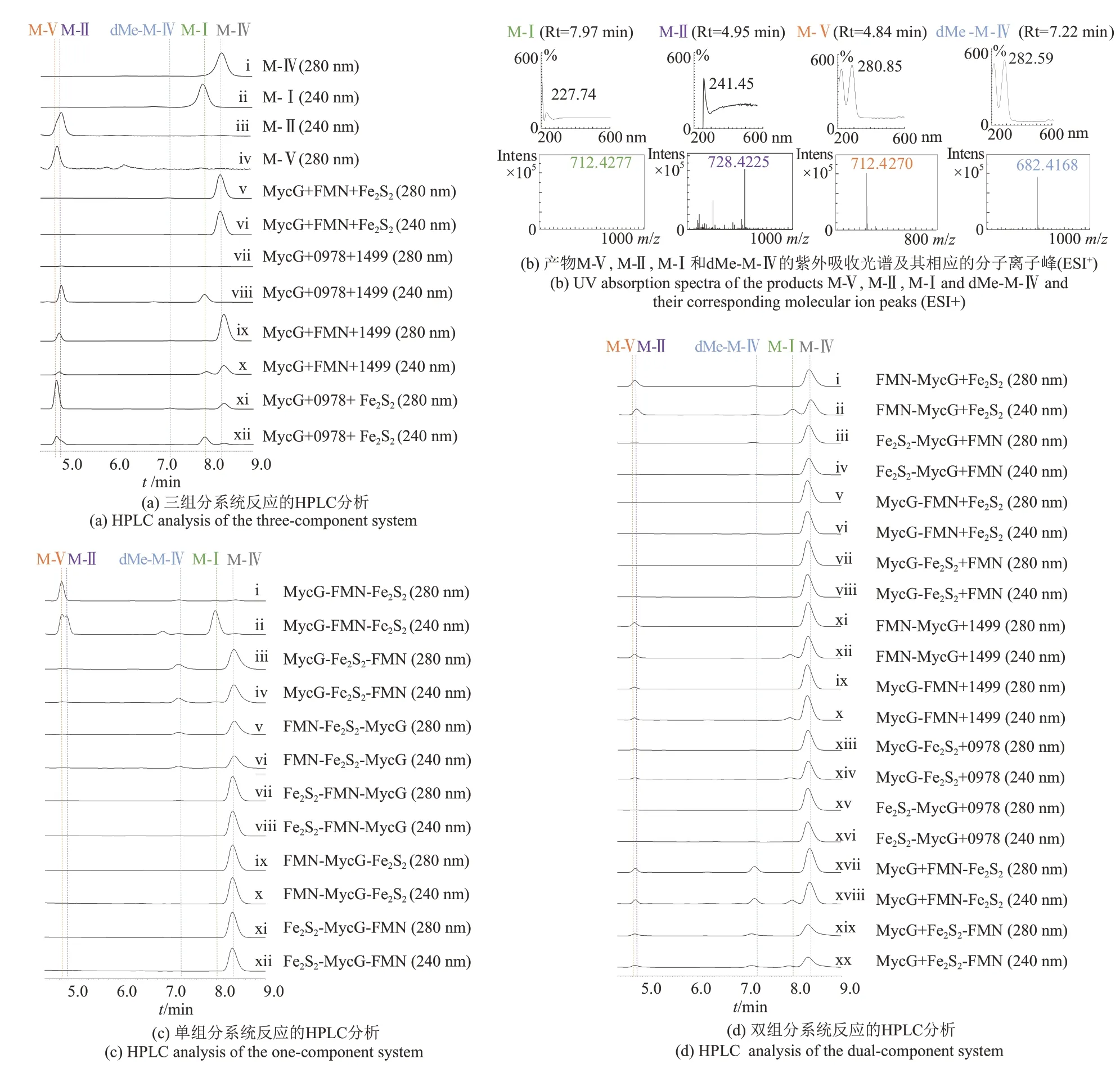
图4 MycG催化麦新米星M-Ⅳ产生氧化和脱甲基产物高压液相色谱和高分辨率质谱分析Fig.4 HPLC and LC-HRMS analysis of the oxidative and demethylative products produced from M-Ⅳunder the catalysis of P450 MycG
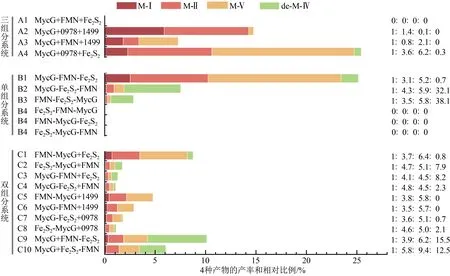
图5 不同还原伴侣系统中MycG催化M-Ⅳ反应的产物分布及催化效率Fig.5 Product distribution and catalytic efficiencies of MycG toward M-Ⅳwith different redox partner systems
FMN 和Fe2S2以独立蛋白形式分别与SelFdx1499 和SelFdR0978 组合时,MycG 能够实现对底物M-Ⅳ的转化,说明FMN 和Fe2S2均为活性蛋白,而催化效率的差异可能是由于SelFdR0978与FMN 的电子传递效率造成的。另外,Fe2S2的存在可能造成MycG 催化构象的改变,从而产生了脱甲基产物dMe-M-Ⅳ。但是,MycG+FMN+Fe2S2组合中未能检测到任何产物,暗示两个结构域由融合蛋白变为独立蛋白之后,蛋白的构象可能均发生了改变,组合后两者之间无法产生有效识别和分子间的电子传递,因而无法支持MycG 的催化功能。这些结果表明FMN 和Fe2S2的融合状态对于维持RhFRED蛋白的活性与反应构象具有重要作用。
2.1.2 MycG、FMN和Fe2S2组成的单组分系统
一些P450 酶和还原伴侣在进化过程中,融合形成一个单组分、“催化自主型”的P450酶,能够在只提供NAD(P)H 的条件下实施催化功能,可能代表了进化上的一种优势组合。“催化自主型”P450 酶的典型代表有P450 BM3(CYP102A1)[11]和P450-RhFRED(CYP116A1)[24]。在这两种蛋白中,P450 和双结构域的还原伴侣蛋白在结构组织方式均为N-P450-CPR/RhFRED-C,迄今为止自然界中尚未发现位于P450 酶N 端的双结构域还原伴侣蛋白[12]。
在本研究中,以MycG 与RhFRED 双结构域FMN 和Fe2S2为研究对象,通过不同的组织方式设计了6 种人工“单组分”融合蛋白(图3,B1~B6)。N-MycG-FMN-Fe2S2-C(即MycG-RhFRED)(图3,B1)、N-MycG-Fe2S2-FMN-C(图3,B2)和N-FMN-Fe2S2-MycG-C(图3,B3)能够在仅添加NADPH 的条件下,催化M-Ⅳ反应产生氧化产物M-Ⅰ、M-Ⅱ、M-Ⅴ和脱甲基产物dMe-M-Ⅳ共计4种产物,但催化效率差异显著[图4(c)i/ii,iii/iv,v/vi;图5,B1~B3]。例如:当还原伴侣位于MycG 的C 端时,催化效率显著降低,且产物分布发生了明显变化,以脱甲基产物dMe-M-Ⅳ为主(图5,B3)。以上结果说明,在催化自主型P450系统中,P450 酶和还原伴侣相对位置的改变,能够对P450酶的催化效率和产物分布造成显著影响。
Fe2S2-FMN-MycG、FMN-MycG-Fe2S2和Fe2S2-MycG-FMN 3 种融合蛋白在以M-IV 为底物的体外反应测试中,未能检测到相应的产物峰[图4(c)vii/viii,ix/x 和xi/xii;图5,B4~B6]。CO 差光谱测定发现,该3种“单组分”融合蛋白未能检测到P450 典型吸收峰。该结果暗示FMN、Fe2S2和MycG 相对位置的改变可能造成了人工蛋白的异常折叠,使得MycG丧失了P450酶催化功能。
2.1.3 MycG、FMN和Fe2S2组成的双组分系统
自然界中存在的P450 双组分催化系统中,P450 酶与还原伴侣蛋白常以独立组分的形式存在,如真核生物中常见的P450 酶与CPR 组合[12]。P450酶仅与Fdx或FdR 发生融合的情况较为罕见,目前仅有两例P450 酶与Fdx 形成融合蛋白的报道,分别是来自于M.capsulatus的CYP51FX(N-P450-Fe3S4-C)[9]和 来 自 于R.rhodochrous11Y 的XplA(N-FMN-P450-C)[10],这种融合方式可能代表了一种由双组分融合蛋白向单组分融合蛋白进化的中间状态。值得指出的是,CYP51FX 和XplA 均需要在同时提供FdR 和NADPH 的条件下才能实现其催化功能[9-10]。将RhFRED 蛋白的两个结构域FMN和Fe2S2分别融合到MycG的N端或C端,构建获得N-Fe2S2/FMN-MycG-C 或N-MycG-Fe2S2/FMN-C 4 种融合形式并成功表达纯化获得目的蛋白,CO 差光谱分析证实纯化获得的融合蛋白均具有P450 典型吸收峰。在以M-Ⅳ为底物的体外反应中添加还原伴侣蛋白的相应缺失组分(FMN 或Fe2S2)后,HPLC 分析发现4 种组合均可以不同程度重建MycG的活性,催化产生3种氧化产物和1种脱甲基产物[图4(d)i/ii,iii/iv,v/vi和vii/viii],但产物分布差别较大:N-FMN-MycG-C、N-Fe2S2-MycG-C、N-MycG-FMN-C 和N-MycG-Fe2S2-C 的 产 物 比 例(M-Ⅰ∶M-Ⅱ∶M-Ⅴ∶dMe-M-Ⅳ)分别为1.0∶3.7∶6.4∶0.8、1.0∶4.7∶5.1∶7.9、1.0∶4.1∶4.5∶8.2和1.0∶4.8∶4.5∶2.3,且主产物也不尽相同,分别为M-Ⅴ、dMe-M-Ⅳ、dMe-M-Ⅳ和M-Ⅱ(图5,C1~C4),其中N-FMN-MycG-C的催化效率明显优于另外3 种融合蛋白[图4(d)i/ii,xi/xii;图5,C1,C5]。值得指出的是,当FMN 或Fe2S2融合在MycG 的N 端或者C 端时,脱甲基产物dMe-M-Ⅳ的产量均发生显著改变。当游离的Fe2S2被SelFdx1499替换后,反应体系不再产生脱甲基产物dMe-M-Ⅳ;而当SelFdR0978 将游离的FMN 替换后,脱甲基产物产量也出现降低。以上结果暗示RhFRED 蛋白的两结构域在脱甲基产物dMe-M-Ⅳ的产生过程中均发挥重要作用,其中Fe2S2结构域的影响大于FMN结构域。
对于RhFRED 蛋白本身,通过FMN 和Fe2S2结构域相对位置互换构建了N-Fe2S2-FMN-C(图3,C2)“非天然”融合蛋白。反应结果显示MycG+N-Fe2S2-FMN-C 组合仍然能够产生氧化产物M-Ⅰ、M-Ⅱ、M-Ⅴ和脱甲基产物dMe-M-Ⅳ[图4(d)xvii/xviii,xix/xx],其与MycG+N-FMN-Fe2S2-C(即RhFRED)相比,产物分布变化不明显,分别为1.0∶5.8∶9.4∶12.1 和1.0∶3.9∶6.2∶15.1,但是产物生成效率下降约50%(图5,C9,C10)。该结果表明双组分系统中Fe2S2和FMN 相对位置改变会影响两者之间电子传递效率,但对P450 酶催化构象、反应偏好及其产物分布的影响较小。
2.2 MycG与还原伴侣融合方式和组织形式对电子传递效率的影响
在P450催化系统中,来自于NAD(P)H的两个电子依次经过FdR(FMN)→Fdx(Fe2S2)→heme 的传递过程。电子传递链各组分之间的电子传递效率是影响P450 催化活性的关键因素。因此,分别以铁氰化钾和细胞色素C 作为替代型电子受体[16-17],测定不同融合方式和组织形式对电子传递效率的影响。如表3所示,与自然进化形成的天然融合蛋白N-FMN-Fe2S2-C(RhFRED)相比,两个结构域互换之后得到的N-Fe2S2-FMN-C 蛋白,对铁氰化钾和细胞色素C 的还原速率都有所下降,表明RhFRED 蛋白的两个结构域相对位置的改变,造成两者之间[FMN→Fe2S2,34.38 μmol/(L·min)±0.05 μmol/(L·min)vs24.37 μmol/(L·min)±0.02 μmol/(L·min)]以及与P450 蛋白之间(Fe2S2→heme,13.57 μmol/(L·min)±0.01 μmol/(L·min)vs10.21 μmol/(L·min)±0.01 μmol/(L·min))电子传递效率的下降,进而影响到P450 酶的催化效率和产物产率:在N-Fe2S2-FMN-C 组成的双组分反应体系中,MycG 催化MIV 产生相应产物的效率约为含有N-FMN-Fe2S2-C(RhFRED)双组分体系的60%(图5,C9、C10)。
在6种不同蛋白组织结构类型的“单组分”融合蛋白中,N-FMN-Fe2S2-MycG-C、N-Fe2S2-FMN-MycG-C与N-MycG-FMN-Fe2S2-C(MycG-RhFRED)对铁氰化钾的还 原 速 率 相 当[FMN→Fe2S2,26.07 μmol/(L·min)±0.03 μmol/(L·min)vs25.36 μmol/(L·min)±0.02 μmol/(L·min)vs21.82 μmol/(L·min)±0.02 μmol/(L·min)],说明还原伴侣位于P450 酶MycG 的N 端,或者FMN 和Fe2S2相对位置改变对FMN 与Fe2S2之间的电子传递效率影响较小。但是,N-FMN-Fe2S2-MycG-C、 N-Fe2S2-FMN-MycG-C 对细胞色素C的还原速率都低于N-MycG-FMN-Fe2S2-C[Fe2S2→heme,10.22 μmol/(L·min)± 0.01 μmol/(L·min)vs6.0 μmol/(L·min)± 0.01 μmol/(L·min)vs10.45 μmol/(L·min)± 0.01 μmol/(L·min)](表3),表明当还原伴侣蛋白位于MycG的N端时,Fe2S2将电子传递给P450 酶的能力减弱(N-FMN-Fe2S2-MycG-C 和N-Fe2S2-FMN-MycG-C 的产率分别约为N-MycGFMN-Fe2S2-C 的10%和25%),可能是造成MycG催化效率降低的主要因素之一(图5 B3、B4)。
将MycG 置于FMN 和Fe2S2之间获得的两种人工融合蛋白N-FMN-MycG-Fe2S2-C 和N-Fe2S2-MycG-FMN-C,以及通过结构域置换获得的融合蛋白N-MycG-Fe2S2-FMN-C 蛋白,对铁氰化钾的还原速率约为N-MycG-FMN-Fe2S2-C(MycG-RhFRED)的30%[FMN→Fe2S2,6.92 μmol/(L·min)± 0.01 μmol/(L·min)vs6.64 μmol/(L·min)± 0.02 μmol/(L·min)vs5.58 μmol/(L·min)± 0.01 μmol/(L·min)vs21.82 μmol/(L·min)± 0.02 μmol/(L·min)],这3个融合蛋白对细胞色素C 的还原速率也同时降低[Fe2S2→heme,8.42 μmol/(L·min)±0.003 μmol/(L·min)vs3.23μmol/(L·min)±0.009μmol/(L·min)vs5.04 μmol/(L·min)±0.009 μmol/(L·min)vs10.45 μmol/(L·min)±0.009 μmol/(L·min)](表3),表明FMN 和Fe2S2结构域与MycG 相对位置的改变也会造成电子传递效率的降低。更为重要的是,尽管能够检测到电子传递,这3个反应体系均无法检测到反应产物的产生,结合CO 测定无法得到P450 酶的特征吸收峰,暗示3 个融合蛋白中的P450 功能域因某些未知原因丧失了催化功能。
由表3 可知,SelFdR0978 对铁氰化钾的还原速率约为游离状态FMN 的5 倍[FMN→Fe2S2,24.23 μmol/(L·min)±0.04 μmol/(L·min)vs5.04 μmol/(L·min)±0.07 μmol/(L·min)],在不同反应组合中当将FMN 替换为SelFdR0978 时,产物的产率都获得了不同程度的提高(图5)。例如:MycG+Fe2S2+FMN 组合检测不到反应产物,而当FMN 替换为SelFdR0978后,MycG+Fe2S2+0978的组合成功实现了对M-Ⅳ的催化反应(图5 A1、A3);N-MycGFe2S2-C+0978 组合的产率也略高于N-MycG-Fe2S2-C+FMN(图5 B7、B8),表明FdR/FMN→Fe2S2的电子传递效率是影响P450酶催化效率的重要因素。
相较于游离状态的Fe2S2,SelFdx1499 对细胞色素C 的还原效率更高(Fdx/Fe2S2→heme),与含有SelFdx1499 的MycG 催化系统比含有游离Fe2S2催化系统的产率更高的结果相符。与天然融合蛋白N-MycG-FMN-Fe2S2-C(MycG-RhFRED)相比,当改变重组蛋白各组分的结构组织方式时,大部分组合的铁氰化钾还原速率以及细胞色素C还原速率均出现降低,表明重组蛋白的融合方式和组分相对位置的改变会影响电子传递效率,进而影响P450酶的催化效率和产物分布。
3 讨论
为模拟自然界中P450 酶与还原伴侣经过进化形成的不同组织形式,探究还原伴侣与P450 酶的融合或分离状态以及融合蛋白中功能域的组织方式对P450 酶催化功能的影响,以P450 酶MycG 与还原伴侣RhFRED 为研究对象,构建了13 种重组蛋白(图3),以麦新米星M-Ⅳ作为反应底物进行体外MycG 催化的生化反应,系统比较了不同还原伴侣组合中MycG 对M-Ⅳ的催化效率和产物分布,以及不同组合中的电子传递效率,探究还原伴侣影响和重塑MycG 催化功能的潜在功能和机制。
在还原伴侣与MycG 组成的“非天然”催化系统中,所有蛋白均获得可溶性表达,16 个组合能够成功重建MycG 的催化功能,其中12 个组合中MycG 能够催化产生3 个氧化产物M-Ⅰ、M-Ⅱ和M-Ⅴ以及1个脱甲基产物dMe-M-Ⅳ。4个组合仅产生氧化产物M-Ⅰ、M-Ⅱ和M-Ⅴ,剩余4个组合未检测到反应产物的产生(图4、图5)。值得注意的是,可检测到反应产物的16 个组合中,有12 个组合产生了脱甲基产物dMe-M-Ⅳ,其催化体系中均含有游离或者融合状态的Fe2S2结构域。
在4个未检测到任何反应产物的组合中,同样含有游离或者融合的Fe2S2结构域,其中MycG+FMN+Fe2S2组合可能是由于将天然融合的双结构域FMN 和Fe2S2拆分后,造成蛋白构象变化影响到电子传递过程,进而丧失了催化活性。游离状态的FMN和游离状态的Fe2S2之间的电子传递效率最低,对细胞色素C 的还原效率仅为0.46 μmol/(L·min)±0.03 μmol/(L·min),仅为RhFRED(N-FMN-Fe2S2-C)的0.03%;游离的FMN 从NADPH 获取电子的速率也是最低的[5.04 μmol/(L·min)± 0.07 μmol/(L·min)](表3)。含有Fe2S2结构域的融合蛋白N-MycG-Fe2S2-FMN-C、N-FMN-MycG-Fe2S2-C和N-Fe2S2-MycG-FMN-C,虽然成功获得可溶性蛋白,但均检测不到420 nm 的特征吸收峰和450 nm迁移峰,可能是因为还原伴侣和MycG 相对位置的改变,使得“非天然”融合蛋白在折叠的过程中构象发生了改变,未能获得活性形式的P450 酶。3 种融合蛋白对铁氰化钾和细胞色素C 均具有还原能力(表3):FMN→Fe2S2,5.58 μmol/(L·min)±0.01 μmol/(L·min)vs6.92 μmol/(L·min)±0.01 μmol/(L·min)vs6.64 μmol/(L·min)±0.02 μmol/(L·min);Fe2S2→heme,5.04 μmol/(L·min)± 0.009 μmol/(L·min)vs8.42 μmol/(L·min)± 0.003 μmol/(L·min)vs3.23 μmol/(L·min)± 0.009 μmol/(L·min),暗示融合蛋白不同组分之间仍然能够建立电子传递链。
在还原伴侣的电子传递链中,铁氧还蛋白Fdx与P450 直接发生相互作用,Fdx 将来自于FdR 的电子传递到P450 酶的heme 铁催化中心。相较于FdR,Fdx 与P450 的适配性是P450 催化系统中更为主要的因素[19]。例如P450cam对其特有的铁氧还蛋白Pdx 具有高度严谨的选择性,在对P450cam与Pdx 复合物的三维结构解析中发现,Pdx 不仅具有传递电子的功能,还具有诱导P450cam发生构象变化的作用[25]。张丽兰等[26]利用X 射线晶体学技术,成功解析了“自给自足P450 酶”CYP116B46的高分辨率蛋白结构:由两段连接肽相连3个结构域,从N 端到C 端依次为P450、FMN 和Fe2S2,电子 的 传 递 方 向 为FMN→Fe2S2→heme,FMN 和Fe2S2之间的直线距离为0.79 nm,但Fe2S2和heme的直线距离为2.53 nm,超过目前认定的有效电子可直接传递的距离,因此两者的氨基酸可能在电子传递过程中扮演着重要角色,该结果也证明了Fe2S2结构域不仅具有传递电子的功能。
本研究实验结果发现,还原伴侣RhFRED 或者其结构域蛋白(FMN 与Fe2S2)存在时,MycG催化M-Ⅳ获得的产物多样性提高,既含有氧化产物M-Ⅰ、M-Ⅱ和M-Ⅴ,又产生脱甲基产物dMe-M-Ⅳ,暗示不同类型还原伴侣能够影响和改变P450 催化效率和产物组成[17]。值得一提的是,单组分融合蛋白N-MycG-Fe2S2-FMN、 N-FMN-Fe2S2-MycG-C和双组分系统MycG+N-FMN-Fe2S2-C(RhFRED)3 种组合中,脱甲基产物dMe-M-Ⅳ为主产物(图5 B2、B3 和C9);而在单组分系统N-MycG-FMNFe2S2-C,双组分系统N-FMN-MycG-C+Fe2S2和三组分系统MycG+0978+Fe2S2组合中,羟基化产物M-Ⅴ为主产物(图5 B1、C1 和A2)。上述结果说明,除还原伴侣的选择之外[27-28],还原伴侣与P450 酶的融合方式和催化系统蛋白组成的改变均会对产物分布造成影响。
不同于传统P450 蛋白自身的改造,本研究通过模拟P450 酶与还原伴侣的不同进化形式,利用还原伴侣工程策略构建“非天然”P450 催化系统,通过改变还原伴侣和P450 酶的融合方式和相对位置,成功影响和改变了MycG 反应的产物分布和产物类型,是一种有效的酶工程策略,将有助于开发最佳的细胞色素P450酶及其还原伴侣催化系统,实现特定的目标化学反应。值得指出的是,还原伴侣影响和改变P450 酶催化性质的隐藏机制,以及P450 催化构象和产物偏好性的选择性机制仍需更加深入的研究和探索。
致谢:本工作得到国家重点研发计划(2019YFA0905 700 和2019YFA0905100)、国家自然科学基金项目(82022066 和32000039)和山东大学微生物技术国家重点实验室开放课题(M2021-4)支持。感谢日本Toho University 的Yojiro Anzai 教授为本研究提供麦新米星M-Ⅰ、M-Ⅱ、M-Ⅳ和M-Ⅴ等标准品化合物;感谢山东大学微生物技术国家重点实验室生命环境研究公共技术平台的朱敬、曲径遥和黎志凤老师在LC-HRMS 样品检测和数据分析方面提供的帮助。

