无细胞蛋白质合成:从基础研究到工程应用
后佳琦,姜楠,马莲菊,卢元
(1 清华大学化学工程系,北京 100084; 2 沈阳师范大学生命科学学院,辽宁 沈阳 110034)
合成生物学是指对生物体进行有目标的设计、改造、重新合成,甚至创建并赋予其非自然功能的“人造生命”。无细胞合成生物学正在发展成为其中一种强大有效的手段,其目的是在不使用整个活细胞的情况下,理解、利用和扩展自然生物系统的功能[1-2]。无细胞蛋白质合成(cell-freeprotein synthesis,CFPS)是无细胞合成生物学的技术核心,也被称为体外蛋白质转录翻译技术,该技术作为基础和应用生物学的研究工具已经使用了近70 年[3]。CFPS 通过提取核糖体、氨酰-tRNA 合成酶、翻译起始和延伸因子、核糖体释放因子等转录、翻译、蛋白质折叠和能量代谢所必需的元素,并向其中添加DNA 模板、能量和各种辅因子,模仿胞内环境以合成目标蛋白质。CFPS系 统 最 初 是 由Nirenberg 和Matthaei[4]在20 世 纪60 年代开发的,在发现遗传密码方面发挥了重要作用。在过去的20 年里,CFPS 系统经历了飞速的发展,以满足对廉价和快速重组蛋白表达技术的日益增长的需求,这导致了众多高活性CFPS 平台的发展[5]。通过PubMed 搜索关键词“cell-free protein synthesis”分析1953—2020 年公开论文发表数量(图1),可以看到CFPS 技术一直受到广泛的使用和关注。
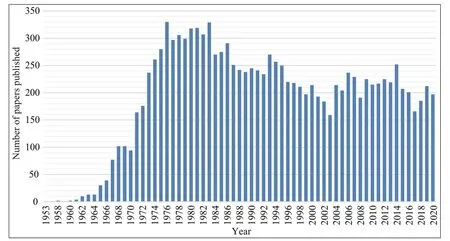
图1 每年CFPS论文发表数量Fig.1 Numbers of annual CFPS publications
CFPS 之所以能够飞速发展,主要是其具有快速表达具生物活性重组蛋白的潜力。具有这种潜力的主要原因是其相较于细胞体系的特有优势(图2)。首先,CFPS 系统使用细胞提取物来模拟细胞内的环境,无需完整的活细胞且没有细胞膜的限制,是一个开放的合成系统。该优点使蛋白质表达操作简单,可直接在体外控制转录及翻译过程,因无跨膜运输问题、允许外源物质直接添加到反应体系,对反应条件可以进行针对性的调控,例如促进蛋白质的折叠和翻译后修饰。并且因为不存在活细胞问题,CFPS 系统可以表达一些难表达的蛋白质,比如有细胞毒性的蛋白质[6],同时表达过程不受细胞代谢产物影响。其次,系统中的所有物质与能量都可以用于生产感兴趣的蛋白质,大大提高了蛋白质的表达效率。这些优势克服了传统的基于细胞的蛋白质合成系统的很多局限性。此外,CFPS可以使用线性DNA作为表达模板,避免了基于质粒方法克隆步骤的耗时问题,使CFPS 系统成为有潜力的高通量筛选工具[7]。
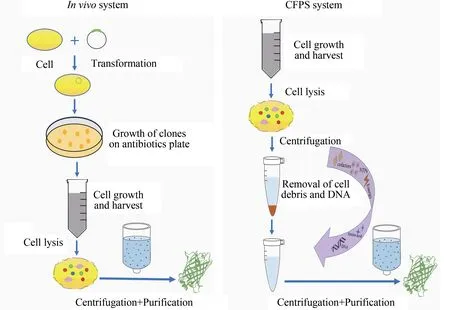
图2 体内细胞和体外无细胞蛋白质合成比较(在体内细胞系统,目的质粒导入细胞,通过培养、裂解和离心纯化获得目的蛋白。在CFPS系统中,通过向细胞提取物中添加DNA模板、氨基酸、NTPs、能量底物等辅助因子,离心纯化后获得目的蛋白)Fig.2 Comparison of protein synthesis through in vivo cellular and in vitro cell-free systems(In the in vivo cellular system,the target plasmid is introduced into the cell,and the target protein is obtained through cell culture,lysis,and product purification.In the CFPS system,by adding DNA template,amino acids,NTPs,energy substrates and other cofactors to the cell extract,the target protein is obtained after centrifugation and purification.)
随着CFPS 的快速发展,CFPS 系统类型已经多种多样。一类是提取物系统,根据细胞的提取物类型可分为高使用率模式细胞类型和低使用率非模式细胞类型。高使用率模式细胞类型主要包括大肠杆菌、酵母、小麦胚芽、昆虫、中国仓鼠卵巢和兔网织红细胞等[8]。这些系统存在各自的优缺点,可根据想表达的蛋白质类型选择合适的提取物。低使用率非模式细胞类型主要包括神经孢霉、链霉菌、需钠弧菌、枯草芽孢杆菌、烟草、拟南芥、恶臭假单胞菌、巨大芽孢杆菌和古生菌等。使用非模式细胞作为底盘进行无细胞体系的构建虽然尚未得到广泛使用或开发,但未来极有可能成为无细胞体系快速创新的源泉。另一类CFPS 系统是2001 年由Shimizu 等[9]开发的一种利用重组元素合成蛋白质的无细胞转录翻译系统,称为PURE 体系。PURE 体系是通过最少数量的转录和翻译元件组合而成,虽然与提取物系统相比成本较高,但因组分明确、可控,在生物化学基础研究中具有很大的优势[10]。
由于CFPS 系统的多样性及其在不同层次方面的优势,使得CFPS 的应用领域也越来越广泛。如今CFPS 系统已在基因电路(原型设计、生物传感和代谢工程)研究、蛋白质工程(膜蛋白、类病毒颗粒、翻译后修饰、非天然氨基酸嵌入和蛋白质进化)和人工“生命体系”构建(噬菌体合成和人工细胞构筑)研究中展现出巨大的应用潜力。本文对CFPS 系统的发展进行了全面的综述,首先介绍了CFPS 系统的组成及不同类型的CFPS 系统的发展,包括以提取物为基础的系统以及PURE体系;之后介绍了CFPS 系统的不同反应模式;接着介绍了CFPS 在不同领域的应用;最后分析了当前CFPS系统遇到的挑战以及对未来发展的展望。
1 CFPS系统及多样性
为合成具有新的特性、结构和功能的蛋白质,应在CFPS 体系中加入编码该蛋白的DNA 或mRNA 模板,以及氨基酸和核苷酸等来启动转录和翻译过程。CFPS 系统利用微生物、植物或动物细胞的粗提物产生核糖体、氨酰-tRNA合成酶、翻译起始和延伸因子、核糖体释放因子等转录、翻译、蛋白质折叠和能量代谢所必需的元素[3](图3)。无细胞蛋白质合成启动后通常会持续,直到其中一个底物(例如ATP、半胱氨酸等)耗尽或副产物积累量(例如无机磷酸盐)达到抑制浓度。迄今为止,已经开发了多种提取物的CFPS 系统,每种系统都有其各自的优缺点,需根据要表达的目标蛋白质,权衡考量其产量、成本和翻译后修饰等要求选择更合适的系统(表1)。

表1 不同提取物体系优缺点对比Tab.1 Comparison of advantages and disadvantages of different extract systems
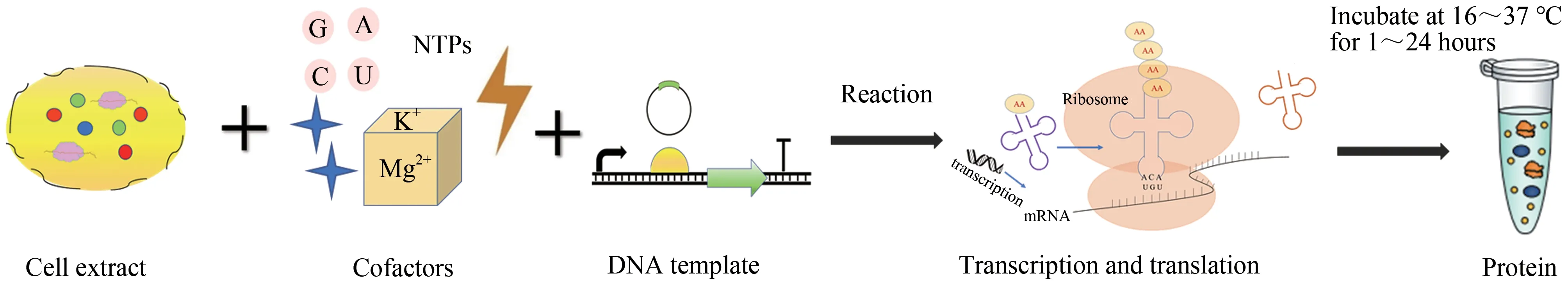
图3 无细胞蛋白质合成过程(无细胞体系的成分包括细胞提取物、辅助因子、DNA模板等,通过细胞提取物中的转录翻译机器,无细胞体系在一定条件下孵育几个小时即可产生目的蛋白)Fig.3 Cell-free protein synthesis process(The components of the cell-free system include cell extracts,cofactors,DNA templates,etc.Through the transcription and translation machinery in the cell extracts,the cell-free system can produce the target protein after incubating for several hours under designated conditions.)
1.1 微生物提取物
大肠杆菌作为最常用的模式菌株,因其生长速度快、易于培养、在分子生物学研究中应用非常广泛等原因成为CFPS 系统构筑广泛使用的底盘来源。1961 年报道了第1 个基于大肠杆菌的CFPS系统,经过之后的不断发展,拓展了其更广泛的应用。大肠杆菌系统能够成为应用最广泛的CFPS 系统,除了更清晰的基因遗传背景外,还因大肠杆菌提取物的制备简单快速且成本效益高,适用于规模化蛋白质合成技术的发展[11]。大肠杆菌提取物来自于多种改造过的大肠杆菌细胞系,包括BL21(DE3)、 BL21 Star(DE3)、 Rosetta、 Rosetta2、C321、C321△A 等[12-13],适用于不同种类蛋白质的表达及应用。例如,BL21(DE3)和BL21 Star(DE3)含有rne131 基因突变体,能够增强mRNA的稳定性,从而有效提高蛋白表达能力。Rosetta系列菌株来源于BL21系列宿主菌,Rosetta2(DE3)来源于Rosetta(DE3),该菌株含有pRARE2 质粒,除了能够提供原Rosetta(DE3)宿主菌含有的AUA、AGG、AGA、CUA、CCC 和GGA 6 个稀有密码子的tRNA 外,还提供了第7 个稀有密码子CGG 的tRNA。这两种菌株主要适用于pET 系列载体,及其他T7 启动子系列载体。C321 是对终止密码子进行调整的菌株,C321△A 进一步删除了释放因子RF1,主要用于基于终止密码子手段的非天然氨基酸嵌入。为进一步提升蛋白质产量,研究人员已对小型或规模化大肠杆菌提取物制备方法进行了优化。Kwon 和Jewett[12]开发了一种基于大肠杆菌提取物的快速、稳健和高通量的超声提取方法,使蛋白产量提升至1 mg/mL。在此基础上, Karig等[14]通过利用糖醇海藻糖(一种简单、低成本的露天干燥步骤,以及干燥过程中反应组分的策略性分离)实现了细胞提取物在高温下前所未有的长期稳定性。合成的CFPS 经冷冻干燥处理,在室温下依旧可以保持活性,从而应用于便携式生物制造、纸基生物传感器的生产[15]。此外,陈鑫杰等[16]的研究表明,在CFPS 系统中加入纳米黏土模拟局部拥挤环境,可提升无细胞系统的蛋白表达。高伟等[17]在基于大肠杆菌粗提物的CFPS 系
统中成功合成了含有非天然氨基酸的绿色荧光蛋白。姜楠等[18]的研究表明无细胞系统中Mg2+浓度是影响蛋白质表达的关键因素。然而,在大肠杆菌CFPS 系统中,缺乏翻译后修饰系统、内源膜结构和有效的分子伴侣,使其合成的真核蛋白具有局限性,因此需开发其他提取物系统。
酿酒酵母作为重要的模式生物和微生物细胞工厂,已广泛用于代谢工程、系统生物学和合成生物学研究[19]。19 世纪70 年代开发了基于酿酒酵母的酵母提取物,因其易于制备培养,被广泛用作模型生物,是真核CFPS 系统制备的重要底盘[20]。然而,基于酵母提取物的CFPS平台蛋白质产量相对较低。最初酵母提取物仅用于研究真核生物的转录和翻译机制[21]。在真核CFPS 平台中,翻译起始通常被认为是蛋白质合成中的限速步骤[22],因此初始的研究聚焦在酵母脱细胞提取物中翻译起始、延伸和终止元件的优化,以提高蛋白质的表达量[23]。近年来,已经开发出了多种用于提高酵母CFPS 平台的蛋白质产量的优化策略,如酵母提取物的制备、模板优化、底物补充和副产物去除等。研究工作者开发了一种使用葡萄糖和磷酸盐的新能源再生系统,使用该系统可生产3.64 μg/mL荧光素酶,与磷酸肌酸和肌酸激酶系统相比蛋白质产量提高了16%[24]。酵母提取物平台的优点是裂解液制备和翻译后修饰简单、快速,可以合成难以在体外合成的病毒样颗粒和医药蛋白质。Wang等[25]开发了用于体外翻译人乳头瘤病毒58(HPV58)L1 mRNA 的无细胞酵母系统,该系统是生产HPVL1 蛋白的潜在工具。Challise等[26]利用基于酵母提取物的CFPS 系统,在24 h内生产具有生物活性的促红细胞生成素。基于酵母提取物的CFPS 平台具有生产重要医学价值的蛋白质的潜力。
细菌种类繁多,除了大肠杆菌,其他细菌也已成为CFPS 平台的重要底盘。作为一种模式生物,革兰氏阴性菌中的恶臭假单胞菌已被广泛用于生物燃料、重组抗体片段和天然产物的实验室研究和工业化生产。Jewett 实验室[27]开发和优化了恶臭假单胞菌CFPS 平台,能够在4 h 内合成大约200 µg/mL 的报告蛋白。Freemont 实验室[28]尝试了巨大芽孢杆菌的CFPS 平台构建,这是一种大型革兰氏阳性细菌,具有生物技术应用潜力,包括生产青霉素G 酰胺酶、β-淀粉酶和维生素B12等,目前该CFPS 平台被用于遗传元件的原型设计,蛋白质产量大约为70 μg/mL。Freemont 实验室[29]还构建了1 种基于芽孢杆菌WB800N 的CFPS 平台,能够表达0.8 µmol/L GFPmut3b,反应可持续几个小时。除酿酒酵母外,其他真菌细胞如毕赤酵母已投入CFPS 使用。毕赤酵母是学术界和生物制药行业中流行的重组蛋白表达宿主,可以合成复杂的治疗性蛋白质[30]。最近开发的新型酵母CFPS系统,通过菌株工程设计和调节,与野生型菌株相比重组蛋白的产量增加了3倍,人血清白蛋白的产量可达到48.1 μg/mL[31]。此外,其他非模式微生物已被用于各种新的CFPS 平台构建,比如古细菌,其中研究较多的为嗜热古细菌,可将其制备成细胞提取物,用于研究不同抗生素对古细菌翻译机制的影响。基于古细菌细胞提取物的CFPS 系统有望应用于热稳定蛋白质的合成,高温条件下可能有利于减少基因二级结构导致的翻译抑制。
1.2 植物提取物
植物细胞提取物研究最多的是小麦胚芽系统,该系统在真核无细胞蛋白表达方法中具有最优的翻译效率和产量。早在1964 年,Marcus 和Feeley[32]就开发了第1 个小麦胚芽无细胞翻译系统。1973 年Roberts 和Paterson[33]确立了商业化小麦胚芽CFPS系统中烟草花叶病毒RNA的有效翻译机制。与大肠杆菌相比,小麦胚芽提取物的制备过程需要去除各种抑制酶使得流程更加复杂。Madin 等[34]通过去除小麦胚芽中的胚乳和抑制剂等,以获得高活性的无细胞蛋白质合成系统。Endo小组[35]基于洗涤分选获得的小麦胚芽,开发了一种高产、持久的小麦胚芽无细胞系统,通过稳定化mRNA,在1 mL 反应体积中合成了高达10 mg的绿色荧光蛋白。
与其他CFPS 系统(例如大肠杆菌)相比,小麦胚芽系统在蛋白质表达方面具有多个优点,包括蛋白质可溶性的增强和毒性蛋白质的表达[36]。由于这些优点,小麦胚芽系统已被用于生产特异性单克隆抗体,探究病毒-宿主蛋白相互作用机制[37-38],合成疟疾疫苗[39],合成流感病毒全长血凝素和神经氨酸酶蛋白[40],合成膜蛋白细胞色素b5 复合物[41]。小麦胚芽系统作为先进的真核系统之一,已广泛用于蛋白质筛选、结构生物学、生物医药合成等方面。
除小麦胚芽细胞外,研究人员对基于烟草BY-2 和水稻细胞的CFPS 系统也进行了研究。小麦胚芽提取物制备过程需4~5 d,而烟草细胞仅需4~5 h 便可获得高活性提取物。有研究表明烟草提取物CFPS 系统不仅有利于合成翻译后修饰蛋白质,还有助于糖基化和二硫键形成[42]。基于水稻愈伤组织提取物的无细胞系统研究发现,通过强化翻译元件或分子伴侣、敲除翻译抑制蛋白(如核酸酶和蛋白酶)等,可以提高水稻愈伤组织无细胞(RCE)系统的蛋白质合成能力。
1.3 动物细胞提取物
动物细胞提取物主要包括兔网织红细胞提取物(RRL)、中国仓鼠卵巢(CHO)细胞提取物以及昆虫细胞提取物。动物细胞提取物的CFPS 系统,其显著特性是具备翻译后修饰功能,有利于真核来源蛋白质的合成[43]。昆虫细胞CFPS平台可用于生产细胞毒性蛋白质,可通过非天然氨基酸嵌入实现对蛋白质荧光标记[44]。
RRL 是20 世纪50 年代就成功构建的哺乳动物无细胞蛋白质合成系统[45]。RRL 虽然易于制备,但是局限性之一是蛋白质产量低。目前已提出几种用于增强蛋白质的合成的研究策略,例如在翻译系统中添加内部核糖体结合位点(IRES)提升蛋白质表达[46],或通过减少ATP 能量消耗使核糖体活性和蛋白质产量最大化[47]。RRL 系统可用于Sindbis 病毒蛋白合成[48];还可以通过将无核糖体的RRL 与人核糖体和体外转录的报告基因重新组装来评估核糖体的活性[49],有助于表征癌症中的核糖体功能;此外RRL 系统也广泛用于蛋白质-分子相互作用研究、筛选技术和展示技术。
CHO 细胞属于哺乳动物细胞,具有源自内质网的翻译活性微粒体结构,因此适合合成具有适当折叠和翻译后修饰的生物活性蛋白[50]。近70%的治疗性蛋白质是通过CHO 细胞合成[51],但是翻译起始的限制,使基于CHO细胞的CFPS系统的蛋白质产量较低。研究表明,基于CHO 细胞提取物的CFPS 系统因为待表达基因mRNA 的5′非翻译区中的IRES 元件能够以不依赖帽的方式启动翻译,使来自板球麻痹病毒(CrPV)基因组的基因间区域(IGR) 的IRES 显 示 出 最 有 效 的 翻 译[52]。Thoring 等[53]通过将包含微粒体组分的CHO 无细胞系统与连续交换无细胞反应(CECF)系统结合使用,可合成高达980 μg/mL的膜蛋白。CHO细胞常用于单克隆抗体(mAb)的合成[54],Martin 及其同事[55]通过调节氧化环境从而调节抗体重链和轻链质粒的表达来优化CHO细胞CFPS系统,可合成具有生物学活性的完整mAb(>100 mg/L)。总之,基于CHO 细胞提取物的无细胞系统可被广泛用于生产生物医药蛋白,特别是“难表达”蛋白质的合成。
昆虫提取物主要是指草地贪夜蛾(Sf21)的提取物,它是体内昆虫细胞合成蛋白质的有效手段之一。大肠杆菌和小麦胚芽系统产量虽高,但它们在合成复杂蛋白质和需要翻译后修饰和共翻译的蛋白质方面仍存在局限性[56]。昆虫提取物系统可以修饰真核蛋白质,例如蛋白质N-肉豆蔻酰化[57]、泛素化[58]、二硫键[59]、异戊二烯化[60]等。近年来,昆虫细胞CFPS 系统获得了进一步优化。例如衍生自Sf21 细胞的无细胞翻译/糖基化系统,提取物借助Mini-Bomb 细胞破裂室通过氮气压力处理制备,可稳定地保留翻译和翻译后修饰组分。然而通过高压氮来制备昆虫细胞提取物难以操作,为解决这一问题,另一粉纹夜蛾昆虫无细胞系统采用在提取缓冲液中冻融昆虫细胞的方法便于操作、降低成本,并通过进一步优化反应成分浓度及5′-非翻译区序列以增加外源蛋白质的产量[61]。最近,Quast等[62]通过使用CECF 反应模式,在含微粒体Sf21 无细胞系统中结合CrPV-IRES 介导的翻译,延长反应的时间,使蛋白质产量提高100倍以上,达到285µg/mL;该系统的主要特点是:其固有的真核翻译和折叠机制可以与具有翻译活性的内质网衍生微粒体相结合,从而形成正确折叠的功能蛋白质。
除上述3种提取物外,基于人类细胞系的细胞提取物也正在被研究和使用,如HEK293 细胞和HeLa 细胞。人类细胞系无细胞系统的特征与基于CHO 的无细胞系统相似,可以获得不同类型的翻译后修饰蛋白。人类细胞系CFPS 系统的一个主要优势是天然密码子的使用,从而促进了高分子量人类蛋白质的合成。此外,基于人类细胞系提取物CFPS 系统还适合于合成完整的病毒或病毒样颗粒。
1.4 PURE体系
无细胞蛋白质合成(CFPS)具有许多优势,包括更好地控制系统组分和配比。使用重组元素蛋白质合成(PURE)体系的CFPS 系统可强化系统组分控制,该PURE系统的开发理念是仅使用转录和翻译元件的纯化组分进行蛋白质的体外合成。使用PURE系统,所有元素都是已知的,无核酸酶和蛋白酶,并且可以优化每种元素的浓度以实现蛋白质最大程度的表达。这些重组元素包括起始因子(IF1、IF2、IF3),延伸因子(EF-Tu、EFTs、EF-G),释放因子(RF1、RF2、RF3),核糖体再循环因子,20 个氨酰-tRNA 合成酶,甲硫氨酸tRNA 甲酰基转移酶和焦磷酸酶。这些重组组分与从大肠杆菌分离的核糖体、tRNA、必需的NTP和氨基酸、ATP 生成催化模块和重组T7 RNA 聚合酶(RNAP)结合在一起,使用DNA 模板合成蛋白质[63]。此外,可在反应混合物中加入伴侣、热休克蛋白和其他因子,以保持蛋白质的可溶性并协助蛋白质折叠[64]。
与原始细胞提取物系统相比,PURE 体系是通过重建转录和翻译过程来实现的。PURE 体系完全定义了每个体系组分的类型和浓度,并最终将组分的数量最小化。因此,通过调节反应组分可以方便地对反应条件进行微调,在生化研究和蛋白质工程中具有很大的优势[10]。此外,PURE体系不存在核糖核酸酶和蛋白酶,因此,mRNA 可以作为翻译模板在体外合成在体内会快速降解的蛋白质[64]。上述优点使PURE 体系成为高度通用的蛋白质合成系统,有利于核糖核酸/蛋白质复合物的形成、易于降解的蛋白质或肽的合成、高通量筛选分析等[64-66]。然而,与细胞提取物系统相比,PURE 体系生产过程复杂且成本昂贵,需要对多种蛋白质进行大规模蛋白纯化,可以通过商业途径获得(PURExpress,New England Biolabs),但是高成本限制了其使用。目前已经有研究者试图降低其制造成本,比如Lavickova 和Maerkl[67]开发了一种简单且成本较低的PURE系统,该系统使用单个烧瓶共培养并诱导大肠杆菌的36 个蛋白质的全部单独表达,并一次性进行了纯化。
2 CFPS系统的反应模式
传统的无细胞反应模式包括两类:批式反应和连续交换反应系统[图4(a)、(b)]。批式反应装置简单,较易实现,所有的无细胞反应组分添加到一个试管中,可以快速合成目标蛋白质[8]。批式反应的这个特点使其适合快速表达蛋白质、自动化合成和筛选应用,特别是与PCR 产生的线性DNA 模板相结合快速合成蛋白质[68]。然而这种反应模式存在局限性,能量和氨基酸的消耗以及副产物的积累,特别是副产物对体外转录/翻译有抑制作用,使得产率低下[69]。为克服该缺点,设计了连续交换无细胞反应系统。该系统需要2 个隔室,由半透性透析膜隔开,CFPS 反应通过半透膜与富含反应物的进料溶液隔开,这样新反应物进入反应与副产物移出同时进行,而蛋白质产物保留在反应室中。使用该技术的无细胞表达反应可以保持数十小时,从而提高蛋白质的产率[70]。因此,连续交换无细胞系统有益于中国仓鼠卵巢、酵母和兔网织红细胞等低产量平台蛋白质产率的提高。
近年来,其他新兴的反应模式得到研究和应用,如套管模式(tube-in-tube)[图4(c)]和数字微流控(DMF)[图4(d)]模式。套管反应器使用半透膜内管(特氟隆AF 2400)和聚四氟乙烯外管组成,其内管具有高气体渗透性且不渗透液体,可以允许气体在不直接接触液体的情况下从气泵连续供应到内管的液体流中,由此可显著提高氧的传质速率,加快ATP 再生,与批式反应模式相比表达速率更快,有望成为一种灵活的按需蛋白质合成手段。DMF 模式通过计算机编程来控制Opendrop 板,使不同无细胞组分液滴从接地电极移动至驱动电极,从而使各组分聚合进而进行无细胞反应。DMF 技术可控制单个液滴的移动、混合、分离等,具有良好的交互性和灵活性,适用于复杂的液体处理方案,以进行高效的生物筛选和蛋白质合成。

图4 CFPS反应模式(a)批式模式。所有反应成分添加到一个管中进行,操作简单、便捷。(b)连续交换。通过半透膜,营养物质和产生的代谢副产物分隔开,克服了代谢产物对体系的抑制作用。(c)套管。气体通过气泵不断地泵入到内管中,显著提高氧的传递效率,提高产量。(d)数字微流控。数字微流控技术可控制单个液滴的移动、混合、分离等,具有良好的交互性和灵活性Fig.4 Modes for CFPS operation(a)Batch mode.All reaction components are added to one tube,which is simple and convenient for operating.(b)Continuous exchange.Through the semi-permeable membrane, nutrients are separated from the metabolic by-products, which overcomes the inhibitory effect of the metabolic products on the reaction.(c) Tube in tube.The gas is continuously pumped into the inner tube through the air pump, which significantly improves the efficiency of oxygen transfer and increases the output.(d) Digital microfluidic technology.It can control the movement, mixing, and separation of a single droplet,with good interactivity and flexibility.
此外,冷冻干燥(freeze-dried)技术可以保障细胞提取物在环境温度中长期储存。通常细胞提取物储存在−80 ℃左右,如在室温下仅储存1 周其活性就会下降50%,1 个月后所有活性都会丧失。相比之下,冻干提取物在室温下保存90 d 后仍然能保持约20%的活性。重要的是,冷冻干燥过程不会对反应产率产生负面影响,在冷冻干燥后直接进行CFPS 反应可以获得与水相反应相同的产率[71]。更重要的是,冷冻干燥无细胞反应系统可以克服冷链运输问题,以实现按需生物诊断传感、偏远地区的按需药物合成等[72]。
3 无细胞蛋白质合成系统的应用
CFPS 技术已实现了廉价且快速的重组蛋白质表达,其灵活性、可控性以及操作便捷等优势迅速扩大其用途并逐步商业化。目前,各种原核和真核生物的无细胞平台已经投入使用。在本节中,我们将重点介绍CFPS 系统在基因电路、蛋白质工程和人工生命体系构建中的应用及所取得的研究进展。
3.1 基因电路
生命有机体进化出复杂的基因代谢网络并与环境相互作用,由于合成生物学的迅速发展,各种模块化的基因元件已经从这些网络中鉴定出来,并被用于构建基因电路,包括拨动开关、振荡器、反馈回路和布尔逻辑门[73]。相比体内基因电路设计,使用CFPS 系统对基因电路进行建模设计具备许多优点:①基因元件和聚合酶浓度可控;②可定量且快速的报告测量;③可高通量方式评估更大的参数空间;④允许加速原型设计,更易对基因电路进行真正的模块化。基因电路快捷、高效,但在构建过程中,仍需要注意DNA 模板在长时间的操作中的遗传稳定性问题。
3.1.1 原型设计(图5)
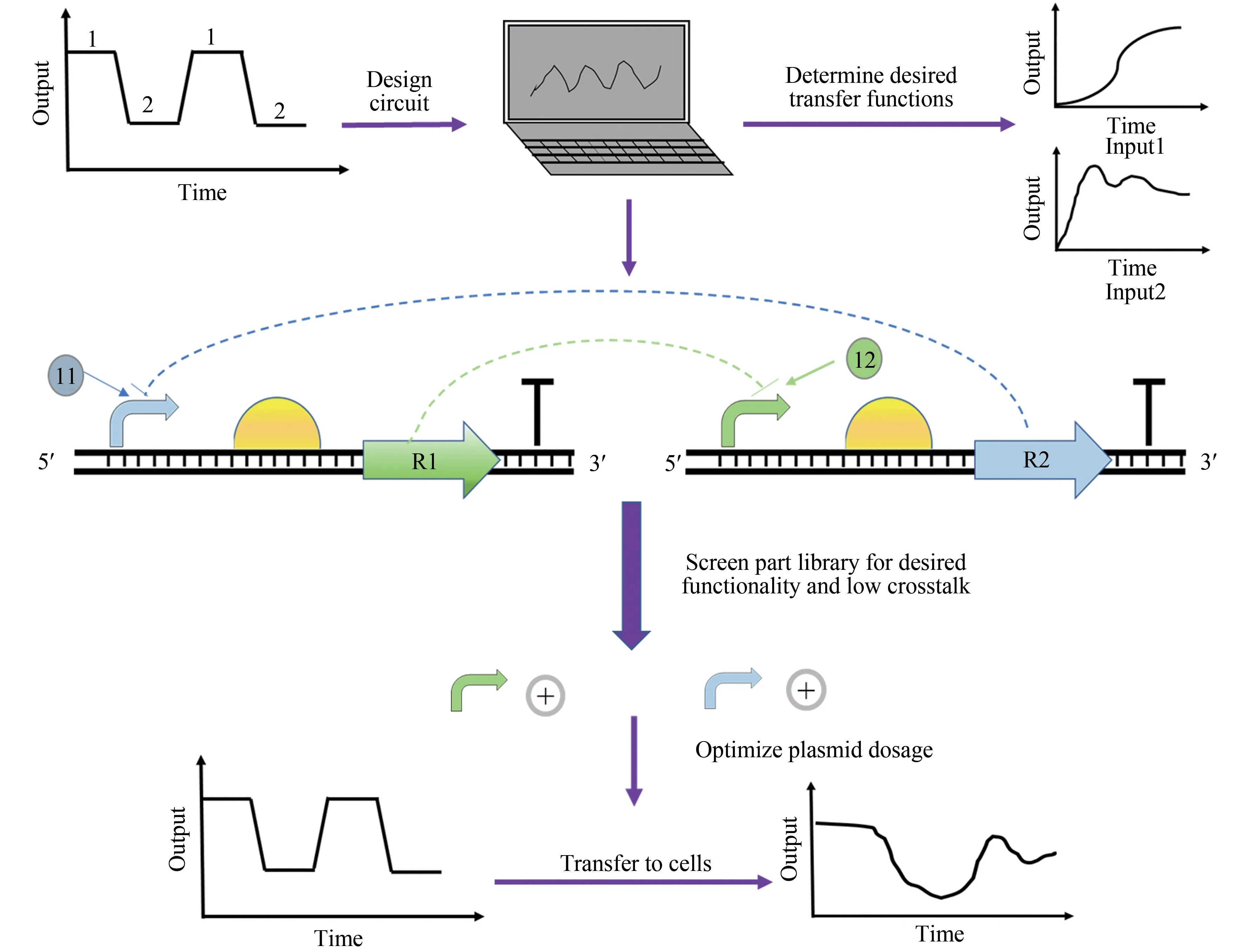
图5 基因电路原型设计(转录单位由单独质粒或线性DNA模板进行编码,可以作为逻辑门的类似物,然后通过无细胞基因表达反应在体外执行分子计算或遗传程序,以预测电路在电路在细胞中的功能)Fig.5 Prototype designs for genetic circuits(The transcription unit is encoded by a single plasmid or linear DNA template,which can be used as an analog of a logic gate,and then molecular calculations or genetic programs are performed in vitro through a cell-free gene expression reaction to predict the function of the circuit in the cell.)
除探测单个遗传元件功能外,基因电路系统还可以用来分析遗传元件在遗传控制网络或“电路”中如何共同发挥作用。利用无细胞策略已经组装和原型设计了许多基因电路,包括由正交聚合酶或Sigma 因子组成的级联电路[74]、溯源性调制器[75]以及RNA 和/或蛋白质介导的单输入模块、前馈循环和负反馈调节[76]、环形振荡器[77]等。Niederholtmeyer等设计了新型3、4和5基因环形架构,可实现电路元件的表征和完整基因网络的快速分析[77]。因此,使用无细胞系统替代正向工程范式可以准确地捕获细胞行为[78]。
3.1.2 生物传感
除了原型设计,生物传感器设计是基因电路的另一重要应用,其广泛应用于环境检测、疾病诊断等,具有灵敏度高、反应速度快的特点。目前生物传感器的类型主要包括酶催化法、酶联免疫法、全细胞传感器、金属纳米颗粒传感器和微流控生物芯片传感器等[79-81]。无细胞生物传感器具有与全细胞生物传感器相同的性能,但无细胞生物传感器稳定性更强且不存在生物安全问题,在医疗诊断和合成生物学方面已得到了广泛应用。Wen 等[81]优化了CFPS 中的模块化DNA 编码生物传感器(LasR 转录因子和启动子),用于检测人痰标本中铜绿假单胞菌感染的细菌标志物。Pellinen等[82]开发了一种利用MerR 作为识别元件来检测汞离子的无细胞生物传感器,与全细胞生物传感器相比(2~200 nmol/L),无细胞生物传感器提供了更宽的检测范围(1~10 000 nmol/L)。在张鹏等[83]针对光传感的研究中,蓝光调控的YF1/FixJ双组分系统被引入到大肠杆菌无细胞系统中来控制蛋白质的合成。
3.1.3 代谢工程
在过去的10 年时间里,代谢工程和合成生物学的快速发展推动了利用微生物细胞工厂生产化学品的应用研究。然而,由于细胞代谢的复杂性,优化代谢途径以获得最大产量是代谢工程面临的一个巨大挑战[84]。CFPS 为解决该生物制造的挑战性问题提供了可行方案,由此发展出来一个新兴的生物技术手段:无细胞代谢工程(cell-free metabolic engineering,CFME)。目前已经有人利用CFME 合成产物,例如李健课题组[85]利用CFME 生产缬氨霉素,产量可达30 mg/L。CFME优化代谢途径主要通过4个方面实现:优化细胞提取物的制备、能量板块的优化和设计、减少副产物的累积以及加快代谢工程的设计-构建-测试(DBT)周期。
激活细胞提取物中蛋白质合成能力在优化代谢途径中至关重要。通过优化细胞提取物的制备,可以激活无细胞合成系统的中枢代谢以此给无细胞蛋白质合成供应能量,而不是由磷酸烯醇式丙酮酸(PEP)等昂贵的化合物来供应能量,这样可大大降低成本[86]。Jewett 等[87]研究在反应中激活中枢代谢中的氧化磷酸化过程,蛋白质合成在2 h内可达到1.2 mg/mL。在代谢过程中,副产物的累积对合成影响较大,蛋白质合成过程中ATP 的水解副产物(无机磷)的累积会降低无细胞反应速率,同时会螯合反应必需的镁离子,抑制反应。考虑到这种抑制机制,Caschera 等[88]设计了含有麦芽糖和麦芽糖糊精的无细胞合成系统,可有效回收无机磷酸盐并通过糖酵解重新生成ATP。在优化代谢途径的过程中,迭代DBT 周期比较费时。最初CFME 使用纯化的酶组装代谢途径,但通过细胞表达和纯化获取每一条代谢途径的酶费时费力。为加快代谢工程的DBT 周期,Jewett 小组[89]构建了一种新的CFME 框架,在基于细胞提取物的CFPS 系统中通过添加DNA 模板原位表达不同代谢途径的酶,以加速DBT 循环。后续工作需要将数学模型与CFPS 相结合,进一步加速合成生物学设计。
3.2 蛋白质工程
图6示出了无细胞蛋白质工程的应用。
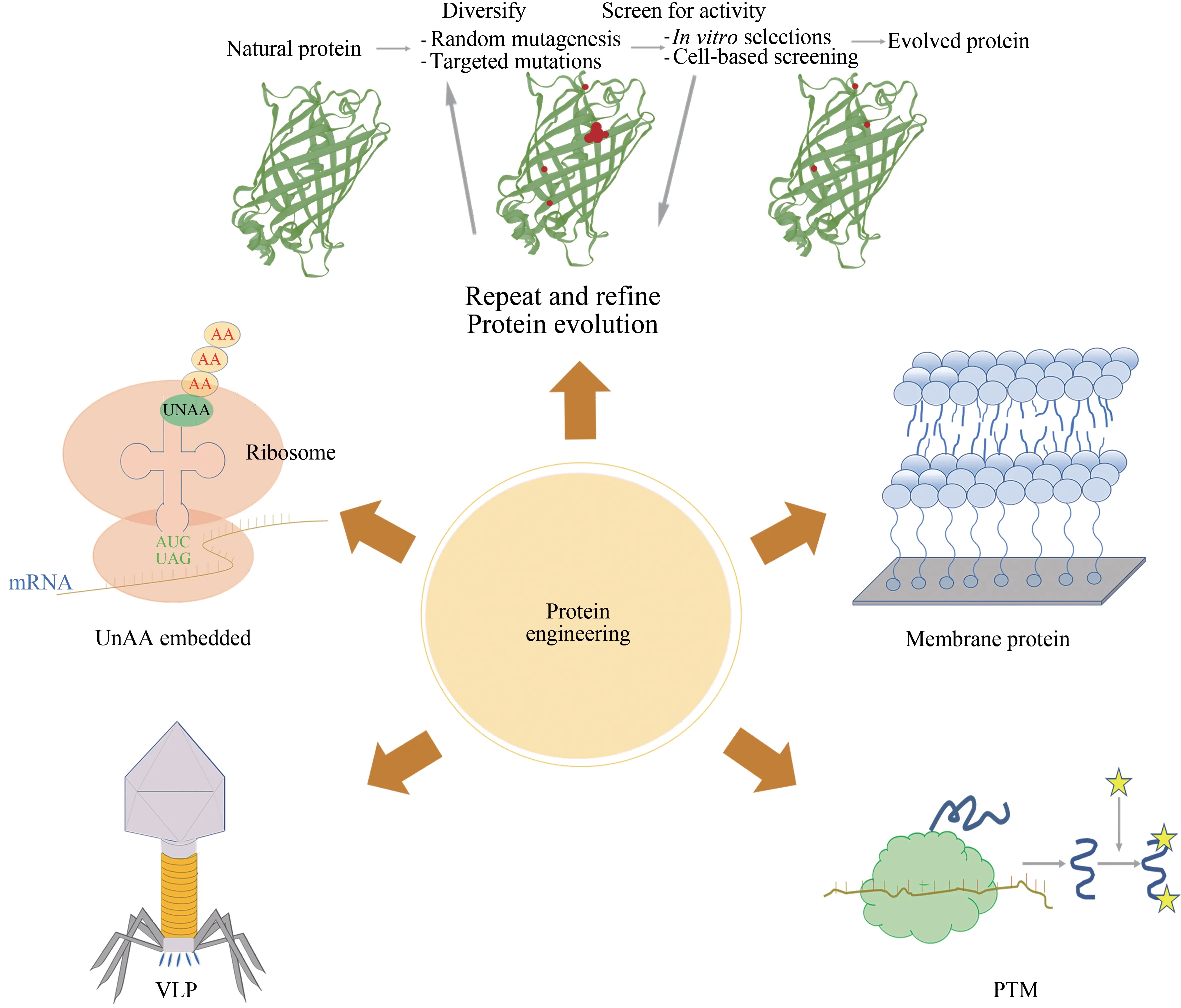
图6 无细胞蛋白质工程的应用(无细胞蛋白质工程的应用主要包括:膜蛋白、类病毒颗粒、翻译后修饰、非天然氨基酸的嵌入和蛋白质进化)Fig.6 Applications of cell-free protein engineering(The applications of cell-free protein engineering mainly include membrane proteins,virus-like particles,post-translational modification,unnatural amino acid intercalation,and protein evolution)
3.2.1 膜蛋白
膜蛋白在生物体的许多生命活动中起着非常重要的作用,如细胞的增殖和分化、能量转换、信号转导及物质运输等。膜蛋白占目前药物靶蛋白的60%以上,约占细胞蛋白质组的30%。由于其复杂的结构、疏水跨膜区域、对宿主的毒性、低效的折叠步骤,使得它们在胞内难以大量表达[90]。CFPS 系统由于反应条件可控和高的毒性耐受性等特点,已发展成为重要的膜蛋白质表达手段。传统的手段是在合成系统中添加脂质、洗涤剂胶束等助溶膜蛋白质,但存在蛋白质构象改变的问题。为有效解决上述问题,采取的手段包括双酚增溶[91]、利用纳米脂蛋白颗粒(NLP)(或称为“纳米盘”)等[92],而这些技术很容易和CFPS系统相结合。其中以NLP 为代表的人工膜结构可以使膜蛋白质稳定在原生状态,已经成为膜蛋白表达的重要手段[93]。将NLP 材料与CFPS 系统相结合,已成功表达出一些GPCR蛋白质,包括细菌视紫红质(BR)、人神经激肽(NK1R)、人β 肾上腺素能(β2AR)和人多巴胺(DRD1R)受体等[94-95]。ERBB 蛋白家族是癌症治疗的药物靶点,通过无细胞表达和NLP 技术的结合,成功表达合成了全长的ERBB受体,对推动靶点药物的发现具有重要意义[96]。虽然NLPs提供了一个高度灵活的平台来辅助功能性膜蛋白正确折叠,但需要注意的是膜蛋白-NLP复合物在形成后可能会稳定数天,但这种复合物在溶液中的长期稳定性仍然存在问题。冷冻干燥是NLP 复合物长期保存的一种可能方式,但还需进一步研究。
3.2.2 类病毒颗粒
类病毒颗粒(virus-like particles,VLPs)是缺乏基因组材料的病毒衣壳,它和病毒结构相似,但因其不具有病毒基因所以无感染性,以及表面可多价展示抗原从而增强免疫原性的特点,已被广泛应用于疫苗、药物递送、显像剂、生物催化、纳米电子学应用等研究[97]。虽然胞内合成类病毒颗粒已研究多年,但仍存在产量低、稳定性较差、表达哺乳动物病毒蛋白复杂、纯化困难等问题[98]。相比之下,CFPS 系统具有显著优势,包括通过有效调控反应环境条件促进颗粒组装[99]、操纵氧化还原环境生成稳定二硫键、通过正交翻译系统与非标准氨基酸相结合等方式可以实现类病毒颗粒的功能化修饰[100],从而实现VLP 高效、稳定性合成。目前多种CFPS 平台已被用于生产不同的VLPs,包括大肠杆菌、HeLa、酵母和兔网织红细胞CFPS 系统[8]。从大肠杆菌和RRL 提取物CFPS系统中已经成功合成乙型肝炎病毒核心抗原VLP[101];人 乳 头 瘤 病 毒L1 VLP 已 在 酿 酒 酵 母CFPS系统中成功合成[102];基于HeLa细胞的CFPS平台已被用于脊髓灰质炎病毒的合成[89];兔网织红细胞CFPS 也用于HIV Gag 蛋白病毒组装[103];大肠杆菌CFPS 平台还可合成全功能活性的T7 和T4噬菌体[104]。
3.2.3 翻译后修饰
蛋白质翻译后修饰(post-translational modification,PTM),可以极大影响蛋白质的折叠、活性和稳定性,在多种细胞功能和生物过程中发挥着重要作用[105]。对PTM 效应进行系统研究的关键是获得具有明确基团修饰的重组蛋白质,这在异源宿主中通常是很难实现的。相比之下,CFPS 系统的灵活特性允许其组分的加/减,为蛋白质折叠和精准化修饰提供了可控环境。目前已发现200多种不同的官能团修饰类型,常见的PTM 形式有糖基化、磷酸化、甲基化、乙酰化、泛素化等。在这里着重介绍糖基化和磷酸化这两大主要的PTM 修饰在CFPS中的研究和进展。
蛋白质糖基化修饰发生在约50%的真核蛋白质上,大多数临床前和FDA 批准的生物医药上都具备糖基化修饰,深刻影响蛋白质折叠、稳定性和免疫原性。但由于细胞代谢的复杂性和干扰,在细胞中构建和测试确定糖基化修饰的糖蛋白仍然具有挑战性[106]。在无细胞糖基化系统GlycoPRIME 中,糖基化途径通过混合和匹配糖基转移酶、将结构明确的糖片段修饰在蛋白质靶标上,已成功合成含有最小唾液酸修饰的抗体[107];并在无细胞系统中成功构建多个天冬酰胺N-糖基化途径,实现了约1 g/L的糖基化蛋白质合成[108]。
磷酸化修饰是继糖基化修饰后的第二大类蛋白质修饰,然而由于技术限制,无法以高纯度和高产量生产具有特定磷酸化状态的磷酸化蛋白,使用CFPS 平台可以显著提高磷蛋白合成的产量和产率。使用基于基因重编码大肠杆菌提取物的CFPS 系统,可特异性将磷酸丝氨酸嵌入人促分裂原激活的ERK 激活激酶1(MEK1),高量合成磷酸化的活性MEK1[109],其产量远高于胞内合成系统[110]。
除了上述通过外源添加方式实现精准的PTM,另外已经有多种类型CFPS 平台利用提取物中存在的天然后修饰酶系进行蛋白质翻译后修饰。这使得中国仓鼠卵巢、HeLa和昆虫等真核生物CFPS平台非常适合这一应用[111]。在兔网织红细胞CFPS平台上,已经研究了各种PTM,包括糖基化、信号蛋白的裂解、预烯化和二硫键的形成[112]。昆虫细胞CFPS 系统含有内源性微粒体,允许信号肽切割、糖基化、磷酸化、N-肉豆蔻酰化、N-乙酰化、异戊烯基化和泛素化[113]。值得注意的是,具有增强折叠活性的CFPS 系统也成功应用于合成具有多个二硫键的活性蛋白质,如纤溶酶原激活剂[114-115]、尿激酶蛋白酶[114-116]、各种抗体[117-119]、病毒样颗粒[120]。此外,短小抗菌肽,例如富含半胱氨酸的阳离子β-防御素-2(HBD2),也可以利用CFPS 系统生产和正确折叠[121]。
3.2.4 非天然氨基酸嵌入
基于非天然氨基酸的蛋白质合成是目前基础和应用科学研究的一个活跃领域。由于天然氨基酸侧链功能基团的有限性,单靠20 种标准氨基酸已不能满足基础和应用科学日益增长的需求][122-123]。 利 用 改 造 过 的 正 交 翻 译 系 统(orthogonal translation system,OTS)的氨酰tRNA合成酶和tRNA 可以引导具有特殊结构或功能侧链基团的非天然氨基酸(unnatural amino acid,UNAA)嵌入目标蛋白的特定位点,从而对合成蛋白的功能进行改造[124]。迄今已有超过150 种非天然氨基酸可以引入生物体内,其中大多数非天然氨基酸是天然氨基酸的衍生物[125]。相比细胞体系,CFPS 具有以下几种优点:①无需考虑UNAA膜转运等问题[126],不受复杂的物质代谢干扰,所有资源都用于目标蛋白的合成;②可以合成有毒且难以在细胞系统中表达的蛋白质[127];③提高合成效率、保真度,实现更广泛的特异性[121]。到目前为止,通过CFPS 系统已经将超过150 种UNAAs纳入到多肽中[128]。
近几年,UNAA 嵌入技术在CFPS 中已经取得了突破性的进展。例如利用多联密码子手段突破了琥珀抑制只能单一嵌入的局限,允许将非天然氨基酸多次嵌入同一蛋白质中。Neumann等[129]在体外翻译系统中,通过四联密码子手段实现了将多个不同UNAA 结合到单一多肽中。此外,利用非天然碱基手段将UNAA 嵌入蛋白质是该领域的前沿方向,如Zhang 等[130]将含有非天然碱基dNaM 和dTPT3 的DNA 在体内转录成两个具有不同非天然密码子的mRNAs 和具有同源非天然反义密码子的tRNAs,在核糖体的有效解码下成功将非天然氨基酸嵌入绿色荧光蛋白,这对遗传信息的存储以及创造新的生命形式具有重要意义。
非天然生物药物蛋白在生物医学领域引起了极大的关注。在抗体-药物偶联物(antibody-drug conjugate,ADC)的开发中,CFPS 为抗体和抗癌药物之间的稳定连接提供了更有效的UNAA 嵌入和偶联方法[131]。UNAA 的嵌入被用于研究功能性人表皮生长因子受体的配体非依赖性二聚化[132]。此外,由D-氨基酸组成的镜像蛋白质或肽是CFPS系统的另一个新兴研究领域。在蛋白质或多肽中引入D-氨基酸可以改变功能,已经有研究工作者设计出与D-氨基酸兼容的新型核糖体翻译系统[133]。研究人员还成功地将多达10个D-丝氨酸引入多肽中,成功表达了含有5 个D-氨基酸的环肽[134]。同时镜像蛋白或多肽在药理上展现出的特殊性也显示出其潜在的应用价值[135]。随着UNAA嵌入平台技术的发展,在分子成像、蛋白质相互作用、生物防护、生物材料、治疗性蛋白和具有新型结构功能生物催化剂等方面展现出重要的研究价值[136]。但需要注意的是为提高UNAA 的精准嵌入,无细胞体系的添加顺序不容忽视,一般先将OTS 组分提前混匀,然后加入无细胞体系,最后再添加细胞提取物。
3.2.5 蛋白质进化
定向进化是在有机化学和生物技术应用中广泛使用的蛋白质工程手段[137]。蛋白质定向进化以相当快的方式模拟自然进化过程,一个由起始酶突变体组成的大型文库在选择压力下经过几轮迭代诱变,进而选出最能实现预期功能的酶[138]。蛋白质体外定向进化的第1步是获得突变体库,获取突变的诱变方法包括随机诱变、位点定向诱变和位点饱和诱变[139]。第2 步是结合蛋白质结构已有知识和计算工具对酶的特定功能和性质进行选择性筛选,从而定向选择所需的非天然蛋白质[140]。此类蛋白质通常具有更高的活性、更强的稳定性等优良性能,具有重要的工业催化酶应用价值。由于无细胞蛋白质合成体系的开放性、可控性等,通过对酶进行灵活修饰,可以改善酶的特异性、活性、效率、分泌性和稳定性等参数,从而提高合成和筛选效率。
近些年,蛋白质定向进化已经在新型蛋白质的构建以及改善酶性能方面取得了突破性进展。由于膜蛋白的毒性或特殊结构性质,膜蛋白的体内定向进化一直极具挑战性。脂质体展示作为一种新的方法,能够在体外定向进化有毒的整膜蛋白。该方法创建了巨型单层脂质体,并将单分子DNA 表达模板与无细胞翻译系统一起包裹,每个脂质体具备单个变体的多个拷贝;反应发生后,可将蛋白质活性与荧光信号相关联,通过流式细胞荧光分选技术(FACS)进行后续分选;应用这种方法可进化出一种溶血素突变体,活性是野生型的30倍[141]。也可通过理性设计与定向进化相结合的方式进行突变库创建和筛选,一个例子是通过定向进化优化计算设计和筛选获得的Kemp 消除酶突变体,反应速度提高了6×108倍[142]。此外,将无细胞转录翻译系统整合到高通量筛选应用中,可以实现多肽和蛋白质的原位和按需表达。与现代微流控技术相结合,无细胞合成方法可以在短时间内以最小的体积筛选、定向进化和选择所需的生物分子[143]。如今,生物催化产业的研究重点是提高酶的活性、稳定性、功能表达和细胞定位等,无细胞合成系统的参与节省了时间成本,并允许创建“更智能”的突变库和更有效的筛选方法,为蛋白质定向进化的发展提供了新的前景和突破点。
3.3 人工生命体系的构建
3.3.1 噬菌体的合成
由于噬菌体对宿主的极端特异性,以及显示出作为抗菌剂和细菌诊断的巨大医学潜力,噬菌体目前已经广泛应用于抗菌剂的研发、细菌诊断、疫苗研发、噬菌体聚合酶的合成以及用作遗传可编程生物材料的支架等多个方面,并且在定向进化研究中发挥重要作用。然而,大多数噬菌体的基因组太大(>20 kb),很难在体外进行操作,而且对细菌宿主是致命的;体外转录翻译无细胞表达系统,为噬菌体的合成和改造提供了更精确控制的可能性[3]。例如在活体噬菌体的改造方面,借助无细胞转录翻译系统,可成功合成T7、ΦX174等功能性噬菌体[144]。
3.3.2 人工细胞的构筑
构建具有生命基本特征的人工细胞是合成生物学领域的一大挑战(图7)。由于合成人工细胞需要涉及物理、化学、生物学等多种学科的专业知识,至今对其仍然没有一个明确的定义。尽管生命系统具有高度的内在复杂性,但一般认为具备5 个共同特征:区室化、生长分裂、信息处理、能量转导和适应性[145]。利用分子生物学工具和方法,自下而上将功能分子组装成人工细胞,虽可实现基本的生命特征,但在实现自组装、自我繁殖等方面面临重大挑战[146]。目前大量利用无细胞转录翻译系统模拟细胞结构和特征的工作已经开展,如分子拥挤、区室化、基因噪声、网络、动态行为和细胞通讯,致力于构建更“完美”的人工细胞[147]。
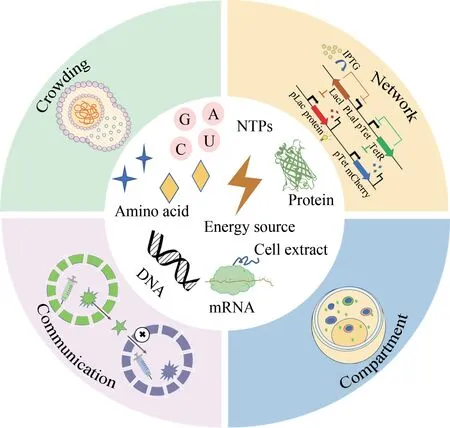
图7 人工细胞的构建(分子拥挤、区室化、基因噪声、网络、动态行为和细胞通讯是维持一个细胞正常生命活动所必须的结构和功能特征,能有效调控操作细胞的正常运行)Fig.7 Construction of artificial cells(Molecular crowding,compartmentalization,gene noise,networks,dynamic behaviors and cell communications are the structural and functional characteristics necessary to maintain the normal life activities of a cell,which can effectively regulate and operate the cell )
区室化的存在为本身无序的生命代谢过程在空间和时间尺度上进行有序调节,从而加快了生命代谢过程效率。区室化的构筑常需要借助天然或非天然材料,以达到不同的人工细胞构筑需求或目的。脂质体因其良好的生物相容性、生物可降解性、易制备和高包封性等特点[148],最常用来构筑人工细胞[149]。高分子材料因为具备较强的稳定性,并可通过温度或化学梯度从外部刺激响应,从而可以构筑响应于生物物理条件的人工细胞[150];例如Mann团队[151]最近成功构筑了基于高分子材料的人工细胞,进而组装成人工组织结构。具备较高生物相容性的水凝胶材料,与脂质体或高分子材料相比,在形成多区间结构微环境时更具优势[148]。凝聚体(coacervates)是Mann 团队首创的一类材料,没有隔室边界,可通过化学键和相分离自发地隔离化学物质从而形成区室化[152]。在区室化构筑的研究中,研究最多的是基于囊泡和人工制备脂质体的人工细胞,脂质囊泡可以高效地包裹无细胞系统实现蛋白质的表达[153],从而形成高效可控的人工细胞系统[154]。此外,微流控技术可以通过调整流速和通道尺寸精确控制液滴大小和形状,在人工细胞构筑方面受到越来越多的关注。Elani 等[155]利用微流体技术生成复杂的混合细胞仿生系统;Trantidou等[156]构筑的人工细胞,可实时监测外部环境中的乳酸,展示了作为生物传感器的潜在应用价值。
拥挤效应和调控表达在人工细胞内部的无细胞转录翻译系统的调整优化中起到至关重要的作用。分子拥挤被认为是维持基因表达动态平衡的重要机制,在存在分子拥挤的情况下,蛋白质的紧密排布可以增强与底物的亲和力,影响人工细胞中发生的酶反应,以增强基因表达的稳健性。但利用不同的拥挤剂可能会导致不同的结果,高浓度的拥挤剂会对蛋白质的表达产生不利的影响。由多个生物大分子组成的无细胞系统本身可作为拥挤剂,以构建真实的细胞内部环境[157],将无细胞系统直接封装到人造细胞中作为“天然”细胞内部状态[158]。基因表达调控是控制细胞内部有序活动的核心,基因表达噪声在原核细胞和真核细胞中普遍存在,但即使来自同一种属的两个独立细胞的表达率也是不同的[105]。无细胞转录翻译系统提供了一个简化的细胞内环境,避开了不需要的噪声源和一些复杂的因素;无细胞系统中的质粒DNA 允许开放的基因网络设计,因此可以被操纵来研究基因表达噪声。在Huck 及其同事[159]的工作中,他们将包含两个基因的无细胞系统封装到液滴中,通过微流控方法获得人工细胞群,进而研究揭示基因表达噪声和物理环境之间复杂的相互作用。基因调控网络是调控系统的核心,各种基因元件如转录因子、触发开关、前馈环路等已经在无细胞系统中被构建和制造,包括σ 因子[160]、负反馈元件[161]等,这些基因元件允许构建具有复杂行为的人工细胞内部调控网络,如与门、多阶段级联和负反馈环[162]。在操控人工细胞内的组织和结构时,一般可使用光学和磁性镊子,但需要更好的控制措施,因为粒子的引入可能具有极大的破坏性[148]。
细胞通讯或信息传递作为生命体系的重要特征,亦是人工细胞构建的主要目标之一,通常通过物理或化学信号递送来实现。Aufinger 和Simmel[163]在液滴包裹的无细胞转录系统中,实现了mRNA 分子在两种类型的无膜琼脂糖凝胶之间进行信息通讯。Adamala 等[164]在脂质体上嵌入孔道蛋白,由此来启动胞内外信息传递和人工细胞内部信息调控。除通过对膜操作进行信息传递外,在人工细胞内部,亦可通过温控核糖体开关等实现信息调控[165]。
随着基于无细胞转录翻译系统的人工细胞的发展,从进化生物学基础研究到生物医疗应用研究都得到广泛拓展[148]。Yomo团队[166]通过使用基于磷脂的囊泡展示了原始细胞的生长-分裂机制;人工细胞的发展还推动了无细胞生物传感的研究[167];在医学领域,可将人工细胞构筑用于药物筛选[148]。然而,要真正实现“完美”人工细胞的构建,还需要实现自我复制、新陈代谢和信息处理等复杂功能,这仍然需要未来在相关领域的进一步拓展。
4 挑战与展望
综上所述,无细胞蛋白质合成系统作为一种强大的合成生物学技术平台,因其开放性、可控性、高效性、灵活性等诸多优点,在过去5~10年时间里得到了多样化的大力发展,其应用跨越了生物制造、生物催化、生物医药、生物传感、人工细胞等重要基础和应用研究领域。各种不同的CFPS 技术平台进一步使具有不同复杂性和物种来源的蛋白质的体外生产成为可能。然而,无细胞蛋白质合成系统的发展中,仍然面临诸多挑战。
规模化和成本是工业制造中的两大关注点。该系统的进一步发展需要无细胞蛋白质生产系统规模的扩大。一些难合成蛋白质的生产离不开动物和昆虫细胞提取物,而这些提取物的制备较为繁琐,有些耗时较长,是扩大工业化生产有待解决的一大问题。同时,一些应用的发展常常受到试剂费用的限制。例如,在大肠杆菌CFPS 系统中,如果以质粒为表达模板,以葡萄糖为供能系统,合成非天然绿色荧光蛋白每100 μg 的总成本为0.658 美元[168]。为进一步提高产量、扩大生产规模,可从以下几个方面寻求解决策略:简化提取物制备程序、开发蛋白质合成的新能源再生系统、稳定底物供应和制备高效的正交翻译系统。
在未来的发展中,无细胞体系需要进一步优化以提高效率、降低成本,同时提高生物大分子(RNA 和蛋白质)合成的个性化、多样化、普适性和稳定性;无细胞系统的使用寿命需进一步延长,需要朝着能够实现自我复制的无细胞合成系统迈进;需要进一步融合先进材料学、人工智能和生物医学等多学科领域,展现出无细胞合成系统更广泛的应用潜力。

