TTC法测定菘蓝种子生活力的优化
吴红,卢军锋,韩大雷,赵嘉豪
(1.江苏农牧科技职业学院 园林园艺学院,江苏 泰州 225300;2.江苏中药科技园,江苏 泰州 225300;3.民乐县诚泰药业有限公司,甘肃 民乐 734500)
菘蓝(Isatisindigotica)为十字花科菘蓝属二年生草本植物,其干燥根入药即为板蓝根,有清热解毒、凉血、利咽的功效;其干燥叶入药即为大青叶,主治热毒发斑、丹毒、咽喉肿痛、口舌生疮、疮痈肿毒等症[1]。菘蓝作为大宗药材板蓝根和大青叶的基源植物,在全国范围内广泛种植。近些年来,市场上以菘蓝根和叶为主要原料的板蓝根颗粒、大青叶片、板蓝根凉茶等销售量大涨,对原药材的需求急剧上升,导致中成药生产及临床应用供不应求的困境[2]。当前国内对菘蓝的化学[3]和药理[4],以及栽培技术[5]等方面进行了研究,对种子的研究多集中在种子分级标准和种子逆境生理方面,如对菘蓝种子抗旱性的研究[6],盐碱胁迫对菘蓝种子萌发的研究[7],微波辐射菘蓝种子的生物学效应研究[8]。
目前关于菘蓝种子生活力尚无专门的报道。种子生活力是指一定条件下种子维持生活力的最长期限,是指种子生命的有无,种子生活力有别于种子的萌芽率[9],在菘蓝的资源研究中我们发现种子发芽率的高低取决于种子的生活力和种子的休眠两个方面,生产上菘蓝主要以种子进行繁殖。种子生活力直接关系到种子的质量和经济效益,因此,在菘蓝种子交易和种植过程中需要一种快速而准确的生活力鉴定技术。本试验以菘蓝种子为材料,采用2,3,5-氯化三苯基四氮唑(TTC)染色法,设置不同的染色时间、染色温度、TTC浓度,采用单因素试验和正交试验设计,对菘蓝种子生活力进行测定,并对测定方法进行优化,以期为菘蓝种子快速测定和种子质量检测提供技术支撑。
1 材料与方法
1.1 材料
菘蓝种子为植物学果实(角果),本试验所用种子(果实)采自甘肃省民乐县三堡镇(37°56′19″~38°48′17″N、100°22′59″~101°13′9″E,海拔2 029 m),于2019年7月下旬整个果穗变紫色时剪下整个果枝,晾晒1~2 d后,碾压、筛选,自然干燥后挑选饱满种子置于牛皮纸袋内存于0~4 ℃冷库。次年初进行试验。
1.2 方法
1.2.1 种子处理
选取低温保存的种子,去除杂质,先用自来水流水冲洗10 min,再用蒸馏水冲洗3次,将冲洗干净的种子室温下置于蒸馏水中浸泡12 h,加水量以没过种子为宜。
1.2.2 种子染色
用手术刀划开种皮,取发育良好、无损伤的种胚,置于磷酸缓冲液(pH 7.0)中保存备用。染色时取出准备好的种胚,蒸馏水冲洗后用滤纸吸干表面水分,置于培养皿中,倒入TTC染色液溶液,染色液量以没过种胚为标准,培养箱中避光培养结束后取出种胚,蒸馏水冲洗后滤纸吸干表面水分,最后根据染色深浅和染色面积大小判断种子生活力。
1.3 处理设计
1.3.1 单因素试验
染色温度。菘蓝种子吸水膨胀后,剥取完整种胚60粒,置于培养皿中,每皿20粒,3次重复,加入浓度为0.5%的TTC溶液,后分别置于20、25、30、35和40 ℃的培养箱中染色2 h后测定菘蓝种胚活力。
染色时间。菘蓝种子吸水膨胀后,剥取完整种胚60粒,置于培养皿中,每皿20粒,3次重复,加入浓度为0.5%的TTC溶液,置于30 ℃的培养箱中分别染色1、1.5、2、2.5和3 h后测定菘蓝种胚活力。
TTC浓度。菘蓝种子吸水膨胀后,剥取完整种胚60粒,置于培养皿中,每皿20粒,3次重复,分别加入浓度为0.1%、0.3%、0.5%、0.7%和0.9%的TTC溶液,后置于30 ℃的培养箱中分别染色2 h后测定菘蓝种胚活力。
1.3.2 正交试验
在上述单因素试验结果的基础上,以染色温度、染色时间和TTC浓度为因素,采用3因素3水平正交试验设计法,考察影响菘蓝种胚染色的主要因素,每皿20粒,3次重复。1、2、3水平,染色温度分别为25、30和35 ℃,染色时间分别为1.5、2.0和2.5 h,TTC分别为0.3%、0.5%和0.7%。
1.3.3 染色后观察
无色的TTC进入种子胚后,种子胚内的细胞呼吸代谢产生的还原型辅酶Ⅱ(NADPH)还原呈现红色,对染色后的胚观察并记录,胚全部或绝大部分染成鲜红色或大红色为有生活力种子,只有少部分胚染色或大部分染色为淡粉红色为低活力或无生活力种子。
1.4 数据统计与分析
试验数据采用Microsoft Excel及DPS v7.05进行分析和作图,各处理采用LSD法进行差异显著性分析。
种子生活力=胚被染色的种子数目/供试种子数目×100%。
2 结果与分析
2.1 菘蓝果实和种子形态特征
植物学上的种子和农业生产上的种子含义不同,本试验采用种子是菘蓝植物学上的果实(角果),长圆形,扁平,翅状,表面紫褐色或黄褐色,稍有光泽,先端微凹或平截,基部渐窄,具残存的果柄或果柄痕;内含1~2粒种子,为植物学上真正的种子,由胚珠发育而成。种子长椭圆形,成熟时表面黄褐色,基部具有一小尖突状种柄,两侧面各具较明显的纵沟(胚根与子叶间形成的痕)及一不甚明显的浅纵沟(两子叶之间形成的痕),千粒重为8.74 g,种子纵径比为2.03;种子由种皮和胚两部分组成,种皮褐色膜质化,子叶为折叠型,子叶两枚,较大,对折包在种皮中,背倚于胚根,胚根圆柱状(图1)。

图1 菘蓝果实、种子和胚形态
2.2 菘蓝种子生活力测定单因素试验
由表1可以看出,在20~40 ℃温度下,随着TTC染色温度的增加菘蓝种子的生活力也增加,在40 ℃时达最大,为71.42%;其后依次为35 ℃和30 ℃处理,分别为70.18%和68.31%;生活力最小的是20 ℃处理,生活力为50.88%,25 ℃处理时生活力为60.48%,方差分析表明20 ℃、25 ℃和30 ℃处理之间差异达极显著水平;在20~40 ℃温度内,随着TTC染色温度的增加,种胚颜色逐渐加深,从粉色、粉红色再到红色,但在40 ℃时种胚呈现深红色,表明种胚生活力下降。因此,本研究表明,菘蓝种子生活力测定的TTC最佳温度为30~35 ℃。

表1 菘蓝种子生活力与染色温度的关系
由表2可以看出,在1~3 h随着TTC染色时间的延长,菘蓝种子的生活力也增加,在染色3 h时生活力为80.68%,与染色2.5 h(80.39%)结果接近,且方差分析表明两组间差异不显著;在1.0~2.5 h处理时生活力增加幅度较大,方差分析表明各处理之间差异极显著;显色结果表示,TTC染色2.5 h时种胚颜色呈红色,但在3 h时种胚呈现深红色,表明种胚生活力开始下降。因此,本研究表明,菘蓝种子生活力测定的最佳TTC染色时间在2.5 h左右。
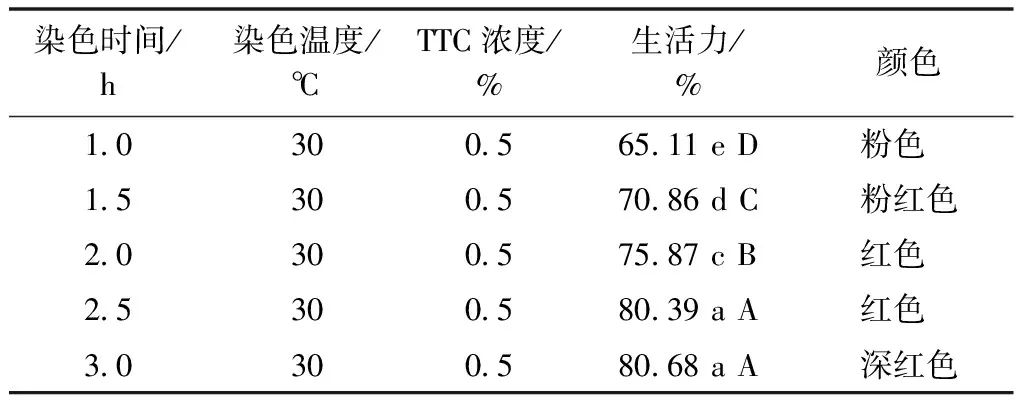
表2 菘蓝种子生活力与染色时间的关系
由表3可以得出,菘蓝胚的生活力随着TTC浓度的升高而升高,在0.1%~0.5%,增加幅度较大,方差分析表明TTC浓度为0.1%~0.5%,各处理组间生活力差异达极显著水平;TTC浓度在0.5%~0.9%,各处理组生活力增加幅度较小;生活力最小的是TTC浓度为0.1%处理组,种子生活力为46.51%;显色结果表示,TTC浓度0.5%~0.7%时种胚颜色呈红色,但在0.9%以上时种胚呈现深红色,表明种胚生活力开始下降。因此,本研究表明,菘蓝种子生活力测定的最佳TTC浓度在0.5%~0.7%。
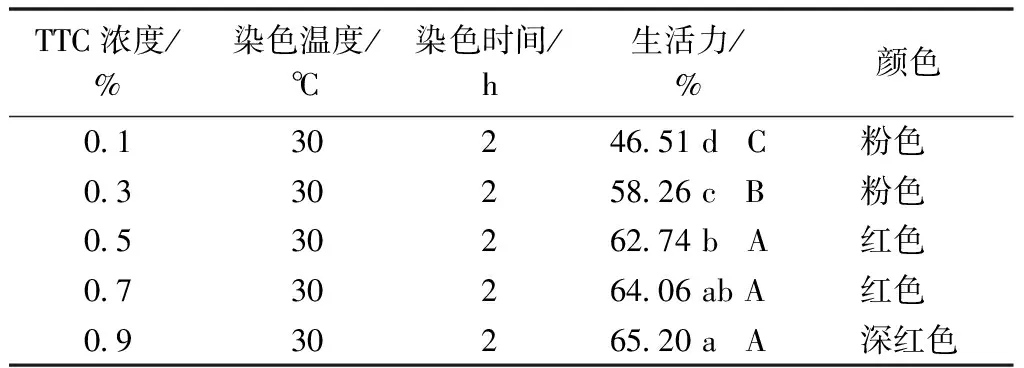
表3 菘蓝种子生活力与TTC浓度的关系
2.3 菘蓝种子生活力测定正交试验
染色时间、染色温度和TTC浓度是影响种子生活力快速测定效率的主要因素[10],本试验在分析单因素试验结果的基础上,选择以上3个因素进行三水平正交试验设计,从而优化菘蓝种子TTC染色法的技术参数(表4)。
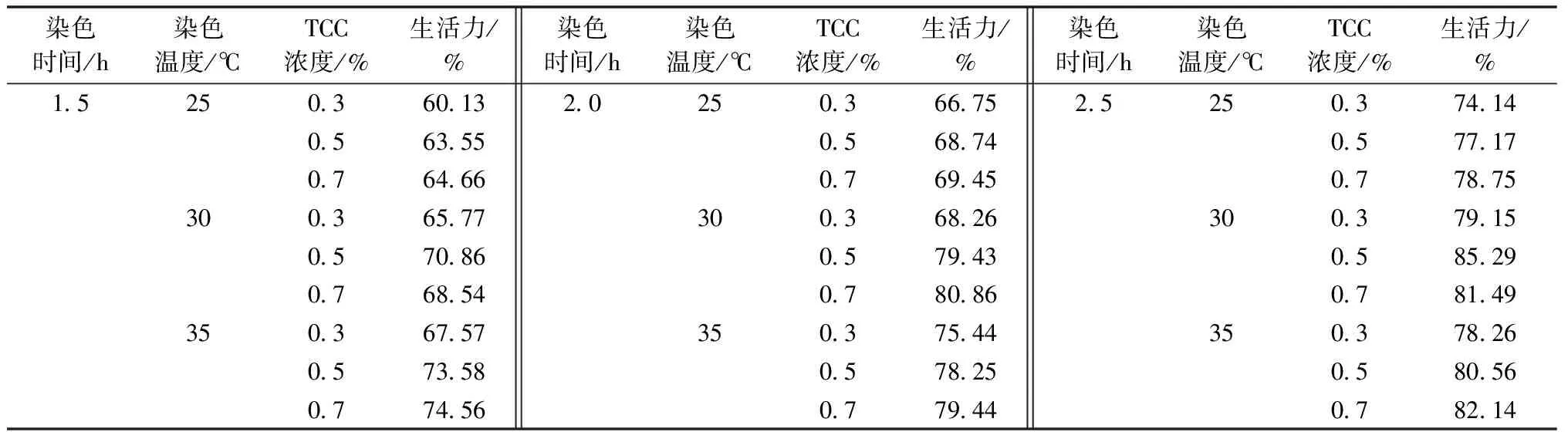
表4 正交试验结果
不同处理组染色结果表明,菘蓝种子生活力介于60.13%~85.29%,其中以0.5%的TTC溶液在30 ℃条件下、染色2.5 h种子生活力最高,染色效果也最好,明显优于其他处理组合;而组合0.3%的TTC溶液在25 ℃条件下、染色1.5 h种子生活力最低,染色较浅,效果较差。
对正交试验设计进行方差分析,结果表明,3个因素的P值均小于0.001,表明染色时间、染色温度和TTC浓度对种子活力的测定都有极显著影响,3个因素的极差值分别为11.67、7.42和4.93,即3个因素对菘蓝种子生活力的影响大小依次为染色时间、染色温度、TTC浓度,染色时间对菘蓝种子生活力影响最大,而TTC浓度影响最小。
3 小结与讨论
3.1 TTC法测定菘蓝种子生活力的最佳条件
种子生活力是衡量种子贮藏方式是否适宜以及播种品质优劣的重要指标,种子生活力测定方法多样,不同的测定方法测定结果也不尽相同[11-12]。本试验中供检菘蓝种子的生活力达85.29%,染色时间过短(<1.5 h)时,种子染色较浅,不适于菘蓝种子生活力测定,可能是因为短时间内种子呼吸产生的H+有限,无法完成还原反应所致;但在较长时间(>2.5 h)、较高温度(>35 ℃)和较高浓度(>0.7%)时菘蓝种子生活力反而下降,可能是种子长时间处于较高浓度和较高温度的染色条件下,种胚内部结构遭到破坏或种胚内酶失活所致;根据正交试验结果,菘蓝种子在30 ℃的0.5%的TTC溶液中染色2.5 h种子生活力最高,为其生活力测定的最佳方法。
3.2 TTC法测定菘蓝种子生活力的可行性
TTC染色法测得生活力一般与发芽率测定一致,有时会高于发芽率[13],本试验采用的是当年新采集的菘蓝种子,采集时含水量为8.60%,种子发芽率为82.55%,TTC染色后种子生活力达到85.29%,略高于种子发芽率,本研究结果与向振勇等[14-16]研究结果一致,采用TTC染色法测定种子生活力,从种子精选、浸种到种子染色需要18~20 h,而实验室测定种子的发芽率一般需要5~6周,因此,TTC染色法可实现菘蓝种子的快速测定。TTC染色法是公认的生活力测定方法,已正式列入我国《农作物种子检验规程》的生活力测定。本试验在单因素试验的基础上,通过多因素多水平组合试验得出探究性试验结果,具有较强的说服力和科学性,可以很好地应用于生产实践。

