离子色谱法同时测定复方葡萄糖酸钙口服溶液中葡萄糖酸根和乳酸根含量
孙 桐,吴 旭,王 悦
江苏省淮安市食品药品检验所,淮安223300
复方葡萄糖酸钙口服溶液主要成分为葡萄糖酸钙和乳酸钙。本品为钙的补充剂,具有促进骨骼及牙齿的钙化形成,维持神经与肌肉的正常兴奋性和降低毛细血管通透性等作用。人体缺钙时,会出现腿软、抽筋的情况,发生乏力、烦躁、注意力不集中,容易疲倦等症状。葡萄糖酸钙的饱和溶液每10 mL含钙元素89 mg,乳酸钙饱和溶液每10 mL 含钙元素100 mg,而复方钙的组合,复方钙源之间有相互增溶、助溶作用,从而提高了单位剂量中钙元素的含量,复方葡萄糖酸钙口服溶液每10 mL 含钙元素可达到110 mg。目前,在现行的质量标准[1]中,复方葡萄糖酸钙的含量都是以钙计,通过EDTA 络合滴定法测定钙盐的含量,这些钙盐可以是葡萄糖酸钙、乳酸钙,还可能是其他易溶的钙盐,如氯化钙、碳酸氢钙、硝酸钙、磷酸二氢钙、氯酸钙等,标准中仅以钙的含量作为限度指标,其专属性不强,即使在检验中钙离子含量测定符合规定,人们也无从得知生产企业是否会用其他钙盐去替换葡萄糖酸钙或乳酸钙,则无法测定葡萄糖酸根和乳酸根的具体含量,就无法对生产企业原辅料的投放进行有效质量控制,不能对药品质量起到严格的监管作用。
现有多篇文献报道关于葡萄糖酸钙、葡萄糖酸钙锌的含量测定方法,有原子吸收法[2]、ICP-OES法[3]、ICP-MS 法[4],这些分析方法都还是测定钙、锌等阳离子。也有文献报道了葡萄糖酸钙和乳酸的高效液相色谱法[5],由于葡萄糖酸钙在C18柱上不宜保留,对流动相、色谱柱等实验条件也相对要求严苛。而离子色谱法具有快速、灵敏、选择性好和同时测定多组分的优点;特别是阴离子方面,同时测定多种阴离子的快速、准确而灵敏的分析手段首选离子色谱法[6-8]。葡萄糖酸钙和乳酸钙在碱性的条件下,葡萄糖酸根和乳酸根以阴离子的形态存在,通过阴离子交换柱的分离后,经由检测器的信号转换形成各阴离子的色谱图,可以准确地进行定量分析。鉴于离子色谱在有机阴离子和无机阴离子检测领域的广泛运用[9,10],本研究旨在建立离子色谱法对复方葡萄糖酸钙口服溶液中葡萄糖酸根和乳酸根进行分离并定量,同时对方法学进行验证,为提高复方葡萄糖酸钙口服溶液的质量标准提供了新的参考。
1 仪器与药品、试剂
1.1 仪器
Dionex ICS 5000+离子色谱仪(美国Thermo)、Dionex EGC ⅢKOH 淋洗液发生器(美国Thermo)、XP205 电子天平(瑞士Mettler)。
1.2 药品与试剂
葡萄糖酸钙对照品(批号:100082-201803,按C12H22O14Ca·H2O 计含量100%);五水合乳酸钙对照品(批号:101179-201902,按C6H10CaO6计含量74.0%)均购自中国食品药品检定研究院;水为超纯水。
复方葡萄糖酸钙口服溶液5 批(哈药集团三精制药3 批,批号:21012712、21021633、21 012523;南京特丰制药2 批,批号:20201232、20200812);规格均为每支10 mL 剂型,每10 mL 含葡萄糖酸钙(C12H22O14Ca·H2O)0.5 g、乳酸钙(C6H10CaO6·5H2O)0.5 g,以钙元素计每10 mL 含110 mg。
2 方法与结果
2.1 色谱条件
检测器:电导检测器;色谱柱:Dionex IonPacTMAS19 RFICTM(4 mm×250 mm);保护柱:Dionex Ion-PacTMAG19 RFICTM(4 mm 50 mm);抑制器:Dionex AERS 500(4 mm),抑制电流70 mA;淋洗液:KOH溶液,梯度洗脱(程序:0~40 min,0.8 mmol·L-1;40~53 min,35 mmol·L-1;53~60 min,0.8 mmol·L-1);柱温:30 ℃;检测池温度:35 ℃;流速1 mL·min-1;进样体积:20 μL。
2.2 溶液制备
2.2.1 混合对照品贮备液 精密称取葡萄糖酸钙对照品和乳酸钙对照品适量,加水制成含葡萄糖酸根100.90 μg·mL-1和乳酸根72.43 μg·mL-1的混合对照品贮备液。
2.2.2 混合对照品溶液 精密量取混合对照品贮备液适量,用水依次稀释成含葡萄糖酸根1.009、2.018、5.045、10.090、25.225 μg·mL-1和乳酸根0.724、1.449、3.621、7.243、18.108 μg·mL-1系列浓度的标准溶液。
2.2.3 供试品溶液 精密量取复方葡萄糖酸钙口服溶液1 mL,置50 mL 量瓶中,加水溶解并稀释至刻度,摇匀;精密量取该溶液1 mL,置100 mL 量瓶中,加水稀释至刻度,摇匀。
2.2.4 空白溶液 取空白溶剂,制备空白溶液。
2.3 方法学验证
2.3.1 色谱系统适用性要求 称取葡萄糖酸钙对照品和乳酸钙对照品适量,加水制成葡萄糖酸根、乳酸根的单一对照品溶液,取混合对照品溶液(葡萄糖酸根5.045 μg·mL-1,乳酸根3.621 μg·mL-1)和单一对照品溶液,按“2.1”项下的色谱条件进样测定,记录色谱图,见图1。结果显示,葡萄糖酸根的保留时间为33.42 min,理论塔板数>9100,拖尾因子1.07;乳酸根的保留时间为36.35 min,理论塔板数>11000,拖尾因子0.98。葡萄糖酸根和乳酸根分离度为2.3(若保证两者分离度不<1.5,葡萄糖酸根和乳酸根的理论塔板数应分别>6500 和8000),在进样40 min 后切换成高浓度淋洗液,其他强保留组分完全洗脱下来。

图1 (A)混合对照品溶液、(B)乳酸根对照品溶液、(C)葡萄糖酸根对照品溶液的色谱图
2.3.2 专属性试验 取空白溶液、混合对照品溶液(葡萄糖酸根5.045 μg·mL-1,乳酸根3.621 μg·mL-1)、供试品溶液,按“2.1”项下的色谱条件进样检测,记录色谱图,见图2。表明空白溶液和复方葡萄糖酸钙口服液中其他成分对葡萄糖酸根、乳酸根无干扰。

图2 (A)空白溶液、(B)供试品溶液、(C)混合对照品溶液色谱图
2.3.3 线性关系考察 取混合对照品溶液,按“2.1”项下的色谱条件进样测定,记录峰面积,以对照品的峰面积(Y)为纵坐标、浓度X(μg·mL-1)为横坐标,进行线性回归,葡萄糖酸根线性方程为:Y=0.008+0.159X,r=0.999 4,线性范围1.009~25.225 μg·mL-1;乳酸根线性方程为:Y=0.160+0.438X,r=0.999 7,线性范围0.724~18.108 μg·mL-1。
2.3.4 定量限 取“2.2.2”项下的混合对照品溶液,用水逐级稀释,稀释到葡萄糖酸根和乳酸根的仪器信噪比(S/N)约为10 的时候,溶液浓度作为定量限,结果显示,葡萄糖酸根的定量限为0.25 μg·mL-1;乳酸根的定量限为0.11 μg·mL-1。
2.3.5 进样精密度试验 精密量取混合对照品溶液(葡萄糖酸根5.045 μg·mL-1,乳酸根3.621 μg·mL-1),按“2.1”项下的色谱条件进样测定,重复进样6 次,记录峰面积,计算峰面积的RSD(n=6),结果显示,葡萄糖酸根、乳酸根峰面积的RSD 分别为0.81%、0.52%,表明仪器精密度良好。
2.3.6 重复性试验 取批号21012712 样品,按“2.2.3”项下方法配制供试品溶液6 份,按“2.1”项下的色谱条件进样测定,记录峰面积,采用标准曲线法,计算复方葡萄糖酸钙口服溶液中葡萄糖酸根和乳酸根含量。结果显示,葡萄糖酸根、乳酸根的含量分别为44.63、31.66 mg·mL-1,RSD(n=6)分别为0.93%、0.71%,表明重复性良好。
2.3.7 稳定性试验 取批号21012712 样品,按“2.2.3”项下方法配制供试品溶液,室温避光放置,在0、2、4、8、12 h,按“2.1”项下色谱条件进样测定,记录峰面积,计算峰面积的RSD(n=5)。结果显示,葡萄糖酸根、乳酸根峰面积的RSD 分别为2.67%、1.51%,表明供试品12 h 内稳定性良好。
2.3.8 加样回收率试验 精密量取已知含量(批号21012712)样品1 mL,置100 mL 量瓶中,加水溶解并稀释至刻度,摇匀,取上述溶液1 mL,共9 份,分别置50 mL 量瓶中,分别精密加入混合对照品贮备液(葡萄糖酸根100.90 μg·mL-1和乳酸根72.43 μg·mL-1)4.0、5.0、6.0 mL,各3 份,最后加水稀释至刻度,摇匀,配制成低、中、高3 种不同浓度的供试品溶液各3 份,按“2.1”项下的色谱条件进样测定,采用标准曲线法,计算加样回收率,测定结果见表1。

表1 加样回收率结果(n=9)
2.4 样品含量测定
取5 个批次样品各2 份,按“2.2.3”项下方法配制供试品溶液,按“2.1”项下色谱条件进样测定,采用标准曲线法,计算复方葡萄糖酸钙口服溶液中葡萄糖酸根和乳酸根含量。通过复方葡萄糖酸钙口服溶液配方含葡萄糖酸钙(C12H22O14Ca·H2O)和乳酸钙(C6H10CaO6·5H2O)的量,折算出葡萄糖酸根和乳酸根的理论含量范围,结果见表2。

表2 复方葡萄糖酸钙口服溶液测定结果(n=2)
3 讨论
葡萄糖酸根和乳酸根均为弱保留成分,保留时间接近,需要在低浓度淋洗液下分离,而样品中含有的强保留成分如硝酸根、磷酸根、硫酸根需要很长时间才能洗脱下来。采用淋洗液的梯度洗脱即能保证分离效果,同样兼顾分离效率。阴离子分离常用淋洗液的体系有2 种:氢氧根体系和碳酸盐体系。碳酸盐体系[11]包括碳酸钠或碳酸氢钠,抑制产物为碳酸,容易形成二氧化碳,导致基线漂移,同时碳酸盐系统不能进行梯度洗脱。最终选定KOH 系统进行梯度洗脱,在低浓度条件下,当葡萄糖酸根和乳酸根完全分离后,切换到高浓度体系,保证在短时间内将强保留成分完全洗脱下来。
葡萄糖酸根和乳酸根较难分离,试验中比较了Dionex IonPacTMAS19 RFICTM、Dionex IonPacTMAS16 RFICTM和Dionex IonPacTMAS11 RFICTM3 种阴离子常用柱,这3 种色谱柱都可以检测葡萄糖酸根和乳酸根,通过调节淋洗液浓度和流速,使用AS16、AS11 两种柱子,葡萄糖酸根和乳酸根都无法分离完全;而使用AS19 柱,分离好,峰型佳。
在相关文献[12]中,言及对照品溶液和供试品溶液需要Na 柱进行预处理,用Na+置换Ca2+,以防在碱性条件下形成氢氧化钙沉淀,沉积在色谱柱内。参考这一做法,对空白溶液、对照品溶液和供试品溶液都进行Na 柱预处理,对照品溶液和供试品溶液的色谱图中在乳酸根峰后都出现了一个未知峰,见图3;而空白溶液中并未出现。配置不同浓度的溶液分析,依然如此,推测是葡萄糖酸钙或者乳酸钙同填料发生某种反应而引入了新的阴离子,对于这些未知不可控因素在试验过程中应该尽量避免。氢氧化钙溶解度是随温度的升高而下降,当温度为0~70 ℃,氢氧化钙在水中的溶解度>1 mg·mL-1,进入色谱柱的溶液Ca2+浓度大概只有每毫升几微克,即便生成少量氢氧化钙也能溶于水中,即使长时间使用会出现Ca2+沉积,使用低浓度草酸溶液对色谱柱进行冲洗即可解决,最终决定不对样品进行Na 柱预处理。
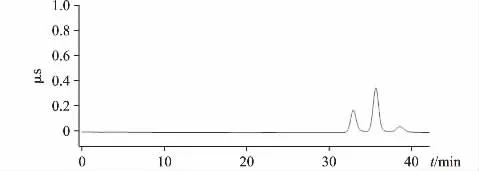
图3 Na 柱预处理后对照品溶液色谱图
现行的复方葡萄糖酸钙口服溶液检验标准中采用薄层色谱法对葡萄糖酸钙和乳酸钙进行了鉴别,结果也只能证明葡萄糖酸根和乳酸根的存在。本方法能准确地测定溶液中葡萄糖酸根和乳酸根的含量,但是由于生产工艺、药用辅料以及杂质等因素的影响,葡萄糖酸根和乳酸根的含量并不能简单折算成葡萄糖酸钙和乳酸钙的含量,因此现行标准中对钙的控制是必须的。如果在现行质量标准中加入对葡萄糖酸根和乳酸根含量的控制,再结合钙的控制,两者相辅相成,可以真正对该药品原辅料投放等关键质量参数做到实验质量分析和监管。
4 小 结
本试验建立了离子色谱法同时测定复方葡萄糖酸钙口服溶液中葡萄糖酸根和乳酸根的含量,并进行了方法学的验证,操作简单,灵敏度高,干扰小,精准度高,本方法可满足该药物中葡萄糖酸根和乳酸根含量测定的要求,特别是乳酸、乳酸钙作为良好的添加剂,已广泛运用于药品、食品领域,该方法可推广应用于测定食品、药品中乳酸根的含量。