香芹酚和月桂酰精氨酸乙酯盐酸盐联用对荧光假单胞菌抑菌作用的研究
李玮玮,蔡天舒*,冀霞,潘锐,黄晴,谢艳慧
(1.惠州卫生职业技术学院,广东 惠州 516025;2.惠州学院,广东 惠州 516007)
荧光假单胞菌(Pseudomonas fluorescens)是一种假单胞菌属的革兰氏阴性菌,易造成低温冷藏食品的污染,是水产品[1]、乳制品[2]、肉制品[3]等产品中的优势腐败菌。该菌的生长迅速,所产生的胞外蛋白酶和脂肪酶会加速食品中蛋白质和脂肪的水解,造成食品腐败变质[2],感官可接受度下降,甚至丧失可食用价值,导致严重的经济损失。此外,荧光假单胞菌还可引起败血症、感染性休克和血管内凝血等疾病,对人类健康造成威胁[4]。因此,有效抑制食品中的荧光假单胞菌,对延长食品货架期和提升食品质量安全具有重要意义。
天然防腐剂因具有安全、无毒、抗菌谱广等优势,已成为食品抑菌防腐领域研究的热点[5]。香芹酚作为一种良好的天然防腐剂,已被美国食品药品监督管理局(Food and Drug Administration,FDA)列为公认安全的食品成分(generlly recognized as safe,GRAS)[6]。香芹酚生物学特性广泛,如抗菌、抗病毒、抗氧化、抗肿瘤、调节免疫反应和调节肠道微生物群[7]。研究发现香芹酚对金黄色葡萄球菌、大肠杆菌、单核增生李斯特菌、鼠伤寒沙门氏菌等食品中常见的食源性致病菌均具有抑制作用[7]。然而,其溶解性差的特点,则制约了其在食品抑菌防腐保鲜中的应用。
月桂酰精氨酸乙酯盐酸盐(ethyl-Nα-lauroyl-L-arginate hydrochloride,LAE)是一种阳离子型表面活性剂,水溶性强,对霉菌、酵母菌、革兰氏阴性菌和革兰氏阳性菌等多种微生物表现出强烈的抗菌活性[8]。研究证实,LAE作为食品添加剂安全性较高,易在体内分解成月桂酸和L-精氨酸等天然成分[8]。2005年,LAE被FDA批准为GRAS类食品添加剂[8]。目前,已有学者将LAE应用于果蔬、肉制品、水产品等相关防腐保鲜研究中[8]。但香芹酚与LAE联合对荧光假单胞菌的抑菌效果与机制尚未被探索。
因此,本试验皆在探索一种基于香芹酚的新型复合食品抑菌剂,即建立香芹酚与LAE联用对荧光假单胞菌的最佳抑菌浓度模式,增强其生物利用度、评估抑菌效果;探讨香芹酚与LAE联用潜在的抑菌作用机制,综合评价其作用模式,从而为扩展其在食品工业中抑菌、防腐领域的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
荧光假单胞菌ATCC 13525:广东环凯微生物科技有限公司。
营养琼脂、营养肉汤、琼脂:北京陆桥技术有限公司;香芹酚(分析纯,99.07%):上海阿拉丁有限公司;月桂酰精氨酸乙酯盐酸盐(化学纯,≥97%):成都傲飞生物化学品有限责任公司;细菌蛋白质提取试剂盒、Bradford蛋白浓度测定试剂盒、蛋白质Marker、戊二醛、磷酸盐缓冲液(phosphate buffer saline,PBS)、葡萄糖、无水乙醇(分析纯)、考马斯亮蓝染色液、1%结晶紫染色液、冰乙酸(分析纯)、96孔板:上海生工生物工程股份有限公司。
1.2 仪器与设备
YXQ-50SII型立式压力蒸汽灭菌锅:上海博迅医疗生物仪器股份有限公司;HR60-IIA2生物安全柜:青岛海尔特种电器有限公司;HZQ-F160型振荡培养箱:哈尔滨市东联电子技术开发有限公司;Infinite M200 Pro NanoQuant多功能酶标仪:瑞士TECAN公司;Nano-Drop2000分光光度计:美国赛默飞公司;JEM-1200EX型透射电子显微镜:日本JEOL公司;GelDoc XR+全自动凝胶成像系统:美国Bio-Rad公司;Eppendorf 5418R离心机:德国艾本德股份公司。
1.3 方法
1.3.1 最小抑菌浓度测定
采用二倍稀释法分别测定香芹酚和LAE的最小抑菌浓度(minimum inhibitory concentration,MIC)[9]。将荧光假单胞菌接种至无菌营养肉汤,30℃、120 r/min条件下振荡培养16 h,6 000 r/min离心10 min,弃上清液保留菌体沉淀。用新鲜无菌营养肉汤重悬菌体,调整菌液浓度约为107CFU/mL备用。将各质量浓度的香芹酚和LAE分别取100 μL加入96孔板中,取100 μL菌液分别加入到已装有不同浓度的香芹酚和LAE溶液中,使香芹酚的终浓度分别为8.000、4.000、2.000、1.000、0.500、0.250、0.125、0.063 mg/mL,LAE 溶液的终浓度分别为256、128、64、32、16、8、4、2 μg/mL。对照组加入100 μL营养肉汤和100 μL菌液。将样品置于30℃下培养24 h,在600 nm波长处测定OD值,以细菌生长被抑制的最低抑菌浓度作为MIC。
1.3.2 联合抑菌效应的测定
以“棋盘法”[9]确定香芹酚与LAE的最佳联合抑菌组合。将香芹酚与LAE分别用营养肉汤稀释至质量浓度为各自的1/8 MIC、1/4 MIC、1/2 MIC、1 MIC、2 MIC、4 MIC和8 MIC。在96孔板中,从左至右,浓度由低至高依次加入50 μL香芹酚溶液,同列中香芹酚浓度相同。同时由上至下,从低浓度至高浓度依次加入50 μL LAE溶液。然后在每孔中均加入100 μL浓度为107CFU/mL的荧光假单胞菌悬液,并充分混匀,使试验组中每孔含有不同浓度的抑菌剂组合。对照组加入100 μL营养肉汤和100 μL菌液。将样品置于30℃下培养24 h,检测OD600值,确定两种抑菌剂联用时的MIC。以部分抑菌浓度指数(fractional inhibitory concentration index,FICI)判定两种抑菌剂的联用效果,计算公式如下。

结果判定依据:FICI≤0.5为协同作用;0.5<FICI≤1为相加作用;1<FICI≤2为无关作用;FICI>2为拮抗作用[9]。
1.3.3 生长曲线绘制
参考舒慧珍等[10]的方法绘制生长曲线。用营养肉汤将荧光假单胞菌培养并稀释至浓度约107CFU/mL,备用。依据联合抑菌效应的测定结果,在96孔板中,每孔中加入菌液100 μL,然后加入100 μL的香芹酚和LAE溶液,使终浓度分别为1/2 MIC香芹酚、1/16 MIC LAE、1/2 MIC 香芹酚+1/16 MIC LAE。以加入 100 μL营养肉汤和100 μL菌液作为对照。将样品置于30℃培养24 h,每2 h测定一次OD600值,并以时间为横坐标,吸光值为纵坐标绘制生长曲线。
1.3.4 胞外蛋白质和核酸的测定
参照Cao等[11]的方法测定胞外蛋白质和核酸,并稍作修改。将荧光假单胞菌培养至对数期,6 000 r/min离心10 min后收集沉淀,并以1×PBS清洗、重悬和调整菌体浓度至OD600=1.0。向上述荧光假单胞菌悬液中加入抑菌剂,使终浓度分别为0(对照)、1/2 MIC香芹酚、1/16 MIC LAE、1/2 MIC 香芹酚+1/16 MIC LAE,于30℃、120 r/min条件下振荡培养3 h。期间分别于0、30、60、90、120、150、180 min收集培养液,以4 ℃、8 000 r/min离心5 min,吸取上清液并用分光光度计分别检测OD260和OD280。
1.3.5 透射电子显微镜进行细菌形态观察
采用透射电子显微镜结合超薄切片技术[11],观察荧光假单胞菌细胞形态变化。向培养至对数期的菌悬液中分别加入终浓度为1/2 MIC香芹酚、1/16 MIC LAE、1/2 MIC香芹酚+1/16 MIC LAE的抑菌剂,以未加抑菌剂处理组作为对照,30℃下振荡培养3 h,取培养液6 000 r/min离心10 min,以1×PBS清洗并调整至OD600值为1.0。向上述菌体处理液加入等体积的5%戊二醛溶液,在4℃条件下固定16 h。样品经1×PBS清洗3次,去除固定液,用乙醇溶液梯度逐级脱水、包埋、加温聚合、超薄切片机切片、醋酸铀-硝酸铅染色后,以透射电子显微镜观察细菌形态。
1.3.6 细菌胞内蛋白质含量的测定
根据耿一鸣等[12]的方法并加以修改。将培养至对数期的荧光假单胞菌悬液,离心后用1×PBS清洗、重悬,调节至OD600=1.0。加入香芹酚和LAE,使其在菌液中的终浓度分别为0、1/2 MIC香芹酚、1/16 MIC LAE、1/2 MIC香芹酚+1/16 MIC LAE,于30℃振荡培养3 h,提取不同处理组中的菌体蛋白质,并以BCA法于OD562下测定蛋白质浓度。
菌体蛋白与5×蛋白上样缓冲液混合,100℃沸水浴5 min,瞬时离心,取等体积上清液进行十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)。浓缩胶恒压80 V、分离胶电压120 V,0.1%考马斯亮蓝染色30 min,脱色液脱色至蛋白质条带清晰,并拍照分析[13]。
1.3.7 生物被膜的形成
参照戴雨芸等[14]的方法,将荧光假单胞菌接种至营养肉汤,30℃培养16 h,6 000 r/min离心10 min后,弃上清液保留菌体沉淀。用无菌营养肉汤重悬菌体,调整菌液浓度至OD600=1.0,再用含0.2%葡萄糖的营养肉汤将上述菌液稀释100倍。加入香芹酚和LAE,使其在菌液中的终浓度分别为0、1/2 MIC香芹酚、1/16 MIC LAE、1/2 MIC香芹酚+1/16 MIC LAE。取上述菌液160 μL加入圆底96孔板,30℃培养24 h。依次吸去96孔板中的菌液,用无菌水洗3次,吸干。加入170 μL 0.1%结晶紫染色15 min,以无菌水洗3次后吸干。最后加入180 μL 33%冰乙酸溶液充分溶解后,测定595 nm处OD值。
1.3.8 香芹酚和LAE对荧光假单胞菌群集与泳动的影响
参照刘楠[15]的方法,并稍作修改。配制群集琼脂基础培养基和泳动琼脂基础培养基,冷却至46℃,向上述两种基础培养基中分别加入不同浓度的香芹酚和LAE,充分混匀制备固体平板,使培养基内的抑菌物终浓度分别为0、1/2 MIC香芹酚、1/16 MIC LAE、1/2 MIC香芹酚+1/16 MIC LAE。将5 μL荧光假单胞菌液滴加于固体平板中央,无菌风吹干,30℃培养24 h,观察菌株的迁移情况。并分别测量荧光假单胞菌在群集培养基、泳动培养基中的面积。
1.4 数据统计与分析
每组试验平行进行3次,结果采用GraphPad Prism 8.0绘图,两组计量数据比较采用Student's t检验统计学分析,P<0.05或P<0.01表示差异具有统计学意义。
2 结果与分析
2.1 香芹酚和LAE对荧光假单胞菌的抑菌效应
2.1.1 香芹酚和LAE对荧光假单胞菌的MIC测定
不同浓度的香芹酚和LAE分别对荧光假单胞菌的生长抑制情况见表1。
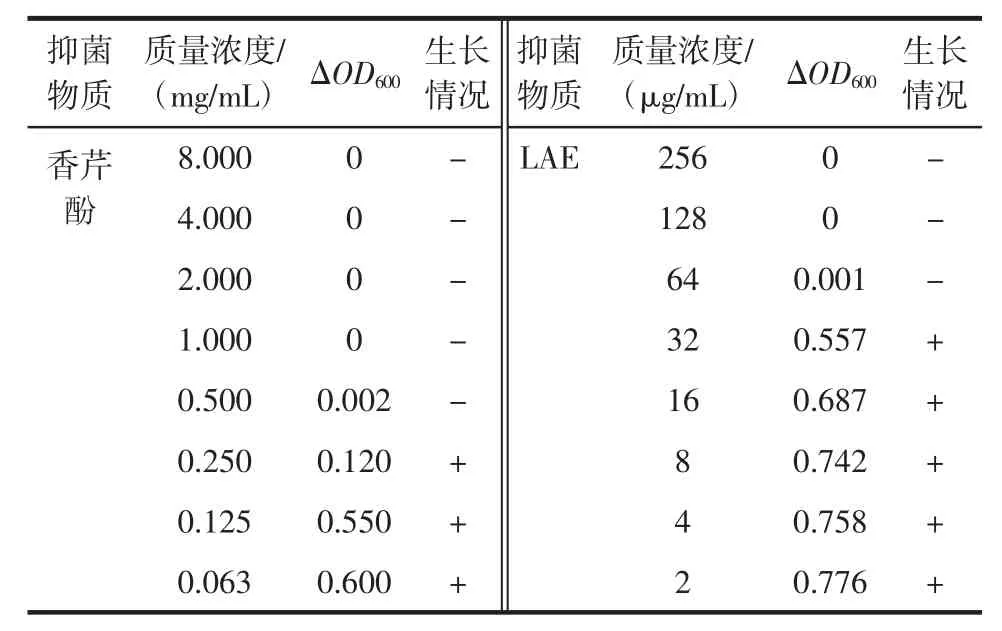
表1 香芹酚与LAE对荧光假单胞菌的抑制作用Table 1 Activity of carvacrol and LAE against P.fluorescens
由表1可知,当香芹酚浓度≥0.500 mg/mL时,荧光假单胞菌未见生长,菌液呈澄清状态;且当香芹酚浓度=0.500 mg/mL 时,光密度变化值(△OD600)<0.05,说明香芹酚对荧光假单胞菌的MIC为0.500 mg/mL。这与Fang等[6]的研究结果一致。同时,表1结果显示LAE对荧光假单胞菌的MIC为64 μg/mL。综上表明,香芹酚和LAE对荧光假单胞菌的生长均有抑制作用,且抑菌能力有浓度依赖性。
2.1.2 香芹酚和LAE对荧光假单胞菌的联合抑菌作用
根据“棋盘法”进行联合抑菌效果的研究,找出最佳联合抑菌浓度。不同浓度的香芹酚与LAE组合对荧光假单胞菌生长的影响见图1。
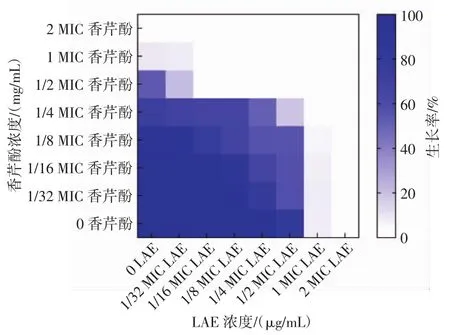
图1 香芹酚和LAE对荧光假单胞菌的联合抑菌作用Fig.1 Synergy of carvacrol and LAE against P.fluorescens
由图1可知,当细菌培养液中香芹酚浓度为0.250 mg/mL(1/2 MIC)、LAE 浓度为4 μg/mL(1/16 MIC)时,作用24 h后,菌液澄清,平板涂布无细菌生长,抑菌率为100%。通过FICI公式计算,1/2 MIC香芹酚+1/16 MIC LAE的FICI值为0.56,该组合具有相加作用,表明香芹酚与LAE的联合应用可以有效降低独立作用剂量。
香芹酚水溶性差,国内外研究学者主要采用磷脂[16]、多糖[17]和β-环糊精[6]等物质将其包埋,以解决其溶解性差的问题。研究表明,LAE有助于增溶丁香酚,促进其与微生物表面的接触,使丁香酚能够更好地接触磷脂膜,具有协同抑菌活性[18]。LAE可以提高百里香酚纳米乳液的稳定性和抗菌功效[19]。本研究采用具有抑菌活性的阳离子表面活性剂LAE与香芹酚复配,利于抑菌生物活性的发挥,提高生物利用度,为双组分抗菌乳液拓展在食品中的应用范围提供参考。
此外,大鼠遗传毒性研究显示,香芹酚(81mg/kgBW~810 mg/kg BW)不会诱导体内基因毒性或氧化性DNA损伤,且无组织病理学变化,其作为食品防腐剂的潜在应用具有良好的特征[20]。同时,欧盟食品安全局对LAE作为食品添加剂的每日允许摄入量为0.5 mg/kg BW[21]。而本研究中所采用的香芹酚和LAE联合抑菌剂量远低于上述限量标准,符合食品安全要求,将在不同食品中发挥联合抑菌效果。
2.1.3 香芹酚和LAE联用对荧光假单胞菌生长曲线的影响
香芹酚和LAE联合使用对荧光假单胞菌生长曲线的影响见图2。

图2 香芹酚和LAE联合对荧光假单胞菌生长曲线的影响Fig.2 Effect of carvacrol and LAE on the growth of P.fluorescens
由图2可知,对照组的细菌生长旺盛,4 h时进入对数生长期,细菌快速生长,24 h时细菌浓度OD600为0.795;当培养基中分别加入终浓度为1/2 MIC香芹酚、1/16 MIC LAE时,24 h时细菌浓度OD600分别为0.394和0.646;当1/2 MIC香芹酚+1/16 MIC LAE联用时,培养基未出现浑浊,菌体未见生长。与对照相比,24 h处理后,1/2 MIC香芹酚抑菌率为56.3%(P<0.05),1/16 MIC LAE抑菌率为24.1%(P>0.05),1/2 MIC香芹酚+1/16 MIC LAE联合抑菌率达97.9%(P<0.01)。结果表明,香芹酚和LAE联合作用,对荧光假单胞菌的生长抑制能力最强,抑菌效果显著,表现出良好的联合抑菌效应。
2.2 香芹酚和LAE联用对荧光假单胞菌的抑菌机制
2.2.1 香芹酚和LAE联用对菌体蛋白质和核酸泄漏的影响
细菌细胞质膜完整是维持细菌生长的关键因素[22]。因此,本研究通过检测菌体蛋白质与核酸胞外泄漏,分析细胞质膜的完整性。香芹酚和LAE联用对菌体蛋白质和核酸泄漏的影响见图3。
由图3可知,对照组和1/16 MIC LAE处理组中胞外蛋白质(OD280)和核酸(OD260)含量随时间变化不显著(P>0.05);1/2 MIC香芹酚组和1/2 MIC香芹酚+1/16 MIC LAE联用组中,处理1 h内均出现菌体蛋白和核酸泄露。其中,与对照相比,1/2 MIC香芹酚+1/16MIC LAE联用组细菌悬液中的蛋白质和核酸泄漏显著增加,吸光度OD280和OD260在1 h时分别升高31.2倍和17.5倍(P<0.01),之后吸光度趋于稳定。上述研究表明,荧光假单胞菌经1/2 MIC香芹酚+1/16 MIC LAE处理后,细胞质膜快速发生不可逆损伤,导致膜通透性发生改变,菌体内大分子物质泄漏到培养液中,细胞膜完整性破坏。研究表明,萜类化合物可以通过破坏细菌细胞壁的脂质组装,造成细胞膜的崩解、细胞蛋白质的变性、细胞质物质的泄漏,最终导致细胞裂解和死亡[22]。LAE主要通过与革兰氏阴性菌外膜中的脂多糖相互作用,使膜去极化,破坏菌体渗透屏障和完整性,抑制细菌生长[18]。

图3 香芹酚和LAE联用对荧光假单胞菌胞内蛋白质和核酸的泄漏的影响Fig.3 Effect of the combination of carvacrol and LAE on release of intracellular proteins and nucleic acids from P.fluorescens
2.2.2 透射电子显微镜观察香芹酚和LAE联用对细菌形态的影响
通过透射电子显微镜观察荧光假单胞菌经香芹酚和LAE联合处理后菌体超微结构的改变,结果见图4。
由图4可知,对照组菌体结构完整,边界清晰,细胞质分布均匀,饱满。1/2 MIC香芹酚处理组和1/16 MIC LAE处理组,菌体结构相对完整,部分菌体细胞质电子密度下降,不均匀。1/2 MIC香芹酚+1/16MIC LAE联用组细菌形态不规则,边界褶皱,细胞质电子密度显著下降。有研究发现,柠檬烯[10]可促进荧光假单胞菌体裂解,细胞壁和细胞膜结构破坏,大分子物质泄漏,菌体形态发生改变。LAE主要的抑菌机制是破坏细胞膜,但未导致细胞裂解[8]。结合本试验结果表明,香芹酚和LAE联用促进荧光假单胞菌的菌体结构破损,导致细胞内容物泄漏,从而抑制细菌生长。

图4 荧光假单胞菌的透射电镜图(50 000×)Fig.4 Transmission electron micrographs of P.fluorescens(50 000×)
2.2.3 香芹酚和LAE联用对胞内蛋白质的影响
香芹酚和LAE联用对胞内蛋白质的影响见图5。
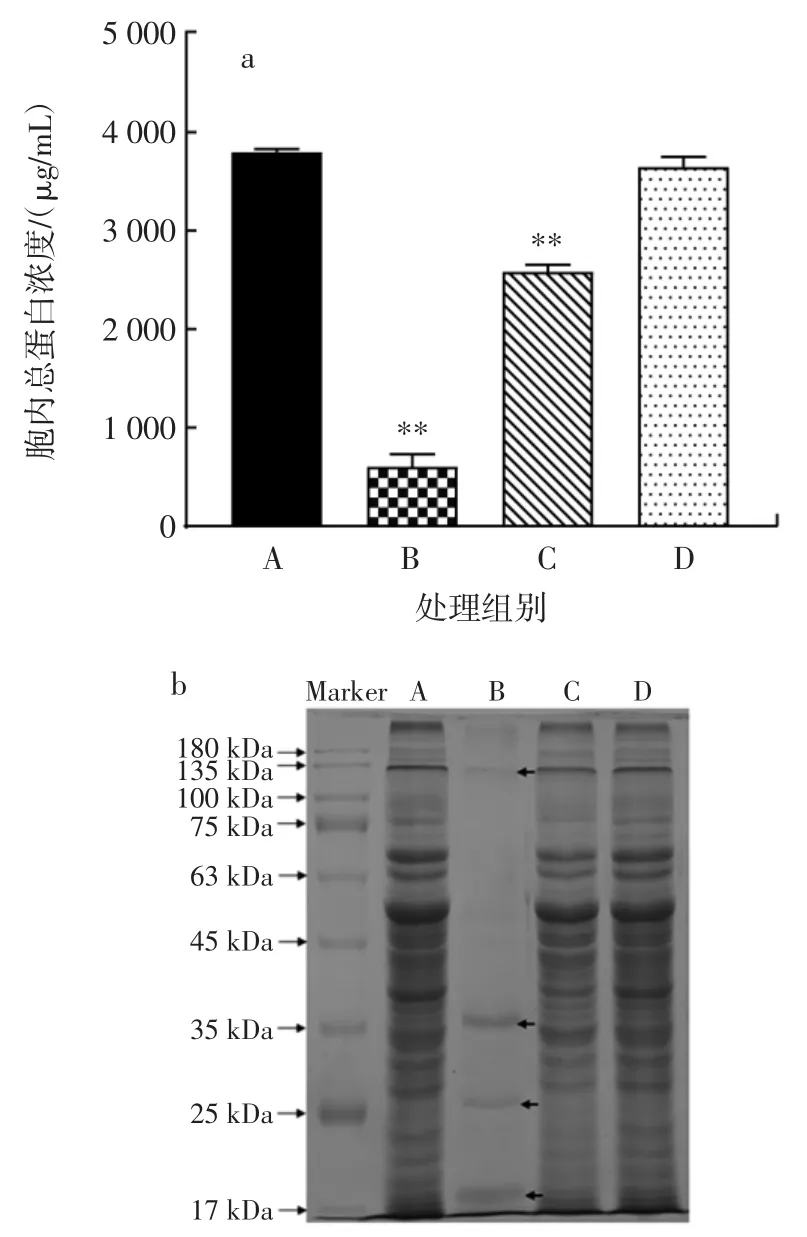
图5 香芹酚与LAE联用对荧光假单胞菌胞内总蛋白浓度的影响与SDS-PAGE电泳图Fig.5 Effect of carvacrol combined with LAE on intracellular protein content and SDS-PAGE profile of P.fluorescens
由图5可知,与上述胞外蛋白质和核酸泄漏测定结果,以及透射电子显微镜观察结果相一致,与对照组相比,1/2 MIC香芹酚+1/16 MIC LAE联用组中,荧光假单胞菌胞内蛋白浓度显著下降,降低了84.1%(P<0.01),1/2 MIC香芹酚处理组降低了32.1%(P<0.01),而1/16 MIC LAE处理组无显著变化(P>0.05)。通过SDS-PAGE进一步分析胞内可溶性蛋白质含量的改变(图5b),对照组蛋白质电泳条带丰富且清晰(泳道A);1/2 MIC香芹酚+1/16 MIC LAE联用组中,所有蛋白质条带亮度明显减弱,甚至消失,仅剩4条微弱的条带,主要位于135、35、25 kDa和17 kDa(泳道B)。
综合上述研究结果表明,在1/2 MIC香芹酚+1/16 MIC LAE作用下,荧光假单胞菌所表达的蛋白质含量和类型减少,进一步揭示香芹酚和LAE联合作用破坏荧光假单胞菌细胞膜结构完整性,导致细菌体内蛋白质泄漏,使得胞内蛋白质合成受阻。研究表明,松油烯-4-醇[12]、柠檬烯[10]和苯乳酸[13]等抑菌剂也具有相似的抑菌机制,即通过改变荧光假单胞菌细胞膜的通透性,导致大分子蛋白泄漏。
2.3 香芹酚和LAE联用对荧光假单胞菌生物被膜形成的影响
生物被膜是细菌处于外界不利环境时,细菌以及其自身所分泌的聚合物所形成的一种聚集膜状物[23]。研究表明,生物被膜的形成将有效保护细菌,使其对抗菌剂以及机体免疫系统的抵抗性显著增强,加剧食品的污染[23]。香芹酚和LAE联用对荧光假单胞菌生物被膜形成的影响见图6。
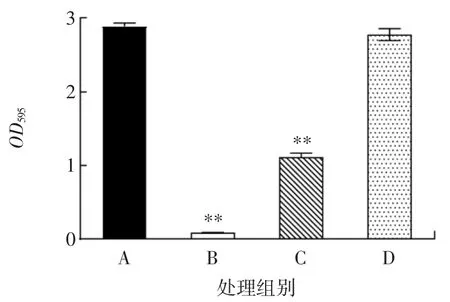
图6 香芹酚和LAE联用对荧光假单胞菌生物被膜形成能力的影响Fig.6 Effect of the combination of carvacrol and LAE onbiofilmforming ability of P.fluorescens
由图6可知,与对照相比,1/2 MIC香芹酚+1/16 MIC LAE、1/2 MIC香芹酚、1/16 MIC LAE分别作用24 h后,荧光假单胞菌生物被膜总量分别减少97.0%(P<0.01)、61.5%(P<0.01)、3.9%(P>0.05)。其中,香芹酚和LAE联用对荧光假单胞菌生物被膜的形成有显著抑制效果。戴雨芸等[14]研究发现,香芹酚对金黄色葡萄球菌生物被膜有明显的抑制和清除作用,主要通过抑制相关基因转录调控细胞间多糖黏附素的合成和胞外DNA的释放,减少生物被膜的形成。丁香酚破坏副溶血性弧菌细胞间连接,分离生物膜,并减少生物膜中的活菌细胞,具有显著的抗生物膜活性[24]。
2.4 香芹酚和LAE联用对荧光假单胞菌群集运动和泳动的影响
荧光假单胞菌是一种具有鞭毛的革兰氏阴性菌,具有鞭毛介导的细菌群集、泳动两种迁移方式,分别代表细菌的群体行为与个体行为[25]。细菌的运动特性对细菌在宿主表面定植和后继生物膜的形成具有重要作用[25]。香芹酚和LAE联用对荧光假单胞菌群集与泳动的影响及运动抑制情况见图7和图8。
由图7和图8可知,与对照相比,1/2 MIC香芹酚+1/16 MIC LAE联用对荧光假单胞菌群集和泳动的抑制率最大,分别为92.5%和65.0%。说明香芹酚和LAE联用能有效抑制荧光假单胞菌的迁移能力,且与上述抑制生物膜形成的结果相互验证。已有研究表明,香芹酚在转录水平调控荧光假单胞菌鞭毛形成和群体感应信号分子酰基-高丝氨酸内酯的产生,从而抑制群体感应系统,调节群集运动[15]。
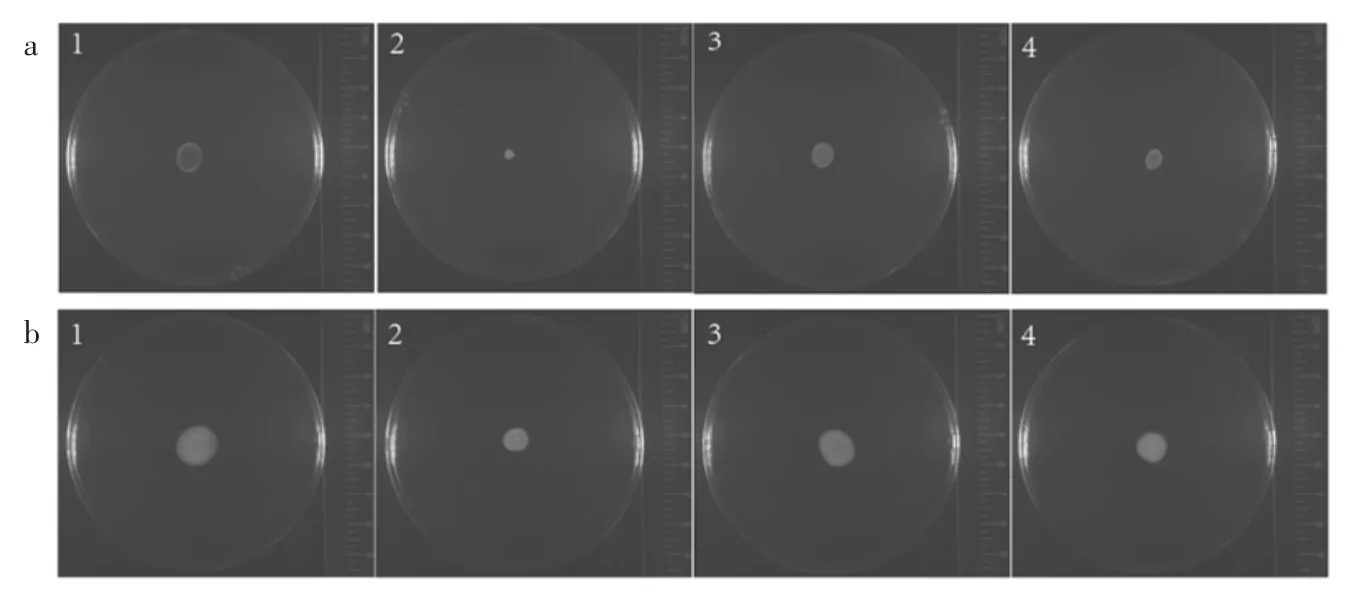
图7 香芹酚和LAE联用对荧光假单胞菌群集和泳动的影响Fig.7 Effect of the combination of carvacrol and LAE on swarming and swimming of P.fluorescens

图8 香芹酚和LAE联用对荧光假单胞菌运动面积的影响Fig.8 Effect of the combination of carvacrol and LAE on area of the motility zone of P.fluorescens
3 结论
香芹酚和LAE对荧光假单胞菌均具有良好的抑菌活性,MIC分别为0.500 mg/mL和64 μg/mL。棋盘法试验结果表明,1/2 MIC香芹酚+1/16 MIC LAE联用具有相加抑菌效果,FICI值为0.56,有效降低各自独立作用的剂量。1/2 MIC香芹酚+1/16 MIC LAE联用使荧光假单胞菌的细胞膜通透性明显增强,主要表现为蛋白质和核酸泄漏、胞内电子密度下降及胞内蛋白质含量和类型减少。因此,香芹酚与LAE联用诱导荧光假单胞菌的细胞壁和细胞膜完整性受损、超微结构改变、膜功能异常,导致蛋白质、核酸等生物大分子物质泄漏,使细菌新陈代谢活性下降,菌体死亡。此外,香芹酚和LAE联用对荧光假单胞菌的生物膜形成、群集运动和泳动均有显著的抑制作用,具有抑制群体感应活性的作用。

