固定化酶催化抗坏血酸硬脂酸酯的合成及抗氧化活性
王 彬,孙尚德,陈晓中
(河南工业大学 粮油食品学院,河南 郑州 450052)
油脂在储藏期容易氧化劣变,添加抗氧化剂能有效延长油脂储藏期。油脂中常用的抗氧化剂有特丁基对苯二酚(TBHQ)、丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)等[1]。近年来发现这些合成抗氧化剂具有潜在毒性,在日本、欧美国家已经禁止或严格限制其应用[2-4]。随着消费者对健康的重视,高效、天然抗氧化剂的应用逐渐受到重视。抗坏血酸脂肪酸酯由抗坏血酸与脂肪酸酯化而成,不仅具有抗坏血酸的功能性且引入脂肪酸链可增加其脂溶性[5],原料均为天然物质,对人体无毒副作用。目前抗坏血酸衍生物——抗坏血酸棕榈酸酯是唯一一种可以应用于婴幼儿食品中的抗氧化剂[6],因此抗坏血酸脂肪酸酯应用前景十分广阔。
抗坏血酸脂肪酸酯主要通过化学法合成,如酯化法、酰氯法和酯交换法[7-8]。化学合成法技术成熟,但存在副产物多、环境污染大、对设备腐蚀性大等缺点。而酶法合成具有反应专一性高、条件温和等优点[9]。酶法合成抗坏血酸脂肪酸酯已有大量报道,Novozym 435和Lipozyme TLIM是具有较好催化性能的商业固定化酶[10-12],虽然抗坏血酸脂肪酸酯比抗坏血酸更易溶于油脂,但其在油脂中依然存在低混溶性,因而限制了其使用。长碳链脂肪酸(C>18)或不饱和脂肪酸(如硬脂酸或油酸)的抗坏血酸脂肪酸酯与脂肪产品具有更好的相容性[13],也可用作食品添加剂。
鉴于酶法合成的优点和商业固定化酶成本高的缺点,为进一步提高抗坏血酸脂肪酸酯在油脂中的溶解性。作者对液体脂肪酶CALB进行固定化,在非水介质中催化合成AS,探究最佳反应条件,对产物进行纯化鉴定,并研究其在玉米油中的抗氧化效果。
1 材料与方法
1.1 材料与试剂
CALB液体脂肪酶(初始质量浓度22.8 mg/mL):诺维信公司产品;L-抗坏血酸、硬脂酸、4A分子筛、叔丁醇、叔戊醇、丙酮、乙腈、正己烷(均为分析纯)、玉米油:安徽中粮油脂有限公司产品;大孔吸附树脂(XB)、氨基树脂(1000EP):西安蓝晓科技新材料股份有限公司产品。
1.2 仪器与设备
pH计:上海仪电科学仪器股份有限公司产品;LY20-A水浴恒温振荡器:上海龙跃仪器设备有限公司产品;RE-52A旋转蒸发器:上海亚荣生化仪器厂产品;酶标仪:赛默飞世尔科技(中国)有限公司产品;Waters e2695型高效液相色谱仪:美国沃特世公司产品;892 Rancimat油脂氧化分析仪:瑞士万通公司产品。
1.3 方法
1.3.1 酶的预处理与固定化吸附树脂:称取树脂5 g,并用磷酸盐缓冲液(0.5 mol/L、pH7.0)洗涤滤干;氨基树脂:取树脂5 g,加入磷酸盐缓冲液(0.2 mol/L、pH 7.0)和体积分数50%的戊二醛(8 mL)于锥形瓶,并于恒温水浴振荡器(25℃、120 r/min)振荡2 h,取出后用磷酸盐缓冲液洗涤数次,滤干。
将酶液与一定体积的缓冲液混合后加入预处理好的树脂,于恒温水浴振荡器(25℃、120 r/min)振荡24 h,抽滤分离出固定化酶,并用缓冲液洗涤数次,至滤液中检测不出酶蛋白,将洗涤后的固定化酶于真空干燥箱(40℃)干燥12 h后储藏备用。
1.3.2 酶负载与酶活的测定按BCA试剂与Cu试剂体积比50∶1配制BCA工作液。以牛血清蛋白(BSA)为标准蛋白质,将20μL不同质量浓度蛋白质标准液加入孔板,再分别加入200μL BCA工作液放置30 min,在562 nm处采用酶标仪测定吸光度,建立标准曲线,计算固定化载体的酶负载量和酶负载率。
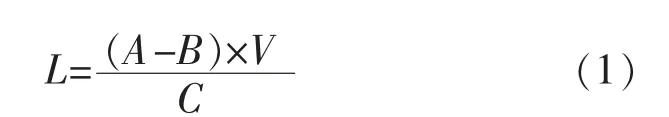
式中:L为酶负载量,mg/g;A为固定化前酶液中的酶蛋白质量浓度,mg/mL;B为固定化后上清液中残留的酶蛋白质量浓度,mg/mL;V为酶液体积,mL;C为加入固定化载体的质量,g。

式中:M为酶负载率,%;X1为固定化前酶液中的酶蛋白质量浓度,mg/mL;X2为固定化后上清液中残留的酶蛋白质量浓度,mg/mL。
采用分光光度法测定脂肪酶催化酯化反应酶活[14],将一定量的对硝基苯酚棕榈酸酯(pNPP)溶于50 mL正庚烷。称取一定质量的酶于试管,加入0.5 mL反应液,然后加入30μL无水乙醇在40℃反应10 min,反应结束取5μL加到96孔板,每个孔加入200μL的0.1 mol/L NaOH溶液终止反应,放置5 min,用酶标仪在410 nm检测各孔吸光度。
1.3.3 AS的合成及纯化称取3 mmol抗坏血酸、24 mmol硬脂酸、4 g分子筛和20 mL叔丁醇于150 mL锥形瓶,在55℃条件下于水浴恒温振荡器预热30 min后加入一定量的酶,隔点取样进液相测产率。反应结束后过滤除去固体物质,旋蒸除去溶剂,采用乙酸乙酯溶解并用去离子水洗涤3次除去抗坏血酸,旋蒸除去乙酸乙酯,用热正己烷洗涤3~5次除去大量硬脂酸,过滤得到白色粉末状AS,纯度约为91%。
1.3.4 AS的HPLC分析采用HPLC对产物进行定量分析,所用仪器为Waters e2695,色谱柱型号为C18(5μm,4.6 mm×250 mm),流动相为甲醇、水、乙酸的混合物,三者体积比为95∶5∶0.05,柱温为30℃,紫外吸收波长为250 nm,流量为1 mL/min,洗脱时间为20 min。根据面积归一法计算产率。

式中:N为产率,%;SAS和SAA分别为AS和抗坏血酸的峰面积。
1.3.5 AS的质谱检测利用UPLC-QQQ-MS/MS对产物进行鉴定,检测模式选择离子监测(SIM)。色谱条件参考1.3.4。质谱条件为:离子源电离模式采用ESI,负离子模式;毛细管电压3.5 kV;脱溶剂气和锥孔气流量:700 L/h和100 L/h;离子源温度:130℃;碰撞能量:25 eV,扫描范围:m/z 50~500。
1.3.6 AS在油脂中的抗氧化评价采用Rancimat法测定不同AS添加量对玉米油氧化诱导期的影响,并与TBHQ进行比较,筛选与添加50 mg/kg TBHQ氧化诱导时间相近的AS添加量。玉米油的氧化诱导时间测定参考GB/T 21121—2007《动植物油脂 氧化稳定性的测定》,称取3 g玉米油于样品管,测定池加入60 mL超纯水吸收产生的挥发性物质,空气流量20 L/h,分别测定在100、110、120℃温度下的氧化诱导期。
1.3.7 统计学分析所有实验重复两次。采用Origin 2021绘图,用SPSS 20.0进行数据处理和分析。结果表示为平均值±标准偏差。使用双向方差分析(ANOVA)评估差异的显著性,P<0.05表明差异显著。
2 结果与讨论
2.1 酶的固定化及筛选
如表1所示,液体CALB脂肪酶具有催化抗坏血酸与硬脂酸发生酯化反应的能力,但是催化效果较差,对液体CALB脂肪酶进行冷冻干燥脱水得到CALB干粉,显著提高了其催化能力。这可能是因为反应是在非水相体系进行,而液体脂肪酶含有大量的水,水会包裹其催化酯化的中心位点[15],致使其催化效率不高。Novozym 435具有较高的酶活和催化效果,这是一种将CALB固定在大孔阴离子树脂上的商业固定化酶。酶的固定化可以改善游离脂肪酶的缺点,作者研究了两种固定化方式,分别为大孔吸附树脂吸附固定化和氨基树脂共价结合法,并探究酶液配比对其固定化和催化效果的影响。在相同的处理条件下吸附树脂在负载量、负载率和酶活方面普遍高于氨基树脂,而且有较高的催化效果。随着酶液与缓冲液配比增加,固定化酶的负载量增加,结合AS产率和经济效益,选择吸附树脂,同时酶液与缓冲液体积比为2∶1作为固定化方法。
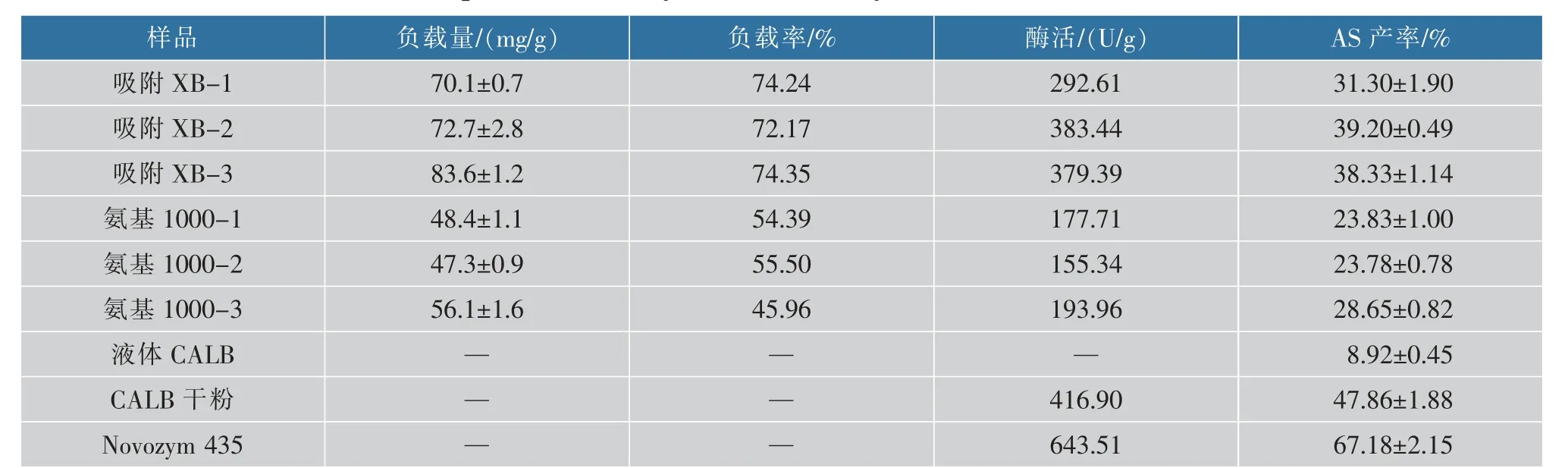
表1 不同处理方式下酶的性质及其催化效果Table 1 Properties and catalytic effects of enzymes under different treatments
2.2 AS合成单因素实验
2.2.1 溶剂对反应的影响在非水相体系,溶剂的选择对酶催化具有重要影响。Laane规律揭示了溶剂极性lg P与酶催化活性之间的关系[16]。反应物中抗坏血酸属于强极性物质,而硬脂酸极性相对较弱。在反应过程中溶剂的选择不仅要满足酶在体系中具有较高的催化活性,同时也要满足反应物在体系中具有较好的溶解度。实验选择不同极性的溶剂:叔丁醇(lg P=1.32)、叔戊醇(lg P=1.15)、丙酮(lg P=-0.23)、乙 腈(lg P=-0.33)和 正 己 烷(lg P=3.53),研究反应溶剂对AS合成的影响。溶剂的lg P越低代表溶剂极性越强,当溶剂极性越强,脂肪酶的必需水化层将被破坏,酶的活性降低,而当溶剂极性减弱,酶具有较好的催化活性。由图1可以看出,在叔丁醇体系中反应产率最高,然后为叔戊醇、丙酮、乙腈和正己烷。丙酮和乙腈相对叔丁醇体系催化效果不高,这可能是因为溶剂极性较强对酶活产生影响。而在弱极性的正己烷溶剂中却没有检测到生成物,这是因为虽然酶在非极性溶剂中具有较高的酶活,但是反应物抗坏血酸属于强极性物质,在正己烷中几乎不溶解,反应几乎不进行。因此选择叔丁醇作为反应溶剂。

图1 溶剂对反应体系的影响Fig.1 Effect of solvent on reaction system
2.2.2 温度对反应的影响由图2可知,当反应温度从35℃增加到55℃,AS产率显著增加,当反应温度为55℃时,反应24 h产率为(30.65±0.67)%,当温度进一步提高,AS产率缓慢增加。这可能是因为温度较低,酶活相对较低,同时抗坏血酸在叔丁醇中溶解度较低致使产率较低。当温度提高可激发酶的活性中心,反应体系黏度降低利于传质,因此产率提高[16]。当温度提高到75℃时,该酶依然有较好的催化效果。
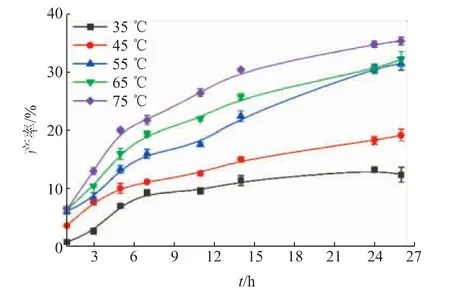
图2 反应温度对产率的影响Fig.2 Effect of reaction temperature on yield
2.2.3 酶添加量对反应的影响由图3可以看出,当酶添加量(质量分数)由10%到25%,AS产率明显提升,当酶添加量由25%到35%,反应产率趋于稳定。这是因为随着酶添加量的增加,可增加酶反应位点与反应物之间的接触,从而提高反应速率和产率。当加入过多的酶可能会影响体系的传质,同时会造成生产成本浪费,因此酶的最佳添加量为25%。

图3 酶添加量对产率的影响Fig.3 Effect of enzyme addition on yield
2.2.4 底物物质的量比对反应的影响由图4可以看出,当底物(抗坏血酸与硬脂酸)物质的量比从1∶2到1∶15时,反应产率明显增加。从1∶2到1∶10时,AS产率具有较高的增加幅度,从1∶10到1∶15,AS产率增加不显著。这可能是因为底物物质的量比的增加引入了更多的硬脂酸以及酶,增加了反应物之间的接触,从而提高产率;当底物物质的量比到达临界值,增加了反应体系的黏度,致使反应传质变慢,反应趋于稳定。
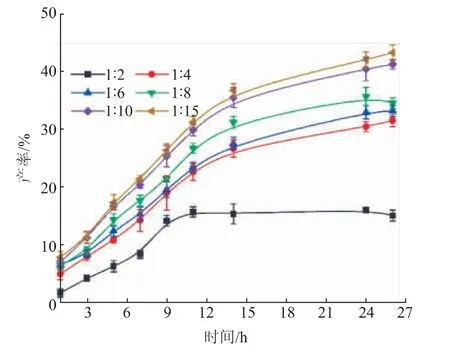
图4 底物物质的量比对产率的影响Fig.4 Effect of substrate molar ratio on yield
2.2.5 底物浓度对反应的影响由图5可知,当底物浓度(以抗坏血酸计)由0.03 mol/L增加到0.21 mol/L时,AS产率呈现先增加后降低的趋势,当底物浓度为0.12 mol/L时,产率最高为(37.66±1.54)%。这可能是因为当底物浓度大于0.12 mol/L后,随着浓度增加,传质阻力也增加,也可能是部分抗坏血酸没有完全溶解,当抗坏血酸浓度过高会与脂肪酶结合成复合体,从而抑制反应[17]。因此选择0.12 mol/L为最佳底物浓度。
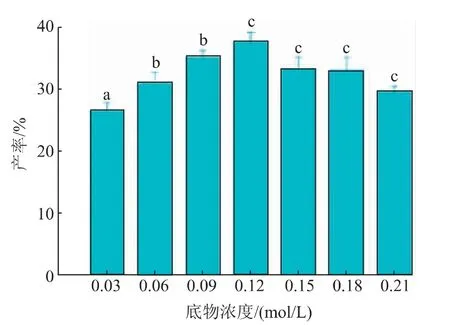
图5 底物浓度对产率的影响Fig.5 Effect of substrate concentration on yield
2.2.6 分子筛添加量对反应的影响酯化反应为可逆反应,生成物有水。通过除去生成物的水可以促进反应正向进行,4A分子筛具有吸水能力,可以降低反应过程中生成的水,同时也能抑制反应逆向进行,从而提高产率。由图6可以看出,与不加分子筛相比,加入分子筛能显著提高反应产率,当分子筛添加量达到100 g/L后,随着分子筛添加量加大,反应产率没有发生显著变化。分子筛作为吸附剂不仅可以吸附水也可能对反应物存在吸附性。综合考虑选择100 g/L为最佳分子筛添加量。

图6 分子筛添加量对产率的影响Fig.6 Effect of molecular sieve addition on yield
2.3 AS合成响应面实验
2.3.1 响应面实验设计和结果分析采用响应面模型拟合单因素与响应值之间的关系,可得到自制固定化脂肪酶催化合成AS的最佳反应条件。采用Box-Behnken设计优化不同变量组合对合成AS的影响,结果见表2和表3。
通过响应面数据分析得到反应变量与AS产率的二次多项拟合式:

式中:Y代表AS的产率,%;A代表反应温度,℃;B代表酶添加量(质量分数),%;C代表底物物质的量比。
由表3可知,反应变量与AS产率的二次多项拟合系数R2=0.979 1,模型P<0.005,表明自制固定化脂肪酶CALB催化合成AS的响应面模型显著,失拟项不显著。此外,3个变量对合成AS的影响顺序为:温度>底物物质的量比>酶添加量。
2.3.2 响应面优化结果各反应变量(温度、酶添加量、底物物质的量比)及其交互作用对自制固定化脂肪酶CALB催化合成AS的影响可以通过3D图来评估(见图7)。随着温度(35~75℃)、底物物质的量比(1∶2~1∶16)、酶添加量(5%~35%,质量分数)的变化,AS产率逐渐增加。如图7(a)所示,温度与酶添加量的交互作用表明,当产率>40%时,反应温度为57~75℃、酶添加量为11%~15%。图7(b)表明当反应温度为57~75℃,底物物质的量比为1∶6~1∶16时有较高的产率。图7(c)表明当酶添加量为23%~35%,底物物质的量比为1∶10~1∶16时有较高产率。由模型可以发现酶添加量和底物物质的量比的交互作用对反应影响更显著。

表2 各因素对AS产率的影响Table 2 Effect of different factors on AS yield

表3 各因素对AS产率的响应面模型分析Table 3 RSM model analysis of AS yield by different factors
根据响应面优化结果,在反应温度72℃,底物物质的量比1∶12,酶添加量22.49%的最佳反应条件下,AS的预测产率为45.68%,实测值为(41.33±1.81)%,结果可信。该结果高于Lerin等使用Novozym 435在超声环境催化合成抗坏血酸棕榈酸酯的产率(27%)[18],这可能是由于其反应时间较短,反应没有达到终点。

图7 酶催化合成AS的响应面3D图Fig.7 3D Response surface diagram of enzymatic synthesis of AS
2.4 质谱表征
由图8可知,电离质谱中出现的m/z 441.511 4与AS的相对分子质量对应,m/z 283.349 2与硬脂酸的相对分子质量对应,m/z 175.083 8与抗坏血酸相对分子质量对应。在二级电离质谱中出现的m/z 156.994 7为m/z 175.083 8丢失一分子水形成的[C6H6O5]-离子碎片,m/z 128.949 3(M-1)为[C5H6O4]-离子碎片,m/z 114.955 0(M-1)为[C4H4O4]-离子碎片,m/z 84.963 9(M-1)为[C3H2O3]-离子碎片。由此可判断产物为AS。AS的电离主要为抗坏血酸硬脂酸酯酯键断裂和抗坏血酸自身电离断裂。

图8 抗坏血酸硬脂酸酯的二级质谱图Fig.8 Secondary mass spectrum of ascorbic acid stearate
2.5 油脂氧化稳定性评价
TBHQ作为一种高效抗氧化剂,添加50 mg/kg有较好抗氧化效果[19],国标中对抗坏血酸棕榈酸酯的添加要求为不超过200 mg/kg。参考抗坏血酸棕榈酸酯的添加量,通过Rancimat法研究不同AS添加量和诱导温度对玉米油氧化诱导时间的影响。
从图9可以看出,添加TBHQ和AS与空白相比能显著延长氧化诱导时间,而添加200 mg/kg抗坏血酸(AA)对诱导时间没有明显延长,这是因为抗坏血酸不溶于油脂,通过将抗坏血酸酯化不仅能提高其在油脂中的溶解度,而且能提高其抗氧化性。随着温度提高10℃,诱导时间缩短约一半。在相同条件下,添加100 mg/kg AS与50 mg/kg TBHQ的氧化诱导时间比较接近,因此AS可以作为一种有效、健康的抗氧化剂应用于油脂中。
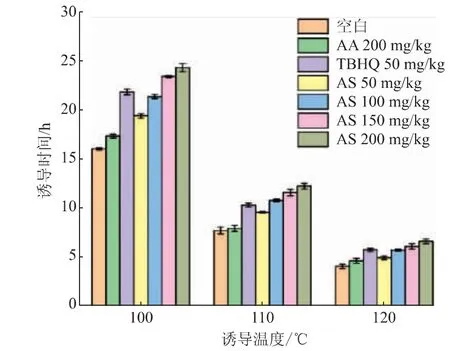
图9 抗氧化剂添加量及诱导温度对玉米油氧化诱导时间的影响Fig.9 Effects of antioxidant dosage and induction temperature on induction time of corn oil oxidation
3 结 语
作者研究出一种简便的液体脂肪酶CALB固定化技术,固定化负载率高。并对反应溶剂、温度、酶添加量、底物物质的量比、底物浓度和分子筛添加量进行研究,在优化条件下:反应温度72℃,底物物质的量比1∶12,酶添加量22.49%,反应24 h,产率可达(41.33±1.81)%。单因素对产率影响顺序为温度>底物物质的量比>酶添加量。通过Rancimat法研究表明AS具有较好的抗氧化活性,可作为一种有效、健康的抗氧化剂。但实验室自制固定化脂肪酶CALB与商品固定化酶的催化能力有一定的差距。

