不同剂量氯氮平用于精神分裂症合并肥胖的价值
张林 叶孝何
精神分裂症属于一种常见的精神心理科疾病,其病因目前尚不明确,临床表现为思维、知觉、行为及情感等多方面的障碍和精神活动的不协调,严重时还会出现思维障碍和认知功能损伤,严重损害患者生命健康[1-2]。目前,临床治疗精神分裂症多是使用药物控制疾病以防止其恶化。氯氮平作为一种非典型精神类治疗药物,近年来其使用频率位于精神类药物首位,由于精神分裂症治疗时间往往较长,长期使用氯氮平不可避免地会损害患者身体健康[3-4]。因此,各医院开始对氯氮平的使用进行监测,防止其滥用。目前,氯氮平治疗精神分裂症常见剂量在200~600 mg/d,但临床上关于氯氮平治疗精神分裂症时剂量高低的选择和维持疗效时最低有效血药浓度仍然存在争议,临床研究中关于患者体内血药浓度的高低对患者疗效与不良反应的影响也报道较少[5]。基于此,本研究分别使用不同剂量氯氮平对179例精神分裂症合并肥胖患者进行治疗,对比治疗效果差异,为临床选择合适治疗剂量及血药浓度提供依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾分析福州神康医院2019年1月-2021年10月179例精神分裂症合并肥胖患者临床资料,按照用药剂量不同分为高剂量组(90例)和低剂量组(89例)。纳入标准:(1)参照文献[6]CCMD-3中国精神障碍分类与诊断标准诊断为精神分裂症;(2)简明精神病量表(BPRS)>35分[7];(3)体重指数(BMI)≥28 kg/m2;(4) 年 龄 18~79 岁;(5) 临床资料完整。排除标准:(1)合并严重器质性疾病、躯体疾病;(2)妊娠期妇女;(3)药物不耐受。其中高剂量组男44例,女46例;年龄24~79岁,平均(46.13±5.23)岁;病程为1~10年,平均(3.12±0.54)年;偏执型精神分裂症40例,未分化型精神分裂症49例,急性精神分裂症样精神性障碍1例。低剂量组男45例,女44例;年龄23~78岁,平均(46.23±5.26)岁;病程为1~9年,平均(3.14±0.59)年;偏执型精神分裂41例,未分化型精神分裂症47例,急性精神分裂症样精神性障碍1例。两组基础资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
两组均给予常规治疗,常规治疗包括认知行为疗法、心理社会支持治疗,如帮助患者建立独立工作能力,管理精神分裂症状,学习应对压力等,并给予患者盐酸哌罗匹隆片(丽珠集团丽珠制药厂,国药准字H20080217),初始剂量为4 mg/次,3次/d,与餐后服用,依反应适当增减剂量,每日最大用量≤48 mg。高剂量组在常规治疗的基础上加服高剂量氯氮平片(上海上药信谊药厂有限公司,国 药准字 H31021152,25 mg/片 )500 mg/d, 分 3次服用,剂量分别为150、150、200 mg。低剂量组在常规治疗的基础上加服低剂量氯氮平片200 mg/d,分3次服用,剂量分别为50、75、75 mg,治疗过程中若患者出现锥体外系不良反应者口服盐酸苯海索片(湖南中南制药有限责任公司,国药准字H43021062,2 mg/片),剂量为 2~6 mg/d,分 2~3次服用,若出现心动过速者口服酒石酸美托洛尔片(阿斯利康制药有限公司,国药准字H32025391,25 mg/片),剂量为 25~50 mg/次,2~3 次 /d。两组均持续治疗8周。
1.3 观察指标及评价标准
(1)于治疗前、治疗8周后观察两组简明精神病量表(BPRS)评分:BPRS包含因子分、单项分、廓图和总分,本次研究对BPRS因子分和总分进行分析,BPRS因子分包含焦虑抑郁、缺乏活力、激活性、思维障碍、敌对性5类,每类为0~7分。BPRS总分范围为18~126分,分值越高,患者病情越严重。(2)统计两组血药浓度:取患者肘静脉血,采用高效液相色谱法测定患者血药浓度。(3)观察不同血药浓度下BPRS减少率与副反应量表(TESS)增分值:治疗8周时测定患者血药浓度后统计血药浓度 <300、300~600、>600 μg/L 时相对于治疗前的BPRS减少率和TESS增分值。TESS可反映患者发生的各种不良体征、症状,包括三方面:症状和药物的关系(0~4分)、严重度(0~4分)、采取的措施(0~6分),评分越高,药物副作用越大。(4)糖代谢指标测定:使用日立7180型全自动生化分析仪测定空腹血糖(FBG)、空腹胰岛素(FINS),计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FPG×FINS/22.5,使用免疫层析技术测定糖化血红蛋白(HbA1c),测定时点同(1)。(5)脂代谢指标测定:氧化酶法测定总胆固醇(TC)和甘油三酯(TG),直接法测定高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C),测定时点同(1)。
1.4 统计学处理
选用SPSS 22.0软件对数据进行统计学分析,计量资料以(±s)表示,两两比较行t检验,计数资料以率(%)表示,不同时点行重复测量的方差分析,多组间行方差齐性检验,组间行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后BPRS因子评分及总分比较
两组治疗前BPRS各评分比较,差异无统计学意义(P>0.05),治疗后两组BPRS评分显著低于治疗前(P<0.05),治疗后两组BPRS评分比较,差异无统计学意义(P>0.05),见表1。
表1 两组治疗前后BPRS因子评分及总分比较[分,(±s)]

表1 两组治疗前后BPRS因子评分及总分比较[分,(±s)]
组别 焦虑抑郁 缺乏活力 激活性治疗前 治疗后 治疗前 治疗后 治疗前 治疗后高剂量组(n=90) 2.22±0.45 1.28±0.36* 2.89±0.53 1.61±0.41* 1.90±0.26 1.12±0.26*低剂量组(n=89) 2.23±0.59 1.21±0.38* 2.88±0.56 1.69±0.45* 1.91±0.28 1.18±0.19*t值 0.128 1.265 0.123 1.244 0.248 1.761 P值 0.899 0.207 0.903 0.215 0.805 0.080
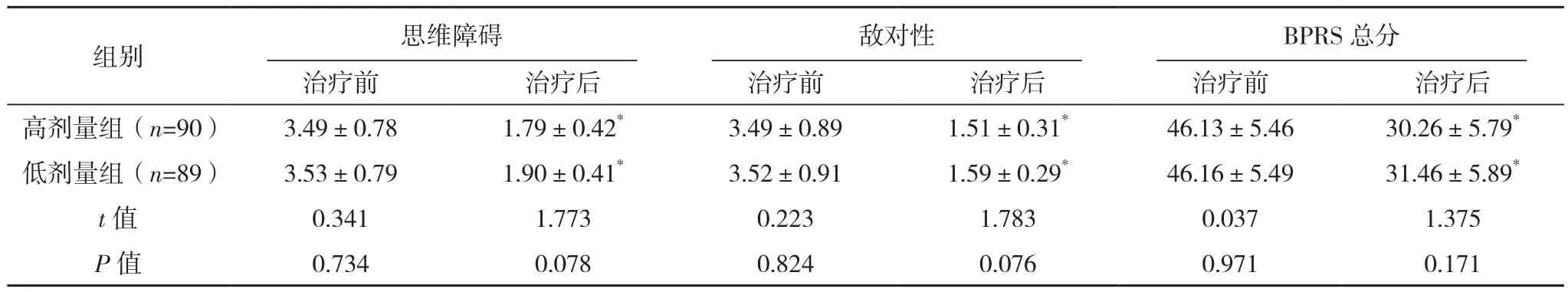
表1(续)
2.2 两组不同时点血药浓度比较
随着时间推移,两组血药浓度均未见明显变化,差异无统计学意义(P>0.05),各时点高剂量组血药浓度显著高于低剂量组(P<0.05),见表2。
表2 两组不同时点血药浓度比较[μg/L,(±s)]
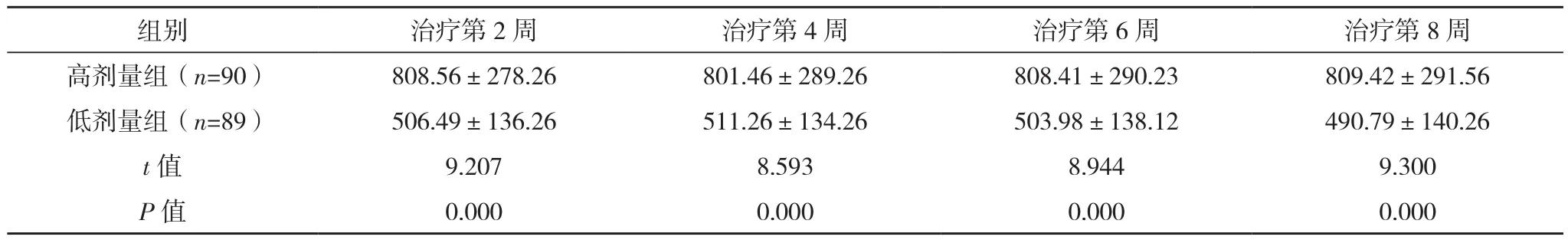
表2 两组不同时点血药浓度比较[μg/L,(±s)]
组别 治疗第2周 治疗第4周 治疗第6周 治疗第8周高剂量组(n=90) 808.56±278.26 801.46±289.26 808.41±290.23 809.42±291.56低剂量组(n=89) 506.49±136.26 511.26±134.26 503.98±138.12 490.79±140.26 t值 9.207 8.593 8.944 9.300 P值 0.000 0.000 0.000 0.000
2.3 不同血药浓度患者BPRS减少率与TESS增分值比较
经统计,12例血药浓度<300 μg/L,118例血药浓度 300~600 μg/L,49 例血药浓度 >600 μg/L。血药浓度 300~600 μg/L、>600 μg/L 患者 BPRS 减少率、TESS 增分值显著高于 <300 μg/L 患者(P<0.05),>600 μg/L 患者 TESS 增分值高于 300~600 μg/L 患者(P<0.05),见表3。
表3 不同血药浓度患者BPRS减少率与TESS增分值比较(±s)

表3 不同血药浓度患者BPRS减少率与TESS增分值比较(±s)
*与 <300 μg/L 比较,P<0.05;#与 300~600 μg/L 比较,P<0.05。
血药浓度 BPRS减少率(%) TESS增分值(分)<300 μg/L(n=12) 25.49±4.46 6.89±0.89 300~600 μg/L(n=118) 42.16±15.12* 8.97±1.26*>600 μg/L(n=49) 43.12±15.49* 11.69±2.46*#
2.4 两组治疗前后糖代谢指标比较
治疗前两组FBG、FINS、HOMA-IR、HbA1c比较,差异无统计学意义(P>0.05),治疗后高剂量组FBG、FINS、HOMA-IR、HbA1c显著高于治疗前及低剂量组治疗后(P<0.05),见表4。
表4 两组治疗前后糖代谢指标比较(±s)

表4 两组治疗前后糖代谢指标比较(±s)
*与同组治疗前比较,P<0.05。
组别 FBG(mmol/L)FINS(mmoL/L)HOMA-IR HbA1c(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后高剂量组(n=90) 4.59±0.31 5.38±0.34* 7.81±0.71 9.21±0.61* 1.59±0.23 2.20±0.35* 5.12±0.68 6.98±0.65*低剂量组(n=89) 4.61±0.29 4.93±0.32* 7.79±0.78 8.46±0.59* 1.60±0.24 1.75±0.39* 5.14±0.69 6.23±0.64*t值 0.446 9.116 0.179 8.360 0.285 8.126 0.195 7.778 P值 0.656 0.000 0.858 0.000 0.776 0.000 0.845 0.000
2.5 两组治疗前后脂代谢指标比较
治疗前两组 TC、TG、HDL-C、LDL-C对比,差异无统计学意义(P>0.05),治疗后高剂量组TC、TG、LDL-C显著高于治疗前及低剂量组治疗后,HDL-C显著低于治疗前及低剂量组治疗后(P<0.05),见表5。
表5 两组治疗前后脂代谢指标比较[mmol/L,(±s)]

表5 两组治疗前后脂代谢指标比较[mmol/L,(±s)]
*与同组治疗前比较,P<0.05。
组别 TC TG HDL-C LDL-C治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后高剂量组(n=90) 4.45±0.24 4.89±0.23* 0.95±0.31 1.89±0.35* 2.89±0.64 1.67±0.46* 2.09±0.34 3.42±0.32*低剂量组(n=89) 4.46±0.21 4.69±0.19* 0.96±0.34 1.42±0.34* 2.91±0.62 2.23±0.56* 2.10±0.38 2.97±0.31*t值 0.297 6.339 0.206 9.111 0.212 7.314 0.186 9.554 P值 0.767 0.000 0.837 0.000 0.832 0.000 0.853 0.000
3 讨论
氯氮平作为一种非典型精神类治疗药物,被广泛应用于精神分裂症的治疗,可有效缓解患者症状,但长期服用氯氮平副作用较大,会持续损害身体健康。为了降低氯氮平的负面影响,在保证疗效的同时找到合适使用剂量已成为临床的迫切需要[8-9]。基于此,本研究通过病例对照的方法,选取不同剂量的氯氮平对精神分裂症合并肥胖患者进行治疗,同时分析不同氯氮平血药浓度下患者的治疗效果及不良反应的影响,为临床选择合适的氯氮平剂量和有效血药浓度提供参考。
本研究中,治疗后两组BPRS评分显著低于治疗前,治疗后两组BPRS评分比较差异无统计学意义(P>0.05)。表明氯氮平治疗精神分裂症合并肥胖时,剂量为200 mg/d与500 mg/d时均有较好疗效。其原因分析如下:精神分裂症合并肥胖患者体内多巴胺水平较高,多巴胺作为兴奋性神经递质,其过高的水平导致患者神经处于长时间兴奋状态[10-11]。氯氮平作为一种5-羟色胺(5-HT)和多巴胺拮抗剂,可有效减少5-HT、多巴胺神经元放电,抑制多巴胺发挥作用,以此对患者进行治疗,因此具有较好疗效[12]。本研究两组疗效相当,其可能与患者体内氯氮平血药浓度有关。研究显示,随着时间推移,两组血药浓度均未见明显变化,各时点高剂量组血药浓度显著高于低剂量组。血药浓度 300~600 μg/L、>600 μg/L 患者 BPRS 减少率、TESS增分值显著高于 <300 μg/L患者(P<0.05),>600 μg/L 患者 TESS 增分值高于 300~600 μg/L 患者(P<0.05)。即当血药浓度≥300 μg/L,随着血药浓度升高疗效不再提高,但不良反应加大。而由表2可知,高剂量组与低剂量组血药浓度均显著高于300 μg/L,所以此时两组均有较好疗效且疗效相当,而不良反应发生与药物剂量呈正相关,当氯氮平剂量增加时,不良反应也不可避免加大[13]。因此,相较于高剂量组,低剂量组治疗效果无明显变化,但可显著减少不良反应发生情况。
本研究中,治疗后高剂量组FBG、FINS、HOMA-IR、HbA1c显著高于治疗前及低剂量组治疗后,治疗后高剂量组TC、TG、LDL-C显著高于治疗前及低剂量组治疗后,HDL-C显著低于治疗前及低剂量组治疗后。表明服用氯氮平会导致患者体内糖脂代谢功能紊乱,且随着剂量提高,其功能紊乱程度更高。翟媛媛等[14]对160例精神分裂症患者进行治疗时也指出氯氮平会导致患者机体糖脂代谢功能紊乱,与本次研究结果相符。其可能与5-HT、儿茶酚胺、多巴胺、瘦素、脂联素、固醇调节结合蛋白等多方面作用有关,也与患者日常活动减少、食欲增加有关[15-16]。
综上,氯氮平治疗精神分裂症合并肥胖患者有较好效果,且其疗效不因剂量的变化而改变,但随着剂量加大,其不良反应会相应增加,同时,氯氮平还会造成糖脂代谢功能紊乱,且剂量越大,患者代谢紊乱程度越高,因此,临床可选择低剂量的氯氮平对患者进行治疗。

