卵孢长根菇不同生长期覆土层微生物群落结构多样性分析
詹颖馨 方亮 付圣麟 苏广林 陈晗 刘斌


摘要:【目的】探究卵孢長根菇不同生长期覆土层微生物群落结构多样性及木霉病害对微生物群落的影响,为长根菇的高产稳产提供理论依据。【方法】采用Illumina高通量测序技术,研究长根菇不同生长阶段(覆土时、现蕾期、采收期、发病期、转潮期)覆土层微生物群落结构组成及其多样性,并利用冗余分析技术分析研究微生物菌群与土壤理化因子的相关性。【结果】从覆土样品中共获得操作分类单元(OTUs)4581个,细菌和真菌OTUs分别为3650个和931个。不同生长阶段土壤的细菌优势菌群存在较大差异,覆土时和采收期的最优势属为广义伯克霍尔德氏菌属(Burkholderia),现蕾期、发病期、转潮期的最优势属的分别为罗尔斯通氏菌属(Ralstonia)、西地西菌属(Cedecea)和噬几丁质菌属(Chitinophaga)。覆工至采收的前3个生长期的最优势真菌属为镰刀菌属(Fusarium),其余生长期则为木霉属(Trichoderma)。木霉病害发病期土壤层微生物菌群结构发生较大变化,微生物数量和丰度均低于其他期;采收期土壤的细菌多样性最高,转潮期真菌多样性最高。冗余分析结果表明,覆土层中速效氮和速效钾与细菌在属水平上有显著正相关(P<0.05,下同);有效磷与真菌属水平菌群显著正相关。土壤有机质与覆土时土壤微生物群落呈正相关;速效氮、有效磷、速效钾和pH则与转潮期土壤微生物群落呈正相关。【结论】不同生长阶段覆土层土壤真菌物种数量在采收期达最大值,细菌物种数量则随着长根菇的生长而不断下降。木霉病害的发生对土壤微生物种类和丰度均有显著抑制作用,同时大量消耗土壤的营养元素,降低pH。
关键词:卵孢长根菇;土壤微生物多样性;高通量测序技术;土壤理化性质;群落结构
中图分类号:S646;S154.3 文献标志码: A 文章编号:2095-1191(2022)04-1143-09
Diversity analysis of microbial community structure in casing soil in different growth stages of Hymenopellis raphanipes
ZHAN Ying-xin, FANG Liang, FU Sheng-lin, SU Guang-lin, CHEN Han, LIU Bin*
(College of Agriculture, Guangxi University/Institute of Edible Fungi, Guangxi University, Nanning,
Guangxi 530004, China)
Abstract:【Objective】To investigate the composition and diversity of microbial community structure of the casing soil in different growth stages of Hymenopellis raphanipes, and the effect of Trichoderma diseases on microbial communities,so as to provide the theoretical basis for the high and stable yield of the H. raphanipes. 【Method】The microbial community structure and diversity in different growth stages(casing stage, pinning stage, harvesting stage, harvesting stage with green mold disease, flush interval stage) of H. raphanipes were analyzed by Illumina high-throughput sequencing technology, while the relationship between microbial community and soil physical-chemical property was studied by environmental factors analysis. 【Result】Results showed the total number of operational taxonomic unit(OTUs) in casing soil was 4581, including 3650 of bacteria and 931 of fungi. There were significant differences in the dominant bacterial community in different growing stages, the dominant bacterial genus in casing stage and harvesting stage was Burkholderia. Ralstonia, Cedecea and Chitinophaga were the dominant genus in pinning stage, harvesting stage and flush interval stage, respectively. The most dominant fungal in the first three stages was genus Fusarium, and the remaining stages were genus Trichoderma. In disease stage, the structure of soil microbial community changed greatly, with the number of microorganisms and relative abundance lower than other stage. In harvesting stage, bacteria diversity reached the highest and in the flush interval stage, fungal diversity was the highest. dbRDA analysis showed that the content of available nitrogen(AN) and available phosphorus(AK) in casting soil was significant positive correlated with bacteria at genus level(P<0.05, the same below). Available phosphorus(AP) had significant positive correlation with bacterial communities at genus level. Soil organic matter(SOM) was significantly positively correlated with soil microbial community in casing stage, while AN, AP, AK and pH were positively correlated with soil microbial community in flush interval stage. 【Conclusion】The number of soil fungal flora in different growth stages reaches the maximum at harvest time; The number of bacterial flora decreased with the growth of long root mushroom. The occurrence of Trichoderma disease can significantly inhibit the species and abundance of soil microbial flora, and consume a lot of soil nutrient elements and reduce pH.
Key words: Hymenopellis raphanipes; soil microbial diversity; high-throughput sequencing technology; soil physicochemical property; community structure
Foundation items: Guangxi Key Research and Development Plan Project (Guike AB18221047)
0 引言
【研究意义】卵孢长根菇(Hymenopellis raphanipes)又名卵孢小奥德蘑、露水鸡枞等,商品名为黑皮鸡枞(Hao et al.,2016),其肉质细腻、香味浓郁、营养丰富,是近年深受消费者喜爱的名贵珍稀食用菌。长根菇虽然不覆土也能出菇,但产量较低,覆土是长根菇栽培过程的一个重要环节,土壤中微生物和组分能直接影响子实体产量和质量。在覆土栽培中最突出的问题是杂菌侵染,尤以木霉(Trichoderma spp.)危害最严重,其在栽培袋和覆土层表面快速生长,与长根菇竞争营养和空间,造成长根菇严重减产甚至绝收,已成为制约长根菇产业发展的瓶颈。因此,开展长根菇生长发育过程中覆土层土壤微生物群落结构多样性研究,对长根菇的高产稳产栽培具有重要意义。【前人研究进展】我国进行卵孢长根菇驯化栽培的时间较晚,20世纪期间已有学者对卵孢长根菇进行栽培研究,但因栽培技术不成熟等问题,未能实现长根菇的规模化生产(李传华等,2011)。孙思国(2010)在山东省济宁市金乡县首次成功实现卵孢长根菇的大规模人工覆土栽培。覆土是某些食用菌栽培的关键环节,不仅能保温保湿,还能提供营养和有益微生物、促进食用菌菌丝扭结,有利于子实体的原基早形成早出菇(Kalberer et al.,1990)。双孢蘑菇(Agaricus bisporus)具有不覆土不出菇的特性,必须覆土才能诱导形成子实体(沈新芬等,2019),是覆土层微生物研究较深入的食用菌。Chen等(2013)的试验结果表明,覆土层中产生1-氨基环丙烷-1-羧酸脱氨酶的细菌可降低双孢蘑菇原基形成抑制剂乙烯的含量,从而促进原基的形成。王琳等(2018)研究确定了恶臭假单胞菌TK3对双孢蘑菇具有促生作用,能实现子实体的大幅度增产。近年来,其他食用菌与土壤微生物群落的关系也相继开展。陈诚等(2017)采用高通量测序技术对羊肚菌白霉病发生前后土壤的微生物群落结构进行研究,结果表明羊肚菌栽培后真菌多样性降低,白霉病发生后根际真菌种类增多,优势真菌类群也产生了较大变化;张相锋等(2019)、杨晓绒等(2020)的研究结果表明,羊肚菌根际土壤微生物多样性与土壤深度成反比,上层微生物多样性最高;赵玉卉等(2021)对羊肚菌根际细菌群落与土壤环境因子相关性进行研究,揭示了羊肚菌根际微生态系统各要素间的相互关系。综上所述,覆土土壤微生物多样性和土壤理化性质在覆土型食用菌菌丝和子实体的生长阶段起着重要作用。【本研究切入点】至今有关长根菇覆土层微生物多样性研究鲜见报道。【拟解决的关键问题】基于Illumina NovaSeq测序平台的第二代测序技术对长根菇不同生长阶段覆土层土壤进行高通量测序分析,通过测定细菌和真菌群落的结构及其多样性,分析其与土壤理化性质间相关性,探究不同生长期覆土层土壤细菌和真菌群落的差异,以期为长根菇的工厂化覆土栽培提供科学依据。
1 材料与方法
1. 1 样品采集
长根菇覆土栽培试验于2021年5—6月在广西梧州市万秀区夏郢镇的上品荟食用菌种植基地(东经111º30′99″,北纬23º56′30″)进行。长根菇菌种由山东远洋农业开发有限公司提供,覆土材料为75%红壤土和25%泥炭土混合组成。选取长根菇不同生长阶段的覆土层,即覆土时(5月19日)、首潮菇现蕾期(6月3日)、首潮菇采收期(6月13日)、采收期发生木霉病害(6月13日,简称发病期)及首潮采收后的转潮期(6月23日)。采集时去除表面2~3 cm的土层,使用内径为5 cm的土钻和100 cm3环刀,采集菇架上的土壤,每个生长期采集3份样品,每份样品采集3个点的土壤进行混合。装入无菌自封袋中密封,立即带回实验室,除去土壤中的石块和可见动植物残体等。土样分2份保存,其中一份样品于-80 ℃冰箱保存,用于土壤微生物群落多样性测定;另一份样品于阴凉处风干后过80目筛,用于土壤理化性质的测定。
1. 2 土壤理化性质测定
有机质(Soil organic matter ,SOM)含量用重铬酸钾容量法测定,pH值用电位法测定(Ciavatta et al.,1991)。速效氮(Available nitrogen ,AN)含量用碱解扩散法测定(Xiong et al.,2008);有效磷(Available phosphorus,AP)含量用钼锑抗比色紫外分光光度法测定;速效钾(Available potassium ,AK)含量经乙酸铵提取后用火焰光度法测定(鲍士旦,2003)。
1. 3 高通量测序分析
采用CTAB法对土壤样本的基因组DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,使用无菌水稀释样本DNA至1 ng/μL。以DNA基因组作为模板,对细菌16S rDNA序列V3~V4可变区和真菌ITS1区进行PCR扩增。扩增引物分别为314F(5'-CCTAYGGGRBGCASCAG-3')和806R(5'-GGACTA CNNGGGTATCTAAT-3'),ITS5-1737F(5'-GGAAGT AAAAGTCGTAACAAGG-3')和ITS2-2043R(5'-GCT GCGTTCTTCATCGATGC-3')。PCR產物经琼脂糖凝胶进行电泳检测后,采用qiagen公司的胶回收试剂盒回收目的条带。文库构建按TruSeq® DNA PCR-Free Sample Preparation Kit试剂盒的说明进行,构建好的文库合格使用NovaSeq6000进行上机测序,高通量测序委托北京诺禾致源生物信息科技有限公司完成。
1. 4 测序数据处理与分析
测序获得的原始数据采用FLASH v1.2.7, (http://ccb.jhu.edu/software/FLASH/)进行拼接,拼接获得的原始Tags数据经Qiime v1.9.1(http://qiime.org/scripts/split libraries fastq.html)质控得到高质量的Clean Tags数据,再与物种数据库进行比对并去除嵌合体序列,得到最终有效数据(Effective tags)(Wang et al.,2007;Quast et al.,2013)。利用Uparse算法(Uparse v7.0.1001)对Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational taxonomic units)。使用Qiime v1.9.1进行微生物群落Alpha多样性和Beta多样性的比较分析(Li and Xu,2007)。用Spearman相关分析(Algina and Keselman,1999)和环境因子分析(Distance-based redundancy analysis,db-RDA)(李晓谦等,2015)研究微生物多样性和群落结构与土壤理化性质间的关系。以上分析均在北京诺禾致源科技股份有限公司售后平台NovoMagic(https://magic.novogene.com/customer/main#/login)完成。
1. 5 统计分析
利用Excle 2016进行柱状图制作,使用SPSS 23.0对试验数据进行方差分析。
2 结果与分析
2. 1 不同生长期覆土层土壤理化性质
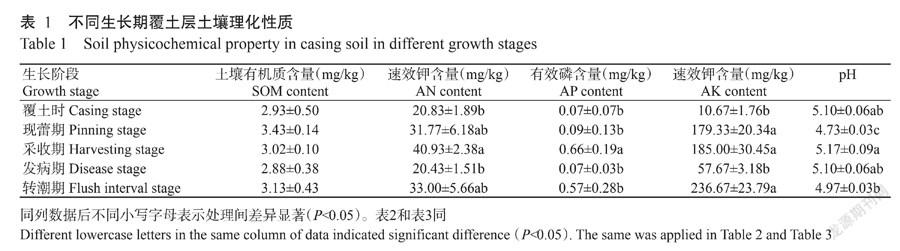
由表1可知,不同生长期覆土层土壤AN、AP和AK含量及pH存在明显差异,SOM含量差异不显著(P>0.05)。土壤AN和AP含量和pH表现为采收期最高,土壤AK含量表现为转潮期含量最高。所有土壤样品的pH均为酸性,现蕾期覆土层土壤pH最低,且与其他时期差异显著(P<0.05,下同)。采收期覆土层的AN、AP和AK含量显著高于同期发生病害的覆土层。
2. 2 不同生长期覆土层土壤微生物群落结构多样性
由图1-A可知,长根菇覆土时土壤细菌的优势属为伯克霍尔德氏菌属(Burkholderia),相对丰度为4.78%,次优势属为罗尔斯通氏菌属(Ralstonia);现蕾期罗尔斯通氏菌属为最优势属,其次是伯克霍尔德氏菌属,丰度分别为4.78%和4.15%;采收期土壤中伯克霍尔德氏菌属是最优势属,相对丰度为9.23%,但发病期的土样则西地西菌属(Cedecea)为最优势属,相对丰度为13.98%,鞘氨醇杆菌属(Sphingobacterium)是第二优势属,相对丰度为12.83%;转潮期土壤中噬几丁质菌属(Chitinophaga)是最优势属,相对丰度为16.98%。不同生长期土壤的细菌组成属与门分类水平的结果不同,优势菌属在不同的样品中存在明显差异,最优势属在不同生长期均不一致。如图1-B所示,不同生长期土壤样品中真菌属水平组成上存在明显差异。对真菌而言,覆土时和现蕾期以镰刀菌属(Fusarium)为最优势属,其相对丰度分别为92.19%和89.06%,采收期仍以镰刀菌属为最优势属,但相对丰度则下降至42.89%;发病期和转潮期的最优势属是木霉属(Trichoderma),相对丰度分别为72.47%和46.73%。在长根菇的生长发育中,覆土层镰刀菌属的相对丰度从92.19%逐渐下降至4.35%,而节丛孢属(Arthrobotrys)和长根菇属(Hymenopellis)的相对丰度则随着生长期的延长而不断增加。
2. 3 不同生长期覆土层土壤微生物群落多样性
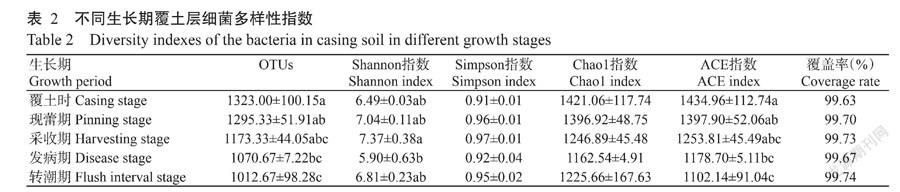
长根菇不同生长期覆土样品中细菌的OTUs数量及多样性指数如表2所示,在97%相似水平上划分的OTUs数量,覆土时最高,为1323个,转潮期最低,为1012个。本研究中5个样品覆盖率为99.63%~99.74%,Chao1指数为1162.54~1421.06,ACE指数为1102.14~1434.96,Shannon指数为5.09~7.37,Simpson指数为0.91~0.97。覆土时的Chao1和ACE指数最高,覆盖率最低。采收期的Shannon和Simpson多样性指数最高,发病期Chao1指数、Shannon指数和Simpson指数最低。采收期的覆土层细菌4个物种多样性指数均高于发病期,且Shannon指数差异显著。
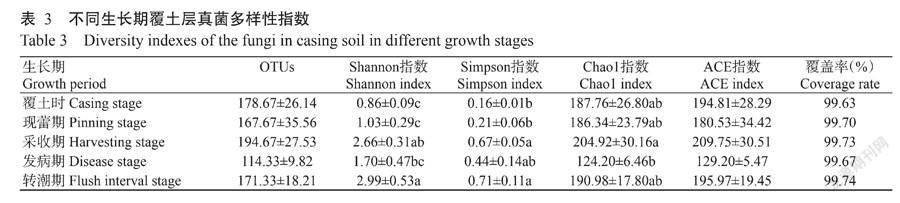
真菌多样性分析见表3,OTUs数量介于114.33~194.67,采收期数量最多,但发生病害的采收期OTUs数量最少。各样品的Shannon指数为0.86~2.99,Simpson指数为0.16~0.71。转潮期的Shannon和Simpson多样性指数最高;覆土時Shannon和Simpson指数最低,Chao1指数为124.20~204.92,ACE指数为129.20~209.75;采收期的Chao1和ACE指数最高,发生病害时则最低。发病期覆土层的微生物多样性较低,其他指数均低于采收期,说明木霉病害的发生严重改变了土壤微生物群落结构,同时降低了物种数量及丰度。
2. 4 不同生长期覆土层土壤微生物群落β多样性
以加权Unifrac距离矩阵对相对丰度排序前10的细菌优势门进行UPGMA聚类分析,结果如图2-A所示,在加权Unifrac距离为0.08的水平上,5组样本聚成两大类。第一类由覆土时、现蕾期和采收期组成,包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)和酸杆菌门(Acidobacteria);第二类由发病期和转潮期组成,主要以变形菌门(Proteobacteria)拟杆菌门(Bacteroidota)等细菌为主。图2-B显示不同样品的真菌聚类结果,在加权Unifrac距离为0.09的水平上,5组样本被聚为三大类,其中,覆土时和现蕾期聚为一类,采收期和转潮期聚为一类,发病期单独分为一类,说明木霉病害的发生使得细菌和真菌群落发生了较大改变。除去其他(others)外,5组样本均以子囊菌门(Ascomycota)为最优势门,担子菌门(Basidiomycota)次之,子囊菌门和担子菌门的相对丰度之和大于96.50%。
2. 5 土壤理化性质与微生物群落结构的相关性
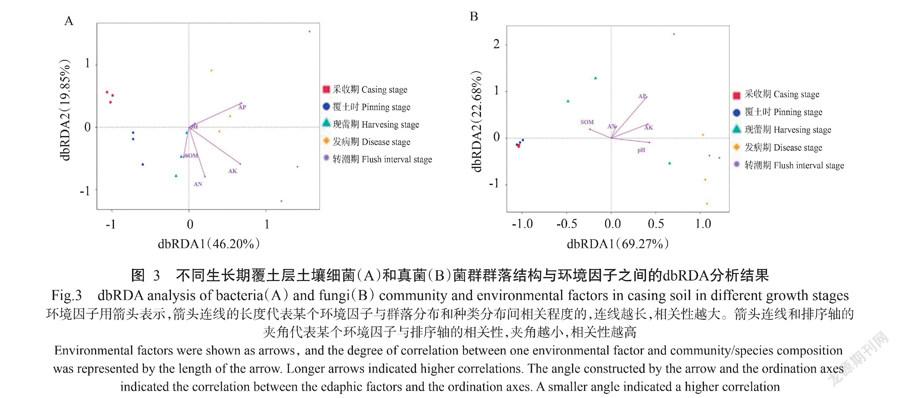
利用dbRDA分析探究土壤理化性质对不同覆土样品微生物群落组成的影响,如图3所示,细菌第一和第二排序轴共解释了66.05%的群落变化,其中对土壤细菌群落影响较大的有土壤AP、AK和AN,土壤pH对土壤细菌群落影响较小;对于土壤真菌群落,第一和第二排序轴共解释了91.95%的群落变化,根据对真菌群落影响的排序为土壤pH、AK、AP和SOM,AN对土壤真菌群落的影响较小。SOM与覆土时、现蕾期和采收期土壤的真菌群落呈正相关。pH、AP和AK与采收期和转潮期土壤的细菌和真菌群落均呈正相关性,AN与该阶段土壤微生物群落相关性不明显,而SOM则与该阶段土壤微生物有显著负相关。SOM与生长前期土壤微生物群落呈正相关,AN、AP、AK和pH则与转潮期土壤呈正相关,是影响土壤微生物群落结构的主要环境因子。
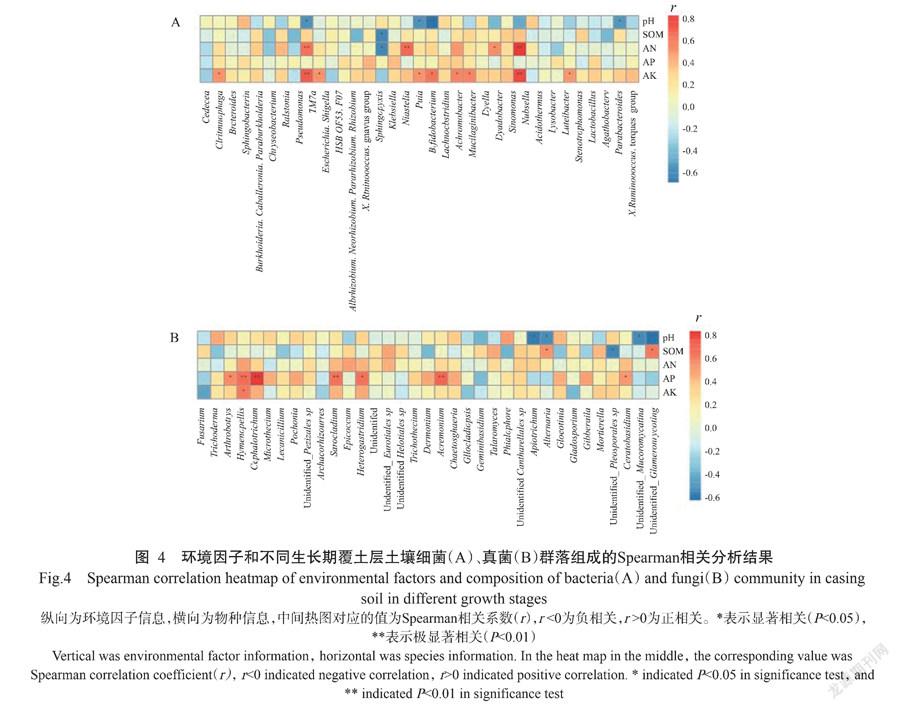
对覆土层土壤微生物细菌属与环境因子进行Spearman相关分析,结果如图4所示。AN与慢生根瘤菌属(Bradyrhizobium)、蒲氏杆菌属(Puia)和TM7a呈极显著正相关(P<0.01,下同),与中华单胞菌属(Sinomonas)呈显著正相关;SOM与克雷伯氏菌属(Klebsiella)呈显著负相关;pH与细菌4个属呈显著或极显著的负相关,而AP对土壤细菌群落结构未产生显著影响。而就真菌而言,AP与土壤真菌群落中的4个属即枝顶孢属(Acremonium)、头束霉属(Cephalotrichum)、长根菇属(Hymenopellis)和帚枝霉属(Sarocladium)呈极显著正相关,与节丛孢属(Athrobotrys)、角担菌属(Ceratobasidium)和Heterogastridium属呈显著正相关;SOM与土壤真菌群落中的链格孢属(Alternaria)呈显著正相关,与土壤细菌群落中的克雷伯氏菌属(klebsiella)呈显著负相关; pH则与4个属的真菌OUTs呈显著负相关;AN和AK对真菌群落没有表现出相关性。
2. 6 不同覆土阶段长根菇高丰度细菌潜在功能分析
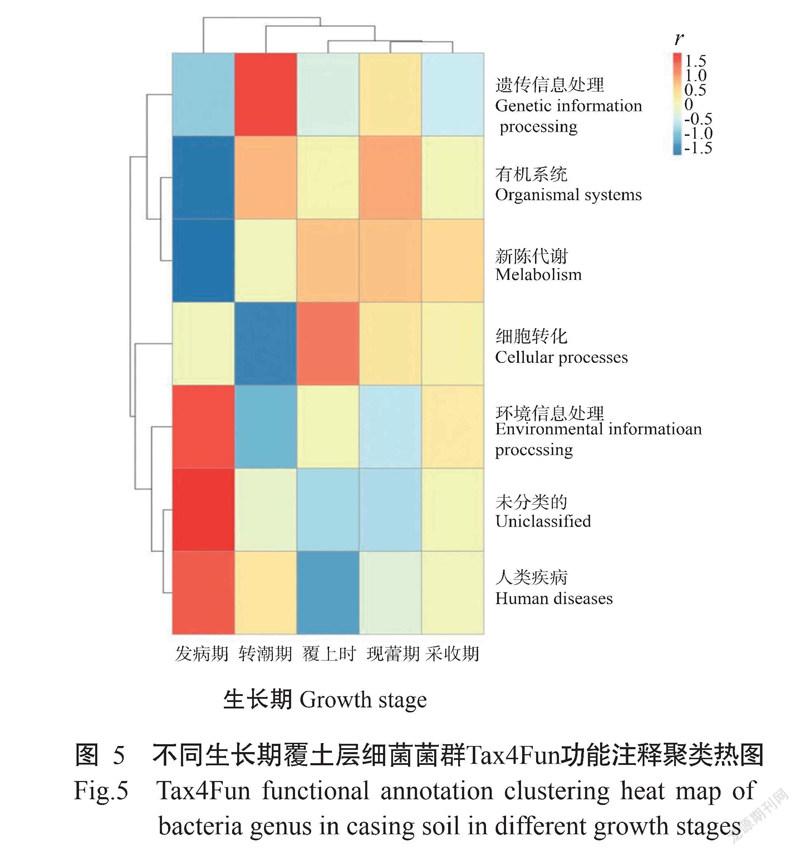
使用Tax4Fun对样品进行功能注释并结合丰度信息,从功能差异层面进行聚类,结果如图5所示,人类疾病(Human diseases)和环境信息处理(Environmental information processing)相关的细菌菌群与发病期土壤样品呈正相关,而与其他样品的相关性不大。另外,还有一类与人类疾病功能接近的菌群被划分为unclassified,说明木霉的大量繁殖使土壤中与人类疾病和环境信息相关的细菌大量扩繁,土壤潜在致病风险增加。
3 讨论
高通量测序技术的发展为高效分析微生物群落结构组成提供了一个强大的平台(Benucci et al.,2019),因此高通量的测序方法是研究土壤微生物群落以及功能的一个非常有效手段(Claesson et al.,2009;张彩霞,2012;Li et al.,2016)。Gong等(2018)、Ke等(2019)均选择利用高通量的测序方法进行食用菌栽培期间微生物多样性的相关研究。本研究获得了3650个细菌OTUs和931个真菌OTUs,同时存在一定比例的微生物为unidentified,未定义到具体的分类单元,表明长根菇覆土土壤中存在大量未知的微生物,同时证明了土壤微生物群落功能的复杂性。
在长根菇的生长发育过程中,覆土层土壤中细菌和真菌在组成和优势菌属上存在明显差异,对土壤微生态起到一定的调节作用。伯克霍尔德氏菌属是长根菇覆土时和采收期土壤的最优势属,伯克霍尔德氏菌属的相对丰度在长根菇生长期中呈先下降、后上升、再迅速下降的趋势,其数量在正常采收期时最高而在转潮期最低。可能是因为伯克霍尔德氏菌属是一种强竞争力的根围定殖细菌(梁晓洁,2020),随着长根菇子实体的大量生长,其在子实体菌根周围大量繁殖。由于长根菇的不断采收,数量不断减少,再加上采收时菌根不断带走周围土壤,导致伯克霍尔德氏菌属的数量不断下降,在转潮期数量达最低值。罗尔斯通氏菌属是现蕾期土壤中最优势属,其相对丰度在长根菇生长期中呈先上升、后逐渐下降的趋势,与土壤中有机质含量的变化趋势相一致,应该与罗尔斯通氏菌属具有较强的化能自养能力,能直接利用有机碳源异养生长有关(马哲等,2021)。噬几丁质菌属在各生长阶段的土壤中均有分布,并于转潮期丰富度达最大。镰刀菌属是前3个阶段土壤的真菌最优势属,并在覆土时和现蕾期具有92.19%和89.06%的绝对优势,而后大幅度下降,究其原因可能是长根菇子实体在生长过程中释放的某些物质对其有明显的抑制作用,也为镰刀菌属病原菌的防治提供一定的研究思路。节丛孢属丰富度从现蕾期起逐漸增加,该属真菌具有捕捉和杀死线虫的能力,在食用菌栽培中被用于控制线虫数量(Goltapeh et al.,2008)。
木霉是土壤中一类普遍存在的真菌,生长速度快且产孢能力强,具有强腐生竞争力;其主要来源于覆土土壤,加之木霉与食用菌的生长条件高度重合,在不通风的环境下极易发生木霉的大量繁殖(Hassan et al.,2019)。发病期土壤中SOM、AN、AP和AK的含量均低于采收期,其中AP含量下降最多,仅为正常采收期的10.61%。除木霉寄生于食用菌菌丝上,包裹菌包生长,并产生有毒物质,抑制和消解菌丝体外(吴小平,2008),木霉繁殖大量消耗土壤中营养元素同样阻碍了长根菇菌丝的生长,严重影响长根菇的产量。木霉病害的暴发使得木霉属在发病采收期相对丰度高达72.74%,整体上减少了土壤微生物多样性和丰度,其中细菌多样性指数略微下降而真菌各多样性指数均有大幅度的下降。该结果与木霉作为生防菌株治理植物病害时,对土壤中微生物群落多样性所造成的影响相一致(马建华,2010;王宁等,2018)。从土壤细菌的潜在功能分析结果可知,木霉病害发生后,土壤中与人类疾病和环境信息相关的细菌菌群有了显著的增长,说明木霉的大量繁殖破坏了土壤中微生物的平衡,改变了细菌的群落结构,使得土壤中致病菌数量增多、潜在致病风险上升,另外土壤中还会有虫害暴发或者虫卵富集的情况,给覆土层土壤的再利用增加了难度。
本研究还对长根菇覆土生长阶段土壤理化因子的变化进行了研究,通过dbRDA分析可知,土壤理化因子是长根菇覆土土壤的微生物群落结构及其多样性的主要因素,显著影响土壤中真菌群落结构,这与李敏和闫伟(2019)的研究结果有相同之处。AN、AK含量和pH在不同生长期有着显著的差异,说明这3个理化因子对长根菇的生长有较大的影响,而SOM和AP对长根菇的覆土生长影响不明显;在工厂化栽培长根菇后期可通过对AN和AK含量的添加来调节长根菇的生长。长根菇喜生于偏酸性土壤中(罗影等,2021),且pH对发病期土壤细菌和真菌均为显著正相关,木霉大量发生会降低土壤pH;木霉病害暴发初期可通过在发生部位施撒生石灰等方式调节pH,以控制木霉(秦文韬等,2020)。
长根菇不同生长阶段覆土层土壤细菌和真菌的微生物群落均發生较显著变化,长根菇生长过程能引起土壤生物和非生物组分特征的一系列变化,特别是木霉病害的发生使得细菌和真菌的物种数量和丰富度均有大幅度的降低,但其变化的具体机制尚不清楚,需展开进一步的试验进行探究。
4 结论
卵孢长根菇的生长能改变覆土层土壤微生物群落多样性,不同生长阶段覆土层土壤真菌物种数量在采收期达最大值,细菌物种数量则随着长根菇的生长而不断下降。木霉病害的发生对土壤微生物种类和丰度均有显著抑制作用,同时大量消耗土壤的营养元素,降低pH。
参考文献:
鲍士旦. 2003. 土壤农化分析[M]. 第3版. 北京:中国农业出版社. [Bao S D. 2003. Soil agrochemical analysis[M]. The 3rd Edition. Beijing:China Agricultural Press.]
陈诚,李强,黄文丽,王剑,伏荣桃,罗曦,卢代华. 2017. 羊肚菌白霉病发生对土壤真菌群落结构的影响[J]. 微生物学通报,44(11):2652-2659. [Chen C,Li Q,Huang W L,Wang J,Fu R T,Luo X,Lu D H. 2017. Effects of Morchella white mold disease on soil fungal community structure[J]. Microbiology,44(11):2652-2659.] doi:10.13344/j.microbiol.china.170030.
李传华,尚晓冬,曲明清,谭琦. 2011. 中国奥德蘑属栽培研究进展[J]. 食用菌学报,18(4):95-98. [Li C H,Shang X D,Qu M Q,Tan Q. 2011. Cultivation of Oudemansiellain China—A review[J]. Acta Edulis Fungi,18(4):95-98.] doi:10.16488/j.cnki.1005-9873.2011.04.027.
李敏,闫伟. 2019. 海拔对乌拉山油松根围真菌群落结构的影响[J]. 菌物学报,38(11):1992-2006. [Li M,Yan W. 2019. Effects of altitude on rhizosphere fungal community structure of Pinus tabulaeformis in Wula Mountain,China[J]. Mycosystema,38(11):1992-2006.] doi:10. 13346/j.mycosystema.190243.
李晓谦,朱京海,宋有涛. 2015. 景观遗传学中Mantel检验和dbRDA统计方法的对比分析[J]. 辽宁大学学报(自然科学版),42(4):289-295. [Li X Q,Zhu J H,Song Y T. 2015. Comparison and analysis of statistics methods of mantel test and dbRDA in landscape geneticsc[J]. Journal of Liaoning University(Natural Sciences Edition),42(4):289-295.] doi:10.16197/j.cnki.lnunse.2015.04.001.
梁晓洁. 2020. 油桐枯萎病拮抗菌伯克霍尔德氏菌Burk-holderia arboris(Ba1)的分离鉴定及拮抗作用研究[D]. 北京:中国林业科学研究院. [Liang X J. 2020. Isolation,identification and antagonism study of Burkholderia arboris (Ba1) against Fusarium wilt disease[D]. Beijing:Chinese Academy of Forestry.]
罗影,关永强,贾培松,赵振豪,努尔孜亚·亚力买买提,魏鹏,贾文捷. 2021. 黑皮鸡枞的分子鉴定与营养需求研究[J]. 安徽农业科学,49(16):44-50. [Luo Y,Guan Y Q,Jia P S,Zhao Z H,Yalimaimaiti N,Wei P,Jia W J. 2021. Study of molecular identification and nutritional equirement of Hymenopellis raphanipes[J]. Journal of Anhui Agricultural Sciences,49(16):44-50.] doi:10.3969/j.issn.0517-6611.2021.16.013.
马建华,张丽荣,康萍芝,杜玉宁. 2010. 秸秆生物反应堆技术的应用对设施黄瓜土壤微生物的影响[J]. 西北农业学报,19(12):161-165. [Ma J H,Zhang L R,Kang P Z,Du Y N. 2010. Application impact of straw bio-reactor technology on soil microbial of facility cucumber[J]. Acta Agriculturae Boreali-occidentalis Sinica,19(12):161-165.] doi:10.3969/j.issn.1004-1389.2010.12.032.
马哲,刘丹,刘梦晓,曹英秀,宋浩. 2021. CO2到高附加值产物:罗尔斯通氏菌的固碳研究进展[J]. 科学通报,66(33):4218-4230. [Ma Z,Liu D,Liu M X,Cao Y X,Song H. 2021. From CO2 to high value-added products:Advances on carbon sequestration by Ralstonia eutropha H16[J]. Chinese Science Bulletin,66(33):4218-4230.] doi:10.1360/TB-2021-0584.
秦文韬,王守现,荣成博,宋忠娟,刘宇. 2020. 我国食用菌病害发生与防控概况[J]. 中国食用菌,39(12):1-7. [Qin W T,Wang S X,Rong C B,Song Z J,Liu Y. 2020. Occurrence and management of edible fungus diseases in China[J]. Edible Fungi of China,39(12):1-7.] doi:10. 13629/j.cnki.53-1054.2020.12.001.
沈新芬,姚明军,沈渊,余琛. 2019. 泥炭覆土厚度对双孢蘑菇产量及品质的影响[J]. 食用菌,41(5):46-48. [Shen X F,Yao M J,Shen Y,Yu C. 2019. Effect of thickness of peat casing soil on yield and quality of Agaricus bisporus[J]. Edible Fungi,41(5):46-48.]
孙思国. 2010. 黑皮鸡枞菌生产方法:中国,CN2007101158 66.7[P]. 2010-09-29. [Sun S G. 2010. Production method of black skin chicken fir fungus:China,CN200710115866.7[P]. 2010-09-29.]
王琳,魏启舜,周影,赵荷娟,陈悦,李辉信. 郭成宝. 2018. 覆土层益生菌恶臭假单胞菌TK3对双孢蘑菇的促生作用[J]. 食用菌学报,25(3):23-29. [Wang L,Wei Q S,Zhou Y,Zhao H J,Chen Y,Li H X,Guo C B. 2018. Addition of Pseudomonas putida TK3 in to the casing soil to promote growth of Agaricus bisporus[J]. Acta Edulis Fungi,25(3):23-29.] doi:10.16488/j.cnki.1005-9873. 2018.03.004.
王宁,刘铜,靳亚忠,咸洪泉. 2018. 木霉菌对土壤微生物多样性及草莓生长和发病的影响[J]. 江苏农业科学,46(18):108-112. [Wang N,Liu T,Jin Y Z,Xian H Q. 2018. Effects of Trichoderma spp. on soil microbial diversity and growth and morbidity of strawberry[J]. Jiangsu Agricultural Sciences,46(18):108-112.] doi:10.15889/j. issn.1002-1302.2018.18.027.
吴小平. 2008. 食用菌致病木霉的鉴定、致病机理及防治研究[D]. 福州:福建农林大学. [Wu X P. 2008. Identification,pathogenic mechanism and control of Trichoderma spp. isolation from edible fungi[D]. Fuzhou:Fujian Agriculture and Forestry University.]
楊晓绒,赖晓辉,吾尔恩·阿合别尔迪,焦子伟,张相锋. 2020. 昭苏县野生羊肚菌根际土壤细菌多样性研究 [J]. 微生物学杂志,40(4):24-33. [Yang X R,Lai X H,Aheberdi U,Jiao Z W,Zhang X F. 2020. Bacterial diversity in rhizosphere soil of wild morels in Zhaosu County[J]. Journal of Microbiology,40(4):24-33.] doi:10.3969/j.issn. 1005-7021.2020.04.004.
张彩霞. 2012. 新一代高通量测序技术研究土壤微生物群落结构对环境条件的响应[D]. 南京:南京农业大学. [Zhang C X. 2012. The research of microorganism composition responces to environment conditions with the next generation high throughput DNA sequencing technology[D]. Nanjing:Nanjing Agricultural University.]
张相锋,杨晓绒,焦子伟. 2019. 伊犁野生羊肚菌根际土壤微生物功能多样性分析[J]. 微生物学杂志,39(2):83-89. [Zhang X F,Yang X R,Jiao Z W. 2019. Functional diversity analysis of rhizosphere soil microorganism of wild Morchella in Yily[J]. Journal of Microbiology,39(2):83-89.] doi:10.3969/j.issn. 1005-7021.2019.02.013.
趙玉卉,路等学,金辉,杨阿丽,秦鹏,魏甲干,郭瑞,张文齐. 2021. 甘肃省野生羊肚菌根际细菌群落与土壤环境因子相关性研究[J]. 微生物学通报,49(2):514-528. [Zhao Y H,Lu D X,Jin H,Yang A L,Qin P,Wei J Q,Guo R,Zhang W Q. 2021. Relationship between the bacterial community and environmental factors in the rhizosphere soil of wild morels in Gansu[J]. Microbiology,49(2):514-528.] doi:10.13344/j.microbiol.china.210592.
Algina J,Keselman H J. 1999. Comparing squared multiple correlation coefficients:Examination of a confidence interval and a test significance[J]. Psychological Methods,4(1):76-83. doi:10.1037/1082-989x.4.1.76.
Benucci G M N,Longley R,Zhang P,Zhao Q,Bonito G,Yu F Q. 2019. Microbial communities associated with the black morel Morchella sextelata cultivated in greenhouses[J]. PeerJ,7:1-19. doi:10.7717/peerj.7744.
Chen S C,Qiu C W,Huang T,Zhou W W,Qi Y C,Gao Y Q,Shen J W,Qiu L Y. 2013. Effect of 1-aminocyclopropane-1-carboxylic acid deaminase producing bacteria on the hyphal growth and primordium initiatiom of Agaricus bisporus[J]. Fungal Ecology,6(1):110-118. doi:10.1016/ j.funeco.2012.08.003.
Ciavatta C,Govi M,Antisari L V,Sequi P. 1991. Determination of organic carbon in aqueous extracts of soilsand fertilizers[J]. Communications in Soil Science and Plant Analysis,22(9-10):795-807. doi:10.1080/00103629109 368455.
Claesson M J,O‘Sullivan O,WANG Q,Nikkilä J,Marchesi J R,Smidt H,Vos W M,Ross RP,O’Toole P W. 2009. Comparative analysis of pyrosequencing and a phylogenetic microarray for exploring microbial community structures in the human distal intestine[J]. PLoS One,4(8):e6669. doi:10.1371/journal.pone.0006669.
Colauto N B,Fermor T R,Eira A F,Linda G. 2016. Pseudomonas pitidastimulates primordial on Agaricus bitorquis[J]. Current Microbiology,72(4):482-488. doi:10.1007/s00284-015-0982-8.
Goltapeh E M,Shams-bakhsh M,Pakdaman B S. 2008. Sensitivity of the Nematophagous Fungus Arthrobotrys
oligospora to fungicides,insecticides and crop supplements used in the commercial cultivation of Agaricus bisporus[J]. Journal of Agricultural Science and Technology,10(4):383-389. doi:10.1111/j.1365-2966.2004.08272.x.
Gong S,Chen C,Zhu J X,Qi G Y,Jiang S X. 2018. Effects of wine-cap Stropharia cultivation on soil nutrients and bacterial communities in forestlands of northern China[J]. PeerJ,6(1):e5741. doi:10.7717/peerj.5741.
Hao Y J,Zhao Q,Wang S X,Yang Z L. 2016. What is the radicate Oudemansiella cultivated in China?[J]. Phytotaxa,286(1):1-12. doi:10.11646/phytotaxa.286.1.1.
Hassan M M,Farid M A,Gaber A. 2019. Rapid identification of Trichoderma koningiopsis and Trichoderma longibrachiatum using sequence characterized amplified region markers[J]. Egyptian Journal of Biological Pest Control,29:2-8. doi:10.1186/s41938-019-0113-0.
Kalberer P P. 1990. Water realations of the mushroom culture Agaricus bispourus; Study of a single break[J]. Scientia Horticulturae,41(4):277-283. doi:10.1016/0304-4238(90)90108-Q.
Ke L Q,Li P D,Xu J P,Wang Q S,Wang L L,Wen H P. 2019. Microbial communities and soil chemical features associated with commercial production of the medicinal mushroom Ganoderma lingzhi in soil[J]. Scientific Reports,9:1-9. doi:10.1038/s41598-019-52368-2.
Li L,Zhu B,Chen C R,Zhang Z H,Wang Q B,He J S. 2016. Precipitation overrides warming in mediating soil nitrogen pools in an alpine grassland ecosystem on the Tibetan Plateau[J]. Scientific Reports,6:31438. doi:10. 1038/srep31438.
Li Y J,Xu L Y. 2007. Improvement for unweighted pair group method with arithmetic mean and its application[J]. Journal of Beijing University of Technology,33(12):1333-1339. doi:10254-0037(2007)12-1333-07.
Quast C,Pruesse E,Yilmaz P,Gerken J,Schweer T,Yarza P,Peplies J,Glöckner F O. 2013. The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J]. Nucleic Acids Research,41(D1):590-596. doi:10.1093/nar/gks1219.
Wang Q,Garrity G M,Tiedje J M,Cole J R. 2007. Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology,73(16):5261-5267. doi:10.1128/AEM.00062-07.
Xiong Y M,Xia H X,Li Z A,Cai X A,Fu S L. 2008. Impacts of litter and understory removal on soil properties in a subtropical acacia mangium,plantation in China[J]. Plant and Soil,304(1-2):179-188. doi:10.1007/s11104-007-9536-6.
收稿日期:2022-01-16
基金項目:广西重点研发计划项目(桂科AB18221047)
通讯作者:刘斌(1966-),http://orcid.org/0000-0001-9345-4674,教授,主要从事真菌学研究工作,E-mail:liubin@gxu.edu
第一作者:詹颖馨(1997-),https://orcid.org/0000-0002-0764-1607,研究方向为食用菌栽培,E-mail:1270025343@qq.com

