UPLC-QTOF-MS快速筛查与确证中药中马兜铃酸类物质
陈金凤,李慧晨,黄巧,姚宁,何聿
(1. 福建工程学院生态环境与城市建设学院,福建 福州 350118; 2. 福州大学食品安全与生物分析教育部重点实验室,福建 福州 350108)
0 引言
马兜铃酸类物质主要存在于马兜铃属植物和细辛属植物中,集中分布在热带、亚热带[1-2]. 2013年已有报道,长期接触马兜铃酸的尿路上皮癌患者,在基因组上会出现特定的突变[3]. 2017年,研究证实了亚洲人群的肝癌和马兜铃酸及其衍生物导致的基因突变具有高度相关性,这种现象在中国的大陆和台湾地区尤为显著[4]. 另有研究表明,马兜铃酸能够紧密结合在DNA上,导致细胞在复制的时候出错,只要微量就会诱发大量DNA突变,且无法修复,成为癌变的诱因[5-7]. 马兜铃酸作为一类持久性土壤污染物,被植物和土壤吸收后,会成为新一类环境和食品污染物,对人体和环境造成危害,因此对马兜铃酸类物质的检测监控尤为迫切[8]. 马兜铃酸类物质的分析检测方法有近红外光谱法[9]、紫外分光光度法[10]、免疫层析法[11]、高效薄层色谱法[12]、高效毛细管电泳法[13]、气相色谱分析法[14]、传感器法[15]、液质联用法[16-17]及双光谱法[18-19]等,但其主要研究对象为马兜铃酸,未覆盖其多种衍生物. 建立一种准确、高效、可同时检测多种马兜铃酸类物质的检测方法,对中草药、制剂及食品的质量和安全性控制具有重要意义.
超高效液相色谱-四极杆飞行时间串联质谱(ultra-performance liquid chromatography with quadrupole-time-of-flight mass spectrometry, UPLC-QTOF-MS)技术是近年来飞速发展的高精度质谱分析方法,具有灵敏度高、准确度好、高效快速、重现性好等优点,与其他鉴定方法相比,在分析基质复杂的样品方面显示出巨大优势. 本研究基于 UPLC-QTOF-MS 检测技术,对常见的马兜铃酸类中草药、鱼腥草,以及相关中草药制品(中成药、眼药水等)中的马兜铃酸类物质进行高通量筛查,并对在样品中筛查到的6种马兜铃酸类物质进行定量分析,为马兜铃酸类物质的快速筛查鉴定提供技术方法.
1 材料与方法
1.1 仪器
Acquity UPLC H-Class型液相色谱仪、Xevo G2-XS QTOF/MS型质谱仪和UPLC BEH C18 色谱柱(2.1 mm×100 mm,1.7 μm)(美国Waters公司); Milli-Q Advantage A10系统超纯水机(德国Merck公司); BSA124S型电子分析天平(北京赛多利斯科学仪器有限公司); KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司); 350Y型高速多功能粉碎机(永康市铂欧五金制品有限公司); IKA RV10数显型旋转蒸发仪(艾卡(广州)仪器设备有限公司); KDC-160HR型高速冷冻离心机(安徽中科中佳科学仪器有限公司).
1.2 试剂与材料
马兜铃酸A(aristolochic acid A, AA-A)、吲哚美辛购自Mackin公司; 马兜铃酸B (aristolochic acid B, AA-B)、马兜铃酸C(aristolochic acid C, AA-C)、马兜铃酸D(aristolochic acid D, AA-D)、马兜铃内酰胺(aristolactam I, AL-I)、马兜铃酮(aristolone, AE)均购自上海同田生物技术股份有限公司; 乙腈和甲醇(质谱级)购自德国Merck公司; 甲酸、氨水(色谱级)购自美国ACS公司; 氢氧化钠(纯度99.99%)购自美国Sigma-Aldrich公司; 亮氨酸脑啡肽购自美国Waters公司; 乙酸铵(色谱级)购自Mackin公司; 其余试剂均为分析纯.
75个样品(其中:中草药1~31号,中成药32~55号,新鲜鱼腥草56~60号,含鱼腥草眼药水61~75号)通过网络购买、药店购买,以及香港浸会大学药学院友情提供等多渠道获得,样品信息详见附录.
1.3 试验方法
1.3.1标准溶液的配制
对照品试液的配制:称取一定质量AA-A、AA-B、AA-C、AA-D、AL-I、AE 6种标准品,分别溶于甲醇,取各标准品溶液混合均匀,得混合标准液,4 ℃避光冷藏保存; 内标溶液的配制:称取吲哚美辛标准品,溶于甲醇,配成10 mg·L-1的内标溶液,4 ℃冷藏保存.
1.3.2样品溶液的制备
1) 中草药. 将中草药置于通风处晾干,用乙醇和丙酮清洗实验用刀,将中草药切削粉碎后过250 μm孔径的标准筛. 称取0.3 g粉末置于50 mL离心管中,加入10 μL 10 mg·L-1内标溶液避光保存30 min,加入30 mL乙酸乙酯没过样品,避光浸泡30 min. 取出试管,超声萃取60 min,10 000 r·min-1离心10 min,取上清液,经0.45 μm有机滤膜过滤后保存于茄型瓶. 重复萃取1~2次,合并滤液. 旋蒸至干,用1 mL甲醇复溶,经0.22 μm有机滤膜过滤后保存于样品瓶中,4 ℃避光保存待测.
2) 中成药. a) 胶囊类. 按照药品说明书取一日用量. 去掉胶囊外壳,将药粉置于50 mL离心管中,后续按中草药前处理方法进行萃取. b) 颗粒冲剂类. 按照药品说明书取一日用量,打开包装放入50 mL离心管中,加入10 μL 10 mg·L-1内标溶液后避光保存30 min,加适量水溶解后,加入30 mL乙酸乙酯,后续按中草药前处理方法进行萃取. c) 液体药剂类. 按照药品说明书取一日用量,将液体药剂倒入250 mL分液漏斗中,加入10 μL 10 mg·L-1内标溶液避光保存30 min后,再加入30 mL乙酸乙酯; 振荡萃取多次,取上层清液,旋蒸至干后,用1 mL甲醇复溶,经0.22 μm有机滤膜过滤后保存于样品瓶中,4 ℃避光保存待测.
3) 新鲜鱼腥草. 去泥洗净、自然风干,称取约6 g,切成小段置于50 mL离心管中,用玻璃棒碾碎后,加入10 μL 10 mg·L-1内标溶液,后续按中草药前处理方法进行萃取.
4) 含鱼腥草眼药水. 取5 mL眼药水置于茄型瓶中,40 ℃水浴旋蒸至干,用250 μL甲醇复溶,经0.22 μm有机滤膜过滤后保存于样品瓶中,4 ℃避光保存待测.
1.3.3色谱方法
ACQUITY UPLC-BEH C18 色谱柱(2.1 mm×100 mm,1.7 μm). 流动相A为水(含 10 mmol·L-1乙酸铵),流动相B为甲醇,柱温为40 ℃,流速为0.2 mL·min-1,进样量为3 μL.
梯度洗脱程序:0~0.25 min,80%(体积分数,以下同)A; 0.25~6.25 min,80% A→1% A; 6.25~12.50 min,1% A; 12.50~12.51 min,1% A→80% A; 12.51~13.50 min,80% A.
1.3.4质谱方法
选择电喷雾离子源,采用正离子扫描模式; 毛细管电压为1 kV,锥孔电压为20 V,离子源温度为120 ℃,去溶剂温度为550 ℃,去溶剂氮气流速为1 000 L·h-1,锥孔氮气流速为50 L·h-1; 扫描时间为0.250 s,采集相对分子质量范围为50~1 200,低能量碰撞电压为 4 V,高能量碰撞电压梯度为10~45 V.
1.3.5定性筛查、定量方法
对处理好的待筛查样品采用MSE模式进行数据采集,借助UNIFI软件中的天然产物信息库,对分子量、分子离子峰、质荷比、碎片离子信息等信息进行对比、筛查,最后以标准品的色谱保留时间tR、母离子和子离子信息进行确证. 以同样的方法对混合标准工作液进行分析,通过UNIFI对定性筛查出的阳性药物选择母离子进行定量分析.
2 实验结果与分析
2.1 方法优化
分别考察甲醇、乙醇、乙酸乙酯、氯仿、乙腈、异丙醇、正己烷、石油醚、丙酮等溶剂对马兜铃酸类物质的提取效率,经对比选择乙酸乙酯作为最优萃取溶剂. 为减少溶剂效应,选择甲醇作为复溶试剂.
2.2 马兜铃酸类物质的筛查与确证
MS同时采用两种模式采集单次UPLC的进样数据,一种是低碰撞能采集全扫MS母离子信息,另一种是高碰撞能采集其相应的MS/MS碎片离子信息. 借助UNIFI软件,将低碰撞能MS全扫描得到的组分列表与数据库中的母离子信息进行匹配,同时通过匹配数据库中的已知关键诊断碎片离子或匹配MassFragmentTM在高碰撞能MSE全扫描中生成的预测碎片离子来确证碎片离子. 列出与天然产物数据库匹配的所有化合物(离子计数高于5 000),选择“良好匹配”模板,即所列出的结果必须有匹配的母离子(相对分子质量误差<2×10-3),且至少有一种诊断碎片离子. 在上述模板下,75个样品中共筛查出6种马兜铃酸类物质,其结构图如图1,对应的匹配标准信息见表1. 马兜铃酸类混合标准品与23号样品马鞍山青木香的总离子流图(total ion chromatogram, TIC)见图2及图3,图4表示马鞍山青木香中提取的6种马兜铃酸类成分的基峰离子色谱图(base peak chromatogram, BPC).

图1 6种马兜铃酸类物质的结构Fig.1 Structure of the six aristolochia substances

表1 马兜铃酸类物质的筛查结果
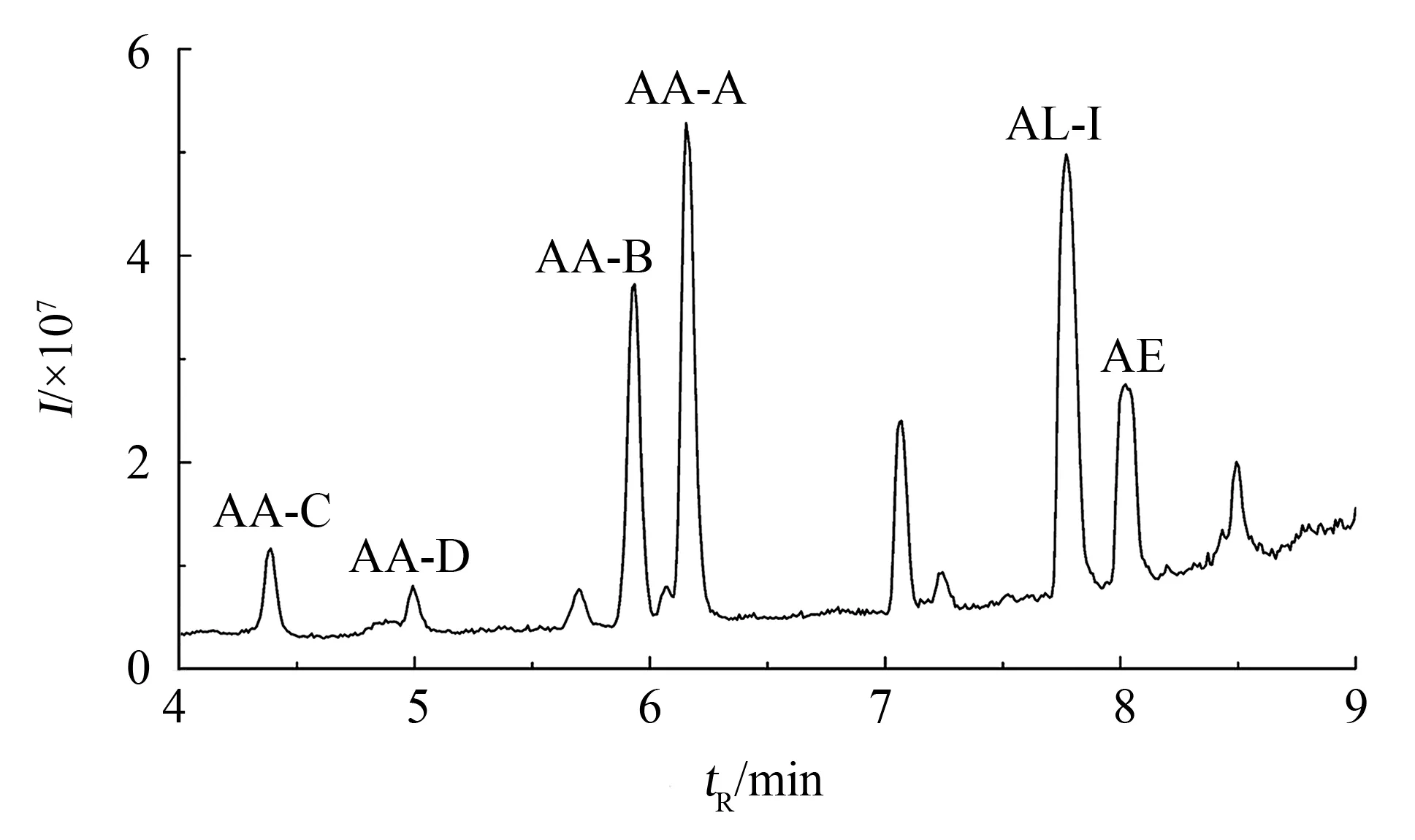
图2 马兜铃酸类混合标准品的TIC图Fig.2 TIC of the mixed aristolochia substances

图3 马鞍山青木香样品的TIC图Fig.3 TIC of the radix aristolochiae from Ma’anshan

图4 马鞍山青木香样品中提取AA-A, AA-B, AA-C, AA-D, AL-I和AE的BPC图Fig.4 BPC of AA-A, AA-B, AA-C, AA-D, AL-I and AE extracted from the radix aristolochiae from Ma’anshan
2.3 方法评价
2.3.1标准曲线、线性范围与检测限
在多反应监测扫描模式下对高精度二级碎片进行定量分析,选择性更强. 使用优化后的质谱条件,以10 mg·L-1吲哚美辛溶液作为内标物,按照表1确定的碎片离子及对应的质荷比进行工作曲线的绘制,确定方法的检测限及线性范围,如表2所示.

表2 6种马兜铃酸类物质的标准曲线
2.3.2回收率与精密度
选取含马兜铃酸类物质种类较少、含量最低的27号样品南木鱼作为回收率实验的样品,分别添加低、中、高3个浓度水平的马兜铃酸类标准溶液,样品经前处理后测试,得到各马兜铃酸类物质的标准添加平均回收率与精密度,6种马兜铃酸类物质各浓度的回收率在86.27%~106.89%之间,回收率良好且可信度高.
2.4 样品检出结果与分析
马兜铃酸类中草药中马兜铃酸类物质的检出结果如图5所示.

图5 中草药中马兜铃酸类物质的检出结果Fig.5 Detection results of the aristolochia substances in Chinese herbal medicines
由图5可知,31种中草药均有AE 检出,28 种中草药检出 AA-A,24 种中草药检出 AA-B,9 种中草药检出 AA-C,14 种中草药检出 AA-D 及 AL-I. 在2号纯野生木防己、4号野生广西马兜铃、8号定心草、11号朱砂莲、12号野生青木香、13号野生马兜铃、18号青木香、23号马鞍山青木香和30号野生北马兜铃中,6 种马兜铃酸类物质均检出,其中23号马鞍山青木香中 6 种马兜铃酸类物质的含量最高,AA-A的检出质量浓度达到 289.21 mg·L-1; 17号寻骨风和26号天仙藤中 AA-A、AE 的含量也较高. 各类物质的检出质量浓度范围如下:AA-A在0.06~289.21 mg·L-1,AA-B在0.21~17.60 mg·L-1,AA-C在0.34~37.17 mg·L-1,AA-D在0.22~11.28 mg·L-1,AL-I在0.06~2.42 mg·L-1,AE在0.11~14.08 mg·L-1. 检出率在29.0%~100%范围内,排序为:AE> AA-A> AA-B> AA-D= AL-I> AA-C.
含马兜铃酸类的中成药中马兜铃酸类物质的筛查定量结果如图6所示. 从图中可知:9种中成药检出AA-A,3种中成药检出 AA-B,1种中成药检出AA-C,7种中成药检出AA-D,15种中成药检出AL-I及AE. 常用药中,32号、36号、44号、49号、51号和52号样品的马兜铃酸类物质检出较高. 各类物质的检出质量浓度范围如下:AA-A在0.06~11.88 mg·L-1,AA-B在0.05~5.00 mg·L-1,AA-C在 0.66 mg·L-1,AA-D在0.21~0.37 mg·L-1,AL-I在0.06~20.94 mg·L-1,AE在0.05~1.27 mg·L-1. 检出率在4.2%~37.5%范围内,排序为:AL-I= AE> AA-A> AA-D> AA-B> AA-C.
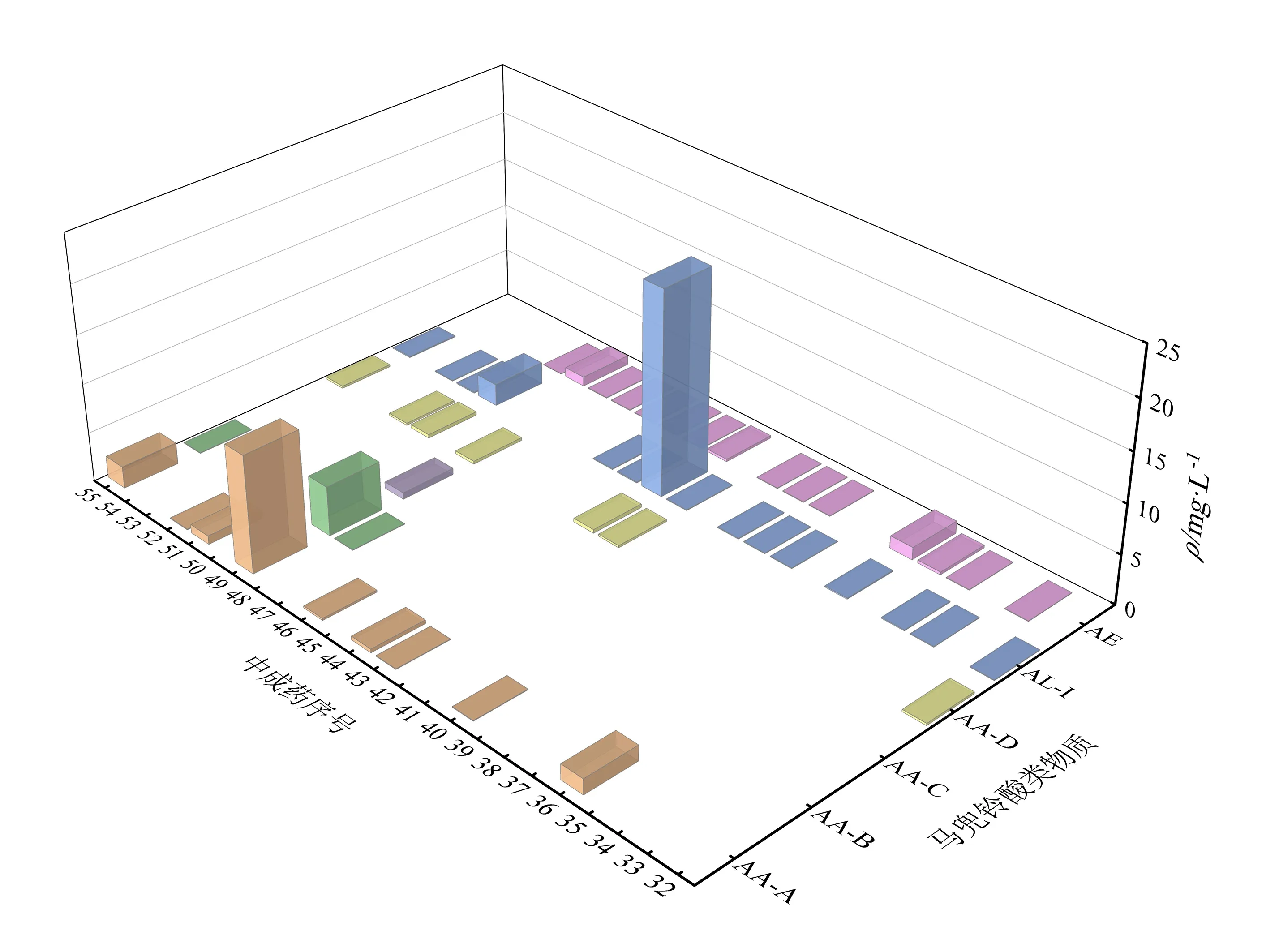
图6 中成药中马兜铃酸类物质筛查的结果Fig.6 Detection results of the aristolochia substances in Chinese patent medicines
由于鱼腥草湿重较大,提取效率低,故检出值较低. 筛查结果表明5 种鱼腥草均有 AE 检出,在57号四川鱼腥草中检出AA-A和AL-I,58号贵州鱼腥草中检出AA-A、AA-B,60号福建鱼腥草中检出AA-A. 可见,不同产地的鱼腥草,马兜铃酸类物质的含量有所不同.
含鱼腥草眼药水中也检出马兜铃酸类物质,但含量较低. 15 种眼药水中,7 种眼药水(样品编号为62、65、66、68、69、72、73)有 AL-I 检出(检出率为46.7%),6 种眼药水(样品编号为62、66、69、70、73、75)有 AE 检出(检出率为40.0%),其中样品编号62、66、69、73的眼药水样品中同时检出AL-I和AE.
3 结语
研究采用UPLC与高分辨MS联用,结合UNIFI的天然产物数据库,建立一种准确、快速、高通量的筛查方法,用于检测中草药、中成药等相关制品中的马兜铃酸类物质. 通过对4种类型共75 个样品的筛查分析,发现31 种中草药中均有马兜铃酸类物质检出,其中马鞍山青木香中的马兜铃酸类物质含量最高,广东白金古榄中的含量最低; 23 种中成药中均有检出马兜铃酸类物质,部分药品中马兜铃酸类物质含量偏高; 5 种新鲜鱼腥草中均检出马兜铃酸类物质,且在不同产地鱼腥草中的含量差别较大; 部分含鱼腥草眼药水中可检出AL-I和AE. 本方法具有良好的回收率和精密度,能够应用于实际样品的快速筛查和鉴定,为马兜铃酸类物质的快速识别提供高效、可靠的检测方法.
——凹脉马兜铃

