黄原胶对微米铁修复地下水氯代脂肪烃污染的影响机制
高 涵,许思雨,黄宣淇,张俊杰*,张 强
1.齐鲁工业大学(山东省科学院)环境科学与工程学院,山东 济南 250353;2.齐鲁工业大学(山东省科学院)生态研究所,山东省应用微生物重点实验室,山东 济南 250103
当前,地下水重质非水相液体(Dense Nonaqueous Phase Liquids,DNAPLs)污染已成为众多工业化国家面临的重要环境问题。其中,氯代脂肪烃(Chlorinated aliphatic hydrocarbons,CAHs)是目前世界范围内地下水中检出率最高的一类DNAPLs。其进入地下环境以后,形成长期的二次污染源,在下游强径流区形成水相污染羽[1],极大地增加了地下水CAHs污染治理的难度。
基于小颗粒零价铁的原位反应带(in-situ reduction zones,IRZ)技术可有效修复地下水CAHs污染[2]。零价铁降解典型CAHs的主要反应途径如图1所示[3]。
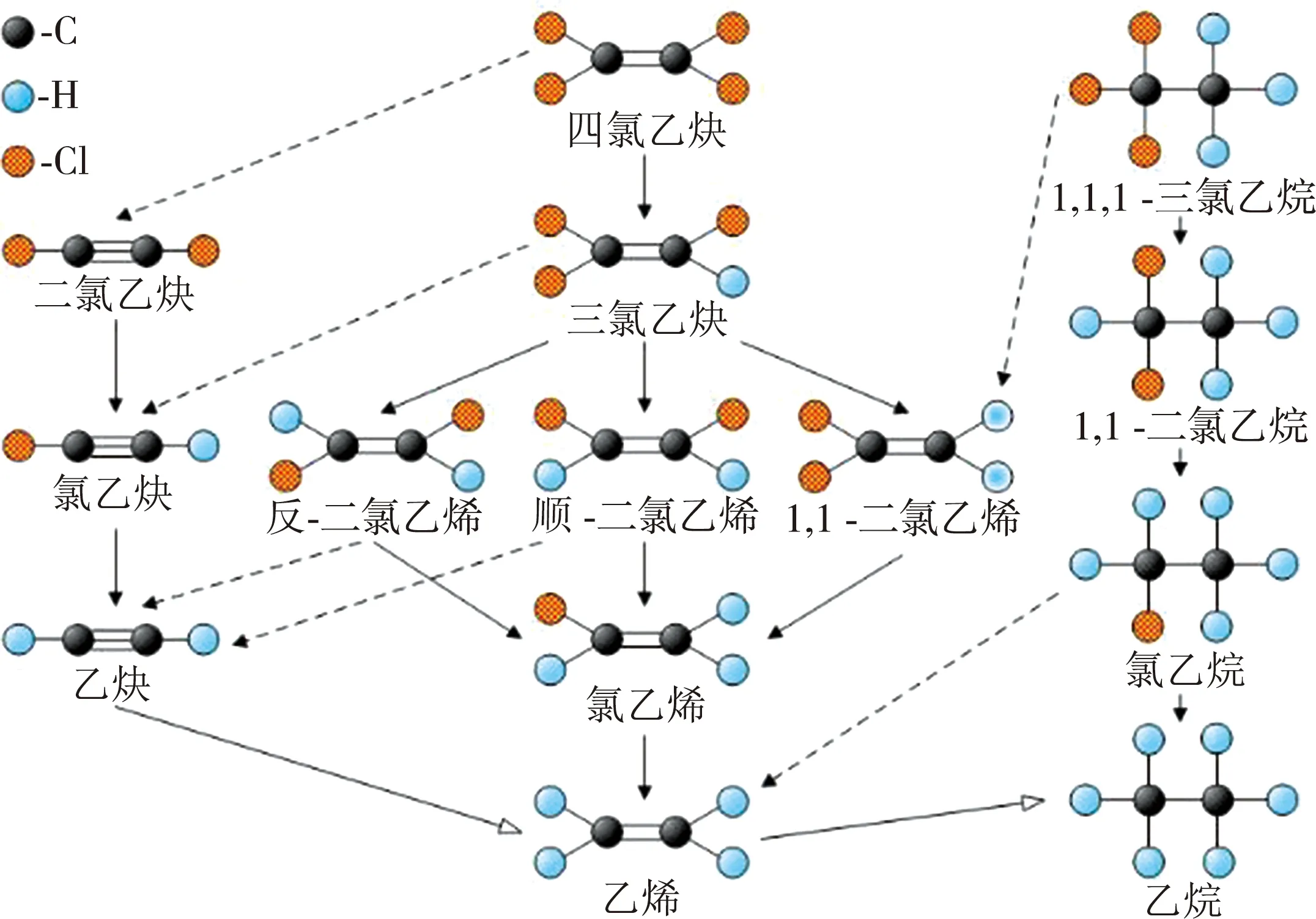
注:实线代表氢解作用(hydrogenolysis);虚线代表还原β-去除作用(reductive β-elimination);空心箭头代表不涉及脱氯的还原反应。
Velimirovic等[4]评估了系列微米铁样本对典型CAHs的去除效能并计算了去除动力学常数kSA,发现铁材料的比表面积是影响其反应速率的重要因素。Comba等[5]对多处针对地下水氯代烃的工程修复案例进行了统计分析,结果显示,在不结合其他技术(如添加有机组分、有催化剂存在等)的情况下,微米零价铁(microscale zero-valent iron,mZVI)对氯代烃的降解效能高于纳米零价铁(nanoscale zero-valent iron,nZVI)。相对于nZVI,mZVI作为IRZ介质的健康风险低[6],而且市场价格通常仅为nZVI的五分之一左右[7]。基于以上优点,mZVI在氯代烃污染场地修复工程中逐渐受到青睐。然而,mZVI颗粒因为密度较大而容易发生重力沉降[8],导致其在地下水中的悬浮稳定性较差,严重影响了其在含水介质中的迁移性能。为了解决这个问题,通常的做法是引入稳定剂对mZVI进行改性。稳定剂需随mZVI颗粒注入含水层,要求其不能产生二次污染。因此,瓜尔胶[9]、黄原胶[10]、海藻酸钠[8]、羧甲基纤维素[11]等生物高分子因为价格低廉、环境相容性好而逐渐受到关注。Han等[12]以改性mZVI的悬浮稳定性和对三氯乙烯的去除率为评价指标,对瓜尔胶、黄原胶和羧甲基纤维素三种稳定剂进行了筛选,发现黄原胶(xanthan gum,XG)在提升铁颗粒脱氯效能和减缓其的重力方面的效果优于瓜尔胶和羧甲基纤维素。Xin等对比了XG改性前后mZVI对三氯乙烯去除效率的差异[13],发现经XG改性的mZVI对三氯乙烯的去除效果显著增强,主要是因为XG对反应体系的pH具有缓冲作用,可以减缓mZVI表面的钝化,从而使其始终保持较强的还原能力。
综上所述,目前在mZVI的筛选以及评估稳定化改性对其反应活性的影响时,目标污染物通常为单一的氯代脂肪烃。然而,实际情况下污染场地的地下水中往往同时存在多种CAHs,这导致目前研究成果在实际应用过程中可能出现偏差。相关研究表明,XG可显著提高mZVI的悬浮稳定性,并且能够促进mZVI对单一的氯代脂肪烃的降解。为此,本研究选取地下水中检出率较高的三种CAHs—四氯乙烯(PCE),三氯乙烯(TCE)和1,1,1-三氯乙烷(1,1,1-TCA)的混合物作为目标污染物,开展以下研究:(1)mZVI对CAHs的去除效能研究:选取3种粒径不同的mZVI构建微反应体系,通过批次实验,考察其去除CAHs的动力学特征,筛选出反应活性强的mZVI作为稳定化改性的对象。(2)XG对mZVI去除CAHs效能的影响机制:用XG对筛选出的mZVI进行稳定化改性,依托去除动力学实验,对比改性前后反应体系特征参数(CAHs还原脱氯量/吸附量、pH、Eh、Fe2+质量浓度)的动态变化过程,从XG的官能团结构、对吸附行为的影响、对水化学条件的改变、对CAHs在铁-水界面传质过程的作用等多个方面考虑,深入探讨其对mZVI去除CAHs效能的影响机制。
1 材料与方法
1.1 实验材料与试剂
本研究使用的mZVI颗粒购买于上海允复纳米科技有限公司。为明确mZVI样品的理化性质,采用激光粒度仪(马尔文Mastersizer2000,英国)测定了其粒径分布;利用全自动比表面和孔径分布分析仪(Autosorb-iQ,美国)通过Brunauer-Emmett-Teller(BET)七点法测定了其比表面积;使用扫描电子显微镜(HitachiS4800,日本)对mZVI颗粒形貌进行了分析。上述理化性质分析的结果由表1和图2所示。

表1 受试mZVI颗粒的理化性质及黄原胶的分子结构

图2 1号铁、2号铁、3号铁颗粒形貌
研究中采用的XG购自阿拉丁试剂(上海)有限公司,其分子结构图见图3。研究中所用的溶液均采用去离子水配置。
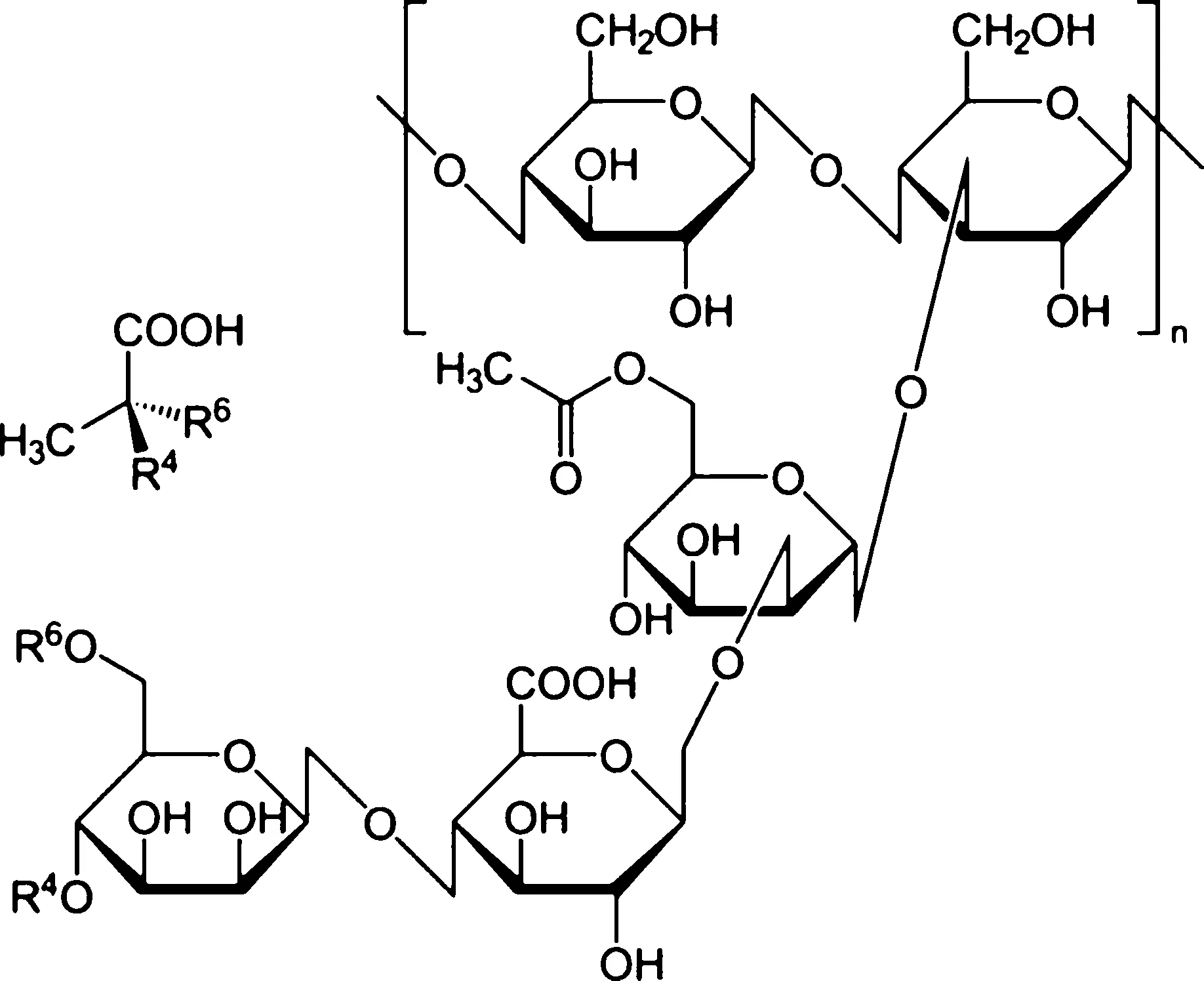
图3 黄原胶分子结构
1.2 微米铁材料的筛选
选取粒径不同的三种mZVI做去除1,1,1-TCA、TCE、PCE的动力学实验,以筛选出反应活性强的微米铁。所有实验均设置三组平行样,并设置空白对照。
构建20 mL的微反应体系,具体操作如下:首先加20 mL去离子水至40 mL样品瓶,加0.4 g mZVI使溶液中铁的质量浓度为20 g/L,模拟地下水的环境条件,通氮气16 min,确保体系内的溶解氧的质量浓度低于2 mg/L,最后加入1,1,1-TCA、TCE、PCE混合液,使污染物浓度为2 mg/L。密封后放置在温度为12 ℃、转速为120 r/min的恒温培养摇床中,设置反应周期为240 h,分别在0 h、6 h、24 h、48 h、96 h、144 h、192 h、240 h取样分析。
测试样品液相中CAHs浓度具体步骤:从20 mL微反应体系中取5 mL液体,加入5 mL正己烷按1:1萃取,用漩涡振荡器振荡2 min后手摇1 min,尽可能使之萃取完全,从萃取液中取0.15 mL用正己烷定容至1.5 mL,利用气相色谱法(Agilent Technoligies 7890B GC System)测定污染物浓度,进而筛选出反应活性强的mZVI。气相色谱仪的运行条件:HP-5型色谱柱(30 m×320 μm×0.25 μm);载气为高纯氮气(99.999%以上);进样方式为分流,分流比20:1;进样量1 μL;柱流量1 mL/min前SS进样口温度200 ℃;后uECD检测器温度320 ℃;柱温程序为初始温度40 ℃,保留5 min,8 ℃/min升温至100 ℃,保留12.5 min。用于定量分析三种CAHs的标准曲线如图4所示。

图4 CAHs标准曲线
1.3 黄原胶改性微米铁浆液的制备
称取一定量的XG粉末加入去离子水中,通过搅拌促进其溶解,得到质量质量浓度为3 g/L的XG溶液。将所得溶液在室温下(20~25 ℃)静置12 h以促进XG的溶解和水化。将500 mL上述溶液分别加入1 L的烧杯中,随后分别加入10.0 g mZVI,充分振荡使铁颗粒分布均匀,得到mZVI质量浓度为20 g/L的XG改性mZVI(XG-mZVI)浆液。
1.4 黄原胶、原状微米铁颗粒和黄原胶改性微米铁的红外表征
分别对XG、原状mZVI以及XG-mZVI在透射模式下进行红外光谱扫描,分析材料的表面官能团构成。实验前预先制备出3 g/L XG包覆的mZVI悬浮液,然后用冻干机(UniEquip,UNICRYO MC2L,德国)进行冷冻干燥,随后收集固态样品粉末进行测试。采用压片法将三种样品分别与光谱纯的溴化钾(KBr)按1∶100的质量比混合均匀后进行压片制样。另外,制备一个纯溴化钾压片。然后用傅里叶变换红外光谱仪(Shimadzu,FTIR-8400S,日本)分别对样品压片和纯溴化钾压片在中红外波段(4 000~400 cm-1)的吸收光谱进行扫描,扫描的分辨率为4 cm-1。最后,将利用纯溴化钾压片得到的背景光谱扣除后即可得到样品的红外谱图。
1.5 黄原胶改性微米铁去除氯代烃的动力学实验
以原状mZVI做对照组,用XG改性后的mZVI进行批次实验。构建相同的20 mL微反应体系,以20 mL 3 g/L的XG溶液取代20 mL水,其余条件相同。在反应周期的0 h、6 h、24 h、48 h、96 h、144 h、192 h、240 h对体系的pH、Eh进行动态监测。
测试样品液相中CAHs浓度的操作步骤同2.2节,可得溶液中的CAHs含量;再从样品瓶内取10 mL液体,采用邻菲啰啉分光光度法(HJ/T 345—2007)测定Fe2+质量浓度。反应体系剩余含铁颗粒的5 mL溶液加入5 mL正己烷萃取,使用漩涡振荡器振荡2 min后手摇1 min,取0.15 mL萃取液用正己烷定容至1.5 mL,待上机分析,与液相内CAHs浓度比对可知mZVI的吸附量。
2 结果与讨论
2.1 微米铁去除氯代烃的动力学特征及黄原胶改性微米铁对氯代烃的去除动力学
为筛选出反应活性强的mZVI,选取三种不同的mZVI构建微反应体系,进行周期为240 h的去除动力学试验。各反应体系内1,1,1-TCA、TCE、PCE的去除率随时间的变化曲线如图5所示。
从图5来看,初始状态1号铁对1,1,1-TCA的去除率为27.02%,2号铁对1,1,1-TCA的去除率为15.73%,3号铁对1,1,1-TCA的去除率为19.65%。直至96 h,1号铁的去除效能明显优于2、3号铁,144 h时去除率略低于3号铁,192 h时去除率低于2号铁,240 h后1号铁优势再次显现。综合整个周期来看,1号铁对1,1,1-TCA的去除效能最好。同样,1号铁对TCE和PCE的去除效能均优于2、3号铁。
反应前期,mZVI对CAHs的去除表现为吸附作用,当吸附到一定程度达到平衡状态,mZVI与CAHs之间开始发生还原脱氯反应,使得CAHs去除率继续增大。1号铁对1,1,1-TCA、TCE和PCE去除率最高,可见小粒径mZVI能更有效地去除地下水中典型CAHs,这与Velimirovic等[4]研究结果相一致。因此,选择1号铁进行稳定化改性。
相关研究证实,XG具有提高mZVI的悬浮稳定性,从而改善其在多孔介质内迁移性能的潜力[14-15]。然而,XG的包覆是否会对mZVI去除CAHs的效率产生抑制作用,是关系到其能否作为稳定剂应用于mZVI改性的关键因素。为此,对XG-mZVI去除CAHs的动力学特征进行考察。每个微反应体系内CAHs去除率随时间的变化趋势如图5所示。实验结果表明,采用XG对mZVI表面改性,可以明显提高1,1,1-TCA、TCE、PCE的去除效果。mZVI去除CAHs主要通过吸附和还原两种方式来实现。稳定剂可以同时以不同方式和程度影响这两种作用过程[13]。
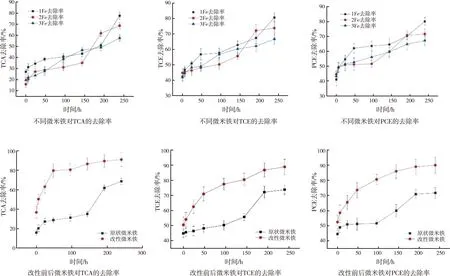
图5 不同微米铁对污染物的去除率及改性前后的污染物去除率
2.2 基于傅立叶变换红外光谱的表面官能团分析
为进一步验证改性的效果,在悬浮稳定性测定的基础上,分别对XG、原状mZVI以及XG-mZVI进行了红外表征,所获得的FTIR谱图如图6所示。
如图6(a)所示,原状mZVI的 FTIR谱图中没有出现明显的特征峰,这与Huang等[16]的研究结果是一致的。而在XG的FTIR谱图6(b)中,在3 411 cm-1处有一个宽峰,这是羟基-OH的伸缩振动引起的红外吸收,在2 910 cm-1处存在一个相对较弱的峰,对应亚甲基-CH2的反对称伸缩振动吸收。位于1 609 cm-1和1 405 cm-1处的峰是解离态羧基-COO-的特征吸收峰,其中,1 609 cm-1处的峰是由解离态羧基中羰基-C=O的反对称伸缩振动引起的,而1 405 cm-1处的峰则对应解离态羧基中羰基的对称伸缩振动所导致的红外吸收[13]。另外,在1 064 cm-1处还存在一个强峰,它对应的是醚键C-O-C的伸缩振动吸收。
XG-mZVI的FTIR谱图如图6(c)所示,从中可以看出,相对于图6(b),羟基所对应的特征峰的位置发生了变化,由此推测mZVI与XG之间可能存在分子间作用力。从羟基的出峰位置看,XG的羟基特征峰出现在3 411 cm-1处,而XG-mZVI的羟基则红移至3 341 cm-1处出峰,表明XG分子与mZVI之间可能存在氢键作用。
比较XG和XG-mZVI的FTIR谱图,发现两者在中红外区域的特征吸收峰数量相同,并且出峰位置基本一致,表明XG包覆在mZVI表面,即mZVI的表面改性效果是比较好的。
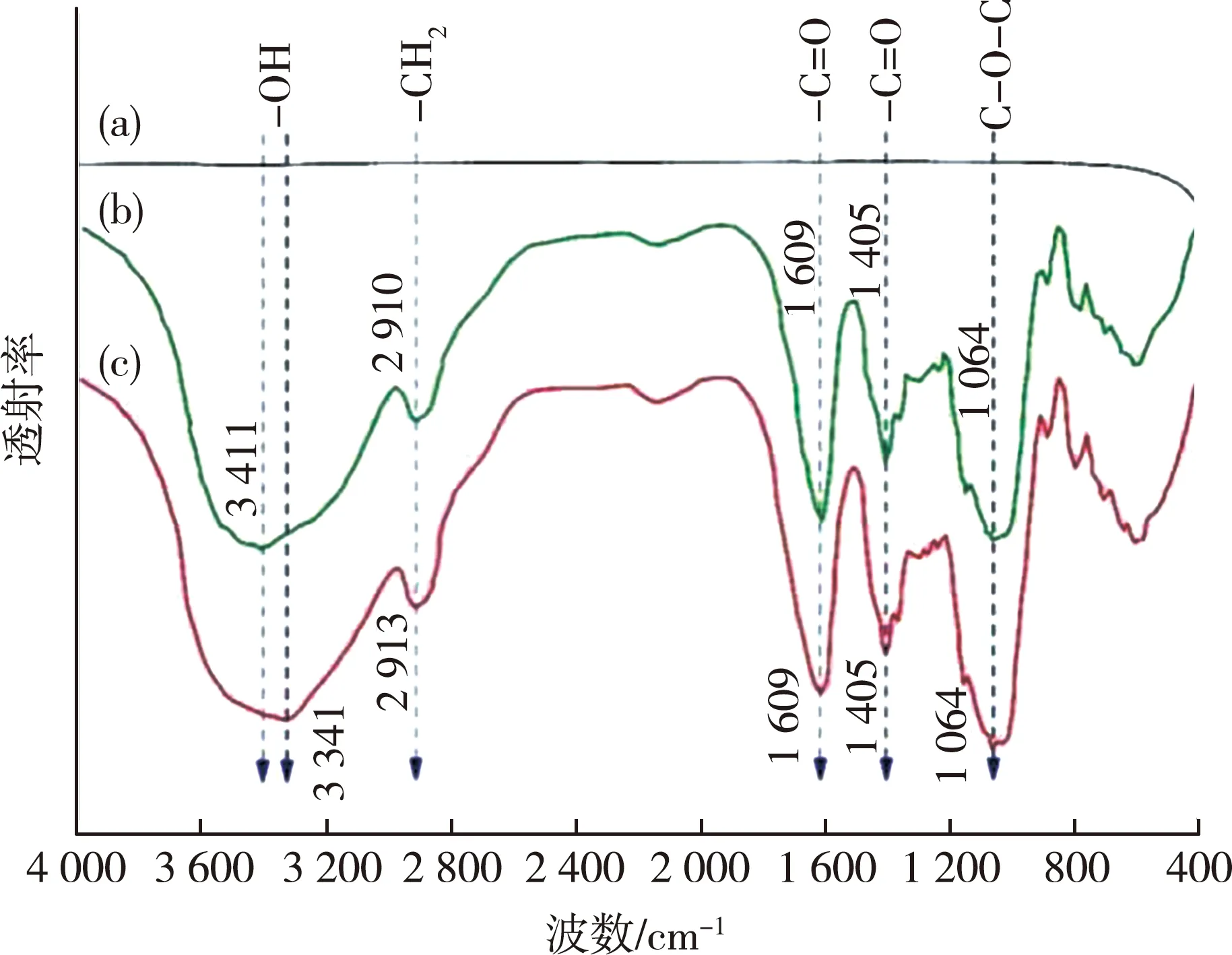
图6 微米铁(a)、黄原胶(b)、黄原胶改性微米铁(c)的傅立叶变换红外光谱
2.3 黄原胶对微米铁吸附与还原氯代烃的影响
基于动力学和表面基团分析,XG 对CAHs的去除可能兼具协同和抑制作用。为进一步证实XG所起的具体作用,进行批次实验以研究原状mZVI和XG-mZVI去除CAHs的动力学,测定实验周期内经由吸附和还原去除的CAHs质量随时间的变化趋势(图7)。如图7(b)所示,单个微反应体系中原状mZVI对TCE的吸附量由6 h的(17.66±0.21)μg 逐渐降低至240 h 的(6.62±0.44)μg,而同一时间段内被还原的 TCE 质量从 (0.75±0.46)μg 增加到 (23.38±0.30)μg。1,1,1-TCA和PCE具有与TCE相似的变化趋势。这表明三者首先被吸附到铁表面,随后发生解吸并被还原。Burris 等曾报道过ZVI 具有吸附氯代烃的能力,这可能是由于铁金属中含碳[17]。因此,实验初期CAHs浓度的迅速下降可能是由于其被吸附在铁表面上所致。随后,通过mZVI 化学还原被进一步去除。
如图7(b)和 图7(e)所示,单个微反应体系内原状mZVI和XG-mZVI在6 h内对TCE的吸附量分别为 (17.66±0.21)μg和(4.27±0.61)μg。对于1,1,1-TCA和PCE,也存在与TCE相似的吸附量差异。这些差异表明 mZVI 表面的 XG 抑制了其对CAHs的吸附。依据前文所述FTIR 分析结果,XG 可通过氢键吸附到 mZVI 表面,与CAHs竞争活性位点,从而减少了CAHs与铁相互作用的机会。此外,结合的 XG 分子由于其亲水特性会抑制 CAHs与铁表面之间的疏水相互作用,从而降低铁表面附近的局部CAHs浓度。
通过对还原反应的分析,发现XG的存在可明显促进CAHs的还原。例如,前 48 h内单个微反应体系中原状mZVI 对TCE 的还原量为(5.34±0.23) μg,而同一时段内,XG-mZVI 对 TCE 的还原量达到(26.01±0.64) μg。在实验周期的第240 h,单个微反应体系中原状mZVI和 XG-mZVI 对TCE 的还原量分别为(23.38±0.30) μg和(33.72±0.79) μg,表明XG能够提高mZVI的还原活性。虽然结合在铁表面的XG分子对疏水性CAHs分子具有排斥作用,使其难以接近铁表面活性位点,但具有酸性官能团的 XG 分子能够缓冲反应体系的pH,抑制铁表面钝化层的形成,并促进电子转移。综上,XG对CAHs还原过程的促进作用强于对其吸附过程的抑制作用,因此整体表现为促进对CAHs的去除。
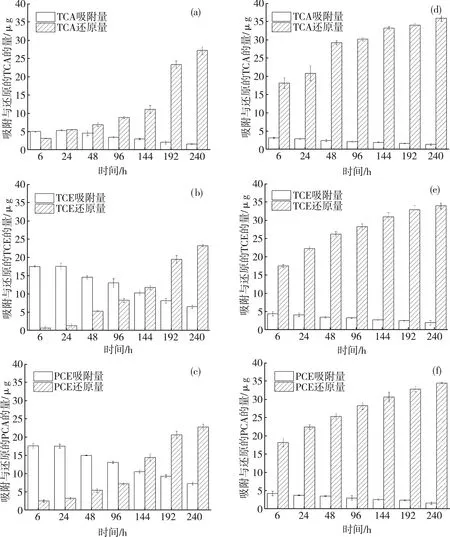
注:(a)~(c)原状微米铁;(d)~(f)黄原胶改性微米铁。
2.4 氯代烃去除过程中反应体系水化学条件的改变
为了进一步探究XG对mZVI还原CAHs过程的影响机理,测定了实验周期内反应体系中pH、Eh和Fe2+质量浓度随时间的的变化情况(图8)。
1)pH的变化
在0~6 h内,两反应体系(原状 mZVI和XG-mZVI)的pH均迅速升高,这是由于mZVI与体系内有限的溶解氧(<2 mg/L)发生反应生成Fe2+,同时伴随着OH-的释放。反应过程如式(1)所示。

在24 h时,原状mZVI和XG-mZVI反应体系的pH均达到最大值,随后两体系pH逐渐开始降低。从整个反应周期来看,两体系均处于碱性环境,但后者的pH提升幅度明显小于前者。究其原因,主要是XG分子中的羧基在碱性条件下更容易电离,产生的H+与体系中的OH-发生了中和反应,从而对体系的pH起到缓冲作用。反观原状 mZVI反应体系,较高的pH会促进Fe2+生成Fe(OH)2及其进一步的氧化产物,如Fe2O3、Fe3O4[18]和FeOOH[19]等。这些铁的氧化物和氢氧化物在mZVI颗粒表面不断累积,形成钝化层,阻塞铁表面的活性位点,从而弱化了mZVI对CAHs的去除效能。
2)Eh的变化
0~48 h内,原状 mZVI和XG-mZVI反应体系的Eh呈下降趋势,在48~96 h内二者的Eh值均有回升,96 h时达到一个相对峰值之后继续下降(图8)。Eh的起伏可能与体系中Fe2+的质量浓度变化有关。从整个反应周期来看,两体系的Eh均为负值,表明两者均显示出还原性。相对于原状 mZVI反应体系,XG-mZVI反应体系的Eh值更低,说明XG的加入增强了体系的还原活性,更有利于CAHs的还原脱氯。
3)Fe2+质量浓度变化
在0~6 h内,XG-mZVI反应体系中Fe2+质量浓度迅速增大,这与pH的升高是同步的,原因是体系中发生了方程式(1)所示的反应。然而,相同时段内,原状 mZVI反应体系中Fe2+质量浓度并无明显变化。这可能是因为mZVI颗粒表面的钝化层阻碍了Fe2+向液相的传输。6~96 h之间,XG-mZVI体系中Fe2+质量浓度呈现降低趋势,同时伴随着pH降低。这是由于一部分Fe2+与OH-反应生成Fe(OH)2。96~240 h之间,XG-mZVI体系中Fe2+质量浓度逐渐回升,原因是该阶段mZVI对CAHs的还原量逐渐增大(图7),作为氧化产物,Fe2+生成量增加。由于Fe2+本身也具备还原性,因此可进一步促进CAHs的还原[20]。
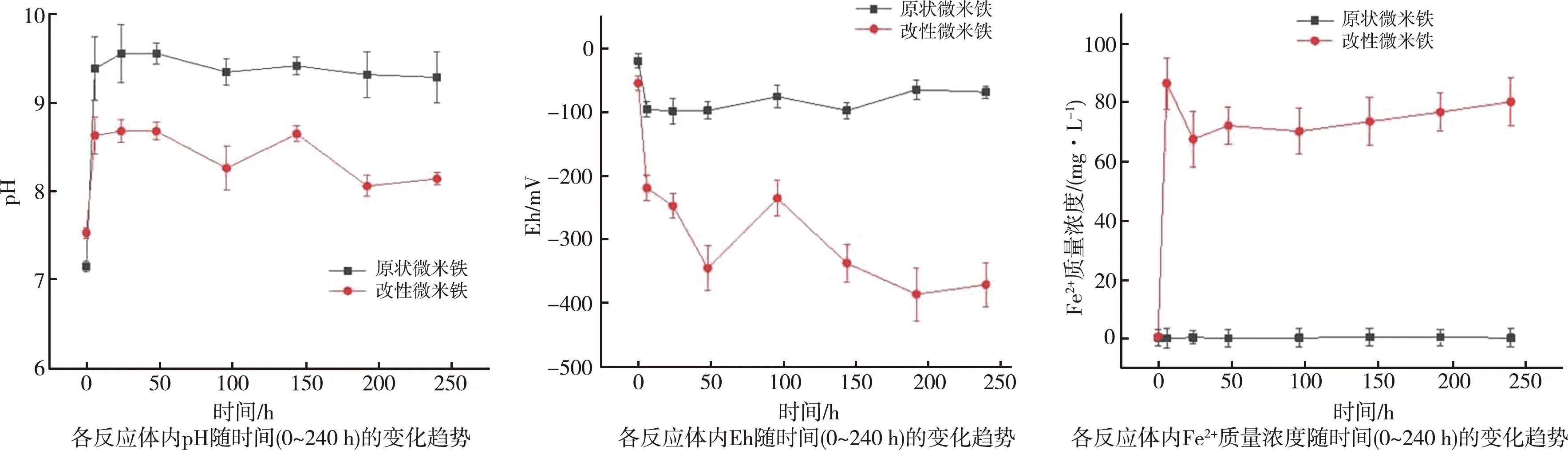
图8 各反应体系内各物质随时间(0~240 h)的变化趋势
3 结 论
1)不同粒径的mZVI对CAHs的去除率存在差异。总体来说,mZVI对CAHs的去除效能随粒径的减小而提高。
2)mZVI去除CAHs是通过吸附和还原实现的。XG虽然抑制了mZVI对CAHs的吸附作用,但同时提升了其对CAHs的还原活性,整体上提高了mZVI对CAHs的去除效能。
3)反应体系水化学条件(pH、Eh和Fe2+质量浓度)的改变对XG-mZVI吸附CAHs的影响较小。然而,其对XG-mZVI还原降解CAHs的过程影响明显。体系中Fe2+质量浓度的增加有利于CAHs的还原脱氯。

