MT1E在三阴性乳腺癌中的表达和意义
梁家玮,郭海峰
(1.牡丹江医学院;2.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011)
三阴性乳腺癌(Triple-negative breast cancer,TNBC)具有雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)和人表皮生长因子受体2(Human epidermal growth factor receptor-2 extracellular domain,HER2)阴性表达的特殊分子表型[1]。鉴于这种特殊表型,TNBC对内分泌治疗和靶向治疗均不敏感,常规术后辅助放化疗而残留的转移病灶最终会导致肿瘤复发,5年内死亡率可高达40%[2-3]。故迫切需要开发针对TNBC的新的治疗方案和靶点。金属硫蛋白1E(Metallothionein1E,MT1E)是一种富含半胱氨酸的非酶类小分子蛋白,是人金属硫蛋白(Metallothionein,MT)的亚型之一,其可由多种内源和/或外源性刺激诱导表达,在多种肿瘤的发生和发展过程中扮演重要角色[4]。本研究通过免疫组化SP法对人TNBC组织和癌旁组织中的MT1E表达进行检测,并进一步分析其与TNBC患者临床病理特征和预后的关系。
1 资料与方法
1.1 一般资料收集自2015年1月至2016年12月间于牡丹江医学院附属红旗医院治疗的45例TNBC患者的TNBC组织和癌旁组织,并制作成石蜡切片。45名患者均为女性,年龄29~79岁,中位年龄56岁,平均年龄(51.87±11.00)岁,资料均来自临床入院病历。纳入标准:患者均行乳腺癌改良根治术+前哨淋巴结活检术(阳性者进行腋窝淋巴结清扫),所有患者术前均未接受放疗、化疗和靶向治疗等。排除标准:临床或病理资料不可获得者;合并其它恶性肿瘤者;术前存在其它脏器转移者;未按乳腺癌治疗指南行术后辅助治疗者。所有使用标本均符合伦理委员会要求并签署知情同意书。
1.2 免疫组织化学染色SP法检测MT1E表达
1.2.1 免疫组织化学染色SP法 (1)烤片:石蜡切片60 ℃恒温箱烤片1 h;(2)脱蜡至水:依次在二甲苯Ⅰ和二甲苯Ⅱ中浸泡 20 min,无水乙醇、95% 乙醇、85%乙醇和 75% 乙醇内各浸泡5 min,最后用PBS清洗切片;(3)抗原修复:切片上滴加柠檬酸缓冲液进行抗原修复后用PBS溶液进行5 min×3次的清洗;(4)阻断内源性过氧化物酶:切片置入3%双氧水后室温避光孵育20 min,PBS溶液进行5 min×3次的清洗;(5)血清封闭: 切片甩干后用组化笔画圈,在组化圈内滴加3%BSA均匀覆盖组织,室温封闭20 min;(6)加一抗:轻轻甩掉封闭液,在切片上滴加配好的一抗溶液,置于湿盒内4°C孵育过夜;(7)滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育1 h后PBS溶液进行5 min×3次的清洗;(8)滴加SP工作液,37 ℃孵育1 h后PBS溶液进行5 min×3次的清洗;(9)DAB显色5 min、苏木精复染2 min,常规脱水、透明、封片后镜检。兔抗人MT1E一抗购自上海泽叶生物技术有限公司(ZY-6074),按1∶100比例稀释。
1.2.2 结果判读 采用半定量法进行结果分析。(1)按细胞着色程度评分:不着色者0分,着色弱、浅黄色者1分,着色中等、棕黄色者2分,着色强、棕褐色者3分。(2)按阳性细胞占比评分:无阳性细胞者记0分,1%~25%者记1分,26%~50%者记2分,51%~75%者记3分,≥76%者记4分。(3)两项得分相乘:0分为阴性,1~3分为弱阳性,4~8分为阳性,9~12为强阳性。最终得分0~3视为低表达,4~12视为高表达。
1.3 随访和预后分析随访方式涵括住院复查、门诊和电话随访。随访起始于术后第一天,每3个月一次,截止时间点为2020年6月30日。总生存期(Overall survival,OS)为患者术后第一日起至因TNBC引起死亡的时间,无病生存期(Disease-free survival,DFS)为患者术后第一日起至TNBC出现复发或转移的时间,对中途失访、死于其它疾病和生存期超过随访截止时间的数据视为删失数据。
1.4 统计学方法以SPSS 23.0软件进行统计学分析。计数资料采用卡方检验进行统计学分析。Kaplan-Meier曲线法用以进行MT1E表达相关的预后分析。Cox比例风险回归模型分析与患者DFS和OS相关的临床病理特征,因该研究样本总数偏少、变量多,先通过单因素分析筛选出可能相关的变量后再行多因素分析。P<0.05代表差异有统计学意义。
2 结果
2.1 患者随访信息患者的随访时间为23~63个月,中位随访时间为49个月,其中41例完成随访,4例失访,失访率为8.9%;至随访截止,出现TNBC复发或转移的患者共15例,其中11例因肿瘤复发转移死亡,死于其他原因者4例。

图1 MT1E在TNBC组织及对应癌旁组织中表达的代表性图片(×400)
2.2 MT1E在TNBC组织及癌旁组织中的表达免疫组织化学染色SP法结果显示,MT1E阳性定位于细胞质,见图1。TNBC组织中MT1E的高表达率高于癌旁组织,差异有统计学意义(P<0.05),见表1。
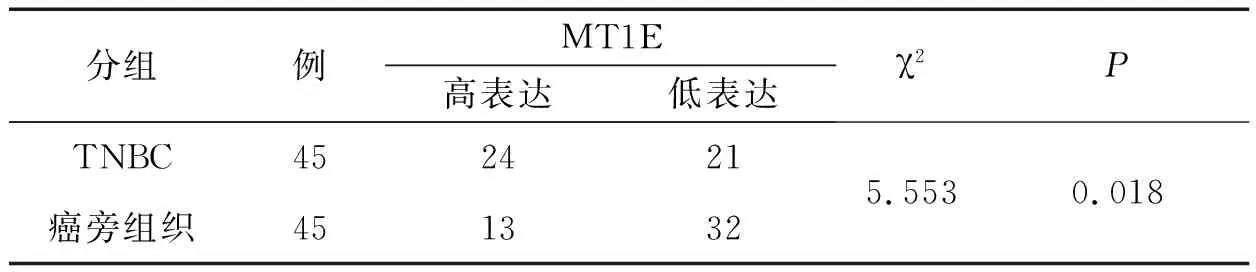
表1 MT1E在TNBC组织和癌旁组织中的表达
2.3 TNBC中MT1E表达与临床病理特征的关系临床病理特征资料均来自临床入院病历及术后病理报告。MT1E高表达与患者年龄、绝经与否和肿瘤大小无关(P>0.05);但与淋巴结转移、TNM分期和组织学分级有关(P<0.05)。MT1E表达水平越高TNBC的恶性程度越高,发生侵袭和转移等恶性事件的可能越大,见表2。
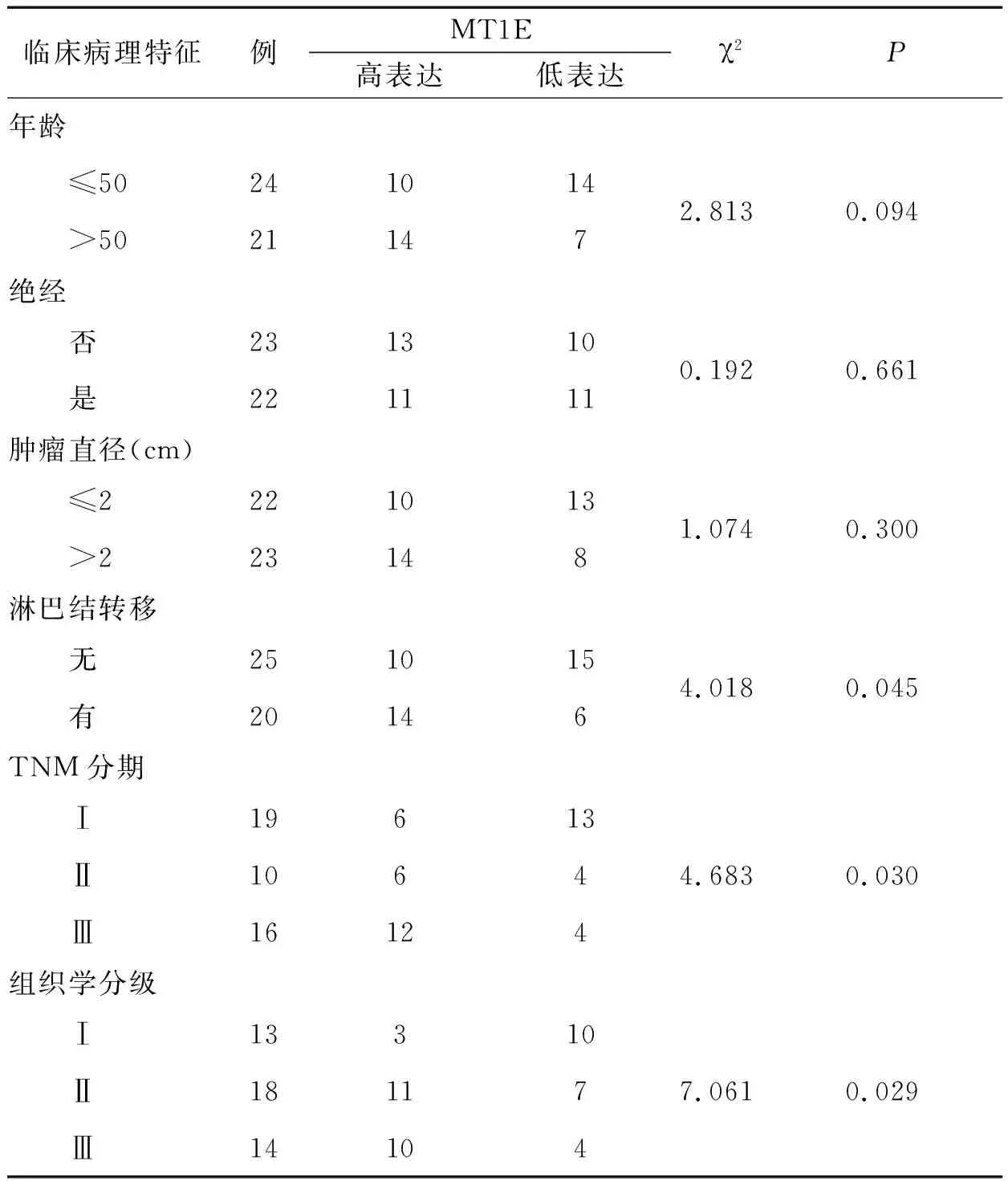
表2 MT1E与TNBC临床病理特征的关系
2.4 MT1E表达与TNBC预后的相关性Kaplan-Meier法进行MT1E表达与TNBC预后相关性的统计学分析,MT1E高表达和低表达患者的无病生存曲线和总生存曲线分别见图2、图3。MT1E高表达组的累积无病生存率为45.5%,低表达组的累积无病生存率为68.0%,MT1E高表达组的累积无病生存率显著降低,差异有统计学意义(P<0.05);MT1E高表达组的累积总生存率为53.6%,低表达组的累积总生存率为75.4%;MT1E高表达组的累积总生存率显著降低,差异有统计学意义(P<0.05)。上述结果提示MT1E高表达组的TNBC患者较低表达组更容易出现复发和死亡等恶性事件且时间较早。

图2 MT1E表达与患者无病生存率的关系

图3 MT1E表达与患者总生存率的关系
2.5 影响TNBC患者DFS和OS的临床病理特征经单因素分析后分别将MT1E表达、淋巴结转移和TNM分期纳入DFS的多因素Cox比例风险回归模型,MT1E表达、淋巴结转移和TNM分期和病理学分级纳入OS的多因素Cox比例风险回归模型。多因素分析结果提示TNM分期、淋巴结转移和MT1E表达与TNBC的复发相关,而TNM分期和MT1E表达与TNBC的死亡相关。推测MT1E表达可作为预测TNBC复发和死亡的独立危险因素。见表3和表4。
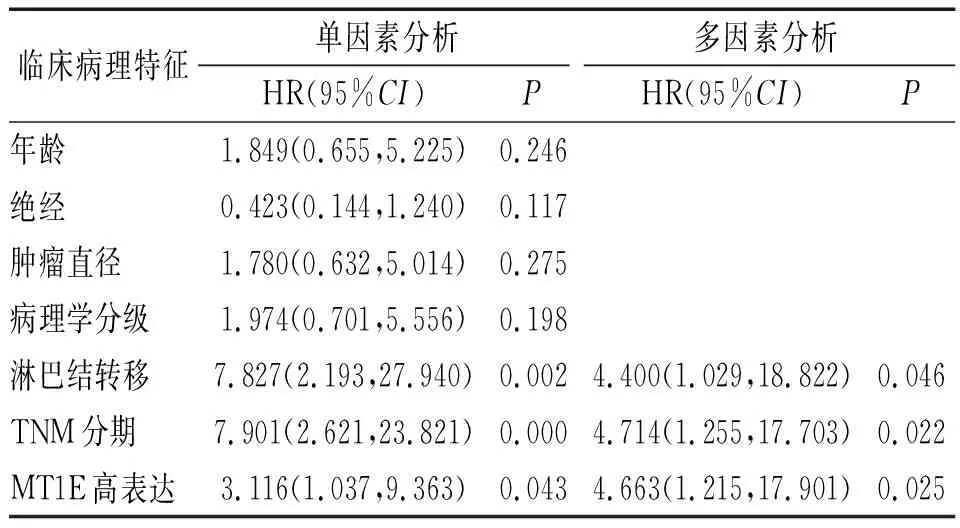
表3 TNBC患者临床病理特征与DFS的单因素和多因素COX比例风险回归模型分析

表4 TNBC患者临床病理参数与OS的单因素和多因素COX比例风险回归模型分析
3 讨论
乳腺癌的分子亚型主要由免疫组织化学的方式进行确定。TNBC具有ER、PR和HER-2表达缺失的分子表型,但作为一种异质性疾病,其基因组和转录组谱等方面都表现出巨大差异[5]。TNBC的这种异质性致使很难在临床前研究中找到合适的分子靶点,无法研发针对整个TNBC的药物,使其主要治疗方法仍然停留在蒽环类和紫杉醇类化疗。虽然新辅助化疗的临床治疗效果明显,但与其他乳腺癌亚型相比TNBC患者的远处复发率仍然更高,预后更差,生存期明显短于其它乳腺癌亚型[6]。因此,除了开发旧药的新用途外,不断寻找新的有效的治疗靶点逐渐成为TNBC治疗重点。
MT是一种分子量低约6~7kDa的、由61~68个氨基酸组成的、高度保守的、富含半胱氨酸的小分子蛋白,其对正常细胞和肿瘤细胞的增殖、分化和凋亡发挥了至关重要的影响[7]。MT在生物学中最初被认定的功能便是与金属离子(锌和镉等)的结合、转运和调控,这项功能使其可调控许多与肿瘤相关的锌依赖性蛋白的合成,对肿瘤的细胞分化与增殖、血管生成、侵袭和转移起重要作用,并作为调节金属稳态的免疫调节剂对肿瘤微环境进行重塑使肿瘤细胞发生免疫逃逸。同时,MT还可作为抗氧化剂保护肿瘤细胞免受由诱变剂、抗肿瘤药和辐射产生的自由基和氧化应激的影响,并对DNA损伤和细胞凋亡起到保护作用[8]。尽管MT在不同肿瘤组织中表达水平具有差异,但这恰恰说明了MT在肿瘤的发生和进展中扮演重要角色[9]。
MT1E是MT的亚型之一,Friedline[10]、Jin[11]以及Tai[13]均发现,相较雌激素受体阳性乳腺癌,MT1E在雌激素阴性受体的乳腺癌中表达更高,MT1E可能在雌激素受体阴性的乳腺癌中具有独特的生物学作用。本研究通过免疫组织化学染色发现TNBC组织中MT1E的表达高于癌旁组织,且MT1E的表达与TNBC的淋巴结转移、TNM分期、组织学分级等临床病理特征,并影响着TNBC的复发、患者的死亡等预后状况。由此可见,MT1E在TNBC中扮演着促进其生长、侵袭和转移的角色,其可能作为调控因子直接或间接调控靶向TNBC的部分肿瘤基因的表达进而参与TNBC的发生和发展中。
综上所述,MT1E可能在TNBC等多种肿瘤的发生和进展中扮演重要的角色。虽然本研究样本量较小且仅采用免疫组织化学染色的实验方法分析了MT1E在TNBC中的表达和作用,但明显可见MT1E在TNBC中具有很高的科研价值。相信通过对MT1E与TNBC的深入研究,不仅可揭示其在TNBC发病机制中的功能,还将为TNBC诊断和治疗提供新的见解。

