系统性红斑狼疮合并下肢静脉血栓的相关因素分析*
秦卫红,廖 香,卜一芝,周 游,谭玉梅
(北海市人民医院风湿免疫科,北海 536000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是累及多脏器的自身免疫性炎症性结缔组织疾病[1],表现为蝴蝶红斑、发热、关节肿痛、血细胞减少、体重减轻等症状。患者常出现高凝、血脂异常和下肢静脉血栓形成[2]。据报道,诊断SLE后第1年并发下肢静脉血栓率高达10%,可形成肺血栓,甚至猝死[3]。同时,下肢静脉血栓隐匿,临床无特异性表现,因此分析SLE患者并发下肢静脉血栓的危险因素对早期预警、诊断和治疗至关重要[4]。笔者通过回顾性分析北海市人民医院收治的SLE患者的临床资料,探讨SLE合并下肢静脉血栓的危险因素,以期为临床预防提供依据,现将结果报道如下。
1 对象与方法
1.1 研究对象
选取2017年8月至2020年8月北海市人民医院风湿免疫科收治的258例SLE患者作为研究对象。病例纳入标准:(1)符合1997年美国风湿病学会制定的SLE分类诊断标准[5];(2)下肢静脉血栓诊断标准按照2008年与2001年中华医学会外科学分会血管外科学组与呼吸病学会制定的诊断标准[6];(3)均经影像学证实;(4)年龄30~70岁;(5)受教育程度在初中或以上,可理解问卷调查内容。排除标准:(1)合并恶性肿瘤者;(2)除肾功能不全外的实质性脏器功能不全者;(3)认知障碍者;(4)继发性抗磷脂综合征等有明显血栓形成危险因素者;(5)无法配合问卷调查者。根据是否合并下肢静脉血栓分为SLE合并下肢静脉血栓组(n=50)和SLE组(n=208),两组患者的一般资料见表1。本研究已取得本院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1 问卷调查 采用自拟的调查问卷收集患者一般资料,包括年龄、性别、体重指数(Ibm)、吸烟和饮酒史、血尿、蛋白尿、狼疮肾炎、肾功能不全、肾性高血压及肾病综合征症状等。本次共发放问卷258份,回收有效问卷258份,问卷回收率为100.0%。
1.2.2 生化指标检测 采集静脉血3 mL,离心沉淀细胞,采用全自动生化分析仪测定活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、血浆凝血酶时间(TT)、血小板(PLT)、白细胞(WBC)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、C反应蛋白(CRP)、血红蛋白(Hb)、D二聚体(DD)、白蛋白(ALB)、血肌酐(Scr)、24 h尿蛋白定量(尿24 h Pro)、补体C3、补体C4,所用仪器均为France STAGO公司提供的全自动凝血分析仪,试剂由仪器配套;采用免疫扩散法测定外周血中免疫球蛋白G(IgG)、免疫球蛋白E(IgE)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)表达水平,仪器及试剂均由上海信然生物技术有限公司提供;采用雅培越捷型血糖仪测定患者空腹血糖(PBG)并记录。
1.3 质量控制
统一培训调查员进行问卷调查,征得调查对象同意,遵循保密原则,如实填写所有内容,严格检查和双重检查,确保数据的准确性。
1.4 统计学方法
数据录入Epi Data 3.1数据管理系统,行逻辑查错,并采用SPSS 20.0软件进行数据分析,计量资料以均数±标准差()表示,组间比较采用t检验。计数资料以构成比或百分率(%)表示,组间比较采用χ2检验,采用单因素和多因素Logistic回归分析法分析相关危险因素,以P<0.05为差异有统计学意义。
2 结果
2.1 SLE并发下肢静脉血栓的单因素分析
两组性别、Ibm、吸烟、饮酒、WBC、APTT、PT、Scr、PBG、IgA、IgG、IgE、IgM、补体C3、补体C4、血尿、蛋白尿比较,差异无统计学意义(P>0.05),两组年龄、PLT、CRP、DD、FIB、Hb、TC、TG、LDL-C、ALB、24 h Pro、狼疮肾炎、肾功能不全、肾性高血压及肾病综合征比较,差异具有统计学意义(P<0.05),见表1。

表1 SLE并发下肢静脉血栓的单因素分析结果
2.2 SLE并发下肢静脉血栓的多因素Logistic回归分析
将单因素分析中差异有统计学意义的变量进一步纳入多因素Logistic回归分析,结果显示:年龄、PLT、CRP、DD、FIB、Hb、TC、TG、LDL-C、ALB、尿24 h Pro、肾功能不全为SLE并发下肢静脉血栓的独立危险因素(P<0.05),见表2。
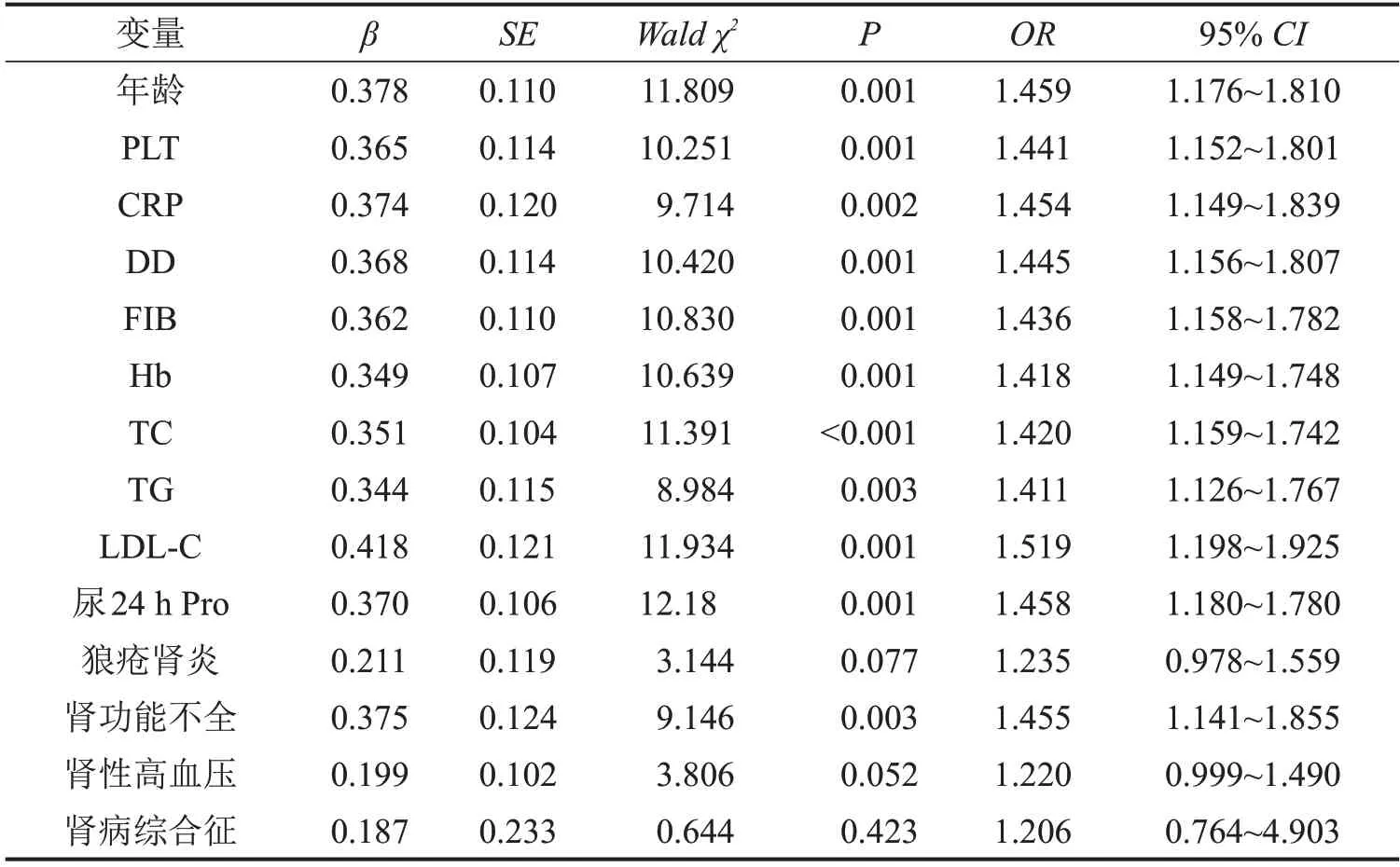
表2 SLE并发下肢静脉血栓的多因素Logistic回归分析结果
3 讨论
SLE是一种自身免疫性疾病,可导致器官损伤,且患者通常有内皮细胞损伤、凝血功能障碍和纤溶活性的改变。因此,当狼疮肾炎伴有高凝性时,可并发静脉血栓[7]。据报道显示,SLE并发静脉血栓的发生率达30%~70%[8]。若不及时诊断和治疗,可导致肺、脑等器官栓塞,致使患者死亡[9]。此外,部分患者不能免于慢性血栓后遗症,易造成长期疼痛,从而影响患者生活质量[10]。
相关研究显示,年龄、PLT、CRP、DD、Hb、TC、TG、狼疮肾炎、肾功能不全、肾病综合征为SLE并发下肢静脉血栓的独立危险因素[11]。而本研究也证实了这一观点,多因素Logistic回归分析结果显示,年龄、PLT、CRP、DD、Hb、TC、TG、ALB、24 h Pro为SLE并发下肢静脉血栓的独立危险因素(P<0.05)。进一步分析其可能原因:老年人血液中凝血因子活性较高,小腿肌肉泵送作用减弱,使血液在比目鱼肌静脉丛和静脉瓣袋内淤滞较重,从而导致下肢静脉血栓发生[12]。而SLE并发下肢静脉血栓患者由于PLT增加,并伴发后续的血流缓慢因素,导致供血血管远端组织器官缺血缺氧,容易发生下肢静脉血栓[13]。研究证实,炎症性疾病与血栓密切相关[14]。炎症反应可通过上调促凝血物质减少抗凝因子抑制纤溶系统活性和活化血小板调节机体凝血功能,因此检测炎症因子可能成为下肢静脉血栓的诊断指标。本研究结果显示,CRP、DD为SLE并发下肢静脉血栓的独立危险因素,分析其原因:炎症因子可通过上调促凝物质,减少抗凝因子,抑制纤溶活性和凝血功能,进而促进血栓形成。而SLE并发下肢静脉血栓患者Hb水平低,提示贫血,贫血时血液携氧能力降低,组织缺氧,引起血管壁损伤,进而导致下肢静脉血栓发生[15]。机体高凝状态下,FIB的溶解度增强,从而增加了FIB浓度。此外,高凝状态还能增强纤溶系统活性,促进纤维蛋白原向纤维酶的转化,进而增强纤维蛋白降解,导致下肢静脉血栓[16]。血液中TC、TG增多时会增加红细胞沉降速度,增加血液黏稠度,减慢血流速度,导致下肢静脉血栓。相关报道显示,血脂异常是下肢深静脉血栓形成的危险因素[17]。本研究也证实了这一观点,进一步分析其原因:LDL对血管内皮具有一定毒性,并参与内皮功能损害,故推测胆固醇可能是通过影响内皮功能来参与血栓形成。本研究还发现,低白蛋白血症和尿24 h Pro是静脉血栓的危险因素,大量蛋白尿导致血中小分子抗凝物质经尿中丢失,抗凝血酶Ⅲ(AT-Ⅲ)减少;同时,由于大量蛋白尿导致低蛋白血症,刺激肝脏代偿性合成功能增强,大分子量的凝血因子包括FIB、凝血因子,纤溶酶原抑制物增加,从而导致SLE并发下肢静脉血栓。
此外,何俊锋[18]研究显示,狼疮肾炎、肾功能不全、肾性高血压、肾病综合征为SLE并发静脉血栓的危险因素。而本研究发现,肾功能不全为SLE并发下肢静脉血栓的危险因素,进一步分析其原因:肾功能不全患者由于血容量相对不足,红细胞和PLT聚集,胆固醇和FIB增高,ALB降低,进而增加血液黏滞度,导致下肢静脉血栓发生[19]。基于此,针对上述危险因素,本研究认为,为防治SLE患者并发下肢静脉血栓,应加强患者健康教育,鼓励进行足和趾主动活动,并嘱多做深呼吸及咳嗽动作,尽可能下床活动,必要时下肢穿医用弹力长袜;并采用药物巩固病情,如抗凝药物,以降低下肢静脉血栓发生率。本研究还存在不足之处:本研究纳入样本量偏少,且为回顾性分析,尚需大样本前瞻性研究来验证SLE合并下肢静脉血栓的危险因素,有助于SLE合并下肢静脉血栓形成的早期预警和诊断。
综上,年龄、PLT、CRP、DD、FIB、Hb、TC、TG、LDL-C、ALB、尿24 h Pro、肾功能不全是SLE并发下肢静脉血栓的危险因素,临床应给予针对性措施,以减少下肢静脉血栓发生。

