TNF-α 对IPEC-1 细胞生长、屏障功能以及程序性坏死关键基因表达的影响
吕青青,秦 琴,涂治骁,肖世平,杨彩梅,刘玉兰,肖 勘*
(1.武汉轻工大学动物营养与饲料科学湖北省重点实验室,湖北武汉 430023;2.浙江惠嘉生物科技股份有限公司,浙江安吉 313307)
肠道不仅承担着消化和吸收营养物质的重要功能,同时还作为机体内表面积最大的器官与外界环境有着直接的接触,随时受到内外环境中不利因素的刺激,从而引起肠上皮损伤、肠道功能障碍,最终诱发肠道疾病。肠道屏障完整对于抵御内源性和外源性有害物质的入侵十分重要。肠道的物理屏障由一层柱状上皮细胞和上皮细胞间的紧密连接蛋白组成,肠上皮细胞是构成肠道黏膜的关键成分,通过与紧密连接蛋白相互作用共同防止有害抗原、微生物及其毒素侵入机体。已有许多研究通过培养猪小肠上皮细胞系(IPEC-1)构建体外肠道模型。肠上皮细胞对肿瘤坏死因子-(TNF-)等炎性细胞因子十分敏感,因此本试验采用TNF-刺激来构建IPEC-1 细胞损伤模型。
肠道损伤与细胞死亡有密切关系。随着生命科学研究领域的不断进展,细胞程序性坏死逐渐引起人们的注意。程序性坏死主要是由受体相互作用蛋白激酶1(RIP1)、受体相互作用蛋白激酶3(RIP3)和混合系激酶样结构域蛋白(MLKL)介导的,它结合了细胞凋亡和坏死的特征。近年来,程序性坏死被证明在多种因素引起的组织损伤中发挥重要作用,如心脏、脑缺血再灌注和肠道炎症,但有关猪肠道程序性坏死的研究报导较少。因此,本试验旨在探究TNF-刺激是否能激活IPEC-1 细胞程序性坏死信号通路,同时诱导IPEC-1 细胞损伤、细胞间紧密连接的破坏和屏障功能障碍,探索关于肠道损伤和肠上皮细胞死亡的新机制。
1 材料与方法
1.1 试验材料 IPEC-1 细胞来自德克萨斯农工大学;DMEM/F-12 培养基购自HyClone 公司;TNF-、荧光素异硫氰酸酯-葡聚糖4(FITC-dextran,FD4)购自Sigma-Aldrich 公司。乳酸脱氢酶(LDH)试剂盒购自南京建成生物科技有限公司;Cell Counting Kit(CCK8)试剂盒购自武汉丁香园生物科技有限公司;台盼蓝购自Solarbio 公司。
1.2 培养基的配制 在DMEM-F12 培养基中按比例加入5%的胎牛血清(FBS)、1%的胰岛素-转铁蛋白-硒-X(ITS-X)、1%的青链霉素混合液(PSF)和0.5‰的表皮生长因子(EGF),配制成完全培养基,经无菌过滤操作后使用。
1.3 细胞培养 复苏IPEC-1 细胞,在含有5%CO、37℃的恒温培养箱中进行培养,每2 d 更换1 次培养基。当贴壁细胞量达到90%~95%时,用胰酶消化。终止消化后,1 500 r/min 离心5 min,弃上清重悬,适当稀释细胞悬液、铺板培养。
1.4 指标测定
1.4.1 细胞活力 将细胞接种于96 孔细胞培养板,当贴壁细胞量达到70%后,用含有50 ng/mL TNF-的培养液刺激细胞,对照组培养液中加入等量的磷酸盐缓冲液(PBS)作为溶剂对照,培养细胞48 h。刺激结束后,用含有CCK8 的培养基(CCK8 和完全培养基按1:9 配制),置于37℃恒温避光孵育1.5 h 后,立即用酶标仪在波长450 nm 处测吸光度。
1.4.2 LDH 活性 将细胞接种于12 孔细胞培养板,细胞处理同上。收集细胞培养上清液,用LDH 试剂盒检测上清液中的LDH 活性。
1.4.3 细胞数量 将细胞接种于12 孔细胞培养板,细胞处理同上。刺激结束后,弃培养液,用PBS 清洗2 遍,每孔加入500 μL 胰酶消化离心后加入1 mL PBS 吹打混匀。取10 μL 细胞悬液与 90 μL 0.5% 台盼蓝染液混合均匀,点样于血球计数板上,放在低倍镜下(10×10 倍)观察,计数4 个大方格内的细胞总数。
1.4.4 跨上皮电阻(TEER)和FD4 通透性 将细胞接种于12 孔Transwell 板中,上室加入0.5 mL 细胞悬液,下室加入1.5 mL 全培。第4 天后,每天用Milicell-ERS 电阻仪测量电阻值并记录,培养至细胞TEER 值趋于稳定,再用50 ng/mL TNF-+1 mg/mL FD4 共同处理48 h,测定TEER,在每个下室中吸取50 μL 培养基至96 孔板中,用全功能酶标仪测定培养基中FD4 的发光度,最后计算FD4 的浓度。
1.4.5 紧密连接蛋白的分布 将细胞接种于共聚焦小皿中,每孔加入1 mL 细胞悬液,待细胞长至70%后,用含50 ng/mL TNF-的培养液刺激细胞48 h,参照Xiao等的方法制备样品后放于激光共聚焦显微镜下拍照并进行荧光定量。
1.4.6 程序性坏死信号通路关键基因mRNA 表达量 将细胞接种于12 孔板中,细胞处理同上,刺激结束后用RNA 裂解液收取细胞,用于程序性坏死关键基因mRNA 表达的测定。RNA 提取、定量和分析方法参照李佩等。相关基因的引物序列见表1。
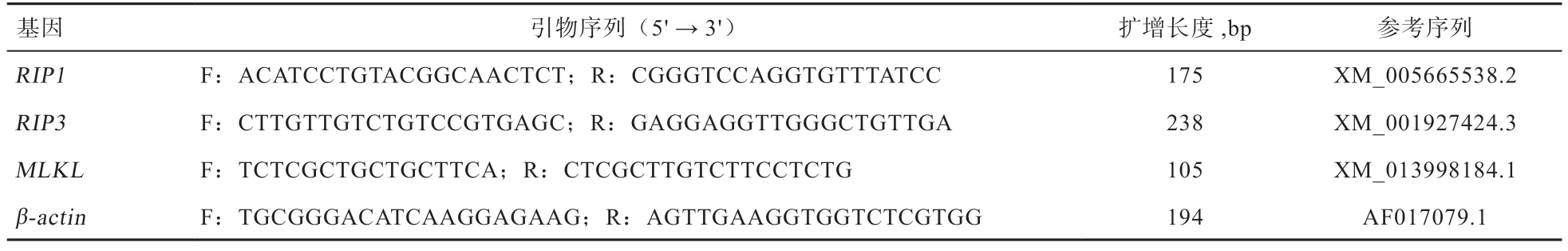
表1 相关基因的引物序列
1.5 统计分析 采用SPSS 24.0 软件进行独立样本检验,结果以平均值±标准误表示,以<0.05 为差异显著性标准,0.05<<0.10 为具有显著性趋势。
2 结果与分析
2.1 TNF-对IPEC-1 细胞生长和损伤的影响 由图1可知,与对照组相比,TNF-刺激使IPEC-1 细胞活力下降(<0.001),细胞培养液中LDH 活性升高(<0.05),IPEC-1 细胞数量减少(<0.05)。
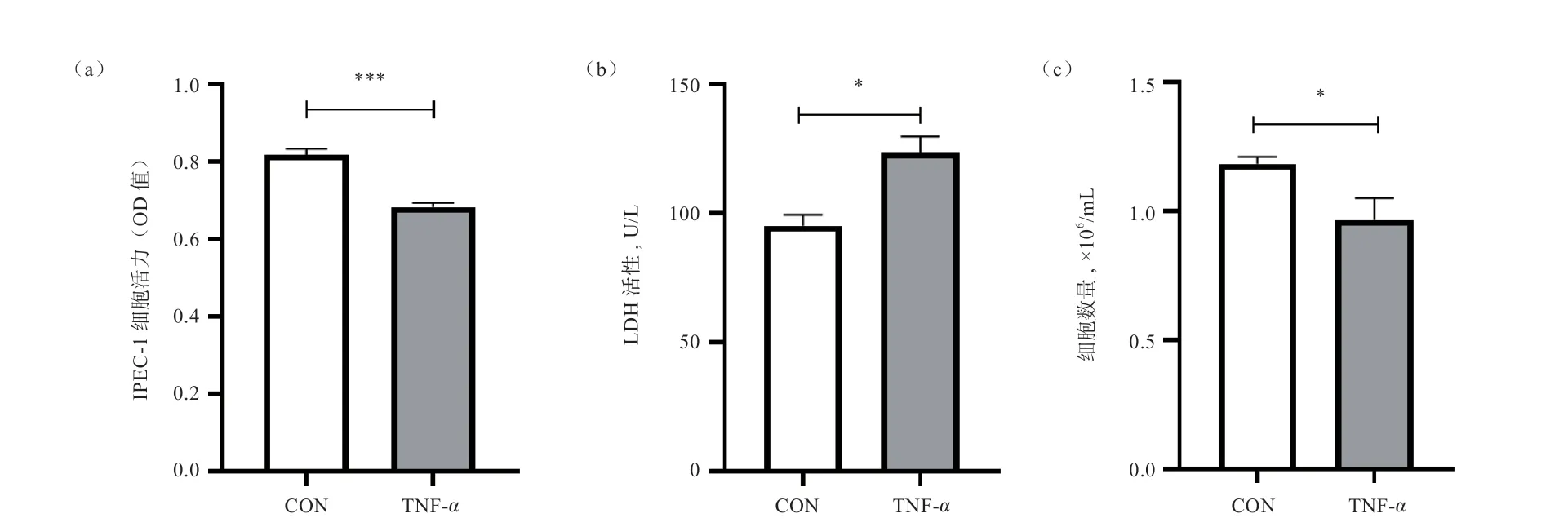
图1 TNF-α 对IPEC-1 细胞活力、LDH 活性和细胞数量的影响
2.2 TNF-对IPEC-1 细胞上皮屏障功能的影响 由图2可知,与对照组相比,TNF-刺激使IPEC-1 细胞跨上皮电阻降低(<0.05),FD4 通透性增加(<0.05)。
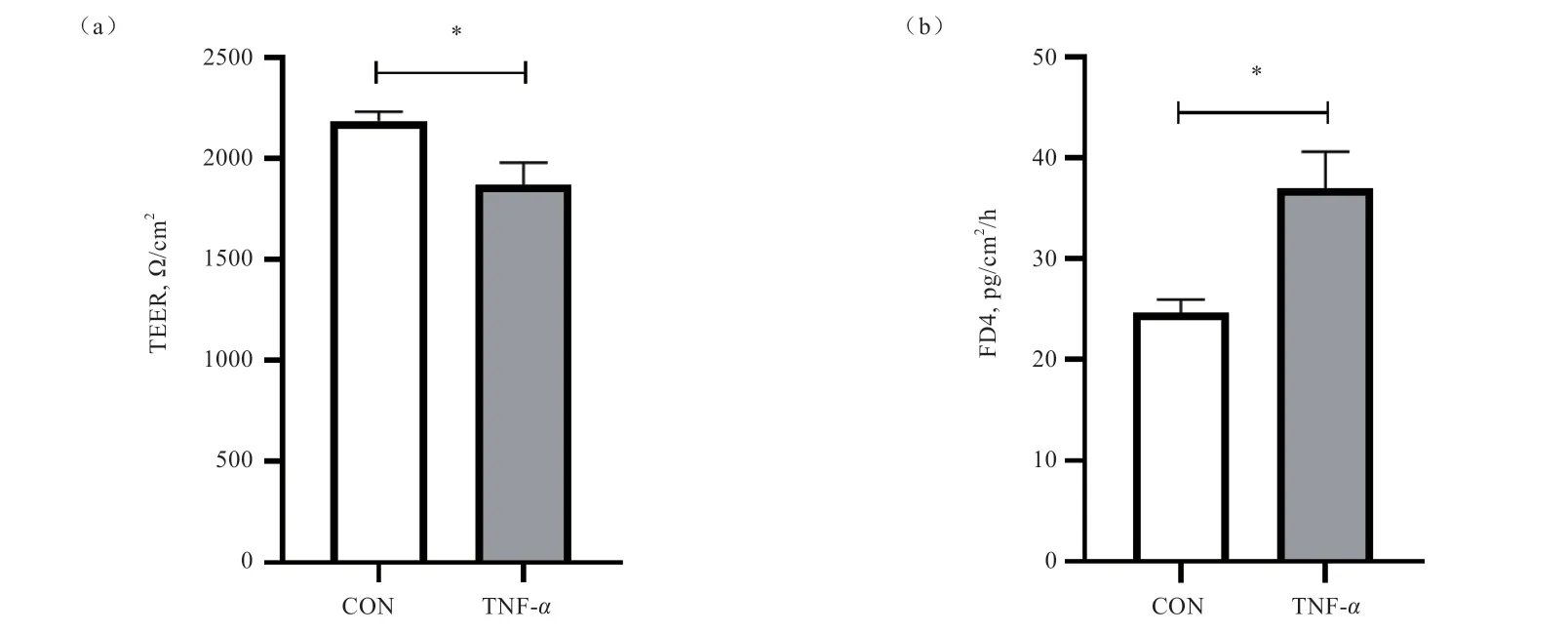
图2 TNF-α 对IPEC-1 细胞TEER 值(a)和FD4 通透性(b)的影响
2.3 TNF-对IPEC-1 细胞紧密连接蛋白分布的影响由图3 可知,对照组细胞间的紧密连接蛋白Occludin和ZO-1 均匀地分布于细胞的边界,但TNF-处理导致细胞膜上Occludin 和ZO-1 分布紊乱,表现为紧密连接蛋白的断裂和边界模糊变淡。对Occludin 和ZO-1 的荧光强度定量也同样表明,与对照组相比,TNF-刺激使Occludin(<0.001)和ZO-1(<0.05)的表达量降低。
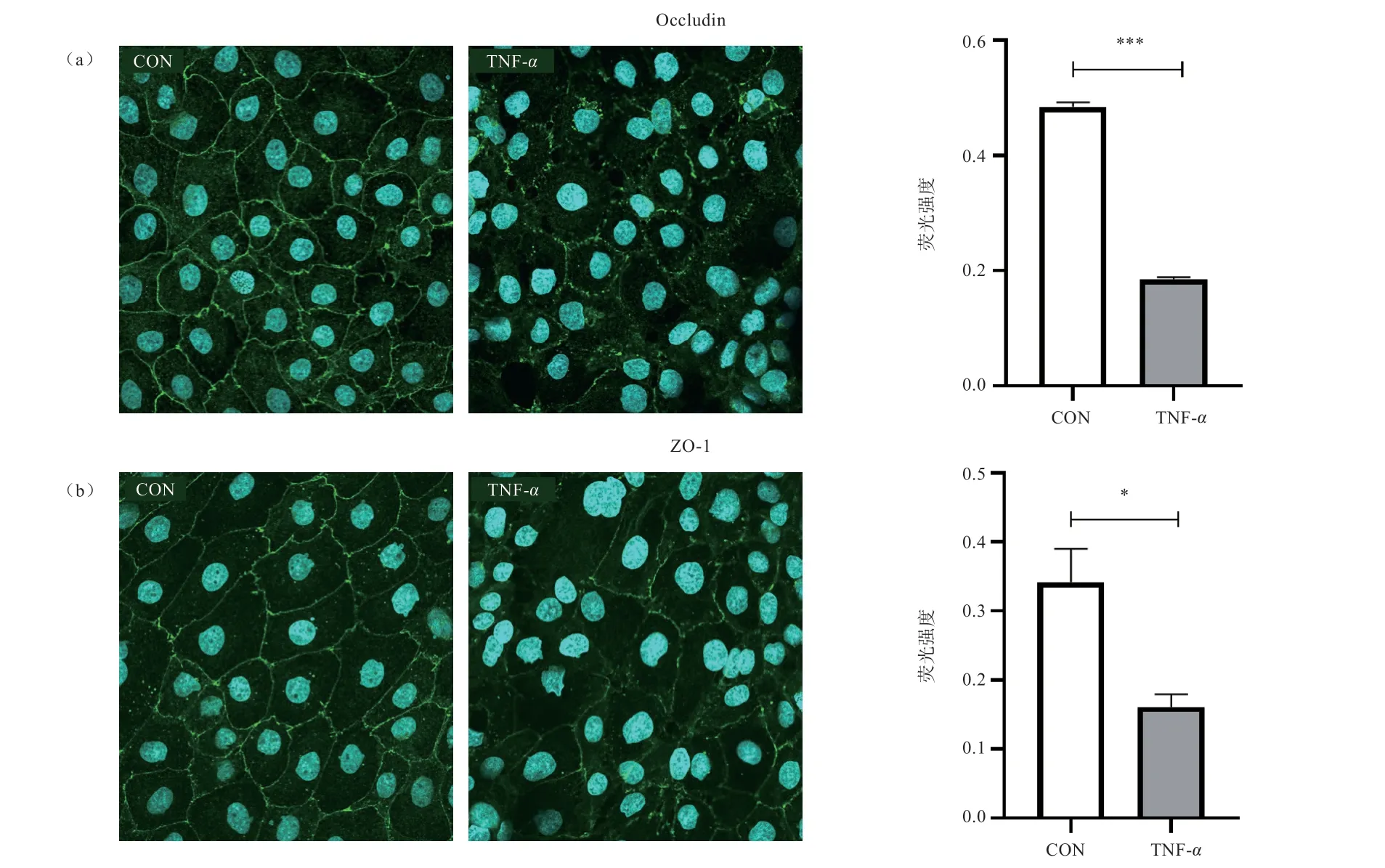
图3 TNF-α 刺激IPEC-1 细胞48 h 对Occludin(a)和ZO-1(b)蛋白表达和分布的影响
2.4 TNF-对IPEC-1 细胞程序性坏死关键基因mRNA表达量的影响 由图4 可知,与对照组相比,TNF-刺激增加了和的mRNA 表达量(<0.05),但对的mRNA 表达量无显著影响。
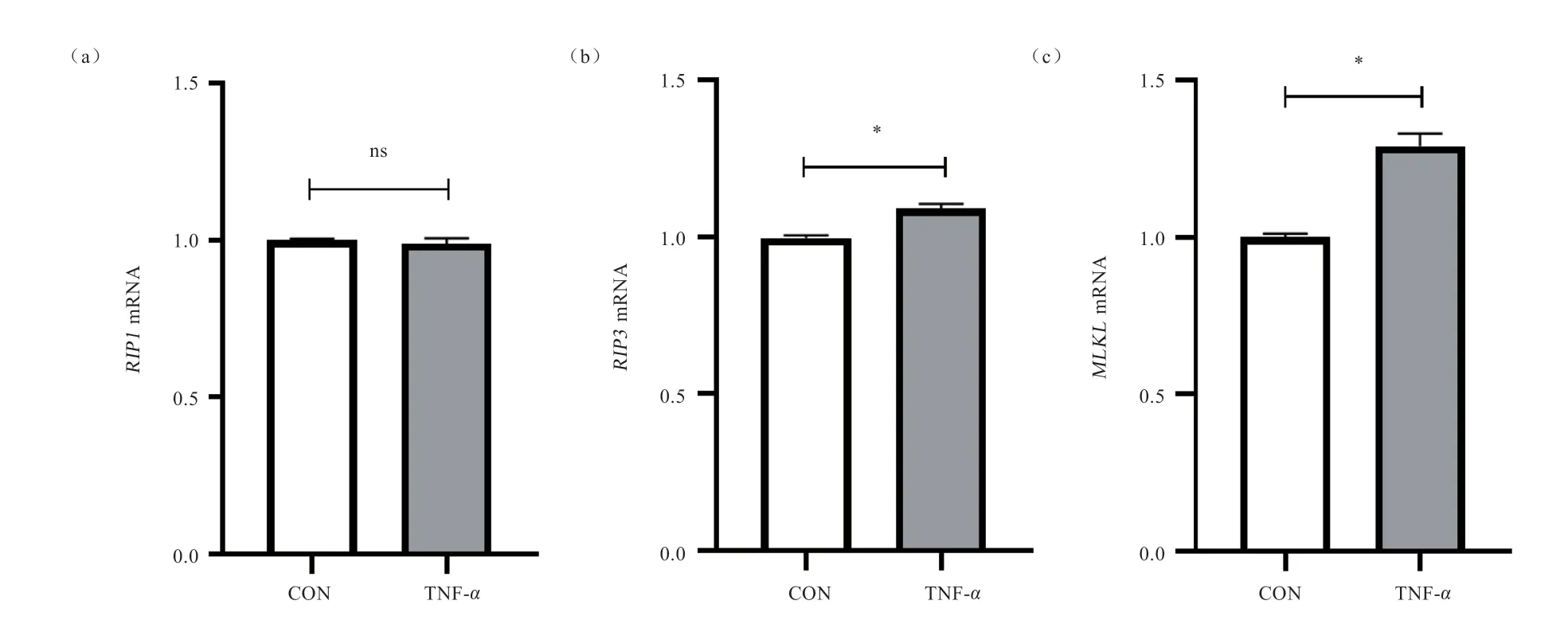
图4 TNF-α 对IPEC-1 细胞程序性坏死关键基因RIP1(a)、RIP3(b)和MLKL(c)mRNA 表达的影响
3 讨论
肠道在维持机体健康方面发挥着重要作用,肠道屏障可以选择性地吸收对机体有利的营养物质、水分和电解质等,而将对机体有害的病原体等物质阻拦在外。大量研究表明,TNF-与包括肠上皮细胞在内的多种类型细胞的损伤有关。本研究使用TNF-诱导的IPEC-1 细胞损伤模型来探索TNF-对IPEC-1 细胞程序性坏死的影响。
细胞活力、细胞上清液中LDH 活力和细胞数量可反映细胞的生长状况和细胞损伤程度。LDH 是一种细胞内酶,当细胞受损时,胞内的LDH 会大量释放到胞外。本试验结果显示,TNF-刺激导致细胞活力显著下降,同时使细胞上清中LDH 活力显著升高,表明TNF-刺激诱导了IPEC-1 细胞损伤。肠上皮细胞大量死亡会导致肠上皮结构和屏障的破坏,而肠上皮屏障的完整性和通透性可以通过TEER 值和FD4 的通透性来反映。当肠道受损时,肠上皮细胞会失去其选择透过性,使一些小分子物质能够轻易穿过上皮层。因此通过测量下室培养液中FD4 浓度可用来反映TNF-刺激后IPEC-1 细胞通透性改变的情况。本试验中TNF-刺激使IPEC-1 细胞跨上皮电阻显著降低,同时FD4 通透性显著增加,表明TNF-可以损害IPEC-1的屏障功能。
肠上皮细胞间的紧密连接依靠Occludin 和ZO-1 等蛋白间的相互作用来发挥其屏障功能,因此,紧密连接蛋白的任何改变都会直接导致屏障功能的损害。据报道,TNF-可通过许多信号通路诱导紧密连接蛋白损失,与Xiao 等、Mankertz 等研究结果一致的是,本试验中TNF-刺激使Occludin 和ZO-1 蛋白表达量降低,蛋白分布紊乱,表明TNF-破坏了IPEC-1 细胞间的紧密连接。
当细胞受到TNF-刺激后,TNF-会与膜上相应的受体TNFR1 结合,进而在胞质端募集一系列的蛋白质形成复合体,在合适的条件下,这些复合体会使磷酸化的RIP1、RIP3 和MLKL 进一步募集而形成坏死复合体,进而引发程序性坏死。在程序性坏死信号通路激活的过程中,RIP1、RIP3 和MLKL 是关键的调节蛋白,其表达量升高表明它们将大量聚集而促进程序性坏死的发生。有研究证明,通过敲除RIP 激酶基因能阻止程序性坏死的形成或激活。本试验中TNF-刺激增加了和的mRNA 表达量,表明TNF-刺激诱导了IPEC-1 细胞程序性坏死信号的激活。
TNF-与肠道损伤密切相关,本研究结果显示TNF-刺激激活了IPEC-1 细胞程序性坏死信号通路中和的表达,为研究肠道损伤机制提供了新的方向,为后续通过营养调控肠道程序性坏死奠定基础。
4 结论
本试验结果表明,TNF-刺激可导致IPEC-1 细胞活力下降和细胞损伤、细胞间紧密连接破坏以及屏障功能障碍,激活了细胞程序性坏死信号通路。

