黄芪汤调节TLR4/NF-κB信号通路改善高糖诱导足细胞损伤的研究
芮蓉,陈瑛,朱冰冰,曹爱丽,王浩,王利
(上海中医药大学附属普陀医院,上海 200062)
糖尿病肾病(Diabetic nephropathy,DN)是由糖尿病引起的微血管并发症之一,最终可导致终末期肾病。一旦早期DN发展成终末期肾病,肾功能衰竭就不可避免且不可逆转,需要采用肾脏替代疗法[1],因此早期诊断、干预和治疗是逆转或阻止DN进展的关键。慢性高血糖造成肾小球滤过屏障的破坏以及肾脏血流动力学的改变,引起尿蛋白分泌增加,持续性蛋白尿诱导肾脏炎症和纤维化,造成肾功能障碍[2]。足细胞是肾小球滤过屏障的重要组成部分,研究表明,足细胞长期处于高血糖环境,会引起足细胞结构功能异常,进而影响肾小球滤过功能,持续、不可逆地产生大量蛋白尿,导致肾功能损害[3]。因此,减轻足细胞损伤被认为是预防或减缓DN进展的有效途径。
慢性炎症是DN的主要病理特征,DN早期即可观察到如白细胞介素(Interleukin,IL)-6、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)等促炎因子分泌的改变,因此抑制高血糖引起的足细胞炎症是预防足细胞损伤的有效治疗策略之一[4]。研究表明,核因子-κB(Nuclear factor kappa-B,NF-κB)调节大量参与炎症反应的基因表达,是足细胞损伤的重要靶点。Toll 样受体 4(Toll-like receptor 4,TLR4)在DN肾小球炎症内在途径中也发挥着重要作用,是公认的NF-κB上游转录因子[5-6]。TLR4/NF-κB信号通路激活可导致促炎细胞因子和趋化因子的产生,介导DN早期炎症损伤。
黄芪汤首载于北宋杨士瀛《仁斋直指方论》卷十七[7],原方由黄芪、茯神、瓜蒌根、麦门冬、北五味子、生地黄、炙甘草7味中药组成。茯神药效长于养心安神,茯苓则功效更长于健脾,且方中五味子、瓜蒌根敛肺益肾、益气生津,可济身中津液之枯,加之茯苓健脾可制胃肠激烈之燥,除燥热之标,三药共奏养阴清热润燥之功,故本团队所用黄芪汤由原方去茯神加茯苓化裁而来。本团队前期研究表明,黄芪汤及其活性成分具有肾脏保护作用,可有效保护足细胞,延缓DN进展[8-10],但黄芪汤在DN进程中减轻足细胞炎症损伤的作用机制目前尚未阐明,因此本研究通过探讨黄芪汤对高糖诱导足细胞的保护作用及可能机制,为黄芪汤的临床应用提供参考。
1 材料与方法
1.1 细胞
永生化人足细胞株(Human podocyte,HPC),由美国Mount Sinai医院何慈江教授赠送。
1.2 药物
黄芪汤方剂组成为[11]:黄芪2 kg,茯苓2 kg,麦门冬2 kg,北五味子1 kg,生地黄3 kg,瓜蒌根2 kg和炙甘草1 kg,共计13 kg。加水热回流提取2 h后过滤,挤干滤渣内水分,再重复上述提取、过滤流程2次。合并3次提取液,减压浓缩为稠浸膏,以95%乙醇调节含醇量为70%,静置过夜,吸取上清液,置于减压干燥箱中,105 ℃下减压干燥48 h,得干粉提取物,每1 g提取物相当于7.5 g处方量。
含黄芪汤培养基的制备:称取适量黄芪汤干粉提取物,经涡旋、超声、水浴等方法使其充分溶解于RPMI-1640培养基后,经0.22 μm过滤器过滤并配制成所需浓度的溶液,4 ℃下保存备用。
1.3 主要试剂
D-葡萄糖(Biosharp公司,货号:BS099),RPMI-1640培养基(Gibco公司,货号:C11875500BT);TLR4抗体(Abcam公司,货号:ab13556),NF-κB抗体(Abcam公司,货号:ab16502),p-NF-κB抗体(CST公司,货号:3033T),TNF-α抗体(Abcam公司,货号:ab66579),IL-6抗体(Abcam公司,货号:ab93356),GAPDH抗体(Abcam公司,货号:ab22555);qPCR试剂盒[天根生化科技(北京)有限公司,货号:FP205-03],CCK-8试剂盒(日本同仁化学研究所,货号:PG657),IL-6 ELISA试剂盒(北京博奥龙免疫技术有限公司,货号:BDEL-0022),TNF-α ELISA试剂盒(北京博奥龙免疫技术有限公司,货号:BDEL-0049)。
1.4 仪器
超净工作台(ESCO公司,型号:SVE-6A1);二氧化碳培养箱(Thermo Fisher Scientific公司,型号:HERAcell240i);电泳仪(BIO-RAD公司,型号:165-8001);酶标分析仪(BIO-RAD公司,型号:BioRad-680);化学发光成像仪(BIO-RAD公司,型号:CDT94547);荧光显微镜(OLMYPUS公司,型号:CKX41/U-RFLT50);qPCR仪(ABI公司,型号:ABI7300)。
1.5 CCK-8法检测细胞增殖能力
取对数生长期的人足细胞经胰酶消化后,配制成细胞悬液,计数后按每孔1×103个的密度铺于96孔板中,每孔加入100 μL细胞悬液,分为空白组(调零组)、对照组、黄芪汤(1、3、10、30、100、300、1 000、3 000 μg·mL-1)组,每组设6个复孔。细胞放入33 ℃培养箱继续培养12 h后观察细胞贴壁情况,根据上述分组加入相应的处理因素,继续培养24、48、72 h,培养结束后,每孔加入100 μL CCK-8工作液在33 ℃孵育2 h,使用酶标仪测定450 nm处吸光度(A)。细胞增殖抑制率计算公式:抑制率=(A对照组-A黄芪汤组)/(A对照组-A空白组)×100%。空白组只加CCK-8工作液;对照组只加细胞、CCK-8工作液。
1.6 实验分组及给药
人足细胞于33 ℃、5% CO2的条件下,在含有10%胎牛血清、1%胰岛素转铁蛋白硒(Insulin transferrin selenium,ITS)、1%青链霉素(Penicillin streptomycin,PS)的RPMI-1640培养基中增殖,于37 ℃、5% CO2的条件下分化7 d用于实验。实验分为对照组(5 mmol·L-1葡萄糖)、模型组(30 mmol·L-1葡萄糖)、黄芪汤低浓度组(30 mmol·L-1葡萄糖+10 μg·mL-1黄芪汤)、黄芪汤中浓度组(30 mmol·L-1葡萄糖+30 μg·mL-1黄芪汤)、黄芪汤高浓度组(30 mmol·L-1葡萄糖+100 μg·mL-1黄芪汤)。黄芪汤在高糖刺激前2 h加入,细胞培养24 h后用于实验。
1.7 划痕实验检测细胞迁移能力
取对数生长期的人足细胞经胰酶消化后,配制成细胞悬液,计数后按每孔1×104密度铺于6孔板中,放入33 ℃培养箱中培养至细胞贴壁,转移至37 ℃培养箱中继续培养7 d,黄芪汤组提前2 h加入含黄芪汤无血清培养基,使用100 μL无菌枪头于板底划线,PBS洗涤去除悬浮细胞,加入对应药物进行干预,立即于显微镜下拍摄加药后初始划痕照片,将细胞放回33 ℃培养箱继续培养,24 h后同一位置拍摄照片,使用Image J分析划痕照片,计算各组细胞迁移率。迁移率=(初始距离面积-24 h距离面积)/(初始距离面积)×100%。
1.8 qPCR法检测细胞炎症因子表达
以10 cm细胞培养皿培养细胞,黄芪汤组根据CCK-8检测结果,设置实验浓度为100 μg·mL-1,给予对应干预24 h后,根据试剂盒说明书进行操作。用2-ΔΔCt计算mRNA表达量。
引物设计与合成由上海捷瑞生物工程有限公司提供,序列如表1所示。

表1 细胞炎症因子引物序列Table 1 Cellular inflammatory factor primer sequence
1.9 ELISA法检测细胞上清炎症因子水平
收取各组细胞培养24 h后的上清液,按照试剂盒说明进行操作,检测细胞上清液中TNF-α、IL-6水平。
1.10 Western blot法检测细胞蛋白表达水平
各组细胞培养24 h后提取蛋白,BCA法测定蛋白浓度。进行SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜,5%BSA封闭1 h,加入对应一抗,4 ℃摇床孵育过夜。次日用TBST洗膜3次,每次5 min,加入对应二抗室温孵育1 h,TBST洗膜3次,每次5 min,ECL避光显影,使用Image J软件分析条带,计算各组目的蛋白与GAPDH比值,得出各组蛋白相对表达量。上述实验均重复3次。
1.11 统计学分析
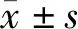
2 结果
2.1 黄芪汤对足细胞增殖活性的影响
CCK-8检测结果显示,与黄芪汤1 μg·mL-1组相比,黄芪汤浓度为3、10、30、100 μg·mL-1时对细胞增殖活性无明显影响(P>0.05),结果见表2。因此,本实验选取10、30、100 μg·mL-1三个浓度观察黄芪汤对高糖诱导足细胞损伤的影响。
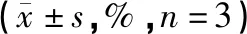
表2 不同浓度黄芪汤对足细胞增殖抑制率的影响Table 2 Effect of different concentration of Huangqi Decoction on podocyte proliferation
2.2 黄芪汤对高糖诱导足细胞迁移及黏附能力的影响
结果显示,与对照组相比,模型组细胞划痕愈合率明显降低(P<0.01),说明高糖抑制了足细胞迁移和黏附作用;与模型组相比,予10、30、100 μg·mL-1黄芪汤干预后,各组细胞划痕愈合率明显升高(P<0.01),表明黄芪汤改善了高糖对足细胞迁移、黏附能力的作用,结果见图1。
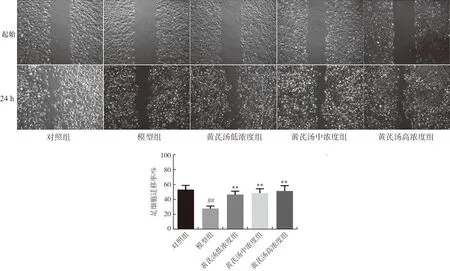
注:与对照组比较,##P<0.01;与模型组比较,图1 黄芪汤对足细胞迁移能力的影响Fig.1 Effect of Huangqi Decoction on the migration ability of podocyte
2.3 黄芪汤对足细胞炎症因子mRNA表达的影响
与对照组相比,模型组中IL-6、TNF-α、CCL24 mRNA表达显著上调(P<0.05,P<0.01);与模型组相比,高浓度黄芪汤干预后,足细胞中IL-6和TNF-α mRNA表达明显减少(P<0.01),表明黄芪汤可抑制高糖诱导的足细胞炎症反应,结果见图2。
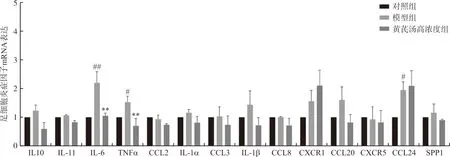
注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,图2 黄芪汤对足细胞炎症因子mRNA表达的影响Fig.2 Effect of Huangqi Decoction on the mRNA fold change of podocyte inflammatory cytokine
2.4 黄芪汤对高糖诱导的足细胞上清液中IL-6和TNF-α水平的影响
ELISA结果显示,与对照组相比,模型组细胞炎症因子IL-6和TNF-α水平明显升高(P<0.01);黄芪汤干预明显降低了上清液中IL-6和TNF-α的水平(P<0.01),表明黄芪汤能够减少高糖诱导的足细胞中炎症因子IL-6、TNF-α的分泌,抑制足细胞炎症反应,结果见图3。
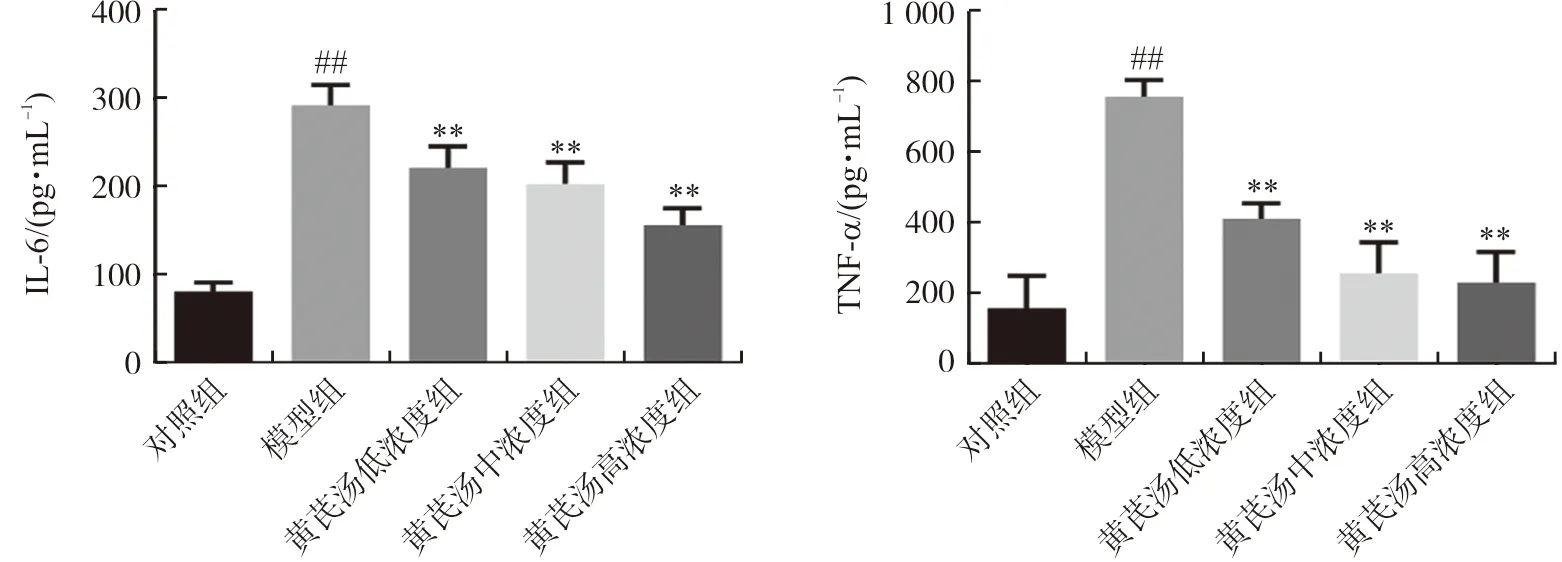
注:与对照组比较,##P<0.01;与模型组比较,图3 黄芪汤对足细胞上清液中炎症因子水平的影响Fig.3 Effect of Huangqi Decoction on the levels of inflammatory cytokine in the supernatant of podocyte
2.5 黄芪汤对高糖诱导的足细胞IL-6和TNF-α蛋白表达的影响
通过Western blot进一步验证黄芪汤对高糖诱导的足细胞炎症的抑制作用。与ELISA结果基本一致,模型组IL-6和TNF-α的蛋白表达水平显著高于对照组(P<0.01); 黄芪汤干预下调了IL-6和TNF-α的蛋白表达(P<0.05,P<0.01),表明黄芪汤可阻碍高糖诱导的足细胞炎症反应,结果见图4。
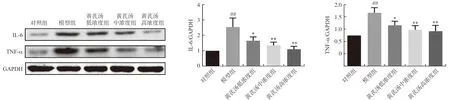
注:与对照组比较,##P<0.01;与模型组比较,图4 黄芪汤对足细胞中炎症因子蛋白表达的影响Fig.4 Effect of Huangqi Decoction on the protein expression of podocyte inflammatory cytokine
2.6 黄芪汤对高糖诱导足细胞TLR4/NF-κB信号通路的影响
通过Western blot进一步分析黄芪汤对高糖诱导的足细胞中TLR4/NF-κB信号通路的影响,结果表明TLR4和p-NF-κB/NF-κB蛋白表达水平在高糖处理的足细胞中均显著升高(P<0.01),黄芪汤处理后,足细胞中TLR4和p-NF-κB/NF-κB蛋白的表达显著降低(P<0.01),表明黄芪汤可抑制高糖诱导的足细胞中TLR4/NF-κB信号通路的激活,结果见图5。
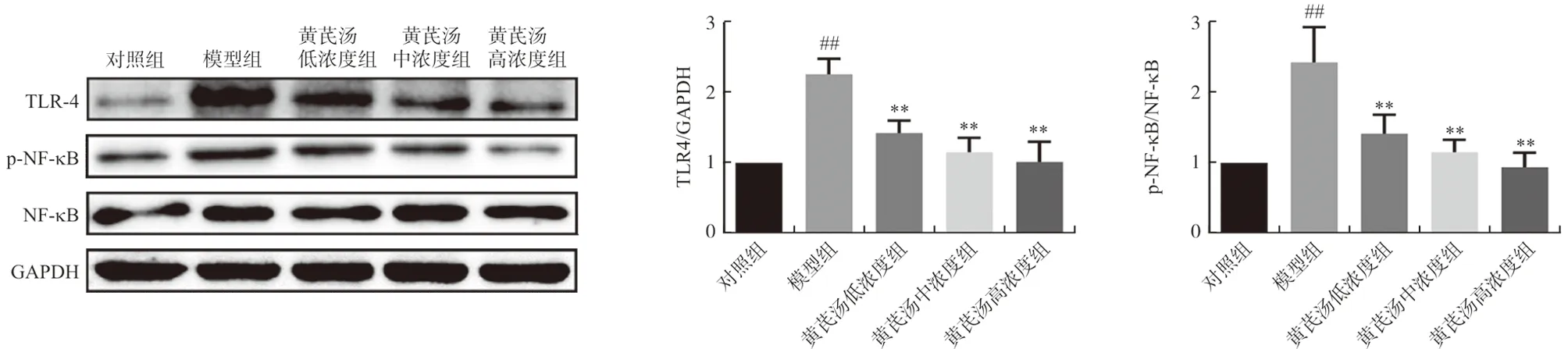
注:与对照组比较,##P<0.01;与模型组比较,图5 黄芪汤对足细胞中TLR4、NF-κB蛋白表达的影响Fig.5 Effect of Huangqi Decoction on the protein expression of TLR4 and NF-κB in podocyte
3 讨论
黄芪汤具有广泛的药理活性,已被证明可通过改善多种病理变化延缓DN进展。本团队之前通过液相色谱-质谱法(Liquid chromatograph mass spectrometer,LC-MS)分析鉴定黄芪汤的主要活性成分[12]包括黄芪甲苷,落新妇苷、毛蕊花糖苷、甘草酸、五味子素、鲁斯可皂苷元、梓醇、甘草苷。现代药理学研究表明,黄芪汤中活性成分可抑制细胞炎症通路的激活[13-15],降低炎症因子TNF-α、IL-6产生[16],增强细胞抗炎、抗氧化能力,改善细胞凋亡[16-19],减弱高糖引起的肾脏结构和功能损伤[16,20],有效保护肾脏功能。足细胞是肾小球滤过屏障的重要组成部分,受到损伤后会发生一系列变化,从肥大、脱离、自噬到细胞凋亡,导致蛋白尿形成,是DN发病机制中的一个重要早期事件,因此足细胞数量和功能变化是进行性DN的最强预测因子[21]。本团队前期在临床工作中发现,黄芪汤明显降低了DN Ⅲ期患者的蛋白尿水平[22],由此我们推测黄芪汤可能具有足细胞保护作用。细胞迁移是正常细胞的基本功能之一,是机体正常生长发育的生理过程。足细胞迁移缓慢说明足细胞黏附作用受损,足细胞黏附性下降导致足细胞大量丢失,足细胞数量减少。足细胞数量下降是肾小球滤过屏障结构异常乃至产生蛋白尿的重要原因[23]。我们在足细胞划痕实验中发现,高糖刺激24 h后模型组的细胞划痕愈合率明显低于对照组,黄芪汤干预后各组划痕愈合率较模型组明显改善,证明黄芪汤能够抑制高糖诱导的足细胞迁移、黏附能力的改变,维持足细胞数量和功能的稳定,改善高糖环境下足细胞损伤,保护肾小球滤过屏障,从而减少DN蛋白尿。
炎症是DN发展重要的病理基础,炎性细胞浸润可促进肾脏纤维化,加重肾组织病理损伤。DN肾组织炎症状态下,炎症因子的分泌增多,免疫细胞被募集到肾组织中积累和浸润,进一步释放促炎因子,从而加重炎症并损害肾脏组织[24]。既往研究发现糖尿病小鼠肾脏中炎症细胞因子mRNA表达显著上调,包括CCL2、CCL3、CCL8、CCL20、CCL24、CXCR1、CXCR5、IL-1α、IL-1β、IL-6、IL-10、IL-11、TNF-α以及Spp1[25]。本研究通过qPCR检测高糖环境下人足细胞中上述炎症因子的表达,与对照组相比,模型组中TNF-α、IL-6、CCL24的mRNA表达明显增加,其他炎症因子的表达无显著差异,黄芪汤的干预明显降低了高糖诱导的足细胞中TNF-α、IL-6 mRNA表达。趋化因子大致分为4个亚家族——CC、C、CXC和CX3C,CC趋化因子家族可反映DN中肾小管炎症损伤的水平[26]。最近研究也表明,CCL24可以通过减轻足细胞炎症来保护肾脏功能[27],CXCR家族CXCR1和CXCR5则参与诱导肾小球内皮细胞损伤[26,28]。此外炎症细胞因子不会单独作用,而是相互调节,因此本研究模型组其他炎症因子表达无显著差异,可能是由于细胞因子之间的相互作用没有达到显著的阈值。另一方面,DN病程相对较长,炎症因子的表达或许与足细胞DN模型的高糖刺激时间相关,此处尚不能排除刺激时间对炎症因子表达的影响。有研究显示,蛋白尿水平的升高伴随着炎症因子IL-6、TNF-α表达的增加[29],本团队前期临床研究发现,黄芪汤能减少DN患者尿微量白蛋白、24 h尿蛋白定量,降低尿白蛋白排泄率,有效降低DN患者血清中炎症因子IL-6、TNF-α水平,改善肾单位内环境,减轻高糖造成的肾功能损伤,延缓DN进展[22]。本研究中,我们通过ELISA和Western blot进一步验证黄芪汤对高糖诱导的足细胞炎症反应有抑制作用,证实黄芪汤具有足细胞保护作用。
众所周知,TLR4/NF-κB信号通路是启动内源性炎症信号转导的经典途径,TNF-α和IL-6是TLR4/NF-κB信号通路激活的产物[30]。TLR4是炎症通路的上游因子,转录因子NF-κB与炎症反应密切相关,高糖刺激会显著促进TLR4的表达和激活,激活的TLR4在肾脏中诱导足细胞中NF-κB的活化,而促进炎症因子TNF-α、IL-6的释放,加重足细胞的炎症损伤[31]。现代药理学研究证明,黄芪汤中多种成分具有调节TLR4/NF-κB信号通路的作用,如:黄芪有效成分黄芪多糖可通过调节TLR4/NF-κB信号通路,抑制IL-6、TNF-α的表达,改善CVB3诱导的心肌损伤和炎症反应[32];茯苓多糖可调节TLR4/TRAF6/NF-κB信号通路,发挥抗氧化和抗凋亡的作用[33];地黄提取物梓醇可抑制TLR4/NF-κB通路,减弱脂多糖诱导的炎症反应[34];麦冬的多糖提取物具有抑制IκB激酶(IκB kinase,IKK)-NF-κB通路、改善胰腺β细胞炎症、增加胰岛素分泌的作用[35];五味子乙素能改善血管紧张素Ⅱ引起的慢性炎症和氧化应激,保护血管功能,也与抑制NF-κB的活化有关[36]。因此,我们猜测黄芪汤可能通过调节经典的TLR4/NF-κB信号通路的活性,抑制炎症反应,发挥保护足细胞的作用。实验结果证实黄芪汤抑制高糖诱导的TLR4/NF-κB信号通路的激活,从而改善高糖诱导的足细胞炎症损伤。
综上所述,本研究证明黄芪汤可通过抑制TLR4/NF-κB信号通路活性改善高糖诱导的足细胞炎症,减少足细胞损伤,延缓DN的进展,为黄芪汤的临床实践提供了更多的参考数据。本实验尚未涉及黄芪汤调节NF-κB表达的具体靶点,后续研究将进一步验证黄芪汤是否通过抑制IKK表达和NF-κB抑制剂(Inhibitor of NF-κB, IκB)磷酸化,从而抑制NF-κB的易位进入细胞核和激活DN炎症反应,改善足细胞损伤。

