聚四氟乙烯改性掺硼金刚石电极强化降解阿特拉津
丁嘉,李钰,官宝红
(浙江大学环境与资源学院,杭州 310058)
作为广泛使用的除草剂之一,阿特拉津(atrazine,ATZ)具有杀草谱广和持效期长的特点。我国从20世纪80年代开始引入并使用ATZ,2009年其施用量超过5 000 t[1]。ATZ可通过降水径流、污染沉积物的释放以及大气沉降等方式进入天然水体,再通过食物链在人体富集,对人类健康产生危害。1997 年世界野生动物基金会将ATZ 列为环境负荷物质,美国、欧洲共同体和日本等均将其列入内分泌干扰剂化合物名单[2]。我国《生活饮用水卫生标准》(GB 5749—2006)对ATZ 的限值与美国环境保护署规定的饮用水标准(National Primary Drinking Water Standards)相同,均为3 μg/L;加拿大制定的水生生物保护区水质标准为2 μg/L;欧洲共同体规定的饮用水ATZ 限值为0.1 μg/L(98/83/EC)[3]。由此可见,国内外都十分重视控制水体中ATZ 的污染。我国部分河流、水库和海域有ATZ被检出。例如,北京官厅水库ATZ质量浓度为0.08~3.90 μg/L,长江南京段、泰州段和南通段中ATZ质量浓度为0.10~64.49 μg/L,吉林省辽河中ATZ 质量浓度为8.85~18.93 μg/L[1]。水体中ATZ 浓度超标的主要原因是生产企业排放废水和农业面源污染[1]。目前去除ATZ 的常用技术为生物法和吸附法[1],但是生物法处理效率偏低,吸附法由于缺乏选择性而利用效率不高,并存在吸附剂的再生或处置问题。因此,亟需开发相应的高效处理技术。
电化学氧化法是一种常见的水处理技术,尤其适用于处理稳定性好、毒害性大的有机污染物[4]。电极材料与降解途径和氧化方式密切相关。根据氧化有机污染物的方式,可以将阳极分为2大类:活性阳极和非活性阳极[5]。2 类电极的初始反应均为H2O 氧化生成羟自由基(·OH),但是活性阳极会将·OH转变为氧化能力较差的氧化物或超氧化物,而非活性阳极不与·OH反应,增大了·OH与有机污染物反应的概率,从而具有氧化速率高(>1×109s-1)的特点[6]。掺硼金刚石(boron-doped diamond,BDD)电极由于化学性质稳定、导电性好、不易结垢[7]、O2过电位大[7]和易于改性等优点成为主流的非活性阳极[8]。但是BDD 电极产生的·OH 和反应的活性位点囿于电极表面[9],受到传质扩散的限制,进而导致有机污染物的降解效果偏低[7,10]。
聚四氟乙烯(polytetrafluoroethylene, PTFE)具有亲气特性[11],本研究将其用于改性BDD电极以强化电极氧化降解ATZ 的效果,以期探究PTFE 改性增强电极性能的机制,揭示ATZ的降解路径。
1 材料与方法
1.1 电极材料与改性
BDD电极采用热丝化学气相沉积法生产(上海晶安生物科技有限公司)。实验所用电极属于同一批次产品,硼原子浓度约为3×1020个/cm3。
为去除电极表面的sp2碳、增强亲水性,将电极在电流密度为20 mA/cm2(电流密度按电极几何体积计算)、1 mol/L NaClO4溶液中处理20 min[12]。处理后的电极分别浸入5.0%、8.6%、20.0%PTFE 分散液[由质量分数为60.0%PTFE 分散液(上海硕旭生物科技有限公司)稀释得到],浸泡10 min 后,取出电极并置于120 ℃的烘箱中干燥30 min,最后在氩气中于350 ℃条件下煅烧30 min[11],分别记为5.0%、8.6%、20.0%PTFE改性BDD电极。
1.2 实验装置及试剂
实验采用三电极体系,工作电极为未改性BDD 电极,5.0%、8.6%、20.0%PTFE 改性BDD 电极(大小为3 cm×3 cm),辅助电极为铂片电极(纯度为99.99%,大小为3 cm×3 cm),参比电极为饱和甘汞电极,工作电极与辅助电极的极间距设置为1.0 cm。实验装置包括100 mL未分隔的玻璃电解池、RXN-35D直流电源(深圳市兆信电子仪器设备有限公司)和HS4 digital磁力搅拌装置(美国IKA公司)。
实验所用试剂购自上海国药集团化学试剂有限公司,使用前无需进一步预处理。高效液相色谱分析所用试剂符合标准GB/T 5750.1—2006(《生活饮用水标准检验方法 总则》)[13],其余实验试剂均为分析纯。
1.3 实验方法
检测不同浓度PTFE分散液改性BDD电极对ATZ氧化降解的影响:依据GB 21523—2008(《杂环类农药工业水污染物排放标准》)[14],实验中ATZ质量浓度设置为3 mg/L(13.9 μmol/L)。将含有7 mmol/L NaCl和13.9 μmol/L ATZ的电解液以电流密度10 mA/cm2处理,取样2 mL,同时加入1 mL 100 mmol/L Na2S2O3溶液用于猝灭样品中的·OH和活性氯。
检测电解质种类对ATZ氧化降解的影响:将含有7 mmol/L NaHCO3或Na2SO4和13.9 μmol/L ATZ的电解液以电流密度10 mA/cm2处理,取样2 mL,加入1 mL 100 mmol/L Na2S2O3溶液用于猝灭样品中的·OH 和其他氧化性物质。为区分吸附于电极表面和溶液本体中的·OH,向电解液中添加10 mol/L甲醇用于猝灭溶液本体中的·OH[12]。电极表面的·OH计算公式[15]如下:
式中:c[ATZ]和c[·OH]分别为ATZ 和·OH 的浓度;kobs,ATZ为ATZ 的 表 观 动 力 学 常 数;k·OH,ATZ为ATZ 与·OH 的准二级反应动力学常数,此处为3.0×109L/(mol·s)[12]。
荧光实验使用的电解池为直径9 cm 的玻璃培养皿,采用三电极系统,工作电极为8.6%PTFE改性BDD 电极(大小为3 cm×3 cm),辅助电极为铂片电极(纯度为99.99%,大小为3 cm×3 cm),参比电极为饱和甘汞电极,使用RXN-35D直流电源提供电压,电解液为7 mmol/L NaCl 和10 μmol/L 2,7-二氯荧光素二乙酸酯(dichlorodihydrofluorescein diacetate,H2DCFDA)。
1.4 分析方法
采用CHI 660E电化学分析仪(上海辰华仪器有限公司)绘制线性扫描伏安曲线。测量前,在电压为3 V,含7 mmol/L NaCl、13.9 μmol/L ATZ 的电解液中,所有电极在开始绘制曲线前均达到稳定电流密度。使用Fluke-117C 万用表测量电极电阻,记2 条对角线端点电阻的平均值为电极电阻。使用ZEISS Gemini 300扫描电子显微镜观察电极表面的形貌与结构。操作步骤:将样品粘贴于导电胶上,然后置于样品台进行观察,放大倍数为5 000倍。
根据GB/T 5750.1—2006[13]方法,使用LC-20AD 高效液相色谱仪(日本岛津公司)分析ATZ浓度。色谱柱为C18 柱(250 mm×4.6 mm, 5 μm),柱温为40 ℃;流动相V(甲醇)∶V(水)=5∶1,流速为0.9 mL/min;检测波长为254 nm;进样量为10 μL。使用FV1200 激光扫描共聚焦显微镜(日本奥林巴斯公司)测量荧光强度,物镜规格40×(水镜),激发波长488 nm,发射波长515 nm/50 nm。
使用Triple TOF 5600超高效液相色谱-质谱联用仪(美国AB SCIEX 公司)分析ATZ 的降解产物。液相色谱条件:色谱柱为ACQUITY UPLC CSH C18柱(2.1 mm×100 mm,1.7 μm,美国Waters 公司),流动相V(乙腈)∶V(水)=50∶50,流速为0.3 mL/min,检测波长为254 nm。质谱条件:使用电喷雾电离源,正离子扫描模式,扫描质量范围m/z50~300,气体压力为6 895 Pa。
2 结果与分析
2.1 PTFE 改性BDD 电极降解ATZ
未改性BDD 电极,5.0%、8.6%、20.0% PTFE 改性BDD 电极的表面形貌与结构如图1 所示。BDD电极晶粒属于微米尺度,微米级金刚石电极可减少使用过程中的针孔数量[16],有利于电极长时间使用。由结果可知:5.0%、8.6%、20.0%PTFE 改性BDD 电极覆盖的PTFE质量分别为2.1、2.7、6.9 mg;PTFE以膜的形式附着于电极表面,且随着PTFE 覆盖质量的增加,裸露的BDD电极表面积降低。
ATZ的表观降解动力学符合准一级动力学原理,PTFE改性对BDD电极降解ATZ速率和效果的影响见图2。从中可知:未改性BDD电极反应动力学常数为3.64×10-4s-1,5.0%、8.6%、20.0%PTFE 改性BDD电极反应动力学常数分别为7.24×10-4、6.85×10-4、6.50×10-4s-1。相比未改性BDD 电极,PTFE 改性BDD 电极对ATZ 的降解速率分别提高了98.9%、88.2%和78.6%。在BDD 电极处理含Cl-的ATZ 溶液时,直接电子转移反应所占比例低[12],主要氧化物质为·OH 和活性氯[17],由于活性氯的反应速率[kHOCl,pH=8=5.2×10-3L/(mol·s)]相较于·OH的反应速率[k·OH=3.0×109L/(mol·s)]可忽略不计[18],因此ATZ的降解归因于·OH的作用。依式(1)计算得到未改性BDD 电极,5.0%、8.6%、20.0% PTFE 改性BDD电极产生的·OH浓度分别为1.21×10-13、2.41×10-13、2.28×10-13、2.17×10-13mol/L。
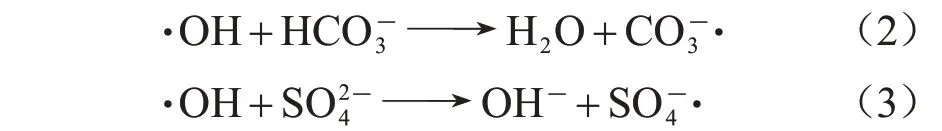
实际水体中,多种共存阴离子会影响BDD 电极降解有机物的效率[7],不同电解质对ATZ 降解效率的影响如图3 所示。从中可知:在NaHCO3和Na2SO4溶液中,BDD 电极降解ATZ 的准一级动力学常数分别为5.74×10-4、5.81×10-4s-1,8.6% PTFE改性BDD电极相较于未改性BDD电极的动力学常数分别提高了49.2%、127.0%,表明PTFE 改性BDD电极在多种电解质中均可提高ATZ 的降解效果。PTFE 改性使BDD 电极产生的·OH 浓度升高,在NaHCO3溶液中,·OH与HCO3-反应[式(2)]生成弱氧化剂·[E0=1.8 V,kCO3-·,pH=8=3.7×106L(/mol·s)][12],因此降低了溶液的总氧化能力;在Na2SO4溶液中,·OH 与反应[式(3)]生成氧化剂·,由于·的E0=2.5~3.1 V,与·OH的E0=1.9~2.8 V相近[12],所以对体系的氧化能力影响小,因此在Na2SO4溶液中,PTFE 改性BDD 电极对ATZ 降解效果的提升最为明显。8.6%PTFE 改性BDD 电极处理120 min 时,NaCl 溶 液 中ATZ 的 去 除 效 率 为99.93%,出水中ATZ质量浓度降低到2.1 μg/L,而在Na2SO4和NaHCO3溶液中ATZ 的去除效率均为100%。3种电解质溶液中ATZ的出水浓度均降至低于GB 3838—2002(《地表水环境质量标准》)[19]中规定的ATZ指标值。

图3 PTFE 改性BDD 电极对Na2SO4 和NaHCO3 溶液中ATZ降解的影响Fig.3 Effects of the modified BDD electrodes with PTFE on the degradation of ATZ in Na2SO4 and NaHCO3 solutions
2.2 PTFE 强化BDD 电极氧化性能的机制
在7 mmol/L NaCl溶液中,电极电阻随PTFE的覆盖质量增大而增加,未改性BDD 电极,5.0%、8.6%、20.0%PTFE改性BDD电极电阻分别为21.8、31.9、37.3、55.1 Ω。但线性扫描伏安曲线(图4)显示的电流大小排序为8.6%PTFE 改性BDD 电极>5.0%PTFE改性BDD电极>20.0%PTFE改性BDD电极≈未改性BDD 电极。电解60 s 后,发现PTFE改性改变了BDD电极电阻,同时提高了电极表面黏附气泡的能力,且黏附气泡的数量随着PTFE 覆盖质量的增加而增加(图5)。电流随电极电阻的提高而增大,说明气泡黏附有利于电流的增大。这不同于当前一些研究的主流观点[7],即气泡黏附使电流降低。推测原因与气-水界面的电场(约1.4 V/nm)引起质子扩散[20],出现局部不平衡的OH-有关,因为过量的OH-作为导电介质,增强了气-水界面的导电性,使电流升高;同时OH-浓度升高会使·OH 的氧化还原电位降低,从而导致·OH浓度增大[21]。

图4 PTFE改性前后BDD电极的线性扫描伏安曲线Fig.4 Linear sweep voltammetry curve for the modified BDD electrode with PTFE

图5 PTFE改性前后BDD电极的气泡黏附现象Fig.5 Photographs of the bubble adhesion on BDD and the modified BDD electrode with PTFE
甲醇(猝灭剂)仅与溶液本体中的·OH 发生反应,因此加入甲醇后ATZ 的降解归因于吸附在电极表面·OH 的作用[12]。当加入10 mol/L 甲醇时,未改性电极,5.0%、8.6%、20.0%PTFE 改性BDD 电极动力学常数分别降低至3.39×10-4、2.16×10-4、1.61×10-4、1.54×10-4s-1,相比加入猝灭剂前分别降低了6.9%、68.5%、76.4%、76.3%(图6)。据式(1)计算,未改性的BDD电极溶液本体中的·OH浓度为8.33×10-15mol/L,而5.0%、8.6%、20.0% PTFE 改性BDD电极溶液本体中·OH 浓度分别为1.56×10-13、1.74×10-13、1.65×10-13mol/L,分别提高了17.73倍、19.89倍、18.81 倍,与其他研究结果[12]相同。在未改性BDD电极降解有机污染物的过程中,溶液本体中的·OH对ATZ的降解影响较小。原因是·OH寿命极短(1×10-9s<t1/2<1×10-6s)[22],且传质系数较低(10-5m/s)[16],导致·OH 作用区仅几百纳米[18],使得其对有机污染物的降解受到传质扩散的限制[7,10]。目前增加溶液本体中·OH浓度的方法是与其他技术联用,如超声和光催化,但各种技术相互之间呈现拮抗作用,使降解效率和能源利用率下降[23]。而PTFE 改性电极溶液本体中的·OH 浓度接近水溶液中·OH 浓度的高值[17],证明PTFE 改性可有效增加溶液本体中的·OH浓度,进而增强其对ATZ的降解作用。
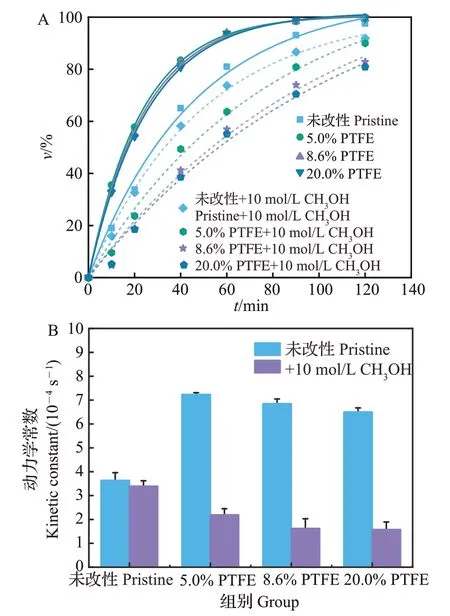
图6 甲醇(猝灭剂)对PTFE改性BDD电极降解ATZ的影响Fig.6 Effects of methanol(quenching agent)on the degradation of ATZ by the modified BDD electrode with PTFE
当电解质为NaCl 时,增强H2DCFDA 荧光强度的活性物质为·OH 和ClO-,其中H2DCFDA 对·OH的选择性是ClO-的86倍[21],因此·OH是引起荧光强度变化的主要活性物质,可以通过施加电压前后荧光强度的变化来判断·OH生成的场所(图7)。在开路电压下,电极表面与距离其50 μm处溶液与气-水界面的荧光强度无明显变化(图7A~B)。当施加电压时,与电极表面相比,距离其50 μm 处溶液和气-水界面的荧光强度显著增加(图7C~E),说明·OH 在气泡的气-水界面生成,并且气-水界面的·OH 浓度明显高于无气泡黏附区域。气泡生长和逸出使得气-水界面上的·OH 与溶液本体中的ATZ充分反应,进而提高了ATZ的降解速率。

图7 8.6%PTFE改性BDD电极的激光共聚焦显微镜图像及荧光强度Fig.7 Confocal microscopy images and fluorescent intensity of the modified BDD electrode with 8.6%PTFE
2.3 ATZ 的降解路径
在7 mmol/L NaCl 电解质溶液中,PTFE 改性BDD电极降解ATZ的路径如图8所示,中间产物见表1。·OH 进攻ATZ 分子侧链的C—N 键,发生脱异丙基和脱乙基反应[24],生成C5H8N5Cl(CEAT)、C3H4N5Cl(CAAT)和C6H10N5Cl(CAIT);由于与杂环相连的Cl 极性较高,容易发生裂解,所以同时发生羟基化反应,生成C8H15N5(HEIT)。随着反应时间的延长,中间产物可进一步发生烷基氧化反应[25],生成 C8H13O2N5(HAITM)、C7H11O2N5(HAET)和C7H9N5O3(HDAT),最终矿化。

表1 PTFE改性BDD电极降解ATZ的中间产物Table 1 Intermediate products during the degradation of ATZ by modified BDD electrode with PTFE

图8 PTFE改性BDD电极降解ATZ的路径Fig.8 Pathway of the degradation of ATZ by modified BDD electrode with PTFE
3 结论
1)在NaCl 水溶液中,BDD 电极降解ATZ 的准一级动力学常数为3.64×10-4s-1,经过5.0%、8.6%、20.0% PTFE 改性后,其动力学常数分别提高了98.9%、88.2%和78.6%。在NaHCO3和Na2SO4溶液中,BDD电极降解ATZ的准一级动力学常数分别为5.74×10-4、5.81×10-4s-1,8.6%PTFE 改性BDD 电极相较于未改性电极动力学常数分别提高了49.2%和127.0%,表明PTFE 改性BDD 电极在多种电解质溶液中均可提高ATZ的降解效果。
2)PTFE 以膜的形式附着于BDD 电极表面,PTFE 改性导致的气泡黏附有利于电流的增加,使改性电极的电流高于未改性电极,同时气泡的气-水界面有利于·OH生成,增加了溶液本体中·OH浓度,在5.0%、8.6%、20.0% PTFE 改性电极降解ATZ过程中,溶液本体·OH 浓度分别增加了17.73 倍、19.89倍、18.81倍,有效增强了对溶液本体中ATZ的降解。
3)PTFE 改性BDD 电极氧化降解ATZ 的主要途径为脱烷基、脱氯-羟基化和烷基氧化反应。
4)气泡的气-水界面上·OH的生成机制尚未明晰,需要进一步研究。

