银叶树幼苗生长和化学计量特征对干旱胁迫的响应*
刘梦芸 甘先华 张卫强 李一凡 黄芳芳黄钰辉 周 毅 陶玉柱
(广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520)
水分是影响植物生长的关键因子之一,水分亏缺可导致植物干物质产生和分配发生一系列变化,如各器官生物量减少,叶、茎、根分配比率发生显著变化[1-2]。干旱胁迫下,植物地上部分生物量的减少能够防止水分在地上部分过多消耗,而地下部分生物量的增加则有利于根系获取更多的水分,增强植物对干旱的适应性[3]。例如,高小锋等[4]利用盆栽试验研究刺槐Robinia pseudoacacia幼树不同生长期对干旱胁迫的响应,发现长期严重干旱(45 ~60 d)胁迫显著降低了刺槐地上部分生物量分配比例,增加了根冠比。干旱胁迫通常会降低植物光合速率、酶活性及其合成速率等[5];导致植物体内可溶性糖、蛋白质以及总氮浓度降低等积累、转移或转化[6],进而影响到植物C、N 及P 生态化学计量特征。例如,王凯等[7]研究干旱胁迫对杨树Ulmus pumila幼苗N、P 化学计量及分配格局的影响,发现干旱胁迫下根N 浓度下降,但根P 浓度上升,导致根N/P 下降。同样的,王凯等[8]研究发现榆树幼苗在干旱胁迫环境下,C 含量和N含量在根、茎、叶中均有增加,P 含量在各器官中下降。化学计量可以将环境变化与器官功能性状联系起来[9],干旱胁迫下不同器官营养元素浓度及分配特征可反映植物对环境变化的适应能力及生态策略[10],对阐明环境作用于植物器官功能的内在机制具有重要意义。
银叶树Heritiera littoralis是最重要的半红树植物之一,具有典型的海陆生境适应性、独特的生态功能及较高的经济价值[11]。近年来,银叶树群落破坏严重,分布面积剧减,中国现存成年个体数在20 株以上的银叶树种群仅见于广东深圳市盐灶和海丰县香坑、广西防城港和海南清澜港的沿海区域[12]。然而沿海区域立地条件较为恶劣,诸如淡水资源缺乏、常年海风强度大导致的土壤水分蒸发快等干旱因素限制了沿海银叶树种群恢复的效果。目前关于干旱胁迫与半红树植物化学计量关系方面的报道较少, 大部分研究集中于北方干旱区植物的化学计量特征对干旱胁迫的响应[7-8,13]。本文以银叶树实生苗为研究对象,通过盆栽试验研究了不同干旱胁迫程度对银叶树幼苗生物量生长及其各器官C、N、P 化学计量特征的影响,探讨银叶树幼苗生长过程对土壤干旱胁迫的适应特征,以期为银叶树种群恢复提供科学依据。
1 材料与方法
1.1 试验地概况
本试验在广东省林业科学研究院内(23°11′N,113°22′E)开展。广州属于典型亚热带季风气候,年平均温度 23 ℃,年降水量1 638 mm,其中4—9 月份的降水量占全年的80%。
1.2 供试材料与方法
本实验于2019 年5 月初开始,采用口径20 cm、下口径16 cm、高20 cm 的花盆(底部有排水通气孔)做盆栽控水实验的容器。每个花盆内单株定植长势良好且生长一致的2 年生实生苗,栽培基质一致,共60 盆。实生苗树高49.9±5.6 cm,茎粗0.82±0.12 cm。盆栽实验在大棚(大棚四周留通风口,通风口宽度为1.0m)内进行,肥水管理一致。土壤容重1.02 g·cm-3,田间持水量为31.5%。
试验植株正常水肥管理1 个月后,于2019 年6 月初进行土壤水分预处理。共设置了4 个干旱胁迫梯度,分别为对照(田间持水量的75%~80%,CK)、轻度干旱(55%~60%,LS)、中度干旱(35% ~40%,MS)、 重 度 干 旱(15% ~20%,SS),即土壤体积含水量分别为:23.6%-25.2%、17.3% ~18.9%、11.0% ~12.6%、4.7% ~6.3%。每个土壤水分处理设置15 个重复。每天18:00 时采用Spectrum 型土壤水分速测仪进行连续监测土壤含水量,及时调整每日的灌溉水量,确保各梯度土壤含水量维持不变。
干旱胁迫处理3 个月后进行破坏性采样。采样时将植物幼苗完整地从花盆中取出,用保鲜膜将根系包好防止失水并迅速带回实验室。然后将植物样本按器官分为叶、茎和根3 部分,放入烘箱烘至恒重然后称重获取各器官生物量的干重,最后磨碎并过筛用以分析各器官的元素含量。C 采用重铬酸钾外热氧化法测定;N 采用凯式定氮法测定;P 采用NaOH-熔融-钼锑抗比色法测定;土壤pH 值采用土水质量比1:2.5 电位法测定[14]。
1.3 数据处理
用单因素方差分析(one-way ANOVA)分析干旱胁迫程度对银叶树幼苗生物量及根冠比、银叶树幼苗各器官C、N、P 养分含量及比值的影响。用Turkey HSD 检验法进行显著性检验。用Pearson 相关分析法分析土壤-植物养分化学计量比的相关性。
2 结果与分析
2.1 银叶树幼苗生物量和根冠比对干旱胁迫对的响应
银叶树幼苗根、茎、叶的生物量和根冠比均对干旱胁迫均存在显著的响应。和CK 相比,LS对银叶树幼苗叶生物量没有显著影响,MS 和SS显著降低了银叶树幼苗叶的生物量,其中SS 处理下的叶生物量又显著低于MS 处理下的叶生物量,即银叶树幼苗的叶生物量随着干旱程度的加剧而逐渐降低(图2)。和CK 相比,LS 对银叶树幼苗茎的生物量没有显著影响,MS 和SS 显著的降低了银叶树的茎生物量,SS 处理下的茎生物量又显著低于MS 处理下的茎生物量,银叶树幼苗的茎生物量随着干旱程度的加剧而逐渐降低(图2)。和CK 相比,LS 和MS 对银叶树幼苗根的生物量没有显著影响,SS 显著降低了银叶树幼苗根的生物量(图2)。和CK 相比,LS 和MS 对银叶树幼苗的根冠比没有显著的影响,而SS 显著增加了银叶树幼苗的根冠比(图2)。
2.2 干旱胁迫对银叶树幼苗C、N、P 浓度的影响
本研究发现,干旱胁迫和器官的不同分别对银叶树幼苗N、P 浓度及其相关比值的效应显著。和CK 对比,银叶树幼苗叶N 浓度在SS 处理下显著增加,叶P 浓度则显著降低(图2)。不同干旱胁迫处理对茎的C、N、P 浓度均没有显著的影响(图2)。和CK 对比,根C 浓度在SS 处理下显著降低,根N 浓度则显著增加。干旱处理对根P 浓度没有显著的影响(图 2)。和CK 对比,干旱胁迫显著降低了叶片的C:N,显著增加叶片C:P 和N:P(图3)干旱胁迫对茎的C、N、P 化学计量比没有显著的影响(图3)。干旱胁迫显著降低了根的C:N 和C:P,对根的N:P 没有显著的影响(图3)。

图2 干旱胁迫对银叶树幼苗不同器官C、N、P 浓度的影响Figure 2 Drought stress effects on carbon, nitrogen, and phosphorus content in differnet organs of Heritiera littoralis seedlings
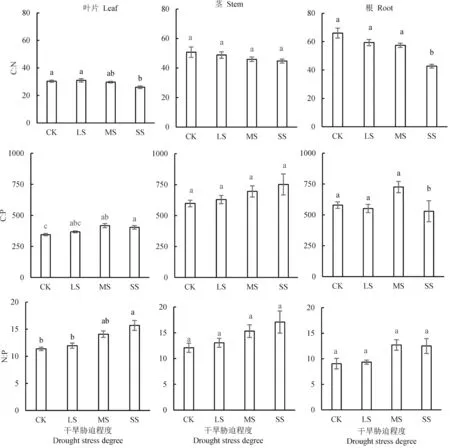
图3 干旱胁迫对银叶树幼苗不同器官C、N、P 化学计量比的影响Figure 3 Drought stress effects on stoichiometric characteristics of carbon, nitrogen, and phosphorus of Heritiera littoralis seedlings
2.3 银叶树幼苗不同器官C、N、P 浓度之间的相关性
银叶树幼苗相同元素在不同器官间进行相关性分析发现,银叶树幼苗不同器官的N 浓度之间和P 浓度之间均显著正相关 (P<0.05),而不同器官的C 浓度之间无显著相关性 (P>0.05)(表 1)。银叶树幼苗相同器官不同元素间进行相关性分析发现,叶的C 和N 之间显著正相关(P<0.05),叶的C 和P 之间显著负相关(P<0.05),根的C 与N之间显著负相关(P<0.05),其他器官中不同元素之间均无显著相关关系(P>0.05)(表1)。
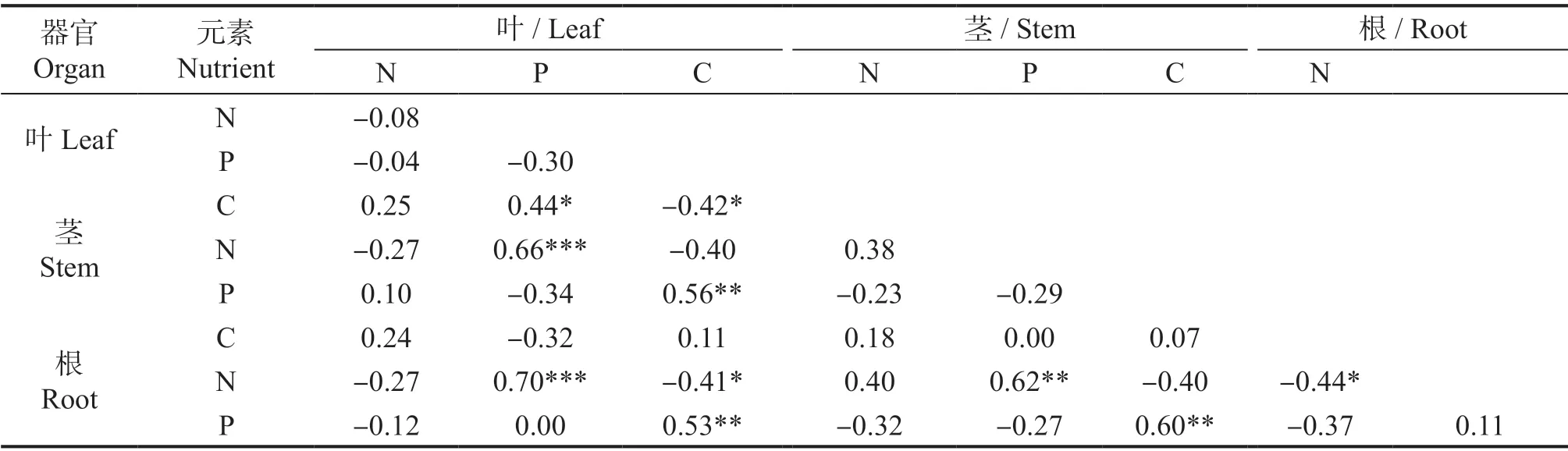
表1 银叶树幼苗不同器官C、N、P 浓度的Pearson 相关系数Table 1 Correlation coefficients among biomass and carbon, nitrogen, and phosphorus stoichiometry in different organs of Heritiera littoralis seedlings
3 结论与讨论
3.1 生物量是植物生长状态的综合反映,生物量分配能够反应植物生境的资源情况[15]。当植物生长受到土壤干旱胁迫时,会通过调节生物量在各器官中的分配以抵御干旱胁迫环境[16-17]。本研究结果显示银叶树幼苗叶生物量、茎生物量、根生物量均随土壤干旱胁迫程度的加剧而降低,而根冠比在极端干旱胁迫的情况下较正常供水量时显著增加,这主要由于干旱胁迫下银叶树幼苗通过增加根生物量来促进对土壤水分吸收,减少叶生物量和茎生物量来降低蒸腾耗水,从而减少干旱胁迫所造成的伤害,进而改变生物量分配格局,使根冠比增加[18-19]。银叶树幼苗叶生物量和茎生物均在MS 处理下显著低于CK 处理,而根生物量则在SS 处理下才出现显著性降低,进而增加了根冠比以适应干旱环境。
3.2 干旱胁迫影响植物C、N、P 的获取、运输、分配及贮存等生理生态过程,导致植物器官各元素浓度发生不同的变化[8]。与对照(CK)相比,根C 浓度在严重干旱胁迫的环境下显著降低(图2),这与在辽宁地区研究樟子松幼苗Pinus sylvestrisvar.mongolica[13]粗根C 浓度对干旱胁迫的响应结果一致,与其细根C 浓度对干旱胁迫的响应结果相反,这可能跟本研究中没有区分粗根和细根有关。在严重干旱胁迫的环境下,叶片N 浓度和根N 浓度显著高于其它处理(P<0.05;图2),这主要是由于在正常水分供给、轻度干旱及中度干旱下叶片生物量和根系生物量显著高于重度干旱下叶片和根系的生物量(图1),而植物生物量增加对其N 含量具有稀释作用[8]。同时,叶片N浓度增加可以提升水分利用效率并降低光合作用的水分散失[10]。研究表明,土壤干旱限制了土壤无机磷的吸附与溶解[20],导致银叶树幼苗根系从土壤中吸收P 减少,进而降低了叶片P 浓度。
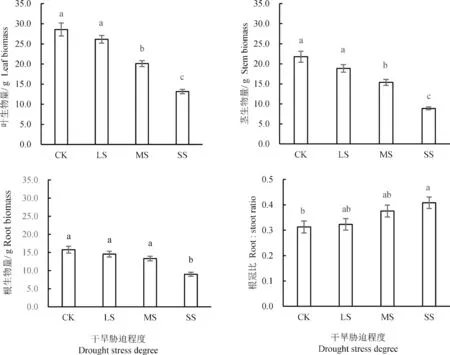
图1 银叶树幼苗生物量与根冠比对干旱胁迫的响应Figure 1 T responses of the biomass and root:shoot ratio of Heritiera littoralis seedlings to drought stress
叶片C:N 和和C:P 反映了植物对N 和P 的利用效率[21-22]。本研究发现,银叶树幼苗叶C:N 和根C:N 随土壤干旱胁迫的增加呈下降趋势,而叶C:P 和根C:P 表现出升高的趋势,表明干旱胁迫一定程度降低了银叶树幼苗对N 利用效率,却提高了幼苗对P 的利用效率。植物叶片N:P 值则能够反映植物生长受N 或P 元素限制的状况[23],N:P<14,植物生长主要受N 限制,14 <N:P <16,主要受N 和P 限制,而N/P >16,主要受P 限制[23-24]。本研究中,在正常供水和轻度干旱胁迫下叶片N:P 分别为11.38 和11.96,暗示银叶树幼苗生长可能受N 限制的影响。而中度干旱与重度干旱胁迫下叶片N:P 分别为14.08 和15.71,说明随着干旱程度的加剧银叶树生长可能受N 和P 共同限制的影响。
3.3 本研究发现银叶树幼苗叶、茎、根不同器官间的N 浓度和P 浓度对干旱胁迫的响应是一致的,说明银叶树幼苗各器官的N 或P 在环境胁迫下有着较强的协变性,即N、P 元素彼此协调以适应干旱环境[7]。研究还发现,银叶树幼苗的N 浓度与P 浓度无显著的相关性(表1)。这与在辽宁研究杨树幼苗Populusspp.[7]的结果一样,与兴安落叶松Larix gmelinii[25]和白刺Nitraria tangutorum[26]的研究结果不一致。这中研究结果的差异可能与研究方法有关,本研究和杨树幼苗的研究均采用盆栽控水法,能够保证其他试验条件均匀一致,而另外两个试验基于环境变化形成的降水梯度,可能受到了其它试验条件变异的影响。

