Hsa_circ_0045943 靶 向 miR-106a 对 胃 癌 细 胞生物学特性的影响
马经伟,张 宁,朱 萌 ,卢新兰,张志勇 ,任牡丹
(1. 宁夏医科大学总医院肿瘤外二科,宁夏银川 750004;2. 宁夏医科大学总医院病理科,宁夏银川 750004;3. 宁夏医科大学基础医学院,宁夏银川 750004;4. 西安交通大学第一附属医院消化内科,陕西西安 710061)
胃癌是世界范围内发病率第5 位和死亡率第3 位的恶性肿瘤[1]。胃癌的流行病学趋势显示,早期胃癌的预后很好,但进展期胃癌临床占比依然很高,多种类型转移的出现预示着5 年生存率不足30%[2];胃癌的发病具有广泛的地域差异,我国是胃癌高发区;由于癌症的自我感知较低,胃癌呈现年轻化趋势,且年轻患者往往呈现印戒细胞癌和低分化癌,预后较差。因此,迫切需要深入研究胃癌发生发展的分子机制。研究显示,非编码RNA 参与调控胃癌的发生发展。微小RNA(miRNA)是一类非常重要的非编码RNA,通过转录后抑制mRNA 而调节基因表达。环状RNA(circRNA)是一类新的非编码RNA,基本来源于其亲本基因的外显子[3-4],外显子环状RNA 结构使其在组织中稳定存在,许多RNA 转录本与miRNA 共享结合位点,通过蛋白质海绵、翻译和miRNA 海绵[3-5],尤以miRNA 海绵作用而参与到许多肿瘤的发病机制中。目前,关于circRNA 靶向miRNA 对胃癌细胞生物学特性的影响尚少见报道。本课题组前期研究显示,miR-106a 在胃癌中异常表达,可能参与调控胃癌细胞的生物学行为[6]。然而,miR-106a 异常表达的原因及调节机制并不清楚。为进一步探索,本研究从circRNA 对miRNA 作用入手,数据库筛选hsa_circ_0045943,检测其表达水平对胃癌细胞生物学特性的影响,以期与miR-106a 共同揭示胃癌发生发展的分子机制。
1 材料与方法
1.1 主要试剂及设备
胎牛血清(Gibco, Cat. No.10099-141),RPMI-1640 培养基(Hyclone,Cat.No.SH30809.01B),青链霉素,PBS 缓冲液,胰酶(Genview,Cat.No.9002-07-7),Lipofectamine™ 3000(Invitrogen,Cat.No.L3000075),CCK-8 检测试剂盒(Dojindo, Cat. No. CK04),Transwell 小 室(Costor, Cat. No. 3422),Matrigel 基 质(Corning, Cat. No. 356234),一步法 TUNEL 检测试剂盒(Beyotime),Trizo(lTakara),Bestar®qPCR RT kit(DBI Bioscience),Bestar®SybrGreen qPCR Master Mix(DBI Bioscience)。Stratagene Real time PCR仪(Agilent),酶联免疫监测仪(Thermo Fisher),倒置荧光显微镜(Leica),倒置显微镜(Motic)。
1.2 细胞培养与转染
人胃癌细胞系MKN-45、AGS 和胃黏膜上皮细胞GES-1购自于中国科学院上海细胞库,在含100 mL/L胎牛血清的RPMI-1640 培养基中于37℃50 mL/L CO2培养箱中常规培养。构建circ_0045943 的沉默载体,通过腺病毒载体将靶向circ_0045943 的短发夹RNA(sh-circRNA)和阴性对照(sh-NC)导入受体细胞;构建circ_0045943 的过表达载体(OE-circRNA)和阴性对照(OE-NC)。以上购自上海吉凯生物技术有限公司。采用Lipofectamine™3000 进行细胞转染,瞬时转染48 h 后用于后续实验。细胞功能实验分组:OE-NC、OE-circRNA、sh-NC、sh-circRNA。
1.3 Real-time PCR 检测 circ_0045943、miR-106a表达
采用Real-time PCR 法检测胃癌细胞中circ_0045943、miR-106a 的相对表达量。Trizol 法提取总RNA。RNA 模板量 2 μg,配置反应液 10 μL。逆转录:取上述反应液 7.0 μL,5×RT 缓冲液 2.0 μL,miRNA RT 0.25 μL,U6 R 0.25 μL,RT逆转录酶0.5 μL,总体系 10 μL。37 ℃ 15 min,98 ℃ 5 min,合成 cDNA 第一链。PCR扩增:cDNA 1 μL,Bestar®SybrGreen qPCR Master Mix 10 μL,PCR Forward Primer(10 μmol/L)0.5 μL,PCR Reverse Primer(10 μmol/L)0.5 μL,ddH2O 8 μL,总体系 20 μL。置于荧光定量 PCR 仪Mx3000P 进行如下反应:95 ℃ 2 min,94 ℃ 20 s,58 ℃20 s,72 ℃ 20 s,40 个循环。miR-106aRT:CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTACCTGC;miR-106a F:ACACTCCAGCTGGGAAAAGTGCTTACAGTGCA;circ_0045943 F:CATAGAAAGTGAATTTTGTAG;circ_0045943 R:GCATGATGTTGTAAATACTTA。每组3 个复孔,按照 2-△△Ct方法处理数据。
1.4 CCK-8 检测胃癌细胞增殖
采用CCK-8 法检测过表达或抑制circ_0045943后AGS 细胞的增殖变化。胃癌细胞AGS 接种于96孔板,细胞密度1×105/mL,每孔100 μL。于接种后0、24、48、72 h 检测,检测前每孔加入 100 μL CCK-8检测工作液,继续培养4 h,酶联免疫监测仪450 nm处测定吸光度值。
1.5 TUNEL 检测胃癌细胞凋亡
采用TUNEL 法检测过表达或抑制circ_0045943后AGS 细胞的凋亡变化。胃癌细胞AGS 接种于置有载玻片的6 孔板,细胞密度5×105/mL,每孔2 mL,细胞贴附于载玻片上,40 g/L 多聚甲醛固定60 min,0.1% Triton®X-100 冰浴 2 min;制备 TUNEL 反应混合液:20 μL rTdT+480 μL 荧光标记液+500 μL TUNEL 检测液混匀,每孔 50 μL,37 ℃避光孵育60 min;浸入 10 μL DAPI 工作液,37 ℃避光 10 min染色;用抗荧光淬灭封片剂封片,倒置荧光显微镜观察荧光信号。
1.6 Transwell 检测胃癌细胞迁移、侵袭
采用Transwell 法检测过表达或抑制circ_0045943 后 AGS 细胞的迁移、侵袭变化。AGS 细胞饥饿培养12 h 后接种于24 孔培养板transwell 小室中,迁移实验不铺胶,侵袭实验铺Matrigel 基质胶(稀释倍数:1∶50)。细胞密度 2×105/mL,每孔 100 μL,下室加入完全培养基,常规培养48 h,40 g/L 多聚甲醛固定20 min,1 g/L 结晶紫染色5 min,置于光学显微镜下计数互不重叠的6 个高倍视野下穿膜细胞平均数。
1.7 划痕实验检测胃癌细胞迁移
采用划痕实验检测过表达或抑制circ_0045943后AGS 细胞的迁移变化。胃癌细胞AGS 接种于6 孔板,细胞密度 5×105/mL,每孔 1 mL,培养 48 h 后用吸头笔直划痕,每孔至少划5 条痕迹,PBS 洗涤细胞3 次,去除划下的细胞,加入无血清培养基,继续培养24 h 后置于倒置显微镜下观察,IPP 软件统计。划痕愈合率=(T0width-Ttwidth)/T0width×100%。
1.8 统计学分析
实验数据采用SPSS 22.0 统计软件进行分析。计量资料的统计描述采用表示,样本均数比较的统计分析采用单因素方差分析(analysis of variance,ANOVA),当总体均数不等时,采用多个样本均数间的多重比较LSD-t检验,以P<0.05 为差异有统计学意义。统计图采用GraphPad Prism(version 5.0)制作直条图表示不同样本总体均数的差异,线图表示吸光度值随时间变量变化而变化的趋势。
2 结 果
2.1 circ_0045943 在胃癌细胞中的表达
首先检测circ_0045943 在人胃癌细胞中的表达。Real-time PCR 显 示 ,circ_0045943 在 胃 癌 细 胞MKN-45 中相对表达量为 0.617±0.038,AGS 中相对表达量为0.520±0.020,与胃黏膜上皮细胞GES-1 相比,circ_0045943 在3 种细胞中表达量的总体均数不等(F=172.458,P<0.001),可以认为 circ_0045943在胃癌细胞中表达降低,尤以AGS 为低(图1)。
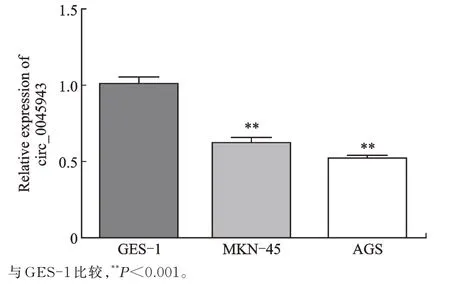
图1 Real-time PCR 检测circ_0045943 在胃癌细胞中的表达Fig. 1 Real-time PCR for detection of circ_0045943 expression in gastric cancer cells
2.2 circ_0045943 对胃癌细胞增殖的影响
为确定低表达的circ_0045943 是否对胃癌细胞生物学特性产生影响,选用AGS 细胞检测其增殖、凋亡、迁移和侵袭能力变化。CCK-8 检测显示,AGS细胞增殖吸光度A 值在过表达和沉默circ_0045943 后出现明显变化(F24h=15.497,P<0.05;F48h=55.726,P<0.001;F72h=70.656,P<0.001),可以认为不同时间点4个处理组AGS 细胞吸光度值总体均数均不等。两两比较显示,OE-circRNA 组A 值低于sh-circRNA(P24h<0.05,P48h<0.001,P72h<0.001),可以认为过表达circ_0045943 抑制AGS 细胞增殖,沉默circRNA促进AGS 细胞增殖(图2)。
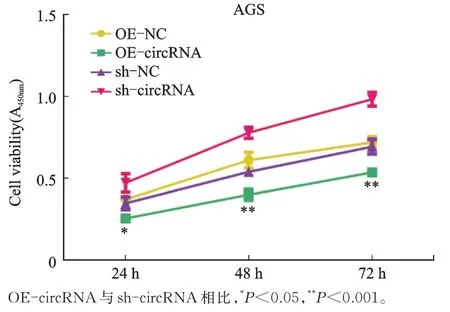
图2 CCK-8 法检测AGS 细胞增殖Fig.2 CCK-8 method for detection of AGS cells’proliferation ability
2.3 circ_0045943 对胃癌细胞凋亡的影响
已检测到circ_0045943 影响AGS 细胞增殖,此处检测其凋亡情况。TUNEL 检测显示,AGS 细胞凋亡随circ_0045943 的过表达和沉默而发生变化,过表达circ_0045943 后细胞凋亡数增多,表现为阳性荧光信号增多,沉默circ_0045943 后凋亡数明显减少,表现为阳性荧光信号减少(图3)。

图3 TUNEL 法检测AGS 细胞凋亡Fig.3 TUNEL method for detection of AGS cells’apoptotic ability,bar=100 μm
2.4 circ_0045943 对胃癌细胞迁移、侵袭的影响
由于本课题组前期研究发现miR-106a 具有调控胃癌侵袭转移的能力,此次从circRNA 和miRNA作用机制角度探讨circ_0045943 是否与miR-106a 通过位点互作而调控胃癌细胞表型。Transwell 检测显示,AGS 细胞迁移和侵袭在过表达和沉默circ_0045943 后发生变化,迁移实验穿膜细胞数为OE-NC=71.17±7.627,OE-circRNA=45.50±3.017,sh-NC=73.17 ± 8.159,sh-circRNA=108.83 ± 4.401(F=106.139,P<0.001)。侵袭实验穿膜细胞数为OENC=52.83±7.139,OE-circRNA=29.83±2.137,sh-NC=51.50±6.317,sh-circRNA=91.50±1.643(F=160.967,P<0.001)。可以认为4 个不同处理组AGS细胞迁移、侵袭的总体均数均不等。两两比较得出OE-circRNA 组细胞穿膜数低于sh-circRNA,P<0.001,可以认为过表达 circ_0045943 后 AGS 细胞迁移侵袭能力受到抑制,而沉默circRNA 促进AGS细胞转移(图4)。划痕实验显示,划痕愈合率为OENC=39.678±2.973,OE-circRNA=16.952±3.234,sh-NC=42.776±2.040,sh-circRNA=47.491±0.671(F=92.368,P<0.001)。可以认为 4 个不同处理组AGS 细胞的划痕愈合不全相同。过表达circ_0045943后AGS 细胞迁移能力最低,沉默circ_0045943 后迁移较高(图5)。
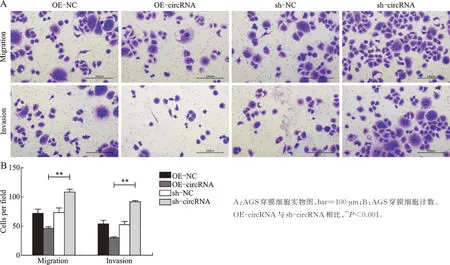
图4 Transwell 法检测AGS 细胞迁移和侵袭Fig.4 Transwell assay for detection of AGS cells’migration and invasion abilities
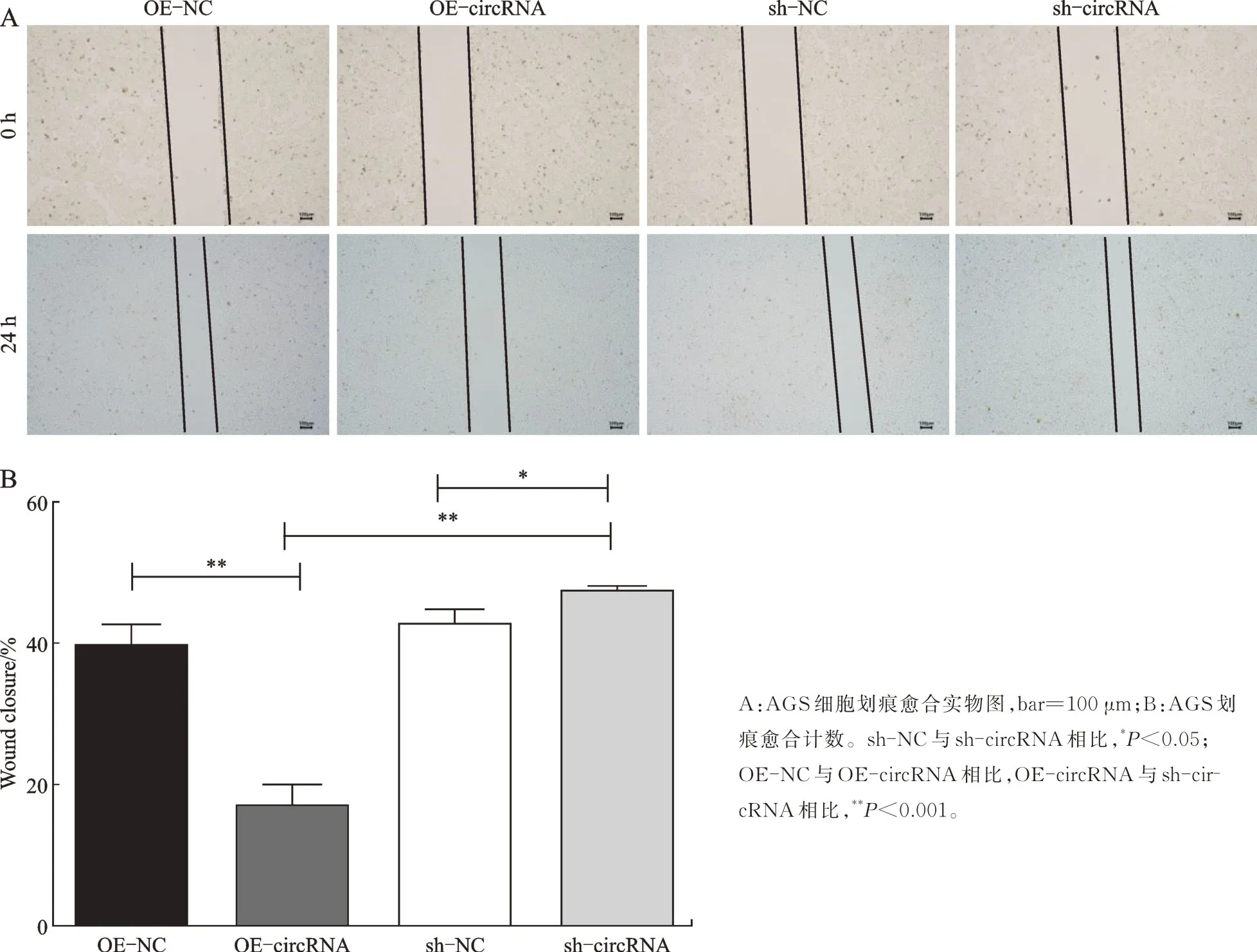
图5 划痕法检测AGS 细胞迁移Fig.5 Wound healing assay for detection of AGS cells’migration ability
2.5 miR-106a 在胃癌中的表达及其与circ_0045943的关系
考虑到circRNA 与miRNA 的潜在相关性,本研究采用starbase 数据库检索到circ_0045943 和miR-106a具有互补结合序列(图6)。Real-time PCR 检测miR-106a在胃癌细胞MKN-45、AGS中的表达量与GES-1的总体均数不等(F=108.891,P<0.001),可以认为miR-106a 在胃癌细胞中表达增高(图7)。随后检测circ_0045943 的表达及转染circ_0045943 后miR-106a的表达变化,real-time PCR 显示circ_0045943 在不同处理组中表达量不全相等(F=222.203,P<0.001)。与Control 相比,过表达后circ_0045943 升高,沉默后circ_0045943 降低(P均<0.001);miR-106a 在不同处理组中表达量亦不全相等(F=125.282,P<0.001)。与 Control 相比,过表达 circ_0045943 后 miR-106a表达下降,沉默circ_0045943 后miR-106a 表达回升(P均<0.001)。可以看出,伴随 circ_0045943 表达升高和下降,miR-106a 表达出现相反变化(图8)。
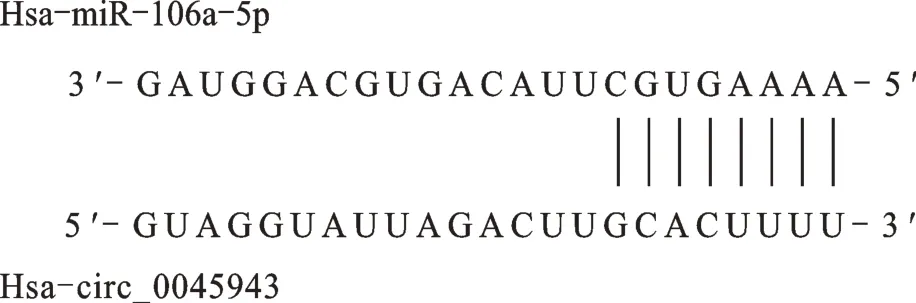
图6 miR-106a 与circ_0045943 的结合位点示意图Fig.6 Schematic diagram of binding site between circ_0045943 and miR-106a
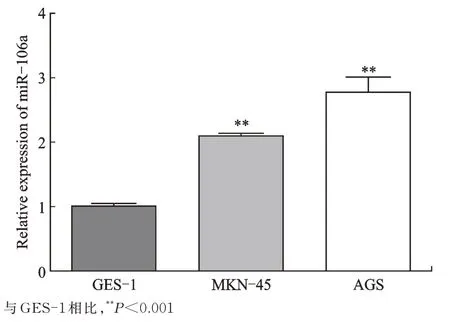
图7 Real-time PCR 检测miR-106a 在胃癌细胞中的表达Fig.7 Real-time PCR for detection of the expression of miR-106a in gastric cancer cells
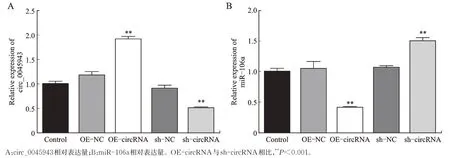
图8 Real-time PCR 检测过表达或沉默circ_0045943 后circ_0045943 和miR-106a 的表达Fig.8 Real-time PCR for detection of the expressions of circ_0045943 and miR-106a after overexpression or silencing of circ_0045943
3 讨 论
恶性肿瘤细胞在进化的过程中将逐渐获得不断的自我更新能力、迁移和侵袭、抵抗凋亡,以及区域扩张和远处播散能力。然而,这些恶性行为获得的原因并不清楚[7]。本课题组之前的研究发现miR-106a 的异常表达具有调控胃癌细胞转移的能力,但具体机制仍不清楚[8]。本研究探索circRNA 与miR-106a 的关联,发现circ_0045943 在胃癌中表达下调,结合之前研究发现miR-106a 在胃癌中高表达,提示二者可能具有潜在的反向关系,circ_0045943 可能作为肿瘤抑制因子减轻miR-106a 的促肿瘤行为。细胞水平进一步证实,过表达circ_0045943 后胃癌细胞增殖能力下降,凋亡增多,迁移和侵袭减少,恶性生物学行为的趋势有所缓和;反方向亦证明,当沉默circ_0045943 后,以上这些趋于缓和的恶性行为得以重新恢复,胃癌细胞表现为增殖加速,凋亡的抵抗和迁移侵袭的增强。此种表型的改变表明,circ_0045943 可能对胃癌细胞的生物学特性具有抑制作用。
CircRNA 最早发现于 20 世纪 70 年代[9],但直到2012 年,对circRNA 的研究才开始集中于阐明其对包括癌症在内的人类疾病的影响[10]。大量研究表明,circRNA 的不同作用机制、高稳定性以及在可获得体液中的存在使其成为生物标记物和治疗干预的潜在靶点[11]。大多数circRNA 由蛋白质编码基因承载,RNA 聚合酶Ⅱ负责转录,其生物发生由剪接体介导。外显子序列组成的circRNA 是由一种称为“反向剪接”的机制产生,其中一个外显子下游5′剪接位点连接到另一个外显子上游3′剪接位点。这一机制的结果是产生共价封闭的环状转录本和跳过外显子的选择性剪接线性RNA[12]。circRNA 参与基因表达的功能多数被认为是一种miRNA 海绵发挥竞争性内源RNA 作用,吸附这些miRNA 并抑制其活性;另外,circRNA 还有RNA 结合蛋白隔离剂及转录调节因子的功能[13-14]。本研究采用定量检测证实,过表达circ_0045943 对应miR-106a 表达降低,沉默circ_0045943后miR-106a 表达升高,表明了二者的反向关系。结合细胞功能实验的结果,circ_0045943 对胃癌细胞增殖凋亡平衡的约束作用,以及迁移侵袭能力获得的抵抗作用,将有可能是通过miRNA 海绵机制竞争性调节靶基因表达。
因此,本研究使用circinteractome 检索circ_0045943 的宿主,发现宿主基质金属蛋白酶抑制物TIMP2,而此宿主恰好是miR-106a 直接靶基因之一。本课题组以往的研究表明,miR-106a 可能通过直接靶向TIMP2 而促进胃癌的发生发展[8]。有研究显示,来源于 TIMP2 的 circRNA 通过靶向 miR-185-5p 促进椎间盘中央髓核细胞的细胞外基质分解代谢并抑制合成,加速椎间盘退变的进展[15]。另有研究显示,低表达的circ_0001649 可能通过负向调控Wnt/βcatenin 信号通路影响直肠癌的发生发展[16]。本研究所观察到的circ_0045943 对胃癌转移的影响也有可能是通过靶向miR-106a 影响下游TIMP2 等靶位点,进而使得细胞外基质完整性破坏调节重塑[17]。
总之,本研究至少在细胞水平证明,circ_0045943调控胃癌细胞增殖、凋亡、迁移和侵袭,其机制可能为靶向miR-106a 而发挥的miRNA 海绵作用。

