2017—2018年长海县浮筏养殖虾夷扇贝生长和存活差异分析
周凯,刘超,孔宁,衣启麟,杨传燕
(大连海洋大学 辽宁省海洋动物免疫学重点实验室,辽宁省海洋动物免疫学与疫病防控重点实验室,大连市水产养殖病害防控重点实验室,辽宁 大连 116023)
虾夷扇贝Patinopectenyessoensis属大型冷水性贝类,广泛分布于日本北海道和本州北部海域、俄罗斯远东海域及朝鲜半岛海域。自20世纪80年代引入中国以来,已成为中国北方沿海尤其是辽宁省重要的经济养殖贝类之一,为中国的海水养殖业带来了巨大的经济效益[1]。浮筏养殖和底播增殖是虾夷扇贝的两种主要养殖方式,其中,浮筏养殖扇贝个体由于受到网笼的保护,贝壳相对轻薄,附着物少,在适宜水层生长快,出肉率较同期底播贝高,经济效益更好[1]。但近年来受到种质、环境病原及养殖模式等诸多因素影响,浮筏养殖虾夷扇贝年产量不稳定,经济效益年际波动巨大[2]。因此,探究浮筏养殖虾夷扇贝产量年际波动的原因具有重要的现实意义。
双壳贝类的生长、存活及病害发生受到环境因素和自身生理机能等综合作用的影响[3]。海水温度和溶解氧含量能够通过调节贝类能量代谢及免疫相关蛋白的活性来影响扇贝的生长、存活等生产性状[4-5]。研究发现,一定范围内的海水温度升高会促进贝类的生长,但剧烈的升温会造成氧化应激胁迫,降低机体免疫防御能力,影响贝类正常的生长发育及能量代谢过程,进而导致贝类大规模死亡[6-7]。与海水温度升高相对应的是海水溶解氧含量的降低[8],这会降低水生生物的呼吸代谢速率[9],使其呼吸方式由有氧呼吸转为无氧呼吸[10],耐受不利环境的能力下降[8],进而对其生长、存活产生不利影响。高温低氧等环境胁迫因子会提高贝类呼吸代谢过程中产生的活性氧(reactive oxygen species,ROS)含量,过量的ROS引起氧化应激反应,对有机体脂类等大分子造成严重损伤[11-12]。
贝类能够诱导产生大量的热休克蛋白(heat shock proteins,HSPs)和超氧化物歧化酶(superoxide dismutase,SOD)等防御性分子来防止过量ROS对机体造成的损伤[13-14]。糖原是贝类进行各种生命活动的主要供能物质,其有效的代谢调控是贝类应对高温、低氧等不利环境条件的重要机制[15-16]。Samain等[17]研究表明,高糖原含量的牡蛎Crasostreagigas在夏季高温期的死亡率较糖原含量较低的牡蛎显著降低。由此推测,高温低氧会引起贝类发生氧化应激反应,进而引发糖原代谢产生的能量在生长及应激反应之间的重新分配,造成生长、存活等正常生理功能所需要能量的供应不足,从而引起贝类死亡[18]。
基于以上假设,本研究中比较了2017年和2018年长海县浮筏养殖虾夷扇贝生产性状之间的差异,并从环境因子、能量代谢水平和免疫防御能力三方面解释产生这种差异的原因,以期为浮筏养殖虾夷扇贝病害预警预报系统的建立和健康养殖提供数据支撑和理论基础。
1 材料与方法
1.1 调查站位
分别于2017年(3月25日、5月20日、6月20日和7月20日)和2018年(3月29日、5月20日、6月20日和7月20日)对长海县浮筏养殖虾夷扇贝进行每年4次调查,所取扇贝为同龄扇贝。调查站点位于大连市长海县小长山岛镇东北方向虾夷扇贝浮筏养殖海区(39°17′23″N、122°44′18″E)。调查站位距离海岸线约9 km,水深为15~20 m(图1)。
图1 2017年和2018年扇贝养殖调查站位Fig.1 Sampling sites of the surveys conducted in 2017 and 2018
1.2 方法
1.2.1 环境指标的检测 在调查站位使用YSI多参数水质分析仪(550A-12)现场测定海水温度和溶解氧(DO)含量。将YSI探头浸入表层水下4 m,待示数稳定后记录温度和溶解氧数据,重复测量4次,计算其平均值。
1.2.2 生产性状指标的测定与计算 在调查站位随机抽取2笼浮筏养殖虾夷扇贝,从中随机选取50只存活虾夷扇贝置于冰袋之上带回实验室,分别使用游标卡尺和电子天平测量其壳长(L,精确到0.01 mm)和体质量(W1,精确到0.01 g)。解剖获得其壳、闭壳肌、性腺、鳃和其余组织,在60 ℃下烘干72 h待其达到恒重后,使用电子天平分别称量其质量,记为W2、W3、W4、W5和W6(精确到0.01 g)。
肥满度计算公式[19]为
肥满度=(W3+W4+W5+W6)/W2×1 000。
其中:W2为壳干质量(g);W3为闭壳肌干质量(g);W4为性腺干质量(g);W5为鳃干质量(g);W6为其余组织干质量(g)。
分别在2017年5月20日和2018年5月20日随机选取2笼扇贝,除去其中死亡和患病个体后装入新的扇贝笼继续养殖,分别在同年6月20日和7月20日计数这2笼扇贝存活、死亡和患病个体数目,并除去死亡和患病个体后重新装入新的扇贝笼中继续养殖。若存活个体贝壳内侧有褐色沉积即被认定为患病个体。存活率(%)和患病率(%)计算公式为
患病率=N3/(N1+N2)×100%,
存活率=N1/(N1+N2)×100%。
其中:N1为存活个体数目;N2为死亡个体数目;N3为患病个体数目。
1.2.3 免疫及能量代谢指标的检测 在调查站位随机选取15只健康虾夷扇贝,解剖收集闭壳肌在液氮中冻存。将每5只扇贝的闭壳肌等质量混合后测定其糖原含量、SOD活性、丙二醛(malonaldehyde,MDA)含量及HSP70含量。
采用南京建成生物技术有限公司的相关试剂盒测定糖原含量、SOD活性和MDA含量,采用上海羽朵生物技术有限公司的HSP70试剂盒测定HSP70含量。采用蒽铜比色法[20]测定糖原含量,采用黄含量嘌呤氧化酶法[21]测定SOD活性,采用硫代巴比土酸法[22]测定MDA含量,采用酶联免疫反应法测定HSP70含量。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用Microsoft Excel 2013软件和SPSS 19.0 软件进行作图和数据分析。使用独立样本T检验分析相同月份生产性状、环境指标及生理指标年际间差异的显著程度。显著性水平设为0.05。
2 结果与分析
2.1 虾夷扇贝养殖水体环境指标的变化
2017年虾夷扇贝浮筏养殖海区水温分别在3月(3.63 ℃±0.15 ℃)、6月(20.39 ℃±0.20 ℃)和7月(23.83 ℃±0.72 ℃)显著高于2018年同期(3.17 ℃±0.06 ℃、16.83 ℃±0.06 ℃、22.14 ℃±0.03 ℃)(P<0.05),而在5月(9.30 ℃±0.10 ℃)则显著低于2018年同期(10.57 ℃±0.06 ℃)(P<0.05)(图2(a))。对溶解氧含量而言,2017年除了5月显著高于2018年5月(P<0.05)外,在其余月份均显著低于2018年同期(P<0.05)(图2(b))。

*表示同一月份不同年际间有显著性差异(P<0.05),下同。Note:*means significant difference between different years in the same month(P<0.05),et sequentia.图2 2017年和2018年虾夷扇贝养殖海区水温和溶解氧含量的变化Fig.2 Variation in the sea water temperature and dissolved oxygen concentration in Yesso scallop culture area in 2017 and 2018
2.2 虾夷扇贝生长性状的变化
从表1可见:在3、5月,浮筏养殖虾夷扇贝壳长的年际间无显著性差异(P>0.05);在2018年6、7月,虾夷扇贝的壳长分别为2017年同期的104.4%、109.2%,年际间有显著性差异(P<0.05);在2018年3月,虾夷扇贝的体质量显著低于2017年同期(P<0.05),而在7月虾夷扇贝的体质量则显著高于2017年同期(P<0.05);在2018年5、6、7月,虾夷扇贝的肥满度显著高于2017年同期(P<0.05),而在3月,虾夷扇贝肥满度的年际间无显著性差异(P>0.05)。
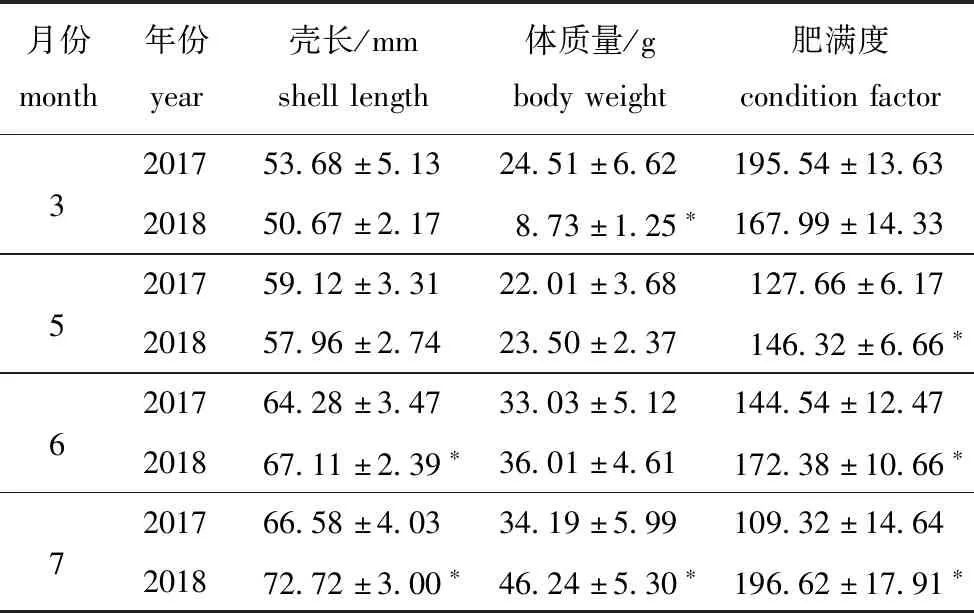
表1 2017年和2018年浮筏养殖虾夷扇贝壳长、体质量及肥满度的变化Tab.1 Variation in shell length,body weight and condition factor of Yesso scallop farmed in raft in 2017 and 2018
2.3 虾夷扇贝能量和免疫代谢指标的变化
2.3.1 糖原含量、SOD活性及MDA含量的变化
从表2可见:在2017年3、6月,虾夷扇贝闭壳肌中的糖原含量显著低于2018年同期(P<0.05),而在5、7月,闭壳肌中糖原含量年际间无显著性差异(P>0.05);在2017年3、6、7月,虾夷扇贝闭壳肌中的SOD活性显著高于2018年同期(P<0.05),而在5月,闭壳肌中SOD活性年际间无显著性差异(P>0.05);在2017年5、6月,虾夷扇贝闭壳肌中的MDA含量显著高于2018年同期,而在3、7月则显著低于2018年同期(P<0.05)。

表2 2017年和2018年浮筏养殖虾夷扇贝闭壳肌中糖原含量、SOD活性及MDA含量的变化Tab.2 Variation in glycogen content,SOD activity and MDA content of adductor muscle in Yesso scallop farmed in raft in 2017 and 2018
2.3.2 HSP70含量的变化 从图3可见,在2017年3、5、6月,浮筏养殖虾夷扇贝闭壳肌中的HSP70含量分别为(7.98±1.02)、(3.52±0.45)、(7.27±0.39)ng/g prot,显著高于2018年同期(P<0.05),2018年3、5、6月分别为(1.01±0.30)、(2.38±0.10)、(3.40±0.07)ng/g prot,而在7月,HSP70含量则显著低于2018年同期(P<0.05)。

图3 2017年和2018年浮筏养殖虾夷扇贝闭壳肌中HSP70含量的变化Fig.3 Variation in HSP70 content of adductor muscle in Yesso scallop farmed in raft in 2017 and 2018
2.4 虾夷扇贝存活率和患病率的变化
从表3可见,2017年5—6月和6—7月,浮筏养殖虾夷扇贝存活率显著低于2018年同期(P<0.05),而扇贝患病率则显著高于2018年同期(P<0.05)。

表3 2017年和2018年浮筏养殖虾夷扇贝存活率和患病率的差异Tab.3 Variation in survive rate and morbidity rate of Yesso scallop farmed in raft in 2017 and 2018
3 讨论
3.1 环境因子对扇贝生长、存活的影响
贝类生长、存活等生产性状受到环境因子与自身生理机能综合作用的影响[23]。本研究中比较了2017年与2018年相同月份间水温、溶解氧等环境因素,以及虾夷扇贝能量代谢、免疫相关酶活性的变化情况,以期寻找不同年份间虾夷扇贝生产性状波动的原因。结果表明,浮筏养殖虾夷扇贝的壳长、体质量等生产性状在2018年显著优于2017年,同时在高温期(6月和7月),2018年浮筏养殖虾夷扇贝的存活率显著高于2017年,患病率则显著降低,因此,2018年浮筏养殖虾夷扇贝的生产状况明显优于2017年。
海水温度及溶解氧含量是影响贝类生长、存活等生产性状的重要环境因子[4-5]。作为一种冷水性贝类,虾夷扇贝的生长适温范围为5~20 ℃,最适水温约为15 ℃[24]。多项研究表明,海水温度是影响虾夷扇贝能量代谢和存活的重要因素[25]。本研究中,2018年5、6、7月,养殖海区水温较2017年同期更接近于15 ℃,更有利于浮筏养殖虾夷扇贝的生长、存活。特别是2017年7月,养殖海区水温达到(23.83±0.75)℃,显著高于虾夷扇贝生长适温范围,从而导致其生长、存活等受到严重影响。与海水温度相似,溶解氧含量对虾夷扇贝呼吸代谢的速率具有重要影响[26]。在2018年3、6、7月,养殖海区溶解氧含量显著高于2017年同期,从而为虾夷扇贝的有氧呼吸提供了充足的氧气供应,有利于虾夷扇贝壳长、体质量和存活率的提高。在2017年6、7月,浮筏养殖虾夷扇贝的弧菌病患病率显著高于2018年。已有研究表明,海洋动物细菌性疾病的发生是不利环境因素导致的细菌群落结构失衡,致病性微生物大量繁殖并入侵宿主的结果[27-28]。本实验室未发表的数据显示,2018年6、7月虾夷扇贝养殖海区致病性弧菌的丰度显著低于2017年同期。由此推断,2017年6、7月养殖海区高温低氧的环境导致其致病性弧菌的暴发,进而造成了2017年虾夷扇贝患病率显著高于2018年同期。
综上,2018年浮筏养殖虾夷扇贝的生长态势明显优于2017年同期,这可能与2018年适宜的水温、较高的溶解氧含量等有利的环境条件密切相关。
3.2 生理状态对扇贝生长、存活的影响
糖原是生物体内重要的营养物质,在有机体的多种生命活动中发挥着重要作用,可从能量和物质供应两方面为扇贝的生长提供保障,对贝类的生长具有重要的促进作用[29]。有研究表明,三倍体牡蛎(糖原含量为21.2 g/100 g干质量)在繁殖季节的壳长和体质量分别是二倍体牡蛎(糖原含量为14.5 g/100 g干质量)的1.2倍和1.9倍[30]。由此推测,本研究中2018年虾夷扇贝壳长和体质量显著高于2017年同期的一个重要原因是2018年3、6月较2017年同期具有较高的糖原含量。在糖原的分解代谢为扇贝生长和免疫反应提供总能量一定的前提下,免疫反应的增强会降低供生长利用的能量比例[31-32]。
SOD是消除ROS最重要的酶之一,HSP70是HSP蛋白家族对热应激最敏感的蛋白,而MDA含量被认为是反映脂类损伤程度的重要指标。在机体能维持正常应激生理功能的前提下,HSP70和MDA 含量升高代表着机体受到热应激和氧化损伤程度升高,而SOD活性升高提示机体内存在大量ROS需要清除。本研究中,通过测定虾夷扇贝闭壳肌中的SOD活性、HSP70含量及MDA含量,来反映免疫反应强度及高温等环境因素对其生物大分子损伤的程度。2017年各月份虾夷扇贝闭壳肌中SOD活性显著高于2018年同期,提示其对ROS的清除作用更强,免疫反应强度更强。MDA作为脂质过氧化损伤的产物,本研究中在2017年5、6月虾夷扇贝闭壳肌中的MDA含量显著高于2018年同期,这表明2018年5、6月虾夷扇贝闭壳肌脂质受到氧化损伤的程度显著高于2018年同期。而在2018年7月,闭壳肌MDA含量显著低于2018年同期,原因可能是2017年7月的高温、低氧及弧菌病等因素导致虾夷扇贝处于濒死状态,产生MDA的能力下降。2018年7月虾夷扇贝闭壳肌MDA含量较2018年5、6月显著升高,这表明2018年7月虾夷扇贝受到的氧化损伤愈发严重。
高温及低氧等环境条件下,生物体内HSP70含量会升高以修复或者清除过量ROS损伤的蛋白质[33]。本研究中,2017年3月—6月虾夷扇贝闭壳肌中HSP70含量显著高于2018年同期,推测2017年虾夷扇贝闭壳肌免疫反应强度更强,免疫反应对能量的需求量更大。而2017年7月闭壳肌中HSP70含量显著低于2018年,推测可能是2017年7月持续高温已经严重影响了虾夷扇贝表达HSP70的能力,导致此时的虾夷扇贝可能已经处于濒死状态。这一推测与前面SOD 活性和MDA含量的结果相对应,也可由2017年7月虾夷扇贝的死亡率、患病率等指标得到验证。2017年5—7月和6—7月,虾夷扇贝的存活率分别为79.18%±1.31%和65.87%±1.37%,患病率分别为3.55%±1.52%和65.22%±1.42%,这说明虾夷扇贝的生理状态不佳,虾夷扇贝的正常抗氧化机能受到严重影响,以至于受到高温刺激后HSP70和MDA含量均不能再升高甚至出现下降的趋势。当然这些只是作者的推测,后续将会寻找新的证据来证明这种推测。根据本部分结果,作者认为MDA及HSP70含量可以作为评价浮筏养殖虾夷扇贝健康状态的重要指标。
综上,本研究中比较了2017年与2018年3、5、6、7月大连市长海县浮筏养殖虾夷扇贝生长和存活等指标之间的差异,并从环境和生理指标等方面解析了这些差异出现的原因。研究结果表明,适宜的环境因素对浮筏养殖扇贝的健康生长具有重要的促进作用。适宜的水温、溶解氧能够显著提高虾夷扇贝闭壳肌中糖原含量,亦不会造成扇贝机体强烈的免疫反应,从而使其正常生理活动能够获得更充足的能量和物质供应,进一步降低患病率,提高扇贝存活率。该研究结果将为长海县和其他相似海区浮筏养殖虾夷扇贝的病害预警预报及健康养殖,提供一定的数据支撑和理论基础。
4 结论
1)2018年长海县浮筏养殖虾夷扇贝的生长、存活等性状显著优于2017年同期。
2)MDA及HSP70含量可以作为评价浮筏养殖虾夷扇贝健康状态的重要指标,若与存活率、发病率等指标结合,则具有更有效的评价意义。
3)适宜的水温、较高的溶解氧含量等有利的环境条件有助于降低患病率,提高扇贝存活率。

